Похожие презентации:
Химия биоорганических соединений
1.
Департамент здравоохранения города МосквыГосударственное бюджетное профессиональное образовательное учреждение
Департамента здравоохранения города Москвы
«Медицинский колледж № 1»
(ГБПОУ ДЗМ «МК № 1»)
Методическая разработка теоретического материала
для студентов II курса
специальности «Лабораторная диагностика»
Тема: Биологическое значение нуклеиновых кислот
Преподаватель специальности
«Лабораторная диагностика»
ПМ 03.01 Проведение лабораторных
биохимических исследований:
Диденко Изабелла Владимировна
Москва, 2020
2.
Раздел 2. ПМ.03Химия
биоорганическ
их соединений.
Тема 2.4.
Химия
нуклеиновых
кислот
Теоретические занятия –
4 часов
• Лекция 9.
Биологическое
значение нуклеиновых
кислот.
• Лекция 10. Строение,
функции нуклеиновых
кислот.
3.
Цели и задачи1.
2.
1.
2.
1.
2.
3.
4.
5.
6.
7.
Цели :
Образовательные:
Обобщить, систематизировать, углубить и закрепить теоретические знания, полученные студентами
на лекциях и в процессе самостоятельной работы над предложенной темой.
Проконтролировать и оценить степень усвоения студентами материала изучаемых тем.
Развивающие:
Развивать логическое мышление и творческую активность студентов, умение анализировать,
сравнивать,
Развивать делать выводы относительно однотипных заданий.
Воспитательные:
1.Воспитывать познавательный интерес к изучаемой дисциплине
2.Воспитывать профессиональные навыки при выполнении заданий, имеющих непосредственное
отношение к выбранной профессии.
Задачи:
Изучить биологическую роль белков.
Обмен нуклеиновых кислот.
Биосинтез ДНК.
Биосинтез РНК.
Процессинг РНК.
Биосинтез белков.
Значение нуклеиновых кислот.
4.
План лекции № 10Биологическое значение нуклеиновых
кислот
1.
2.
3.
4.
5.
6.
7.
Биологическая роль белков
Обмен нуклеиновых кислот
Биосинтез ДНК
Биосинтез РНК
Процессинг РНК
Биосинтез белков
Значение нуклеиновых кислот.
5.
Биологическая роль белковБиологическая роль белков В количественном отношении белки
образуют самую важную группу макромолекул. Белкам присущ ряд уникальных
функций:
– биокаталитическая, все ферменты – вещества белковой природы;
– пластическая, белки входят в состав важнейших структур клеток и тканей;
– регуляторная, большинство гормонов имеют белково-пептидную природу;
– защитная, белки – иммуноглобулины – обеспечивают защиту организма от
действия чужеродных антигенов;
– дыхательная, белок гемоглобин в составе эритроцитов обеспечивает транспорт
кислорода в ткани и СО2 в легкие;
– транспортная, перенос многих важных для организма веществ по крови
происходит в комплексе с белками.
В организме человека массой 70 кг содержится примерно 10 кг белка,
суточная норма белков в питании составляет примерно 100 г. Доля других
азотсодержащих соединений в организме невелика, поэтому и баланс азота в
организме определяется прежде всего метаболизмом белков. В отличие от
углеводов и липидов белки и составляющие их аминокислоты не способны
резервироваться в организме.
6.
Обмен нуклеиновых кислотПереваривание нуклеиновых кислот
Нуклеиновыми кислотами богаты мясо, икра, дрожжи.
Поджелудочная железа выделяет ферменты РНК - азу (рибонуклеазу) и ДНК –
азу (дезоксорибонуклеазу), которые деполимеризуют нуклеиновые кислоты до
нуклеотидов. В кишечном соке содержатся ферменты фосфатазы,
нуклеотидазы, нуклезидазы, эстеразы, осуществляющие распад нуклеотидов.
Всасыванию подвергаются нуклеозиды, азотистые основания, пентозы и
фосфорная кислота.
Распад нуклеиновых кислот в тканях
Распад нуклеиновых кислот в тканях идентичен процессу их
переваривания. Углеводы и фосфорная кислота используются стандартно, а
азотистые основания подвергаются распаду до конечных продуктов: мочевой
кислоты (пуриновые основания) и мочевины (пиримидиновые основания).
Распад пуриновых нуклеотидов
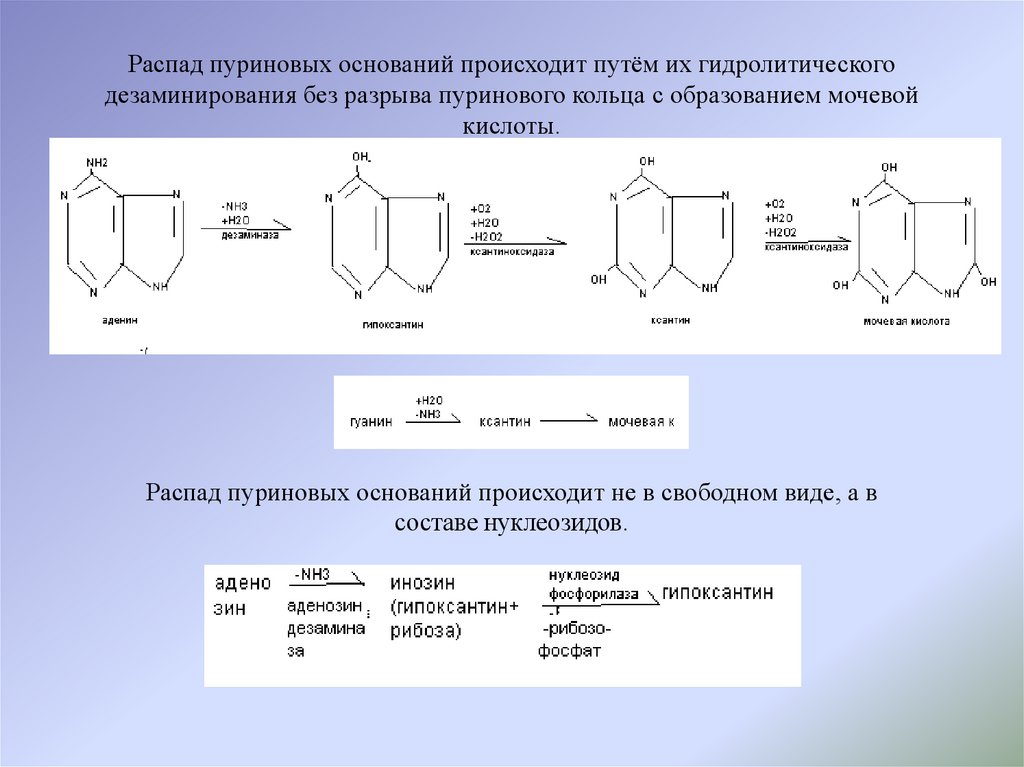
Распад пуриновых оснований происходит путём их гидролитического
дезаминирования без разрыва пуринового кольца с образованием мочевой
кислоты.
7.
Распад пуриновых оснований происходит путём их гидролитическогодезаминирования без разрыва пуринового кольца с образованием мочевой
кислоты.
Распад пуриновых оснований происходит не в свободном виде, а в
составе нуклеозидов.
8.
У взрослого человека экскретируется 0,5-1,5 г мочевой кислоты в сутки, азот
которой составляет 3,5% всего выводимого азота.
У детей относительная доля мочевой кислоты выше, чем у взрослых, на её азот
приходится до 8,5%. В крови взрослых людей содержание мочевой кислоты
равно 0,1-0,3(0,4) ммоль/л, у детей - до 0,47 ммоль/л.
Мочевая кислота является антиоксидантом, в детском возрасте стимулирует
развитие головного мозга, может присутствовать в тканях и в крови как в
свободной форме (плохо растворимой в воде), так и в виде солей (более
растворимых в воде).
Повышение концентрации мочевой кислоты в крови - гиперурекимия. На её фоне
могут развиваться подагра и почечнокаменная болезнь. При подагре кристаллы
мочевой кислоты откладываются в околосуставных тканях в виде подагрических
узлов. При почечнокаменной болезни кристаллы мочевой кислоты формируют
камни в мочевыводящих путях.
К нарушениям распада пуриновых оснований относят некоторые
иммунодефициты. При отсутствии аденозиндезаминазы развивается Т- и В –
иммунодефицит, а отсутствии нуклеозидфосфорилазы возможен В иммунодефицит.
Для уменьшения гиперурекемии используют препараты – аналоги пуриновых
оснований (например, аллопуринол), которые угнетают фермент
ксантиноксидазу и блокируют образование мочевой кислоты.
9.
Биосинтез ДНКВозможны 2 пути биосинтеза ДНК в организме: репликация, репарация
Репликация - самовоспроизведение молекулы ДНК с целью передачи
генетической информации. В репликации ДНК участвует сложный
репликационный комплекс, который включает в себя:
• нуклеотиды в виде трифосфатов (АТФ, ГТФ, ТТФ, ЦТФ). Они являются
одновременно и структурным материалом и источником энергии;
• ДНК-матрица – программа, по которой будет синтезироваться ДНК;
• праймер (затравка) - короткая молекула РНК, к которой присоединяется
первый нуклеотид ДНК;
• ферменты:
– ДНК-полимеразы соединяют нуклеотиды в полинуклеотидную цепь,
– ДНК-рестриктазы разрывают полинуклеатидную цепь ДНК.
– ДНК-лигазы соединяют фрагменты ДНК,
– хеликазы раскручивают молекулу ДНК,
– топоизомеразы осуществляют кратковременные разрывы ДНК в
процессе синтеза и контролируют конформацию вновь синтезированной
ДНК,
– праймазы – осуществляют синтез затравки;
• белковые факторы;
• ионы металлов.
Репликация ДНК происходит в S-фазу клеточного цикла. Важную роль в
чередовании циклов выполняют белки - циклины.
10.
Сущность репликации сводится к соединению нуклеотидов вкомплементарную антипараллельную дочернюю цепь ДНК. В
репликации выделяют 3 стадии: инициация (начало синтеза), элонгация
(удлинение цепи), терминация (окончание синтеза).
• Матрицей для синтеза ДНК являются обе полинуклеотидные цепи
материнской ДНК. Репликация начинается в нескольких участках
материнской ДНК (точки репликации, точки Ориджины). В них
происходит частичный разрыв водородных связей с формированием
репликационных утолщений (узелков).
• При участии ферментов ДНК-рестриктаз происходит разрезание
молекулы ДНК. Под действием ферментов хеликаз возникает
расплетание (раскручивание) двух цепей, и при
участии топоизомераз формируется репликационная вилка, в которой
одна цепь имеет направление 5→3, а вторая 3→5.
• На каждой из ПНЦ синтезируются дочерние нити ДНК по принципу
комплементарности. Поскольку ДНК- полимераза замыкает связь
только в направлении 5’→3’, то на одной цепи ДНК происходит
синтез непрерывной (лидирующей) нити ДНК в направлении 5→3.
• При синтезе лидирующей цепи праймазы синтезируют праймер, затем
ДНК- полимераза присоединяет к праймеру первый ДНК-овый
нуклеотид и по принципу комплементарности происходит удлинение
молекулы ДНК.
• На второй материнской нити ДНК синхронно синтезируется
отстающая нить ДНК, которая синтезируется в виде небольших
фрагментов в направлении 5→3.
11.
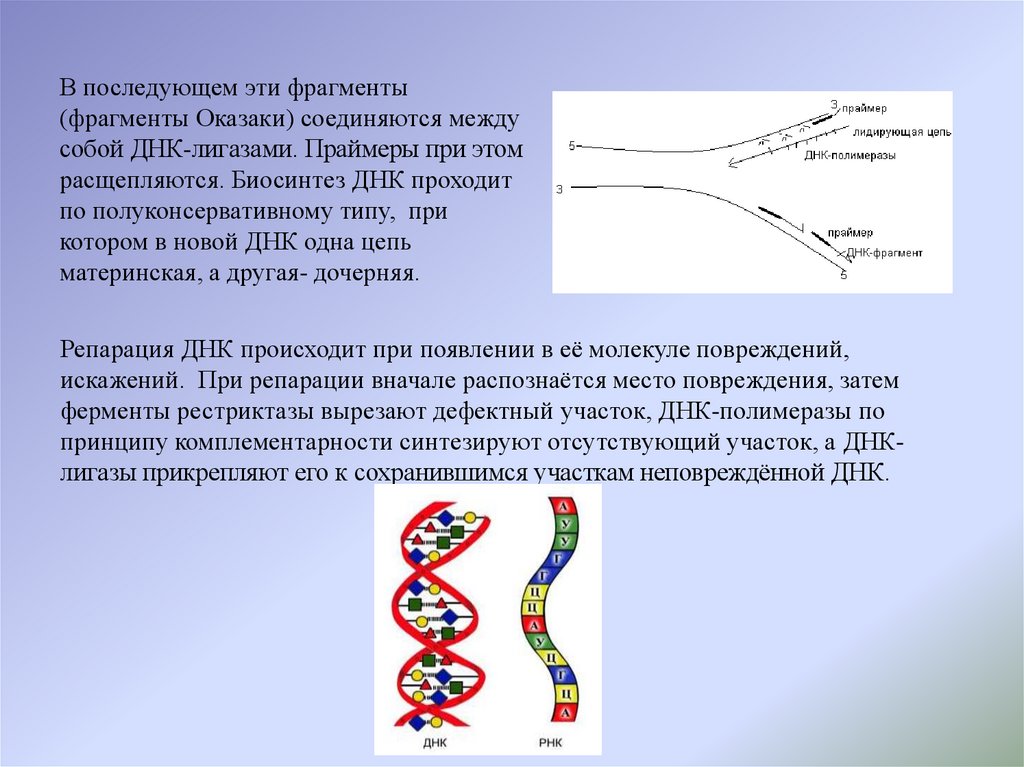
В последующем эти фрагменты(фрагменты Оказаки) соединяются между
собой ДНК-лигазами. Праймеры при этом
расщепляются. Биосинтез ДНК проходит
по полуконсервативному типу, при
котором в новой ДНК одна цепь
материнская, а другая- дочерняя.
Репарация ДНК происходит при появлении в её молекуле повреждений,
искажений. При репарации вначале распознаётся место повреждения, затем
ферменты рестриктазы вырезают дефектный участок, ДНК-полимеразы по
принципу комплементарности синтезируют отсутствующий участок, а ДНКлигазы прикрепляют его к сохранившимся участкам неповреждённой ДНК.
12.
Биосинтез РНК (транскрипция)Транскрипция – синтез молекулы РНК по матрице ДНК. Биологическая роль:
перенос генетической информации с ДНК на РНК. Для транскрипции необходимы:
матрица (программа) – кодирующая нить ДНК,
субстраты – АТФ, ГТФ, УТФ, ЦТФ,
ферменты – РНК-полимеразы,
белковые факторы,
ионы магния, марганца.
Выделяют 3 стадии транскрипции: инициация, элонгация, терминация
На молекуле ДНК имеется особый участок промотор, с которым связывается РНКполимераза. Промотор иногда называют ТАТА участком (преобладает тимин,
аденин, между которыми 2 Н-связи). Рядом с промотором расположены
сигнальные участки, определяющие скорость транскрипции. Далее в молекуле
ДНК располагаются кодирующие (экзоны) и некодирующие (интроны) участки
гена. Участок (сайт) терминации определяет окончание синтеза РНК.
Инициация заключается во взаимодействии иницирующих белков с промотором и
расхождении нитей ДНК, их раскручивании и формировании транскрипционной
вилки. РНК-полимераза связывается с промоторным участком и по принципу
комплементарности соединяет нуклеотиды цепи РНК в направлении от 5 конца к 3.
13.
РНК-полимераза - это олигомерный фермент, состоящий из несколькихсубъединиц, не требующий затравки. При достижении РНК –
полимеразой участка терминации происходит его связывание с белками
терминации, что сопровождается отсоединением РНК-полимеразы от
ДНК, диссоциацией её и окончанием транскрипции.
Процессинг РНК
Синтезированная РНК переписывает с кодирующей нити ДНК, как кодирующие
участки, так и некодирующие участки гена и является про-РНК (незрелой РНК).
Про-РНК в последующем подвергается созреванию (процессингу). Существует
несколько механизмов процессинга:
• сплайсинг – вырезание копий интронов и соединение копий экзонов;
• присоединение к про-РНК добавочных нуклеотидов;
• модификация азотистых оснований в составе про-РНК
Особенности процессинга для рРНК, тРНК, иРНК.
Процессинг иРНК заключается в добавлении КЭП - участка и полиаденилового
хвоста в сочетании со сплайсингом.
Процессинтг тРНК происходит путём метилирования азотистых оснований и
добавления акцепторного участка ЦЦА в сочетании со сплайсингом.
14.
Процессинг рРНК заключается:в вырезании из большого предшественника фрагментов всех видов
РНК: 18S; 5S; 5,8S; 28S;
Возможен альтернативный сплайсинг, который состоит в том, что для
разных белков интроны могут играть роль экзонов.
Возможен и безматричный синтез РНК; он происходит из
нуклеозиддифосфатов при участии фермента
полинуклеотидфосфорилазы. В этом варианте синтезируются
стандартные, небольшие молекулы РНК, необходимые для синтеза
стандартных белков.
Передача генетической информации происходит в следующем
направлении: ДНК→ РНК→ белок.
В некоторых фагах, эмбриональных тканях возможен синтез ДНК по
матрице РНК (РНК→ДНК). Этот вариант синтеза катализирует
фермент РНК-зависимая ДНК-полимераза (обратная транскриптаза,
ревертаза). В вирусах возможен также вариант синтеза РНК→РНК при
участии РНК-репликазы.
15.
Биосинтез белков – трансляцияОсновной структурой синтезируемых белков является первичная структура
(последовательность аминокислот в полипептидной цепи), которая заложена в
генетическом коде ДНК.
Генетический код имеет ряд характеристик.
1. Триплетность –1 аминокислота кодируется тремя нуклеотидами. Из 4 видов
нуклеотидов ДНК при триплетности кода возможно 64 различных сочетания, что
достаточно для кодирования 20 аминокислот.
2. Однозначность – 1 триплет кодирует только 1 аминокислоту.
3. Вырожденность – для кодирования 1 аминокислоты имеется несколько
триплетов
4. Непрерывность – между триплетами отсутствуют нуклеотиды, не
принадлежащие соседним триплетам.
5. Неперекрываемость – один нуклеотид не может одновременно принадлежать
2-м триплетам.
6. Универсальность – код в разных организмах одинаков, отвечает за одни и те
же аминокислоты.
Таким образом, код ДНК является линейным непрерывным и
однонаправленным. Последовательность нуклеотидов строго соответствует
последовательности аминокислот в синтезируемом белке – принцип
коллинеарности.
16.
ТрансляцияДля трансляции необходимы следующие факторы:
• все виды РНК (тРНК, иРНК, рРНК),
• аминокислоты в активной форме,
• макроэрги (донаторы энергии),
• ферменты,
• добавочные белковые факторы,
• ионы Mg2+
На первой подготовительной стадии происходит активация
аминокислот и связывание их со своей транспортной РНК. В
этой стадии участвуют ферменты аминоацил-тРНКсинтетазы. Это специфичные ферменты, обеспечивающие
соединение аминокислоты с соответствующей тРНК.
17.
Инициация синтеза белка происходит:при образовании инициирующего комплекса, который включает в себя
инициирующий кодон (АУГ, АГУ) иРНК, аминоацил - тРНК, рибосому.
Информационная РНК своим КЭП-участком соединяется с малой
субъединицей рибосомы.
К инициирующему кодону присоединяется тРНК со своей первой
аминокислотой (чаще всего метионином).
К малой субъединице присоединяется большая субъединица рибосомы, и на
рибосоме формируется два функциональных участка: пептидильный (Ручасток) и аминоацильный (А-участок).
Первая тРНК с первой аминокислотой присоединяется к Р-участку, а Аучасток оказывается свободным.
Элонгация включает в себя замыкание пептидной связи, транслокацию
рибосомы по иРНК с использованием энергии ГТФ и АТФ.
Терминация происходит:
• при приближении белоксинтезирующего комплекса к терминирующему
кодону иРНК (УАГ, УГА). Этому кодону не соответствует ни одна из
тРНК, поэтому не приносится новая аминокислота, и синтез белка
обрывается.
18.
Посттрансляционная модификация белковМногие синтезированные белки в последующем подвергаются
посттрансляционной модификации. Существует несколько её вариантов.
Наиболее часто встречается:
1. Частичный протеолиз – отщепление «ненужных» участков
(профермент→фермент; прогормон→гормон);
• модификация отдельных аминокислот:
• окисление (пролин→гидроксипролин в коллагене);
• фосфолирирование (присоединение фосфата);
• гликозилирование (присоединение углевода);
• карбоксилирование (присоединение группы СООН в некоторых факторах
свёртывания крови);
2. присоединение простетической группы;
• замыкание дисульфидных мостиков;
• изменение олигомерности белка (объединение нескольких мономеров)
В посттрансляционной модификации белков играют важную роль белки шапероны (они «следят» за правильностью модификации).
19.
Значение нуклеиновых кислот• Значение нуклеиновых кислот очень велико. Особенности их
химического строения обеспечивают возможность хранения,
переноса в цитоплазму и передачи по наследству дочерним
клеткам информации о структуре белковых молекул, которые
синтезируются в каждой клетке. Белки обусловливают
большинство свойств и признаков клеток. Понятно поэтому, что
стабильность структуры нуклеиновых кислот - важнейшее условие
нормальной жизнедеятельности клеток и организма в целом.
Любые изменения строения нуклеиновых кислот влекут за собой
изменения структуры клеток или активности физиологических
процессов в них, влияя таким образом на жизнеспособность.
• Существует два типа нуклеиновых кислот: ДНК и РНК.
• РНК (рибонуклеиновая кислота), так же как ДНК, представляет
собой полимер мономерами которого служат нуклеотиды.
Азотистые основания те же самые, что входят в состав ДНК
(аденин, гуанин, цетозин); четвертое - урацил - присутствует в
молекуле РНК вместо тимина. Нуклеотиды РНК содержат вместо
дизоксирибозы другую пентозу - рибозу.
20.
Тест для самоконтроля:1. К какой группе соединений относятся
нуклеиновые кислоты?
А) биополимеры;
В) α- аминокислоты;
С) мономеры;
D) низкомолекулярные вещества;
Е) углеводы.
2. Мономер нуклеиновых кислот:
А) нуклеотид;
В) моносахарид;
С) α- аминокислота;
D) первичный амин;
Е) карбоновая кислота.
3. Мононуклеотиды – составная часть
молекул:
А) нуклеиновой кислоты, кофермента;
В) гликопротеина, фосфолипида;
С) гемоглобина, лецитина;
D) липопротеина, кефалина;
Е) гомополисахарида, гепарина.
4. Из остатков каких молекул состоит
нуклеотид?
А) аланин, глюкоза, серная кислота;
В) аденин, рибоза, фосфорная кислота;
С) урацил, дезоксирибоза, азотная
кислота;
D) валин, фруктоза, угольная кислота;
Е) глицерин, жирная кислота, фосфорная
кислота.
5. Из остатков каких молекул состоит
нуклеозид?
А) α- аминокислота, амин;
В) пиримидиновое основание, фосфорная
кислота;
С) жирная кислота, глицерин;
D) кетокислота, глюкоза;
Е) пуриновое основание, рибоза.
21.
6. Чем отличается нуклеозид отнуклеотида?
А) отсутствием остатка молекулы
фосфорной кислоты;
В) наличием остатка молекулы
глюкозы;
С) отсутствием остатка молекулы
пентозы;
D) наличием остатка молекулы αаминокислоты;
Е) наличием остатка молекулы
глицерина.
7. Какие элементы обязательны для
молекул нуклеиновых кислот?
А) сера, хлор;
В) кислород, натрий;
С) фосфор, азот;
D) барий, стронций;
Е) мышьяк, водород.
8. Укажите пуриновое основание
нуклеиновых кислот:
А) аденин;
В) тимин;
С) цитозин;
D) урацин;
Е) этиламин.
9. Какое пиримидиновое основание
является составной частью РНК?
А) урацил;
В) аденин;
С) гуанин;
D) тимин;
Е) диметиламин.
10. Какое пиримидиновое основание не
входит в состав ДНК?
А) урацин;
В) тимин;
С) цитазин;
D) аденин;
Е) гуанин.
22.
Что такое глоссарий?• Глоссарий представляет собой своего рода сборник
научных терминов и «профессионализмов», разъяснение
которых требуется для понимания сути работы. Таким
образом, глоссарий является толковым словарем
специальных терминов. В него входят термины, которые
чаще других упоминаются в работе.
• Глоссарий является структурной частью работы. Как
правило, он приводится в конце работы после списка
литературы или перед ним.
• Поэтому целесообразно сначала ознакомиться с
методическими рекомендациями по выполнению
конкретной работы, в которых будут приведены и
требования к оформлению глоссария.
• В некоторых случаях глоссарий оформляют в отдельной
папке и используют титульный лист.
23.
Правила составления глоссария• Чтобы глоссарий подчеркивал положительные стороны
работы, его следует составлять по основным правилам:
• использование в словаре только тех терминов, которые
отражают суть работы и подходят к профилю дисциплины;
• указание ссылки на источник, из которого заимствовано
определение;
• использование исключительно новых для студента
терминов для исключения дублирования материала (это
правило не касается диссертации – там должны быть
собраны, в первую очередь, новые для членов комиссии
определения;
• рекомендуемое количество терминов – обычно по
рекомендации преподавателя;
• расположение терминов в алфавитном порядке (если не
предусмотрено иное).
24.
Внеаудиторная самостоятельнаяработа
1.Составить глоссарий терминов.
2.Учебник «Теория и практика лабораторных
биохимических исследований»
Н.В.Любимова, И.В.Бабкина, Ю.С.Тимофеев,
25.
Список литературыОсновные источники:
1.Учебник «Теория и практика лабораторных биохимических
исследований» Н.В.Любимова, И.В.Бабкина, Ю.С.Тимофеев,
учебное пособие.- М.: Гэотар-медиа, 2019.
2.Л.М. Пустовалова Теория лабораторных биохимических
исследований, Ростов н/Д; Феникс, 2016 г. (Среднее
медицинское образование)
3.Кишкун А.А. Клиническая лабораторная диагностика:
учебное пособие.- М.: Гэотар-медиа, 2013.
4.Клиническая лабораторная диагностика : Т. 1, 2 / под ред.
профессора В. В.Долгова. — М. : ООО «Лабдиаг», 2018.
Интернет-ресурсы:
https://himija-online.ru-kisloty/nukleinovye-kisloty.html
http://refleader.ru/poljgemerujgaty.html
https://biohimist.ru/podborka-lektsij-po-biokhimii






















 Биология
Биология








