Похожие презентации:
Гетеро-функциональные соединения
1.
Федеральное государственное бюджетное образовательное учреждениевысшего образования
Кемеровский государственный медицинский университет
Министерства здравоохранения Российской Федерации
Кафедра фармацевтической и общей химии
Гетерофункциональные
соединения
2.
ПЛАН ЛЕКЦИИ:1. Классификация гетерофункциональных
соединений.
2. Гидроксикислоты (классификация,
изомерия, физические и химические
свойства).
3. Оксокислоты (классификация, изомерия,
химические свойства).
4. Фенолокислоты.
5. Аминоспирты.
2
3.
1. Классификация гетерофункциональныхсоединений
3
4.
Гетерофункциональныесоединения – органические
соединения с функциональными
группами различных классов
(аминоспирты, фенолокислоты,
гидроксикислоты, оксокислоты).
4
5.
2. Гидроксикислоты5
6.
ГИДРОКСИКИСЛОТЫ – это производныекарбоновых кислот, у которых один или
несколько атомов водорода в радикале
замещены
соответствующим
числом
гидроксильных.
Общая формула гидроксикислот:
(OH)m – R – (COOH)n,
где n – количество карбоксильных групп,
m – гидроксильных.
6
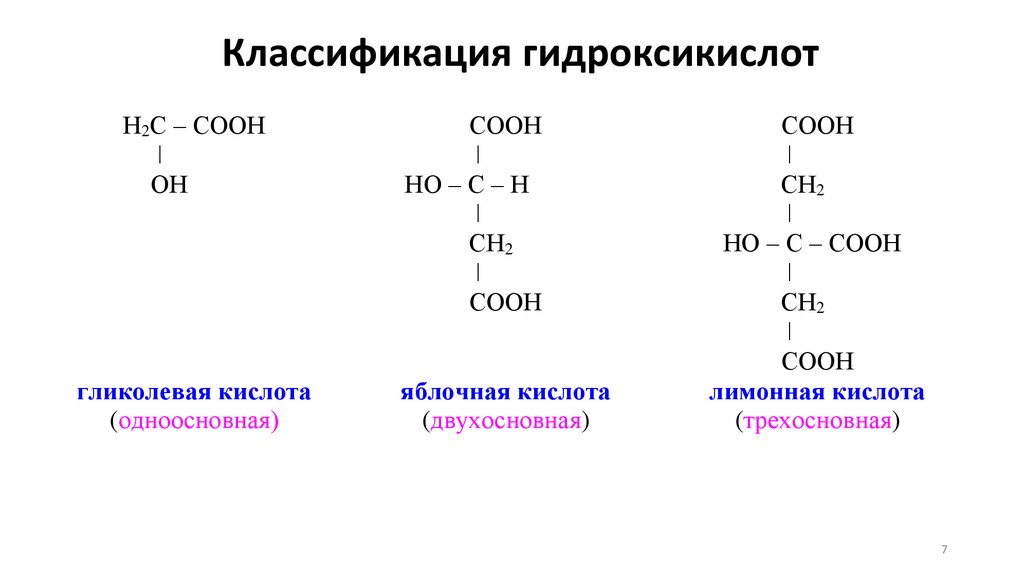
7.
Классификация гидроксикислотН2С – СООН
ǀ
ОН
гликолевая кислота
(одноосновная)
СООН
ǀ
НО – С – Н
ǀ
СН2
ǀ
СООН
яблочная кислота
(двухосновная)
СООН
ǀ
СН2
ǀ
НО – С – СООН
ǀ
СН2
ǀ
СООН
лимонная кислота
(трехосновная)
7
8.
Наиболее важные представители гидроксикислотН2С – СООН
ǀ
ОН
гликолевая кислота
(α-гидроксиуксусная,
2-гидроксиэтановая)
8
9.
Н3С – СН – СООНǀ
ОН
молочная кислота
(α-гидроксипропионовая,
2-гидроксипропановая)
9
10.
Н3С – СН – СН2 – СООНǀ
ОН
β-гидроксимасляная
кислота
(3-гидроксибутановая)
10
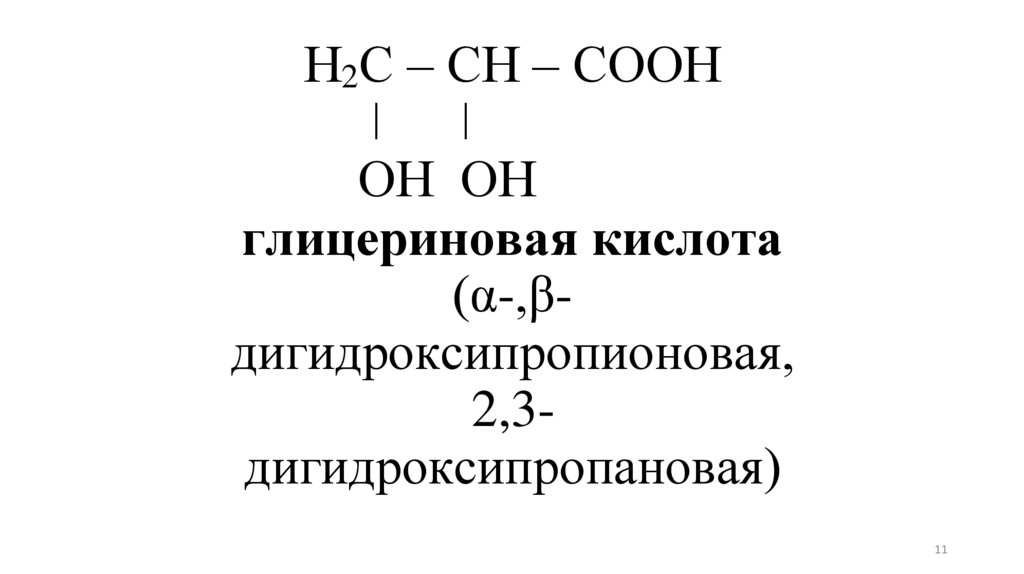
11.
Н2С – СН – СООНǀ
ǀ
ОН ОН
глицериновая кислота
(α-,βдигидроксипропионовая,
2,3дигидроксипропановая)
Фосф
обме
11
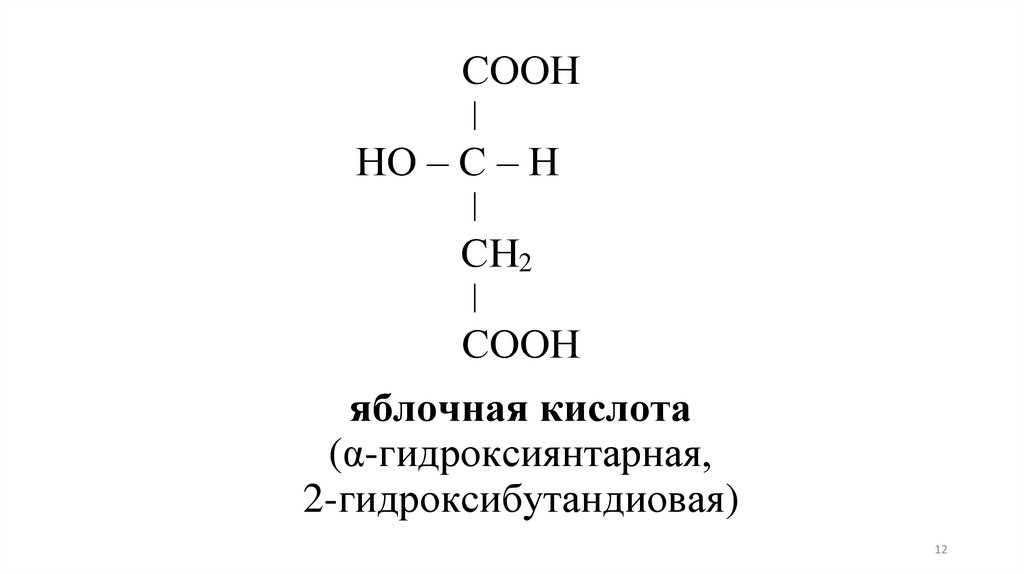
12.
СООНǀ
НО – С – Н
ǀ
СН2
ǀ
СООН
Содержит
в ягодах р
участвует
и человек
цикла три
и произв
малатам
яблочная кислота
(α-гидроксиянтарная,
2-гидроксибутандиовая)
12
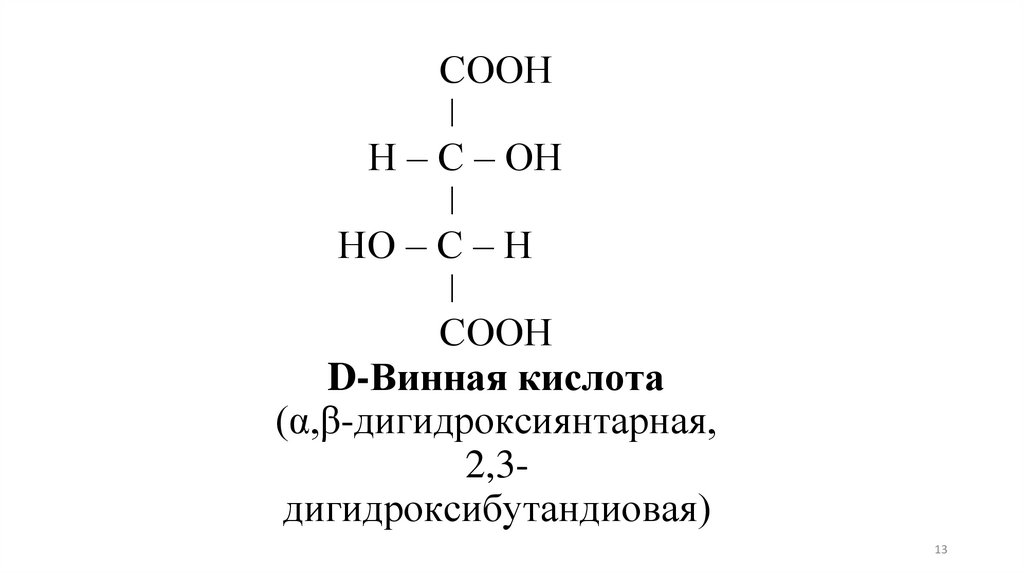
13.
СООНǀ
Н – С – ОН
ǀ
НО – С – Н
ǀ
СООН
D-Винная кислота
(α,β-дигидроксиянтарная,
2,3дигидроксибутандиовая)
Находится в
в винограде
кислой кал
процессе ви
Соли и с
называются
13
14.
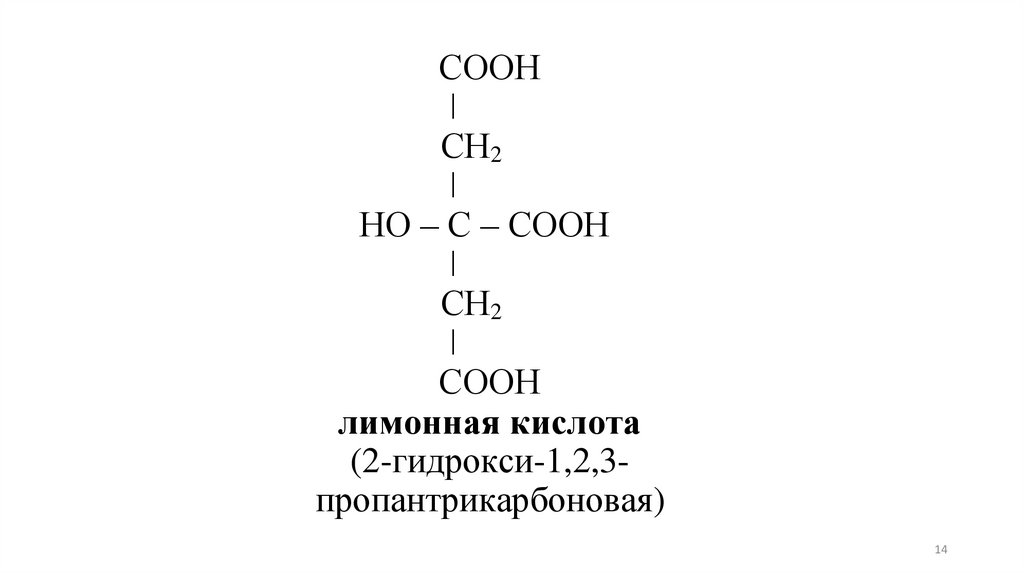
СООНǀ
СН2
ǀ
НО – С – СООН
ǀ
СН2
ǀ
СООН
лимонная кислота
(2-гидрокси-1,2,3пропантрикарбоновая)
Впервые выделе
кислота участву
промежуточным
трикарбоновых
называются
цитратами.
антикоагулянтом
крови и использ
крови. Он связ
свёртывания
нерастворимый
используется при
14
15.
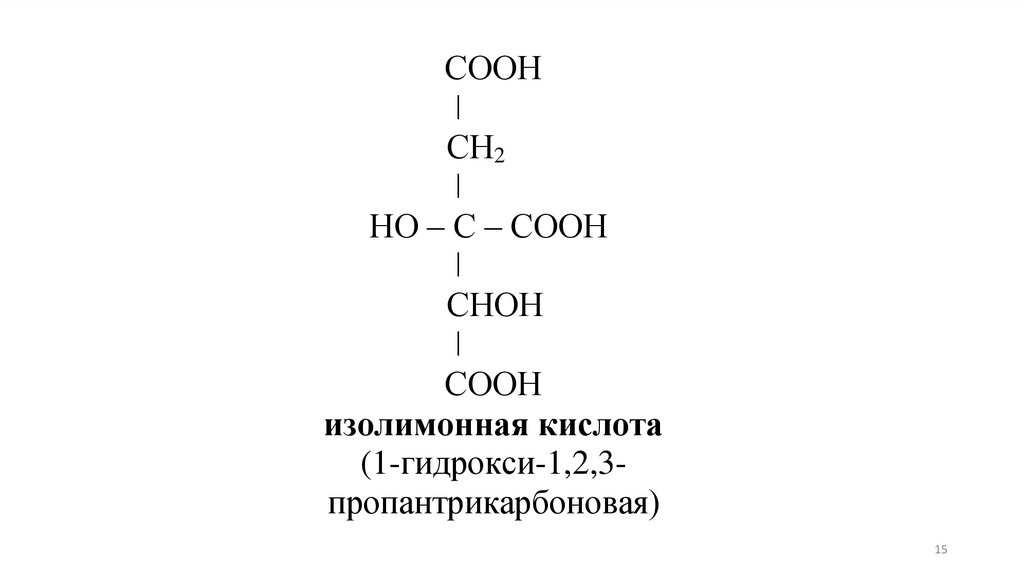
СООНǀ
СН2
ǀ
НО – С – СООН
ǀ
СНОН
ǀ
СООН
изолимонная кислота
(1-гидрокси-1,2,3пропантрикарбоновая)
изолимон
Соли
изоцитратами. И
обмене вещест
метаболитом цикл
15
16.
Структурная изомериягидроксикислот обусловлена
строением (разветвлением)
углеродного скелета и
положением гидроксильной группы
относительно карбоксила.
16
17.
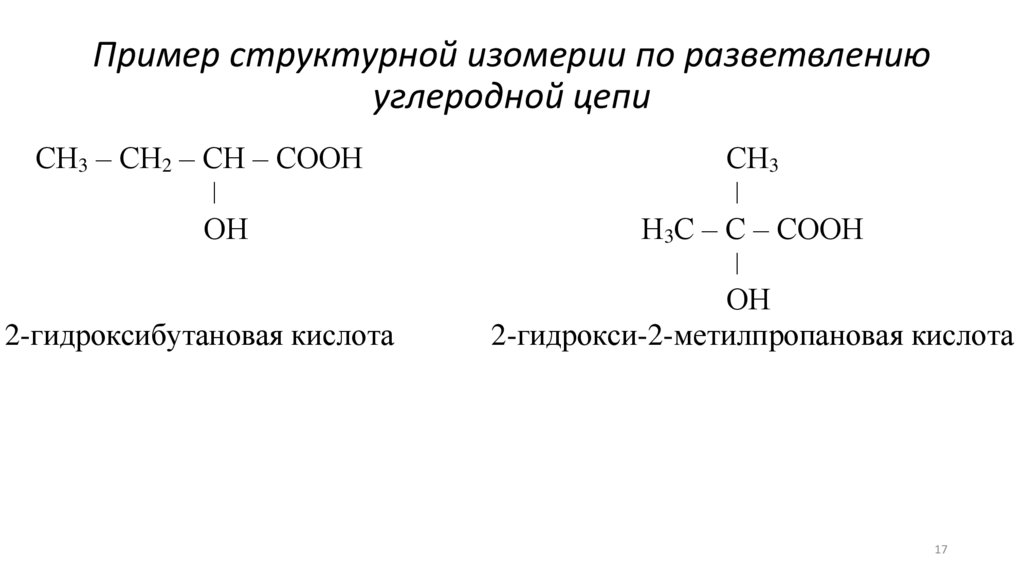
Пример структурной изомерии по разветвлениюуглеродной цепи
СН3 – СН2 – СН – СООН
ǀ
ОН
2-гидроксибутановая кислота
СН3
ǀ
Н3С – С – СООН
ǀ
ОН
2-гидрокси-2-метилпропановая кислота
17
18.
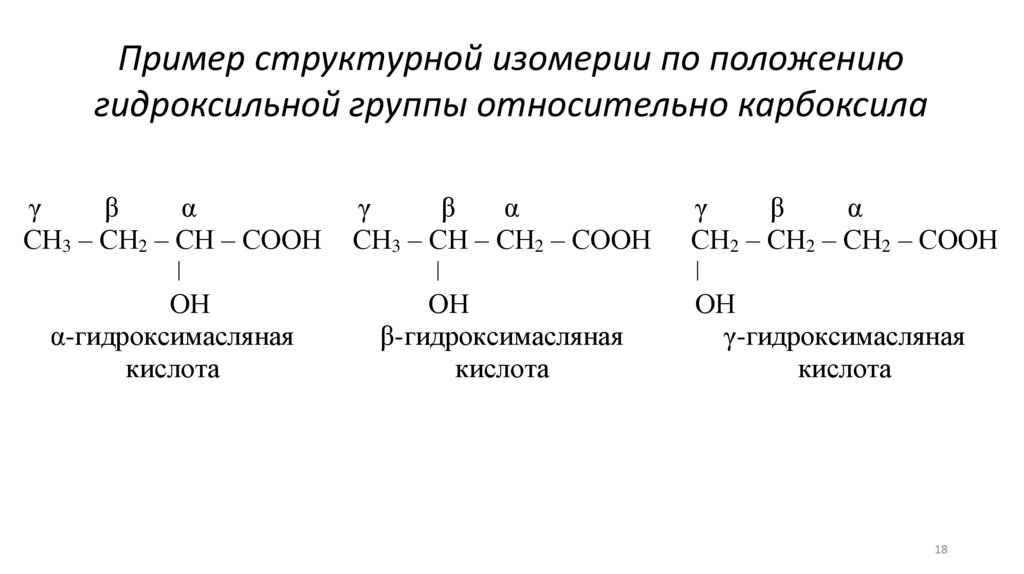
Пример структурной изомерии по положениюгидроксильной группы относительно карбоксила
γ
β
α
СН3 – СН2 – СН – СООН
ǀ
ОН
α-гидроксимасляная
кислота
γ
β
α
СН3 – СН – СН2 – СООН
ǀ
ОН
β-гидроксимасляная
кислота
γ
β
α
СН2 – СН2 – СН2 – СООН
ǀ
ОН
γ-гидроксимасляная
кислота
18
19.
Оптическая изомерия обусловлена наличиемассиметричных атомов углерода С*
СООН
ǀ
НО – С* – Н
ǀ
СН3
L-молочная кислота
СООН
ǀ
Н – С* – ОН
ǀ
СН3
D-молочная кислота
19
20.
Физические и химические свойства гидроксикислотФизические свойства. Простейшие представители
одноосновных гидроксикислот густые жидкости или
твердые вещества. Двух- и трехосновные
гидроксикислоты – твердые кристаллические
вещества. Многие обладают оптической активностью.
Химические свойства. Свойства характерные как для
карбоновых кислот, так и для спиртов.
20
21.
Диссоциация гидроксикислотСН3 – СН – СООН →
ǀ
←
ОН
СН3 – СН – СОО
ǀ
ОН
лактат-анион
–
+ Н+
Реакции по карбоксильной группе
21
22.
* При взаимодействии со щелочами образуютсясоли
О
ǀǀ
СН3 – СН – С – ОН
ǀ
ОН
+ NaOH
→
О
ǀǀ
СН3 – СН – С – ОNa
ǀ
ОН
лактат натрия
+ Н2О
22
23.
* При взаимодействии со спиртами в кислой средеобразуются сложные эфиры
О
ǀǀ
СН3 – СН – С – ОН
ǀ
ОН
+ CН3 – OH
H2SO4
→
О
ǀǀ
СН3 – СН – С – О – СН3
ǀ
ОН
метиллактат
+ Н2О
23
24.
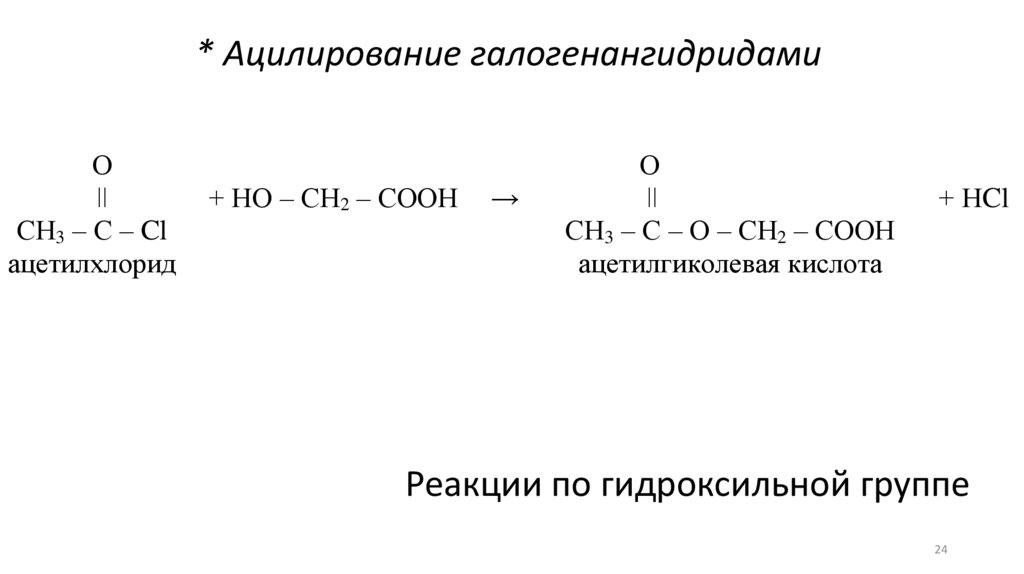
* Ацилирование галогенангидридамиО
ǀǀ
СН3 – С – Cl
ацетилхлорид
+ НО – СН2 – СООН
→
О
ǀǀ
СН3 – С – О – СН2 – СООН
ацетилгиколевая кислота
+ НCl
Реакции по гидроксильной группе
24
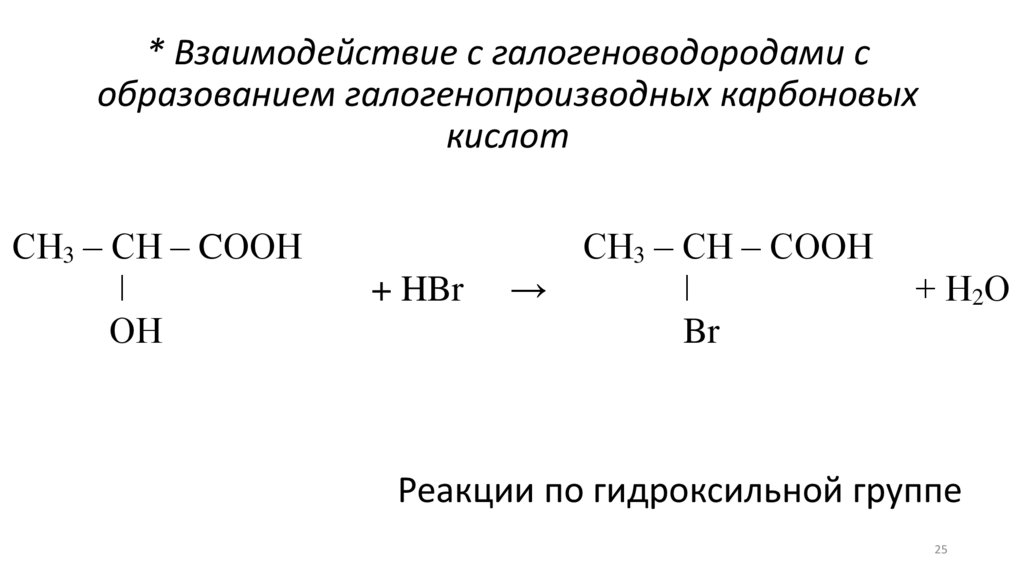
25.
* Взаимодействие с галогеноводородами собразованием галогенопроизводных карбоновых
кислот
СН3 – СН – CООН
ǀ
ОН
+ HBr
СН3 – СН – СООН
→
ǀ
Br
+ Н2О
Реакции по гидроксильной группе
25
26.
3. Оксокислоты26
27.
ОКСОКИСЛОТЫ – это соединения,содержащие наряду с карбоксильной
карбонильную (оксо-) группу. Они
подразделяются на альдегидо- и
кетокислоты. В зависимости от
расположения функциональных групп
различают α-, β-, γ- оксокислоты и т.д.
27
28.
СООНǀ
С=О
ǀ
Н
глиоксалевая
(глиоксиловая) кислота
(2-оксоэтановая)
Глио
проц
28
29.
СООНǀ
С=О
ǀ
СН3
пировиноградная
кислота
(α-кетопропионовая,
2-оксопропановая)
Пировин
процесса
промежу
Соли и
называю
пируват
29
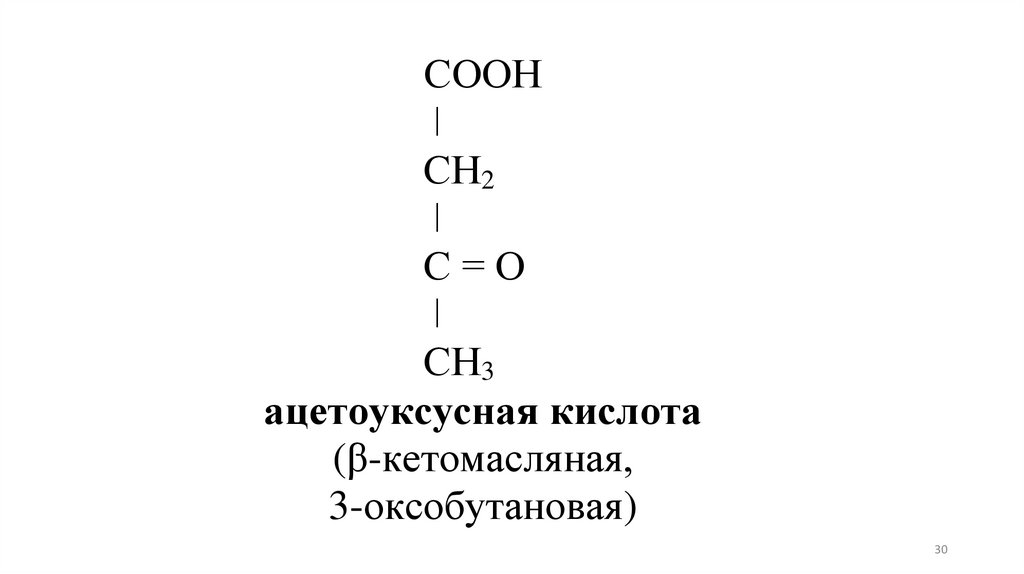
30.
СООНǀ
СН2
ǀ
С=О
ǀ
СН3
ацетоуксусная кислота
(β-кетомасляная,
3-оксобутановая)
Ацетоуксусн
веществ. От
кетозом и
нарушения
повышенное
кислоты и п
эфиры ац
ацетоацет
30
31.
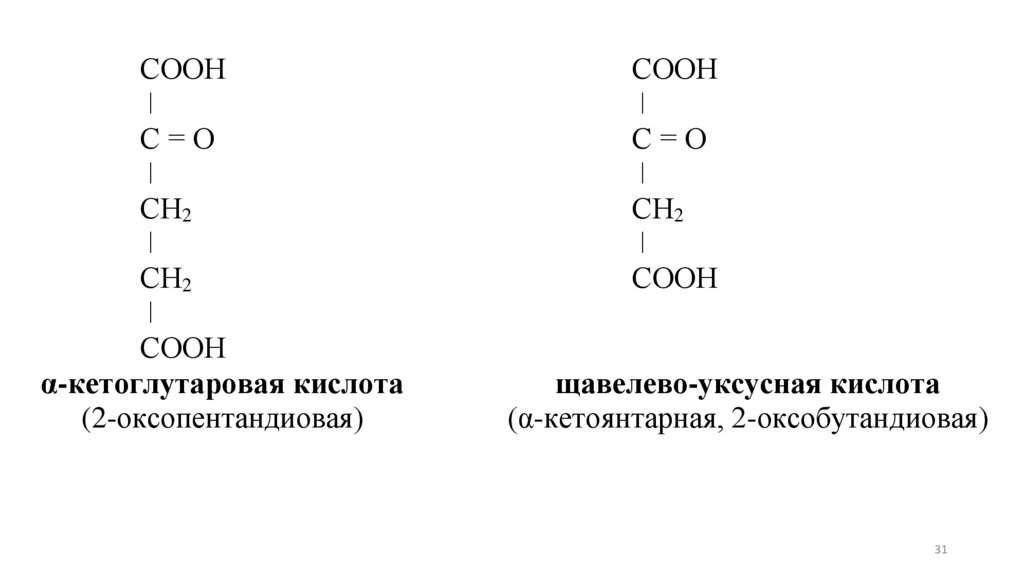
СООНǀ
С=О
ǀ
СН2
ǀ
СН2
ǀ
СООН
α-кетоглутаровая кислота
(2-оксопентандиовая)
СООН
ǀ
С=О
ǀ
СН2
ǀ
СООН
щавелево-уксусная кислота
(α-кетоянтарная, 2-оксобутандиовая)
31
32.
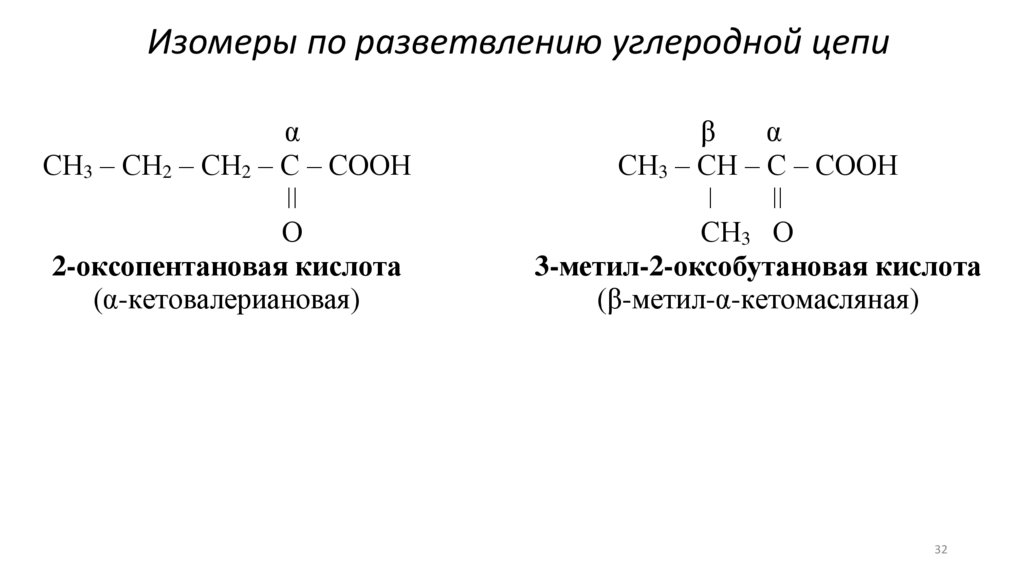
Изомеры по разветвлению углеродной цепиα
СН3 – СН2 – СН2 – С – СООН
ǀǀ
О
2-оксопентановая кислота
(α-кетовалериановая)
β
α
СН3 – СН – С – СООН
ǀ
ǀǀ
СН3 О
3-метил-2-оксобутановая кислота
(β-метил-α-кетомасляная)
32
33.
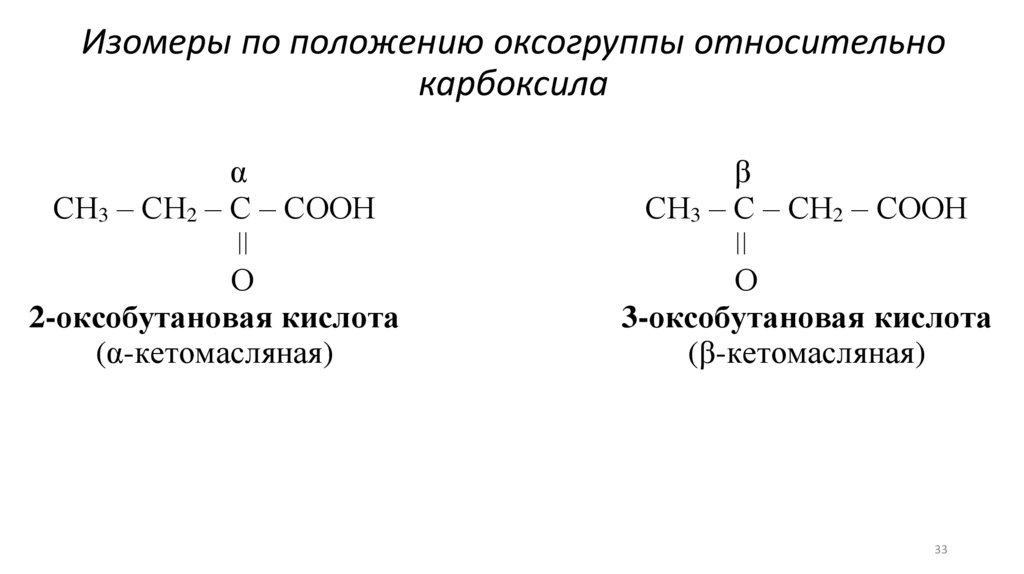
Изомеры по положению оксогруппы относительнокарбоксила
α
СН3 – СН2 – С – СООН
ǀǀ
О
2-оксобутановая кислота
(α-кетомасляная)
β
СН3 – С – СН2 – СООН
ǀǀ
О
3-оксобутановая кислота
(β-кетомасляная)
33
34.
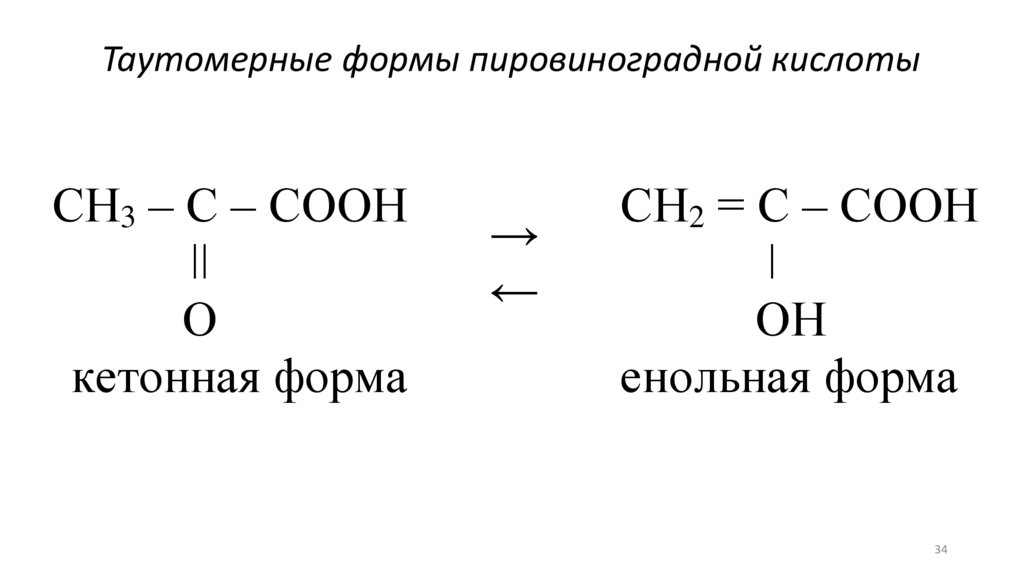
Таутомерные формы пировиноградной кислотыСН3 – С – СООН
ǀǀ
О
кетонная форма
→
←
СН2 = С – СООН
ǀ
ОН
енольная форма
34
35.
Диссоциация оксокислотСН3 – С – СООН →
ǀǀ
←
О
СН3 – С – СОО
ǀǀ
О
пируват-анион
–
+ Н+
35
36.
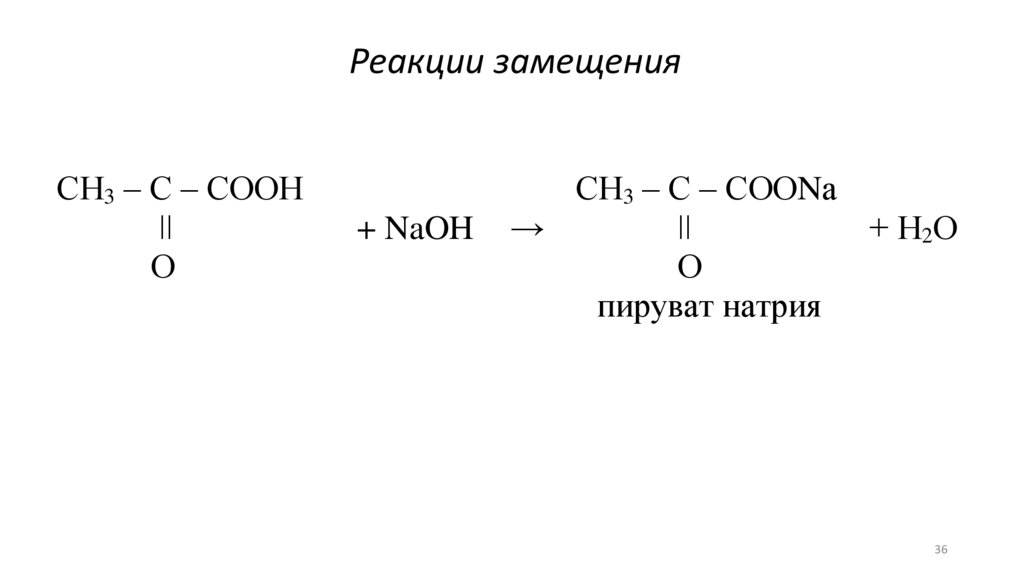
Реакции замещенияСН3 – С – СООН
ǀǀ
О
+ NaOH
СН3 – С – СООNа
→
ǀǀ
+ Н2О
О
пируват натрия
36
37.
Реакции присоединенияСН3 – С – СООН
ǀǀ
О
+ H2
СН3 – СН – СООН
→
ǀ
ОН
молочная кислота
37
38.
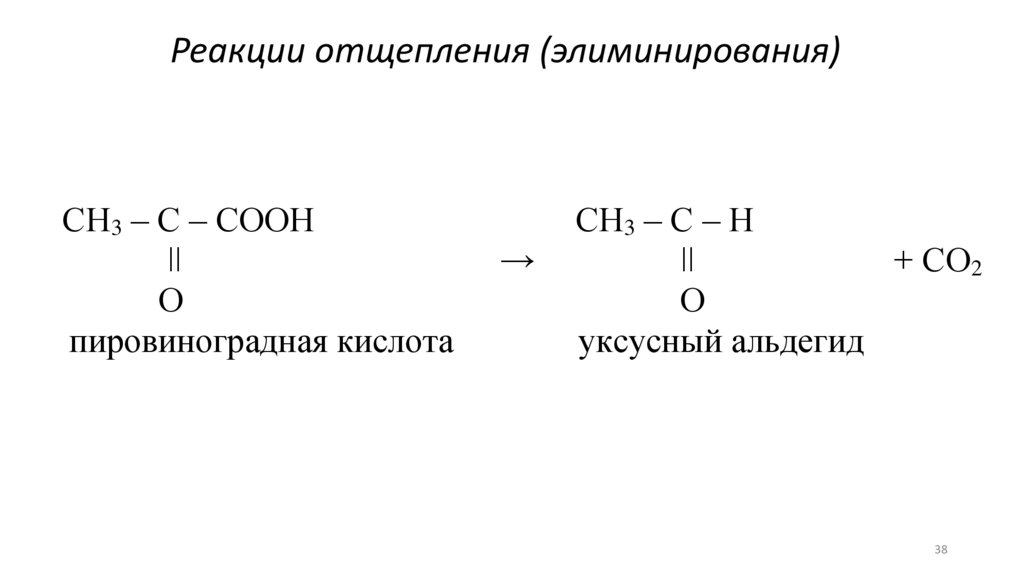
Реакции отщепления (элиминирования)СН3 – С – СООН
ǀǀ
О
пировиноградная кислота
→
СН3 – С – Н
ǀǀ
+ СО2
О
уксусный альдегид
38
39.
4. Фенолокислоты39
40.
ФЕНОЛОКИСЛОТЫ – этогетерофункциональные
соединения, имеющие в своей
структуре карбоксильную группу
и фенольный гидроксил.
40
41.
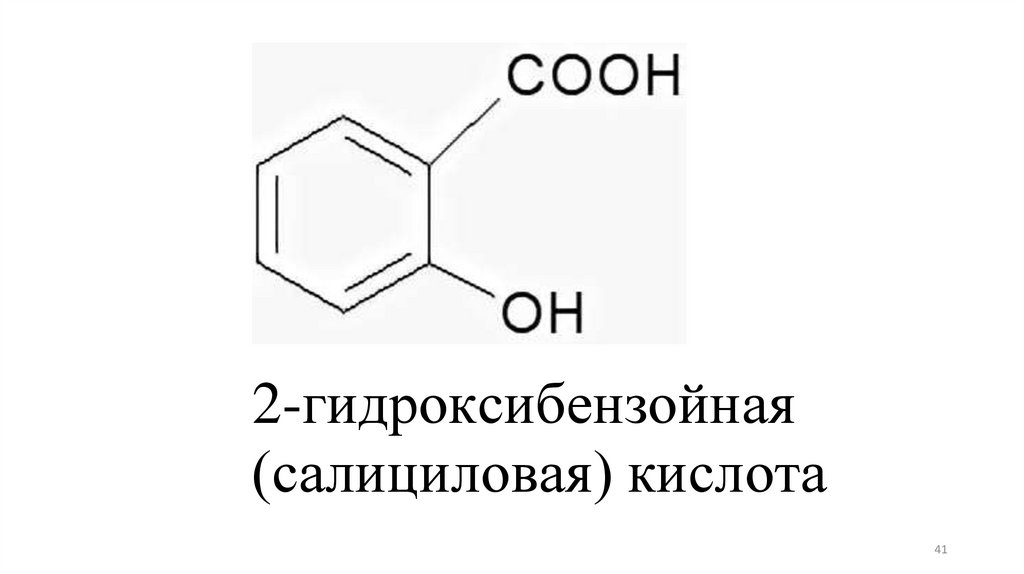
2-гидроксибензойная(салициловая) кислота
41
42.
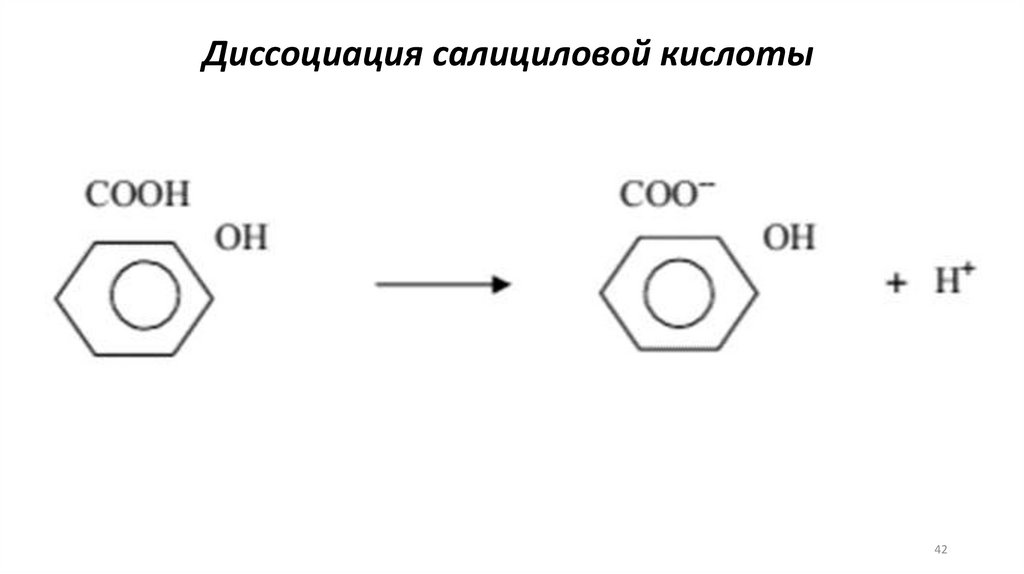
Диссоциация салициловой кислоты42
43.
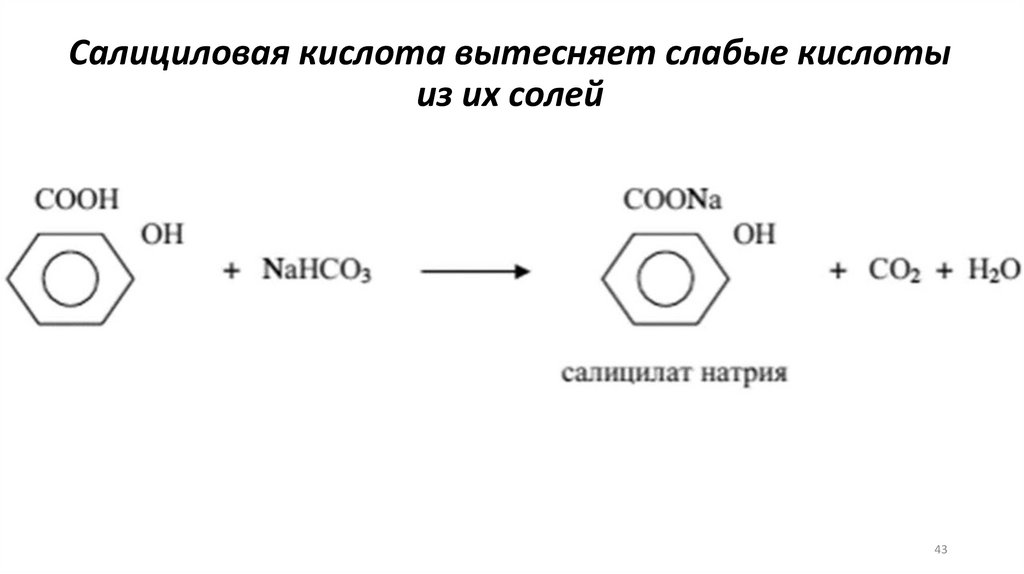
Салициловая кислота вытесняет слабые кислотыиз их солей
43
44.
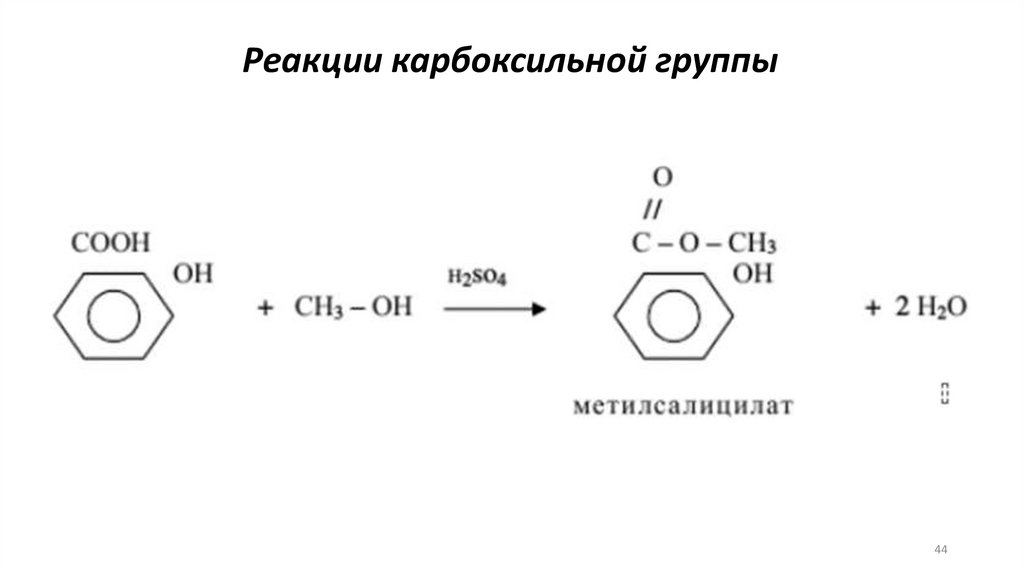
Реакции карбоксильной группы44
45.
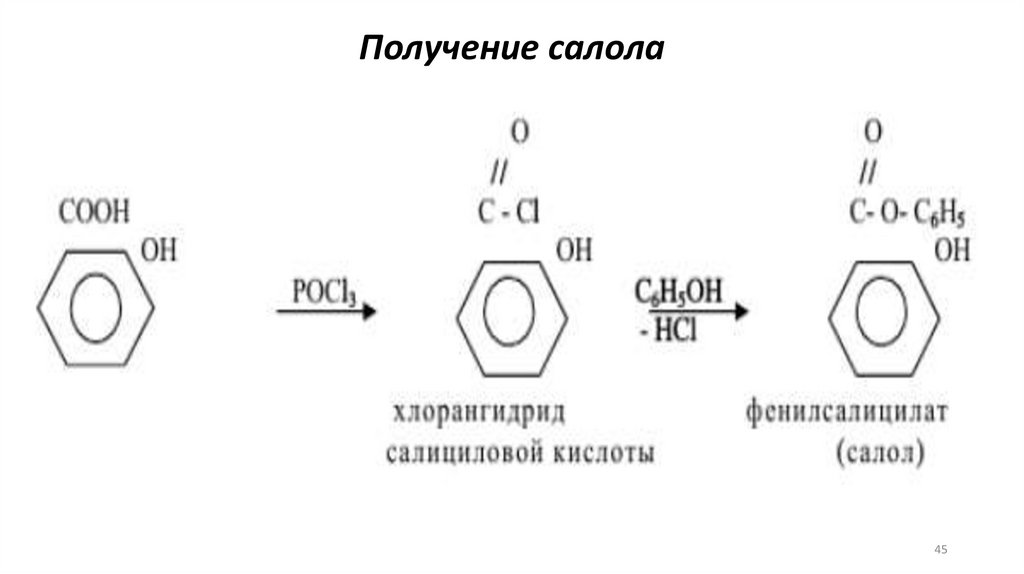
Получение салола45
46.
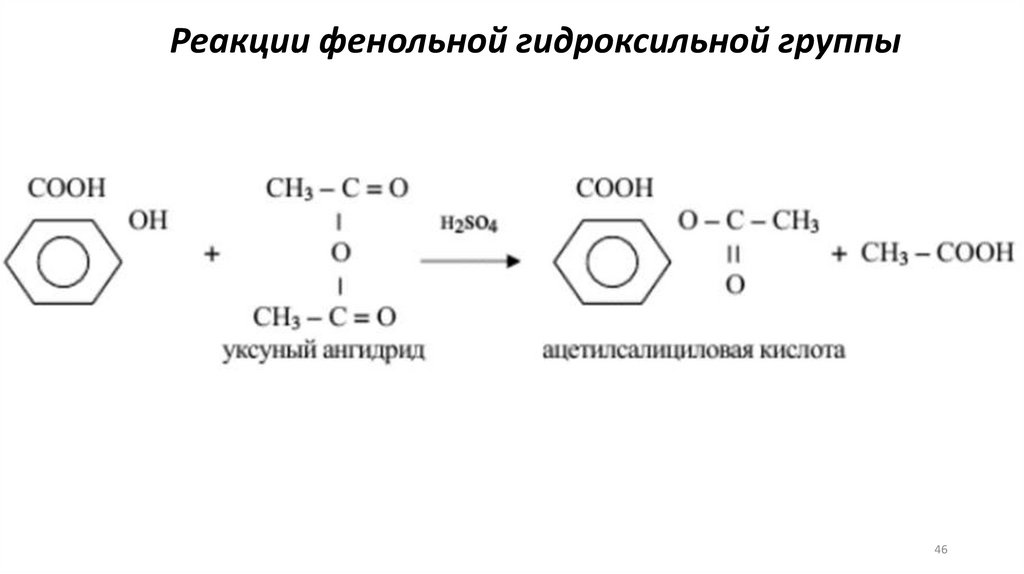
Реакции фенольной гидроксильной группы46
47.
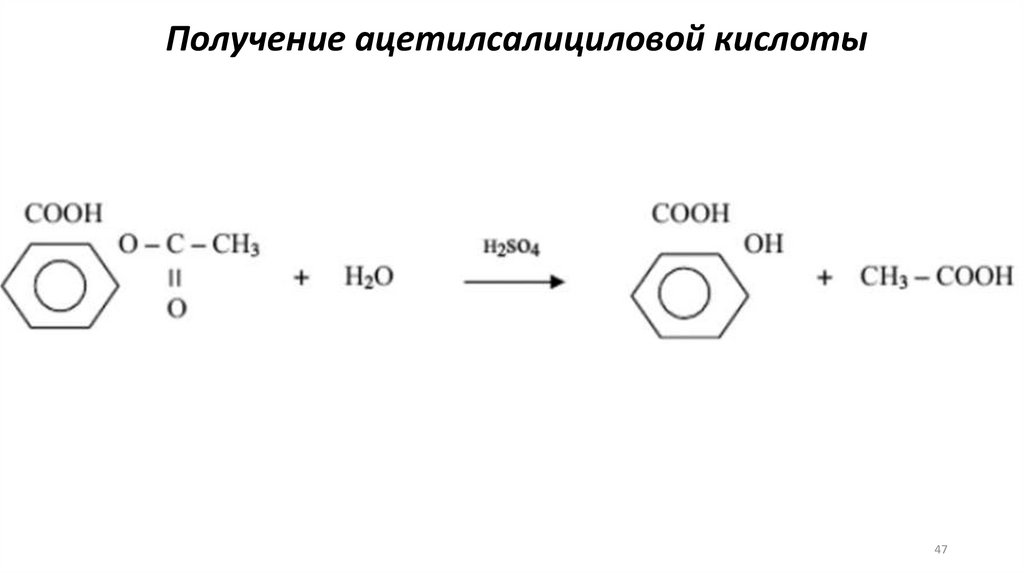
Получение ацетилсалициловой кислоты47
48.
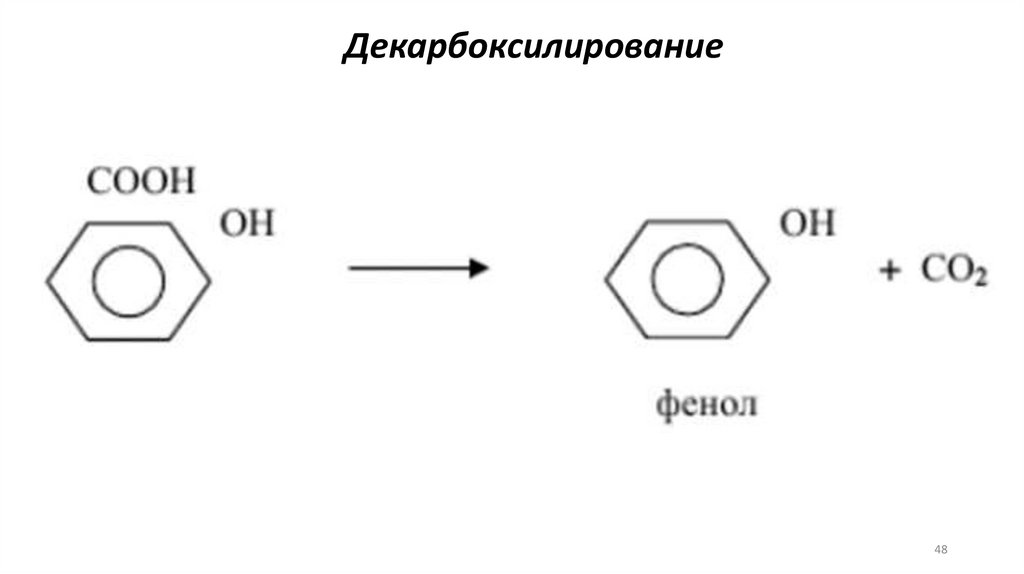
Декарбоксилирование48
49.
5. Аминоспирты49
50.
АМИНОСПИРТЫ – этопроизводные углеводородов,
содержащие одновременно
амино- и гидроксильную группы.
H2N – CH2 – CH2 – OH
2-аминоэтанол (коламин)
50
51.
5152.
БЛАГОДАРЮ ЗА ВНИМАНИЕ!52



























 Химия
Химия








