Похожие презентации:
Гидроксикислоты. Оксокислоты
1.
Гидроксикислоты.Оксокислоты
(семинар)
2.
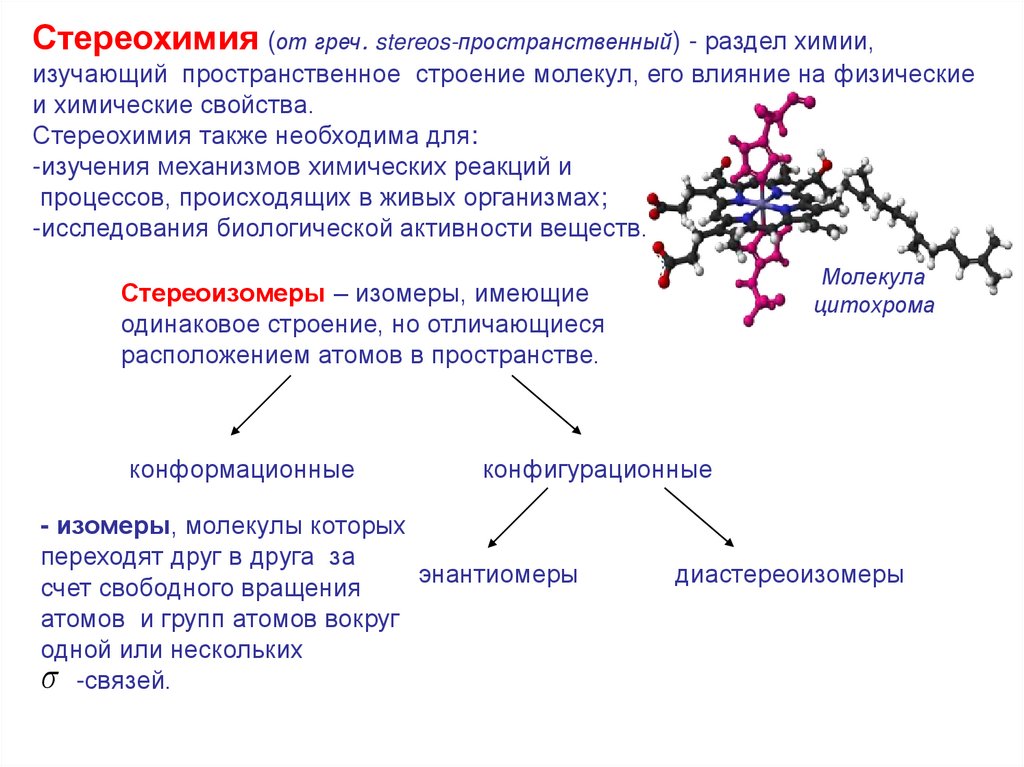
Стереохимия (от греч. stereos-пространственный) - раздел химии,изучающий пространственное строение молекул, его влияние на физические
и химические свойства.
Стереохимия также необходима для:
-изучения механизмов химических реакций и
процессов, происходящих в живых организмах;
-исследования биологической активности веществ.
Молекула
цитохрома
Стереоизомеры – изомеры, имеющие
одинаковое строение, но отличающиеся
расположением атомов в пространстве.
конформационные
конфигурационные
- изомеры, молекулы которых
переходят друг в друга за
энантиомеры
счет свободного вращения
атомов и групп атомов вокруг
одной или нескольких
-связей.
диастереоизомеры
3.
Конфигурационными изомерами называются стереоизомеры, молекулыкоторых имеют различное расположение атомов в пространстве без учета
конформаций. Конфигурационные изомеры не могут превращаться друг в
друга без разрыва химических связей.
Энантиомеры – стереоизомеры, относящиеся друг к другу как предмет и
несовместимое с ним зеркальное изображение.
Хиральность (сheir (греч.) рука) - свойство объекта быть несовместимым
со своим зеркальным изображением любой комбинацией вращений и
перемещений в трехмерном пространстве.
4.
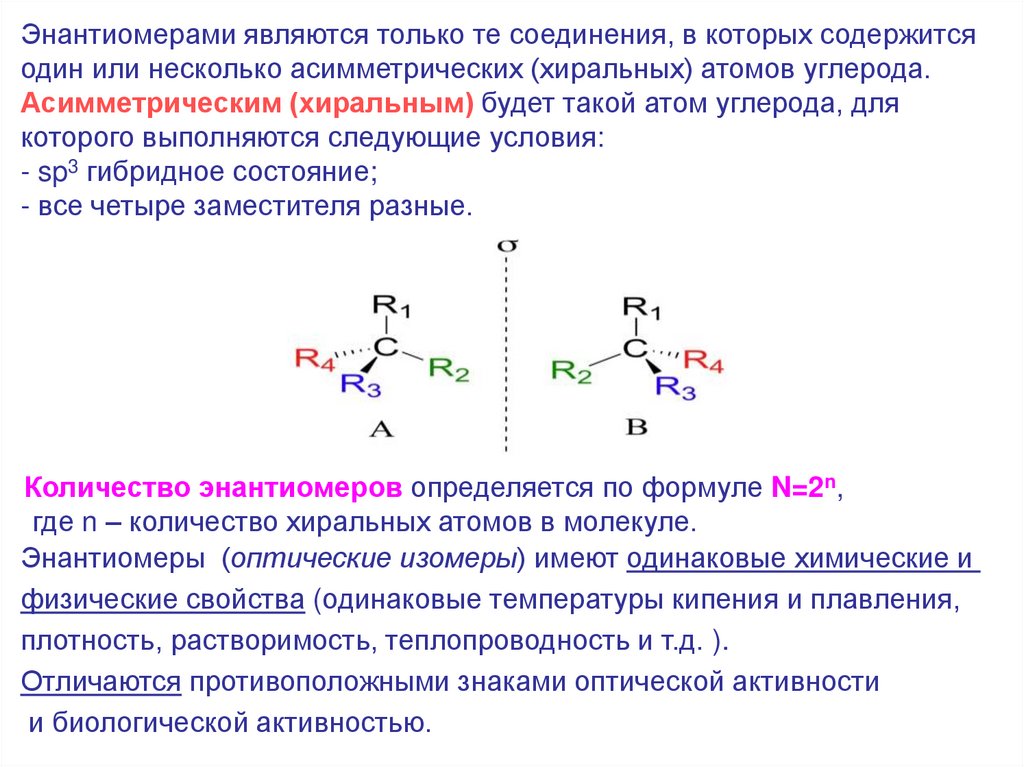
Энантиомерами являются только те соединения, в которых содержитсяодин или несколько асимметрических (хиральных) атомов углерода.
Асимметрическим (хиральным) будет такой атом углерода, для
которого выполняются следующие условия:
- sp3 гибридное состояние;
- все четыре заместителя разные.
Количество энантиомеров определяется по формуле N=2n,
где n – количество хиральных атомов в молекуле.
Энантиомеры (оптические изомеры) имеют одинаковые химические и
физические свойства (одинаковые температуры кипения и плавления,
плотность, растворимость, теплопроводность и т.д. ).
Отличаются противоположными знаками оптической активности
и биологической активностью.
5.
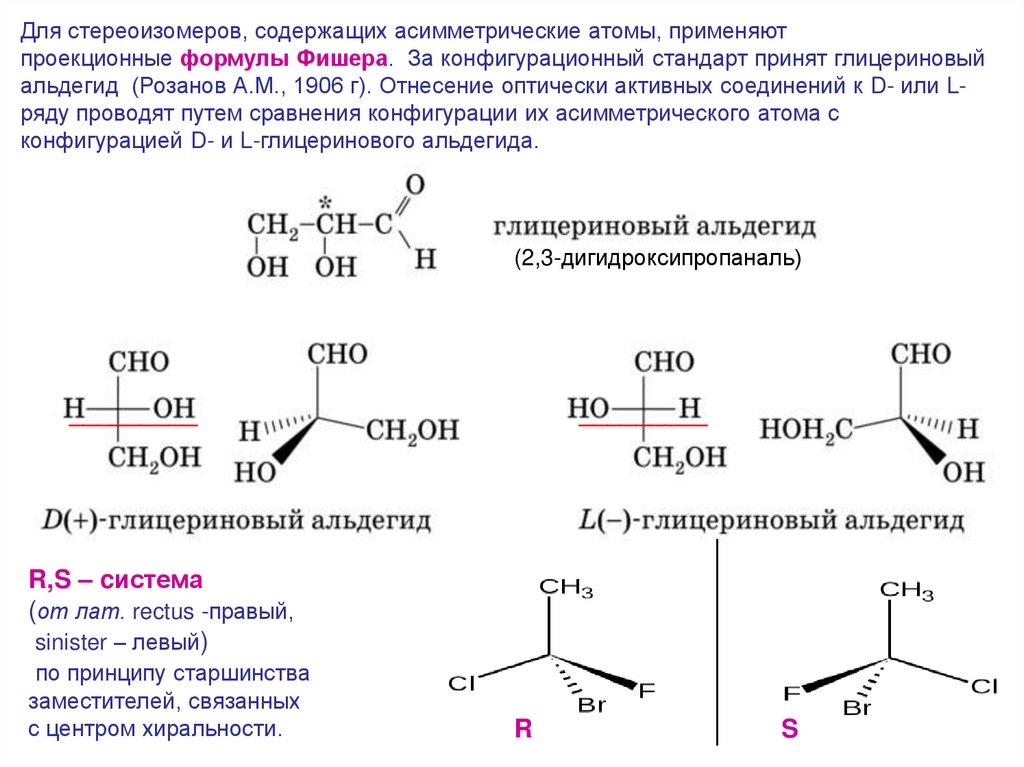
Для стереоизомеров, содержащих асимметрические атомы, применяютпроекционные формулы Фишера. За конфигурационный стандарт принят глицериновый
альдегид (Розанов А.М., 1906 г). Отнесение оптически активных соединений к D- или Lряду проводят путем сравнения конфигурации их асимметрического атома с
конфигурацией D- и L-глицеринового альдегида.
(2,3-дигидроксипропаналь)
_________
_________
R,S – cистема
(от лат. rectus -правый,
sinister – левый)
по принципу старшинства
заместителей, связанных
с центром хиральности.
R
S
6.
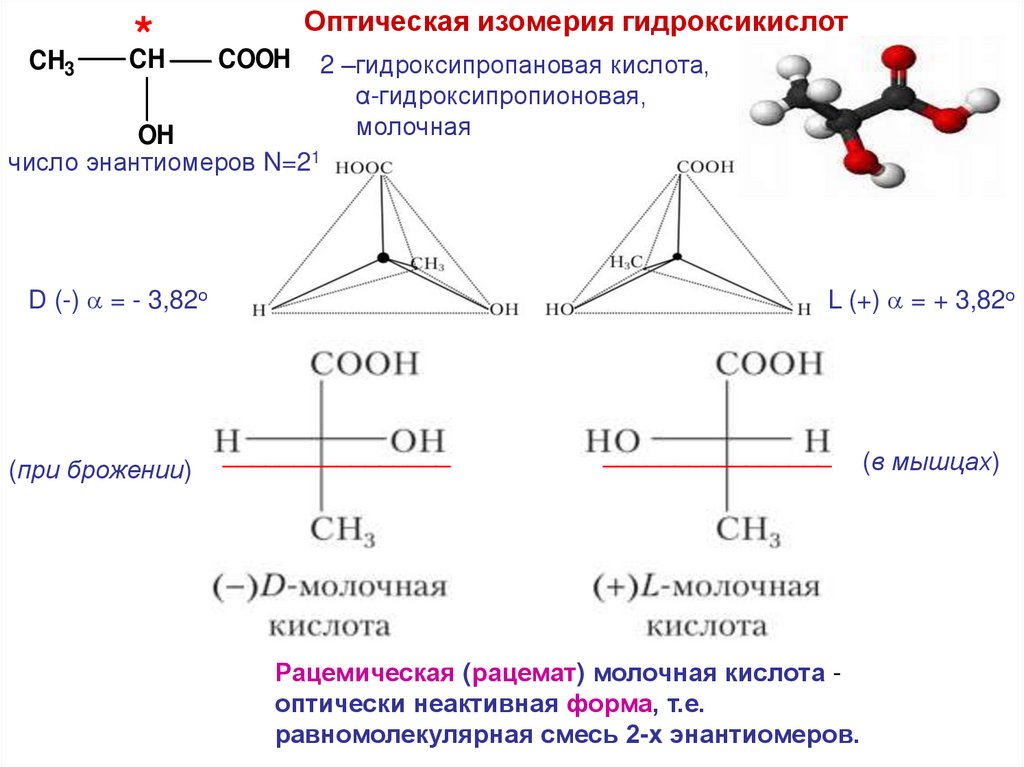
CH3*
CH
Оптическая изомерия гидроксикислот
COOH
2 –гидроксипропановая кислота,
α-гидроксипропионовая,
молочная
OH
число энантиомеров N=21
D (-) = - 3,82о
(при брожении)
L (+) = + 3,82о
________________
________________
Рацемическая (рацемат) молочная кислота оптически неактивная форма, т.е.
равномолекулярная смесь 2-х энантиомеров.
(в мышцах)
7.
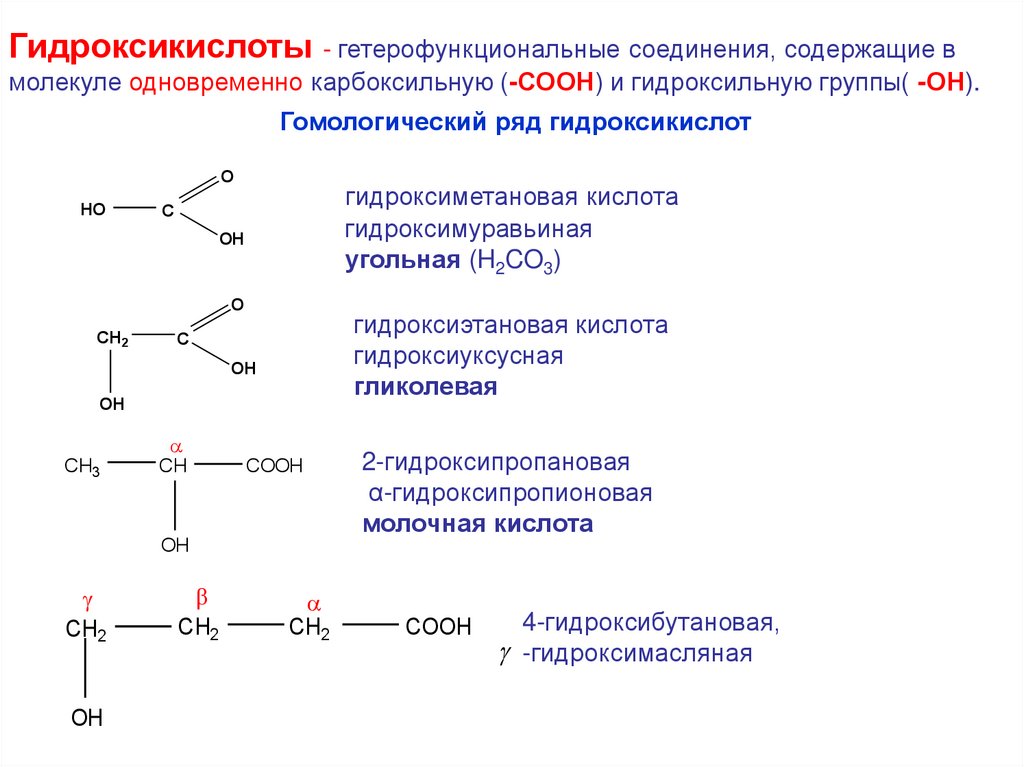
Гидроксикислоты - гетерофункциональные соединения, содержащие вмолекуле одновременно карбоксильную (-СООН) и гидроксильную группы( -ОН).
Гомологический ряд гидроксикислот
O
HO
гидроксиметановая кислота
гидроксимуравьиная
угольная (H2CO3)
C
OH
O
CH2
гидроксиэтановая кислота
гидроксиуксусная
гликолевая
C
OH
OH
CH3
CH
COOH
OH
CH2
OH
CH2
CH2
2-гидроксипропановая
α-гидроксипропионовая
молочная кислота
COOH
4-гидроксибутановая,
-гидроксимасляная
8.
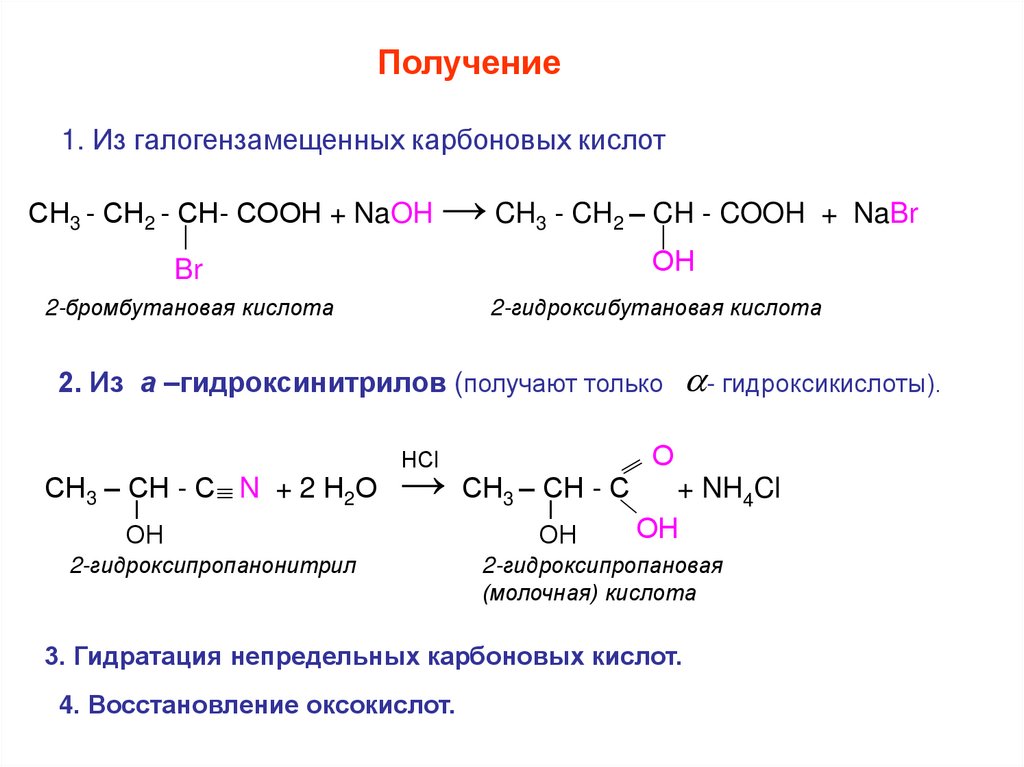
Получение1. Из галогензамещенных карбоновых кислот
СН3 - СН2 - СН- СООН + NaOH → CH3 - CH2 – CH - COOH + NaBr
|
|
ОН
Br
2-бромбутановая кислота
2-гидроксибутановая кислота
2. Из а –гидроксинитрилов (получают только
СН3 – СН - С N + 2 Н2О
Ι
ОН
НСl
→
2-гидроксипропанонитрил
О
СН3 – СН - С
Ι
ОН
+ NH4Cl
ОН
2-гидроксипропановая
(молочная) кислота
3. Гидратация непредельных карбоновых кислот.
4. Восстановление оксокислот.
- гидроксикислоты).
9.
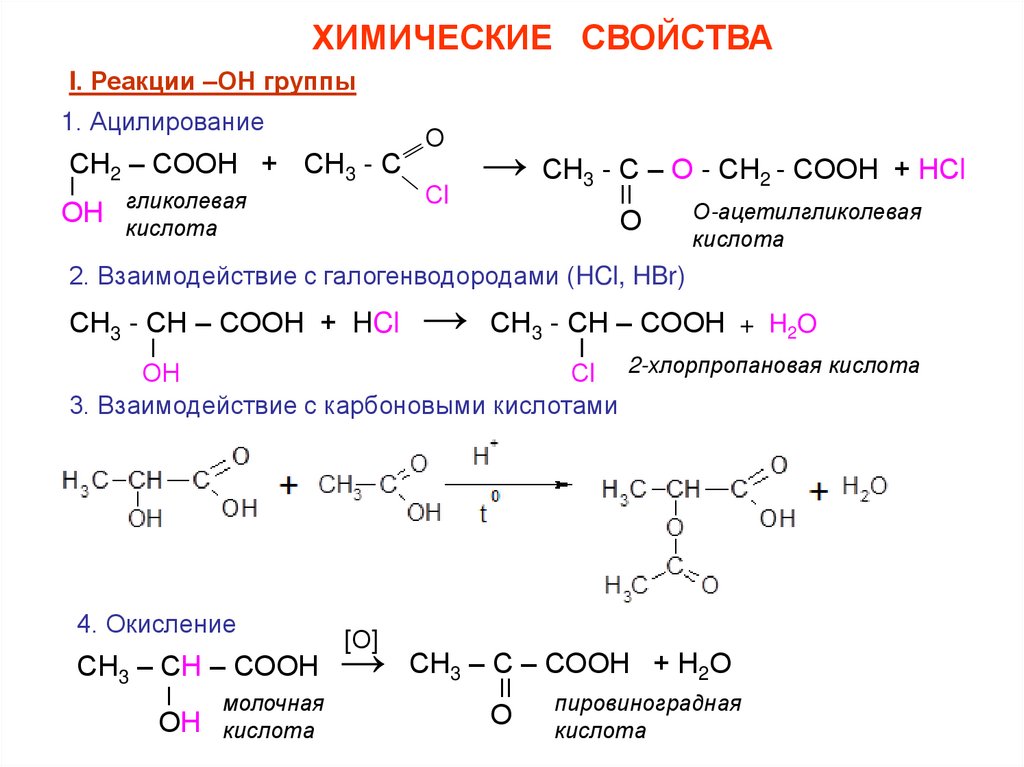
ХИМИЧЕСКИЕ СВОЙСТВАI. Реакции –ОН группы
1. Ацилирование
СН2 – СООН + СН3 - С
Ι
ОН
гликолевая
кислота
О
Сl
→
СН3 - С – О - СН2 - СООН + НСl
ΙΙ
О
О-ацетилгликолевая
кислота
2. Взаимодействие с галогенводородами (HCl, HBr)
СН3 - СН – СООН + HCl
→
СН3 - СН – СООН + H2O
Ι
l
ОН
Сl 2-хлорпропановая кислота
3. Взаимодействие с карбоновыми кислотами
4. Окисление
СН3 – СН – СООН
Ι
ОН
молочная
кислота
[О]
→
СН3 – С – СООН + Н2О
ΙΙ
О
пировиноградная
кислота
10.
II. Реакции –СООН группы1. Взаимодействие со щелочами
СН3 – СН – СООН + NaOH
Ι
→ СН3 – СН – СООNa
+ Н 2O
Ι
ОН
ОН
2. Взаимодействие с галогенидами фосфора
О +2PCl5
НО – СН2 – СН2 – С
ОН
→
O
Сl – СН2 – СН2 – С
Хлорангидрид 3-хлорпропановой
кислоты
Сl
+ 2 POCl3 + 2HCl
3. Взаимодействие с аммиаком
О
СН3 – СН – С
Ι
ОН
ОН
ОН-, t
+ NH3
→
O
СН3 – СН – С
Ι
+ Н 2O
NН2
ОН
4. Взаимодействие со спиртами (реакция этерификации)
СН3 – СН – С
Ι
ОН
О
ОН
5. Деабоксилирование
СН3 – СН – СООН
Ι
ОН
H2SO4
→
+ CH3OH
СН3 – СН – С
Ι
ОН
→
O
ОCН3
метиллактат
СН3 – СН2
Ι
ОН
+ СО2↑
+ Н 2O
11.
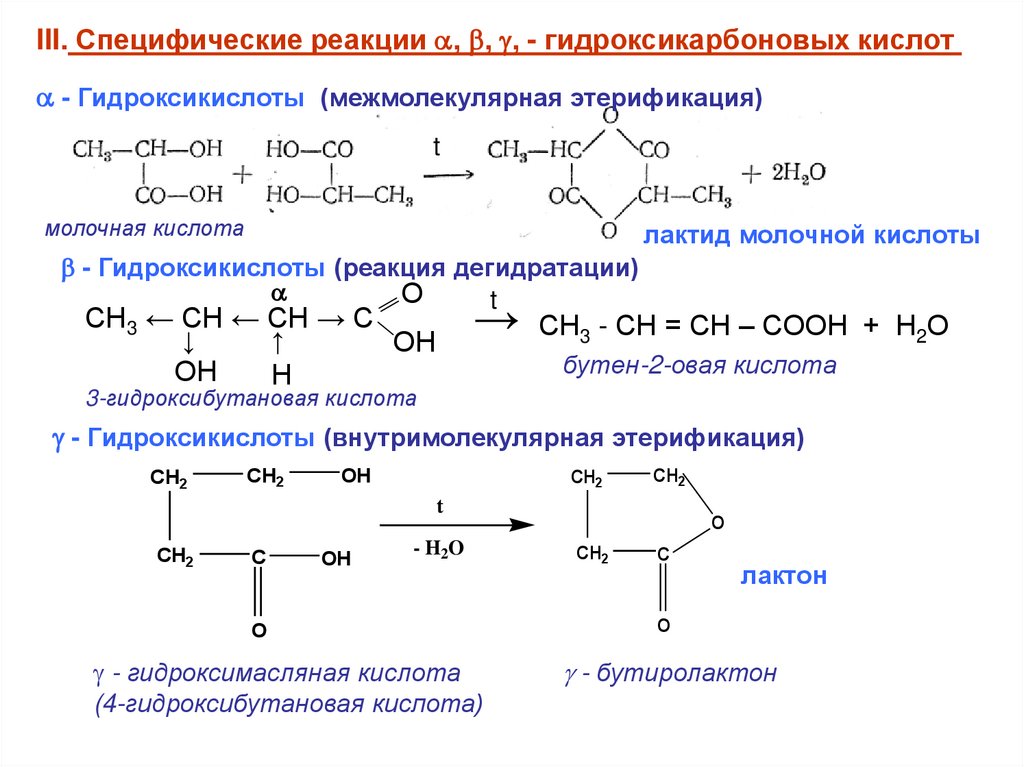
III. Специфические реакции , , , - гидроксикарбоновых кислот- Гидроксикислоты (межмолекулярная этерификация)
t
молочная кислота
лактид молочной кислоты
- Гидроксикислоты (реакция дегидратации)
О
t
СН3 ← СН ← СН → С
↓
↑
ОН
Н
→
ОН
СН3 - СН = СН – СООН + Н2О
бутен-2-овая кислота
3-гидроксибутановая кислота
- Гидроксикислоты (внутримолекулярная этерификация)
CH2
CH2
OH
CH2
CH2
t
CH2
C
OH
- H2O
O
- гидроксимасляная кислота
(4-гидроксибутановая кислота)
O
CH2
C
лактон
O
- бутиролактон
12.
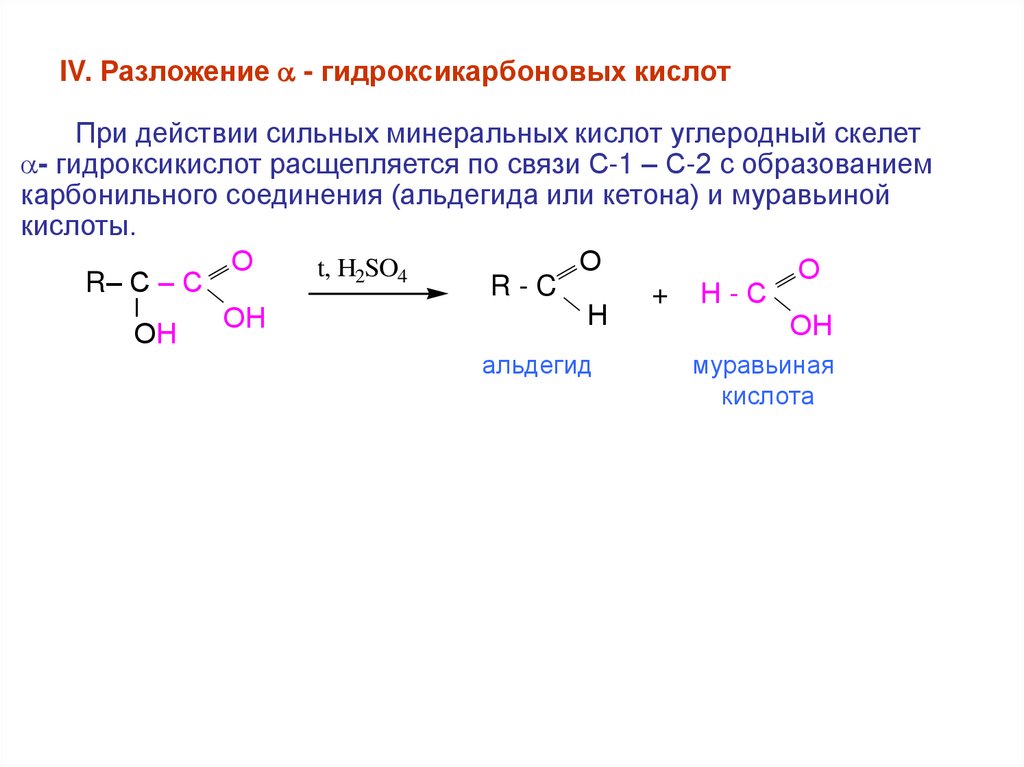
IV. Разложение - гидроксикарбоновых кислотПри действии сильных минеральных кислот углеродный скелет
- гидроксикислот расщепляется по связи С-1 – С-2 с образованием
карбонильного соединения (альдегида или кетона) и муравьиной
кислоты.
О
О
t, H2SO4
О
R– С – С
R-C
+ Н-С
Ι
Н
ОН
ОН
ОН
альдегид
муравьиная
кислота
13.
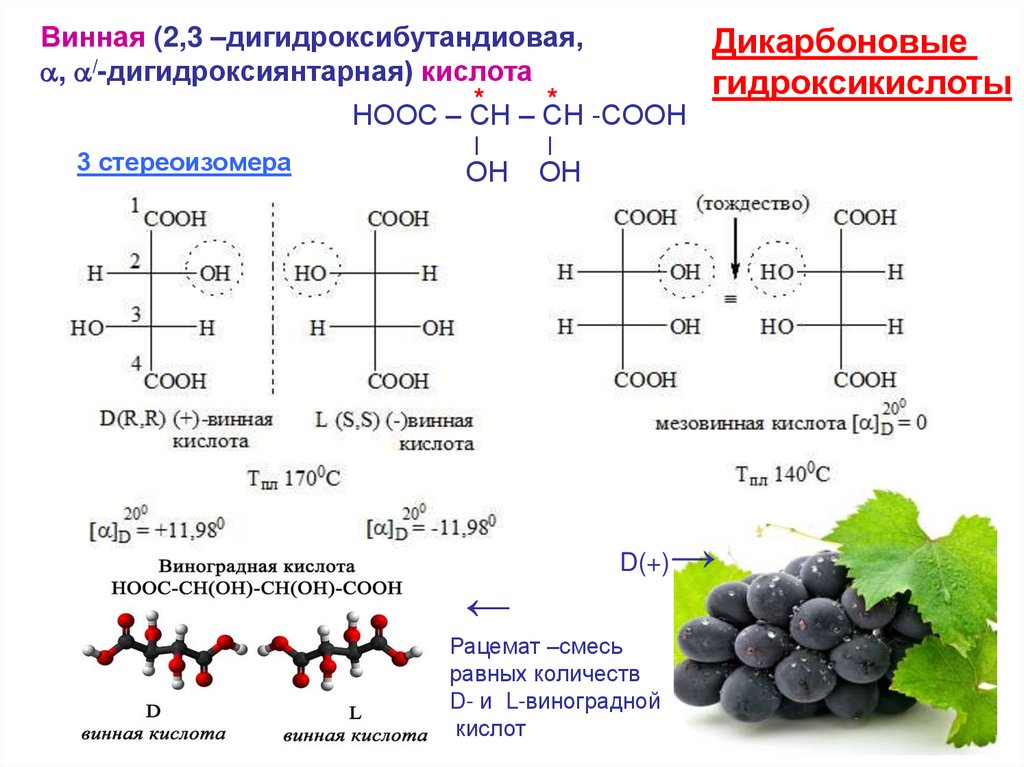
Винная (2,3 –дигидроксибутандиовая,Дикарбоновые
, /-дигидроксиянтарная) кислота
гидроксикислоты
*
*
НООС – СН – СН -СООН
3 стереоизомера
Ι
ОН
Ι
ОН
D(+)
←
Рацемат –смесь
равных количеств
D- и L-виноградной
кислот
→
14.
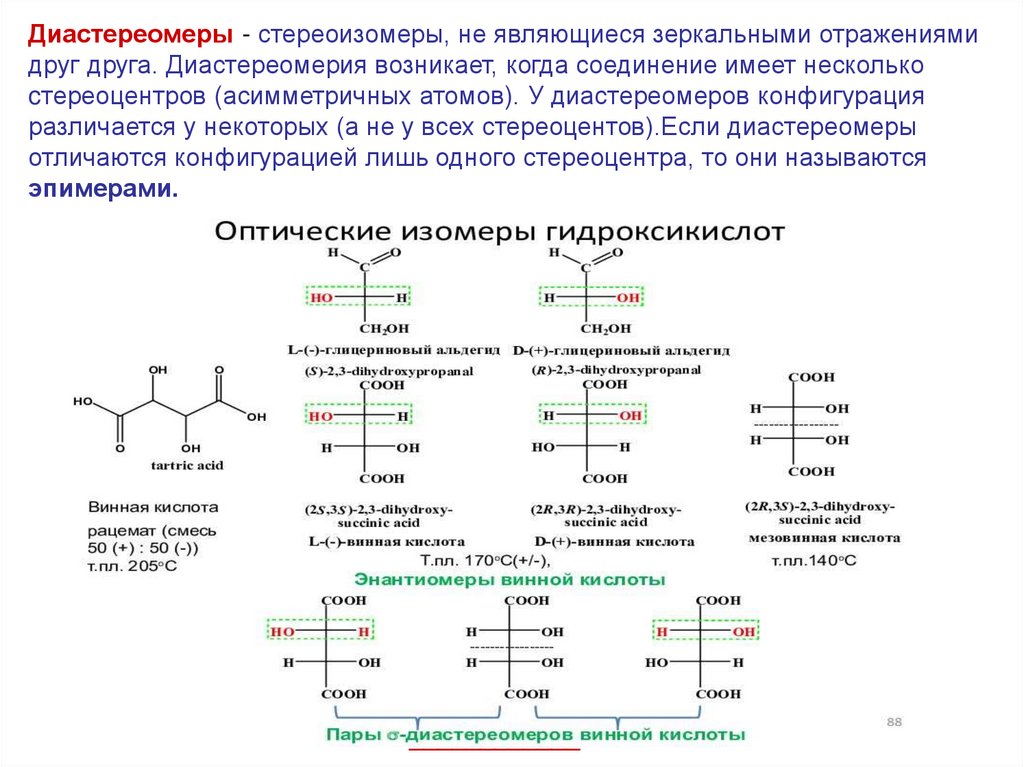
Диастереомеры - стереоизомеры, не являющиеся зеркальными отражениямидруг друга. Диастереомерия возникает, когда соединение имеет несколько
cтереоцентров (асимметричных атомов). У диастереомеров конфигурация
различается у некоторых (а не у всех стереоцентов).Если диастереомеры
отличаются конфигурацией лишь одного стереоцентра, то они называются
эпимерами.
____________
15.
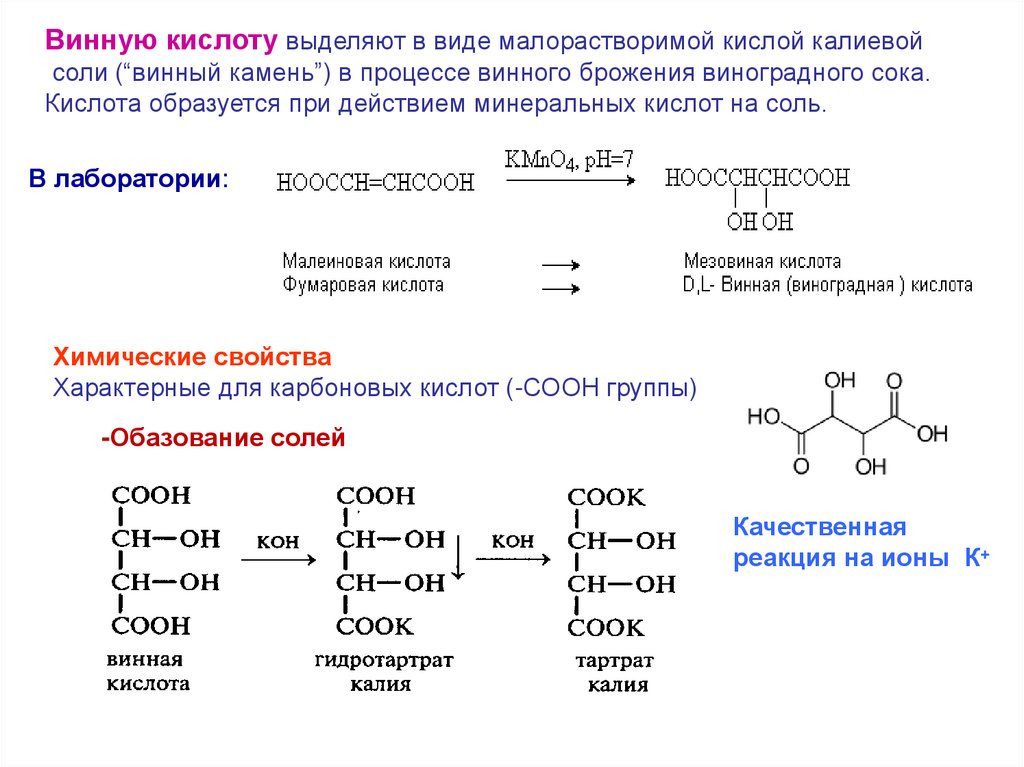
Винную кислоту выделяют в виде малорастворимой кислой калиевойсоли (“винный камень”) в процессе винного брожения виноградного сока.
Кислота образуется при действием минеральных кислот на соль.
В лаборатории:
Химические свойства
Характерные для карбоновых кислот (-СООН группы)
-Обазование солей
Качественная
реакция на ионы К+
16.
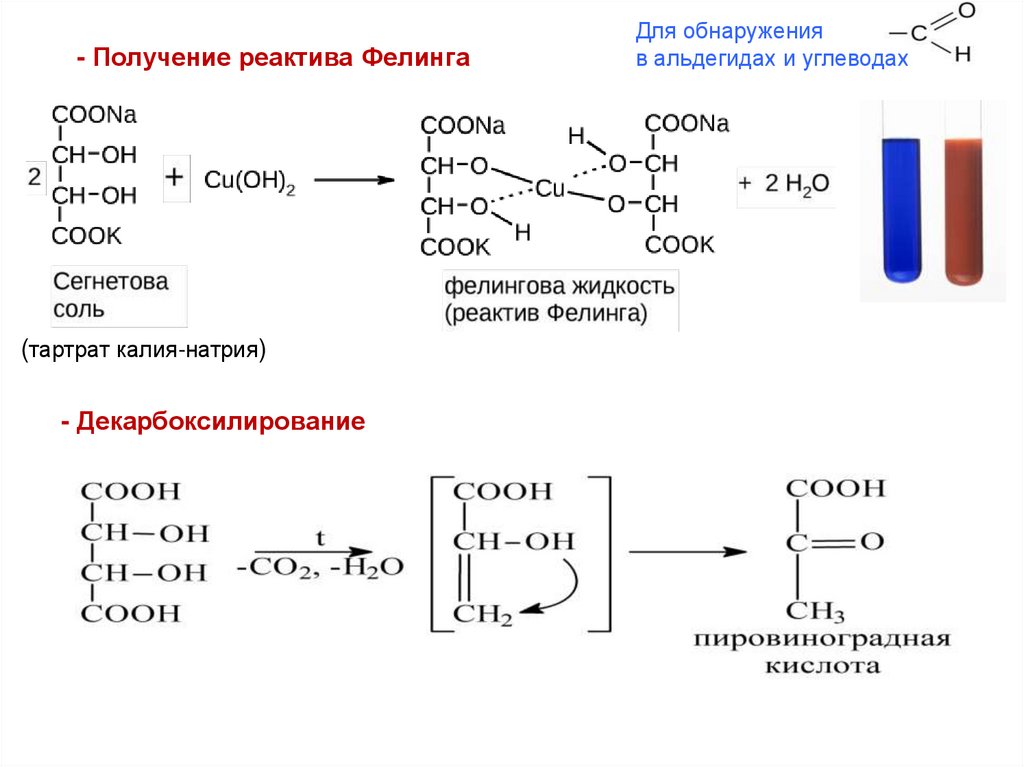
- Получение реактива Фелинга(тартрат калия-натрия)
- Декарбоксилирование
Для обнаружения
в альдегидах и углеводах
17.
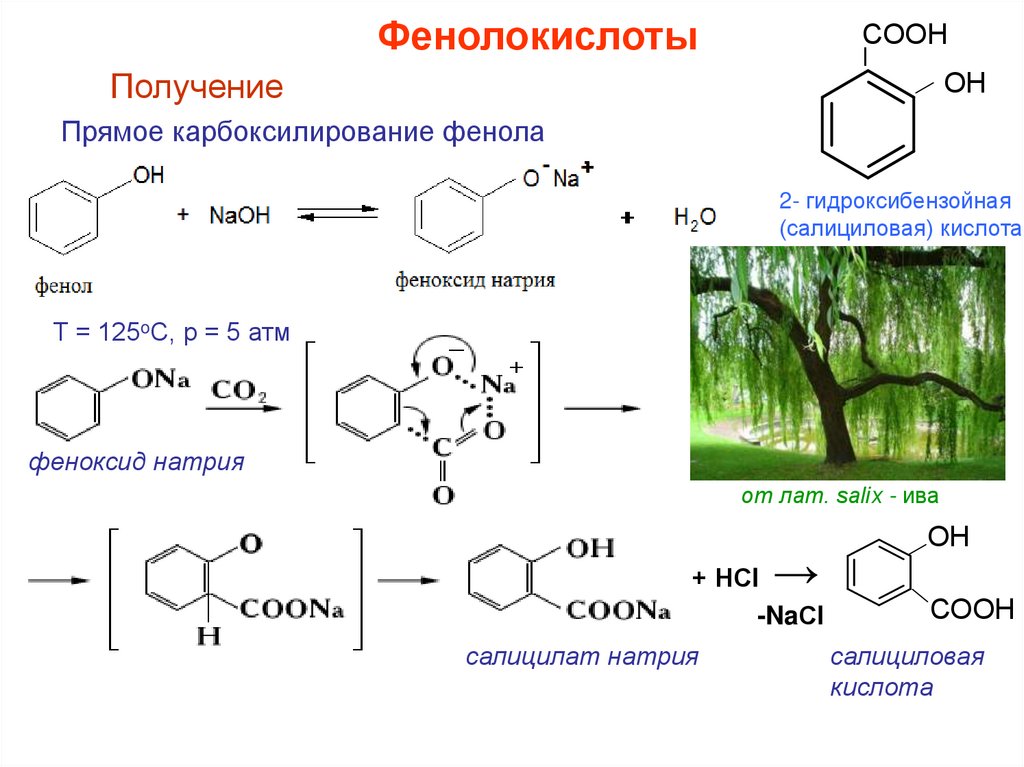
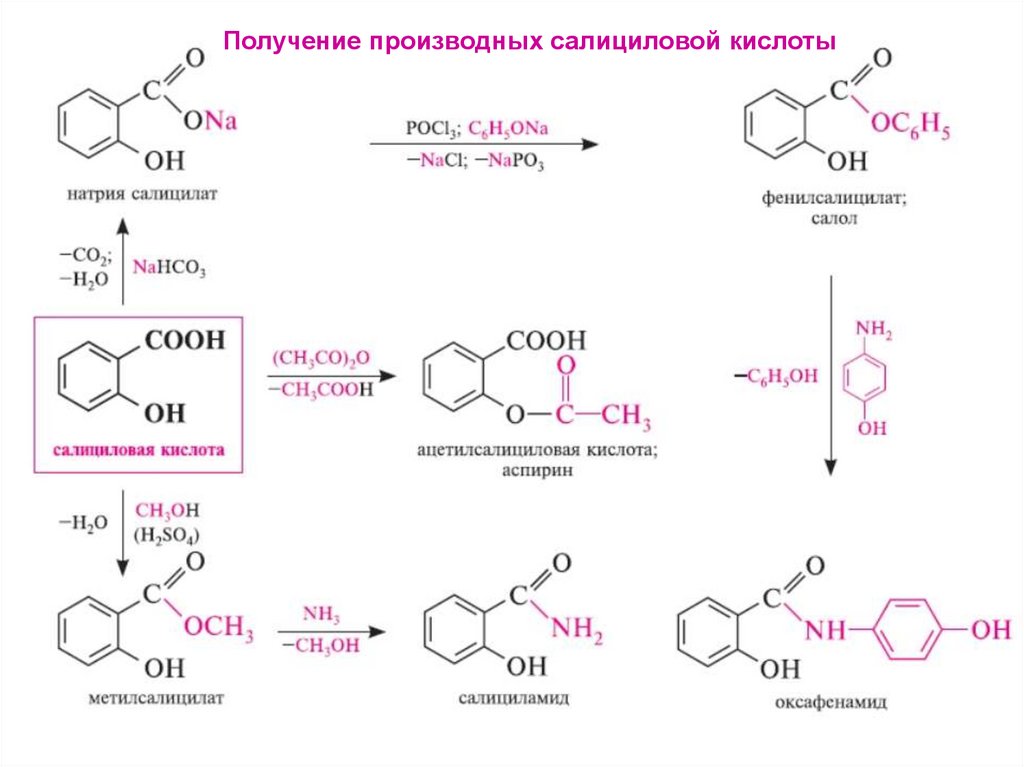
ФенолокислотыСООН
Ι
Получение
ОН
Прямое карбоксилирование фенола
2- гидроксибензойная
(салициловая) кислота
Т = 125oС, р = 5 атм
феноксид натрия
от лат. salix - ива
→
+ НСl
-NaСl
салицилат натрия
ОН
СООН
салициловая
кислота
18.
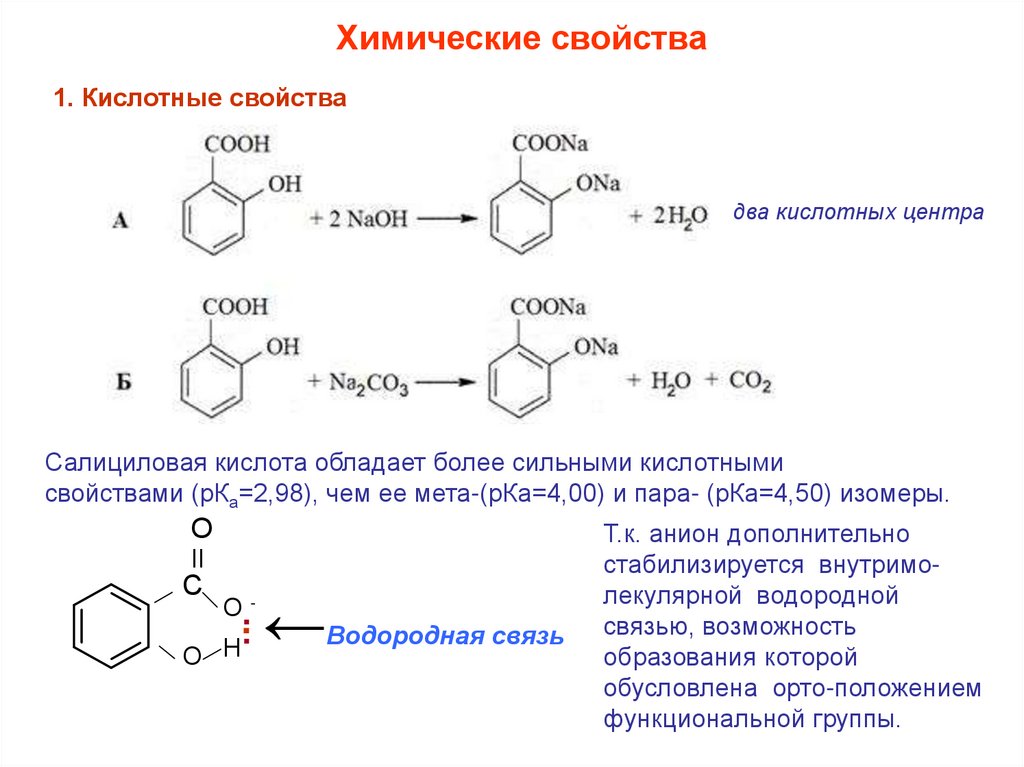
Химические свойства1. Кислотные свойства
два кислотных центра
Салициловая кислота обладает более сильными кислотными
свойствами (рКа=2,98), чем ее мета-(рКа=4,00) и пара- (рКа=4,50) изомеры.
О
ΙΙ
С
О
.
:
Н ←Водородная связь
О-
Т.к. анион дополнительно
стабилизируется внутримолекулярной водородной
связью, возможность
образования которой
обусловлена орто-положением
функциональной группы.
19.
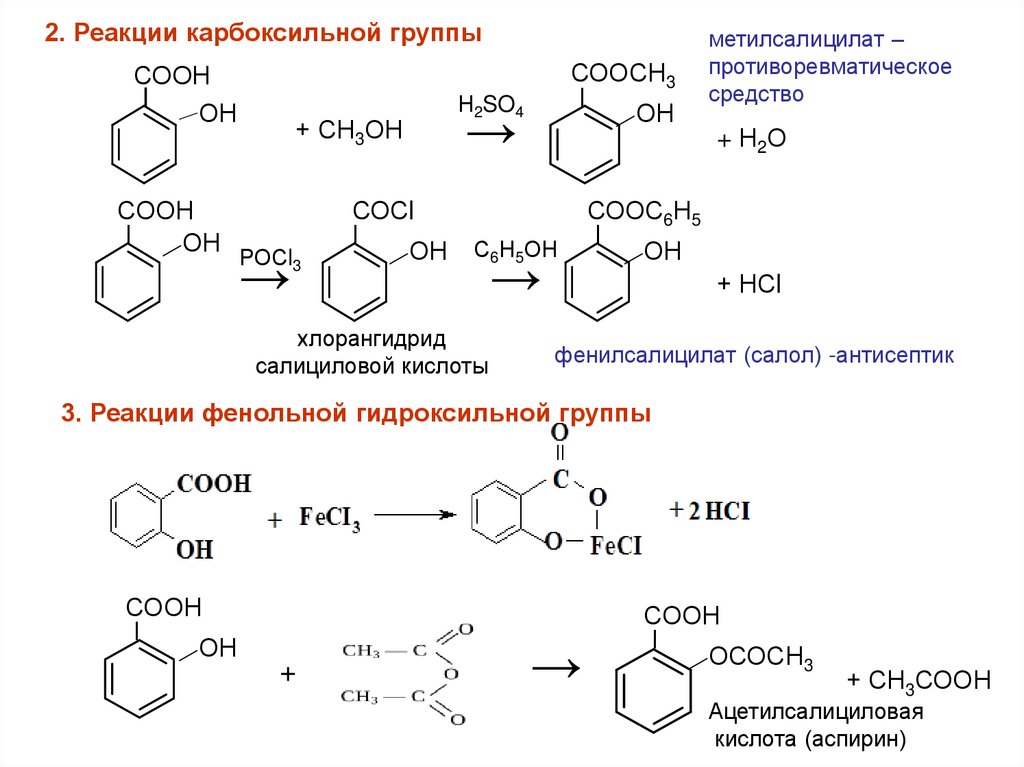
2. Реакции карбоксильной группыСООН
I
ОН
СООН
Ι
ОН
+ СН3ОН
РОСl3
→
СОСl
Ι
ОН
СООСН3
Ι
ОН
Н2SO4
→
С6Н5ОН
хлорангидрид
салициловой кислоты
→
метилсалицилат –
противоревматическое
средство
+ Н2О
СООС6Н5
Ι
ОН
+ НСl
фенилсалицилат (салол) -антисептик
3. Реакции фенольной гидроксильной группы
СООН
Ι
ОН
+
→
СООН
Ι
ОСОСН3
+ СН3СООН
Ацетилсалициловая
кислота (аспирин)
20.
Получение производных салициловой кислоты21.
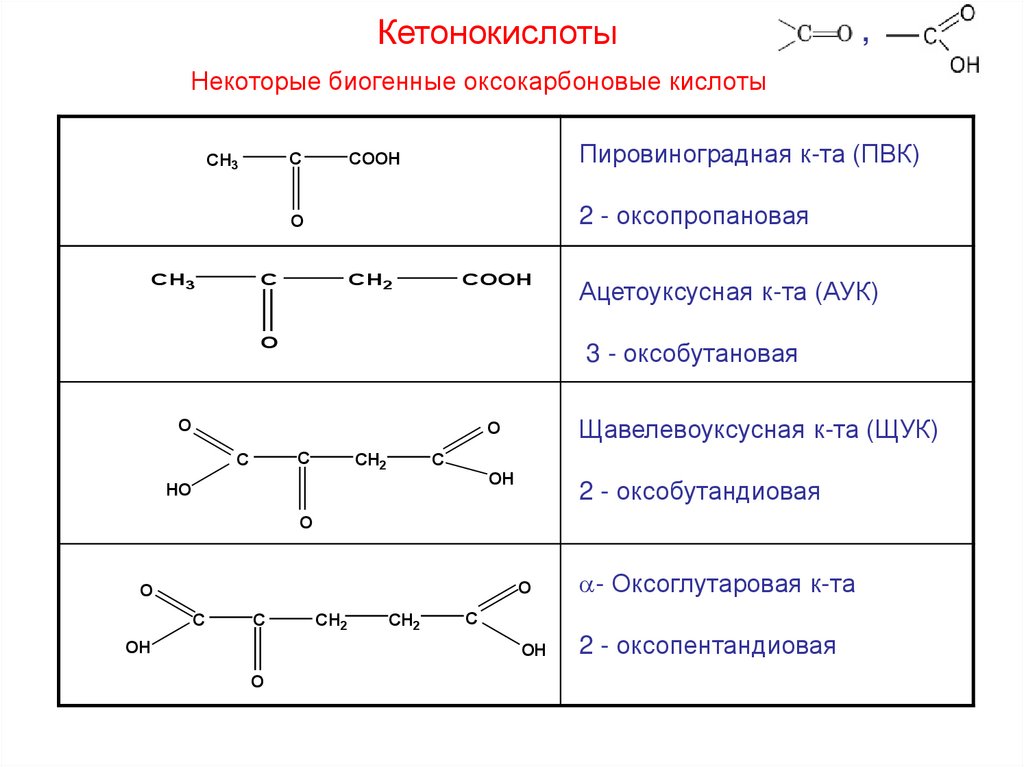
Кетонокислоты,
Некоторые биогенные оксокарбоновые кислоты
C
CH3
Пировиноградная к-та (ПВК)
COOH
2 - оксопропановая
O
CH3
C
CH2
COOH
O
3 - оксобутановая
O
C
C
Ацетоуксусная к-та (АУК)
CH2
C
HO
O
Щавелевоуксусная к-та (ЩУК)
OH
2 - оксобутандиовая
O
O
C
C
OH
O
CH2
CH2
O
- Оксоглутаровая к-та
OH
2 - оксопентандиовая
C
22.
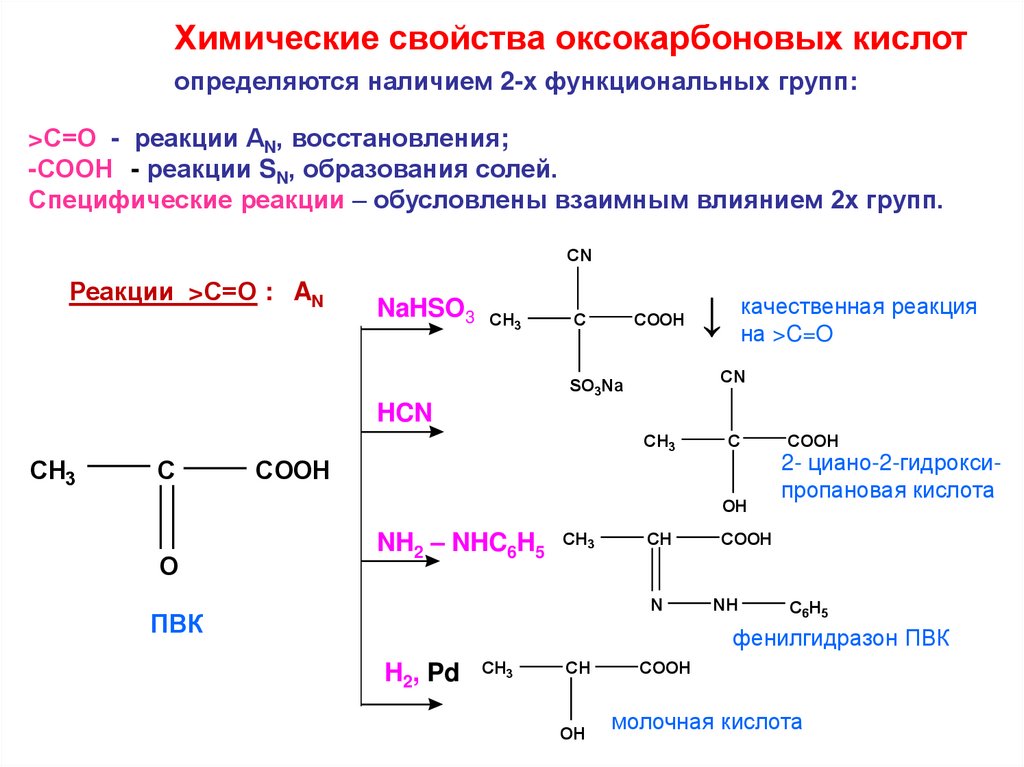
Химические свойства оксокарбоновых кислотопределяются наличием 2-х функциональных групп:
>С=О - реакции АN, восстановления;
-СООН - реакции SN, образования солей.
Специфические реакции – обусловлены взаимным влиянием 2х групп.
CN
Реакции >С=О : AN
NaHSO3
CH3
C
COOH
↓
качественная реакция
на >C=O
CN
SO3Na
HCN
CH3
CH3
C
C
COOH
OH
O
NH2 – NHC6H5
CH3
CH
N
ПВК
COOH
2- циано-2-гидроксипропановая кислота
COOH
NH
C6H5
фенилгидразон ПВК
H2, Pd
CH3
CH
OH
COOH
молочная кислота
23.
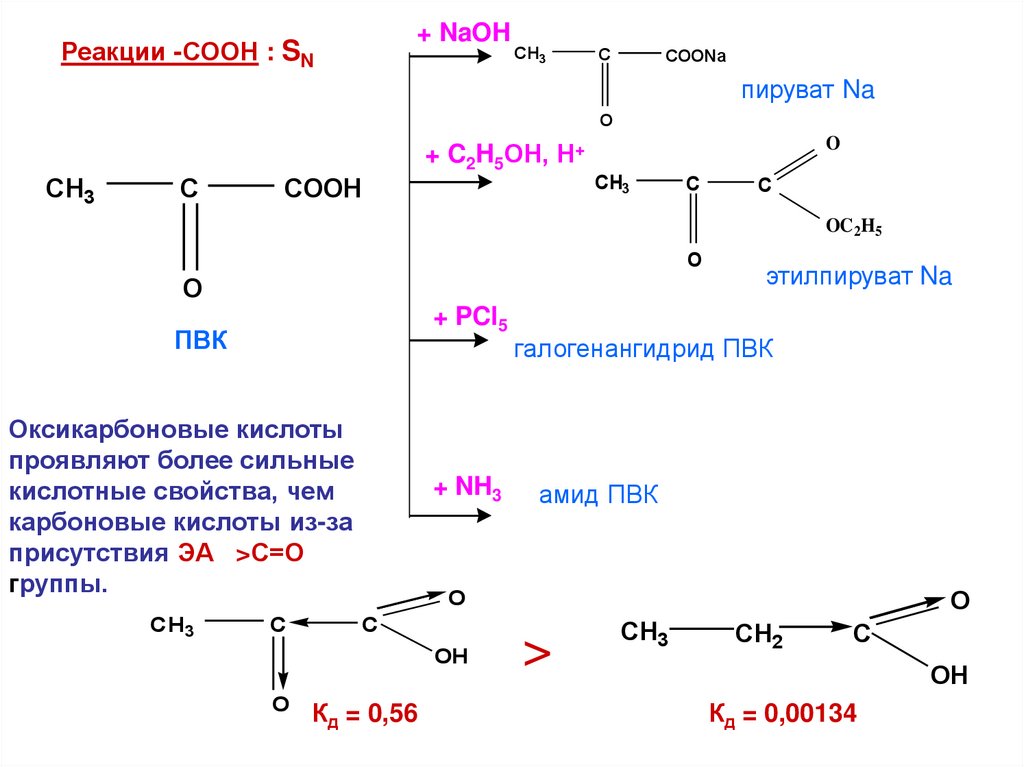
+ NaOHРеакции -СООН : SN
CH3
C
COONa
пируват Na
O
+ C2H5ОН, Н+
CH3
C
COOH
O
CH3
C
C
OC2H5
O
O
+ PCl5
ПВК
Оксикарбоновые кислоты
проявляют более сильные
кислотные свойства, чем
карбоновые кислоты из-за
присутствия ЭА >С=О
группы.
CH3
C
+ NH3
галогенангидрид ПВК
амид ПВК
O
O
C
OH
O
этилпируват Na
Кд = 0,56
>
CH3
CH2
C
OH
Кд = 0,00134
24.
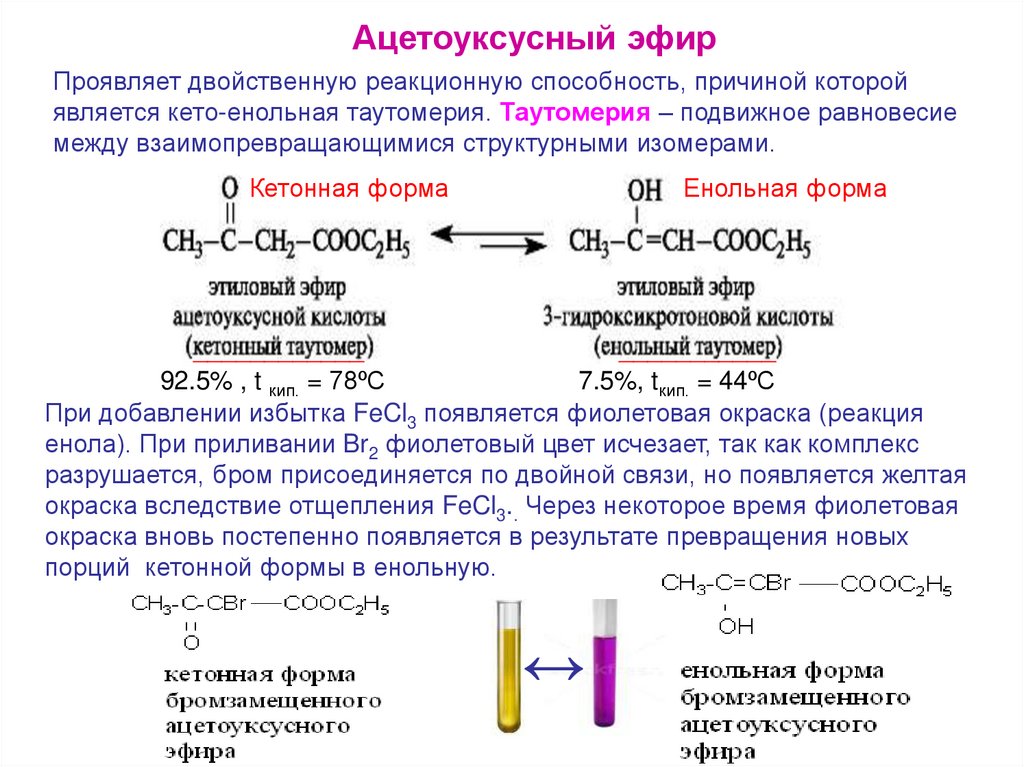
Ацетоуксусный эфирПроявляет двойственную реакционную способность, причиной которой
является кето-енольная таутомерия. Таутомерия – подвижное равновесие
между взаимопревращающимися структурными изомерами.
Кетонная форма
Енольная форма
____________
___________
92.5% , t кип. = 78ºС
7.5%, tкип. = 44ºС
При добавлении избытка FeCl3 появляется фиолетовая окраска (реакция
енола). При приливании Br2 фиолетовый цвет исчезает, так как комплекс
разрушается, бром присоединяется по двойной связи, но появляется желтая
окраска вследствие отщепления FeCl3.. Через некоторое время фиолетовая
окраска вновь постепенно появляется в результате превращения новых
порций кетонной формы в енольную.
↔
25.
Химические свойства(примеры некоторых реакций)
26.
А также:Енольная форма стабилизируется за
счет сопряжения двойной
углерод-углеродной связи с
карбонильной группой и
образования внутримолекулярной
водородной связи
Как енол ацетоуксусный
эфир мгновенно
обесцвечивает раствор Вг2
(реакция служит
для количественного
определения енола)
+ FeCl3, образуется комплекс –
интенсивного фиолетового
окрашивания
Реакция характерна
для енольных
соединений
и отсутствует у кетонов.
27. Задания
1. Написать структурные формулы изомерных одноосновныхпредельных гидроксикислот, содержащих четыре атома
углерода. Какие изомеры существуют в виде оптических
антиподов?
2. Написать уравнения реакций взаимодействия молочной
кислоты с бромистоводородной кислотой; пятихлористым
фосфором; реакцию разложения (кипячения)
3. Написать реакции дегидратации -гидроксипропионовой;
-гидроксивалериановой кислоты.






 Химия
Химия








