Похожие презентации:
Главные квантовые числа
1.
Главные квантовые числа2.
Считается, что состояние каждого электрона в атомеопределяется с помощью четырех квантовых чисел.
Первое из них называется главным квантовым числом
(n).
Принимает значение целых чисел и определяет энергию
электрона, степень удаленности от ядра, размеры
электронной орбитали.
3.
4.
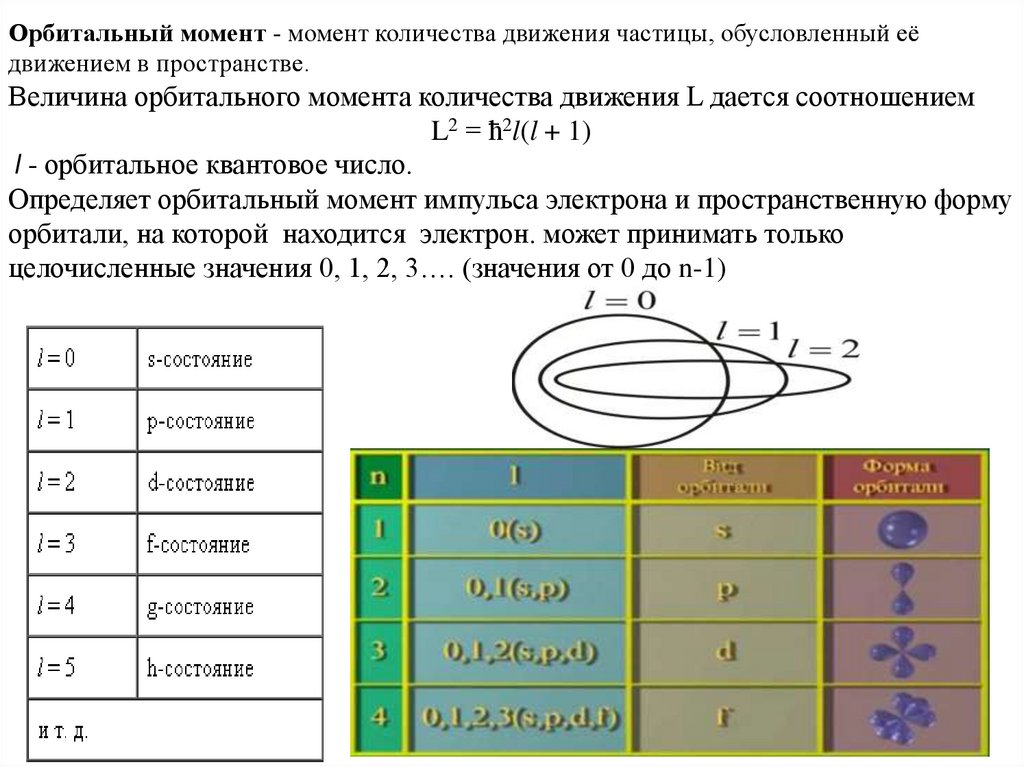
Орбитальный момент - момент количества движения частицы, обусловленный еёдвижением в пространстве.
Величина орбитального момента количества движения L дается соотношением
L2 = ћ2l(l + 1)
l - орбитальное квантовое число.
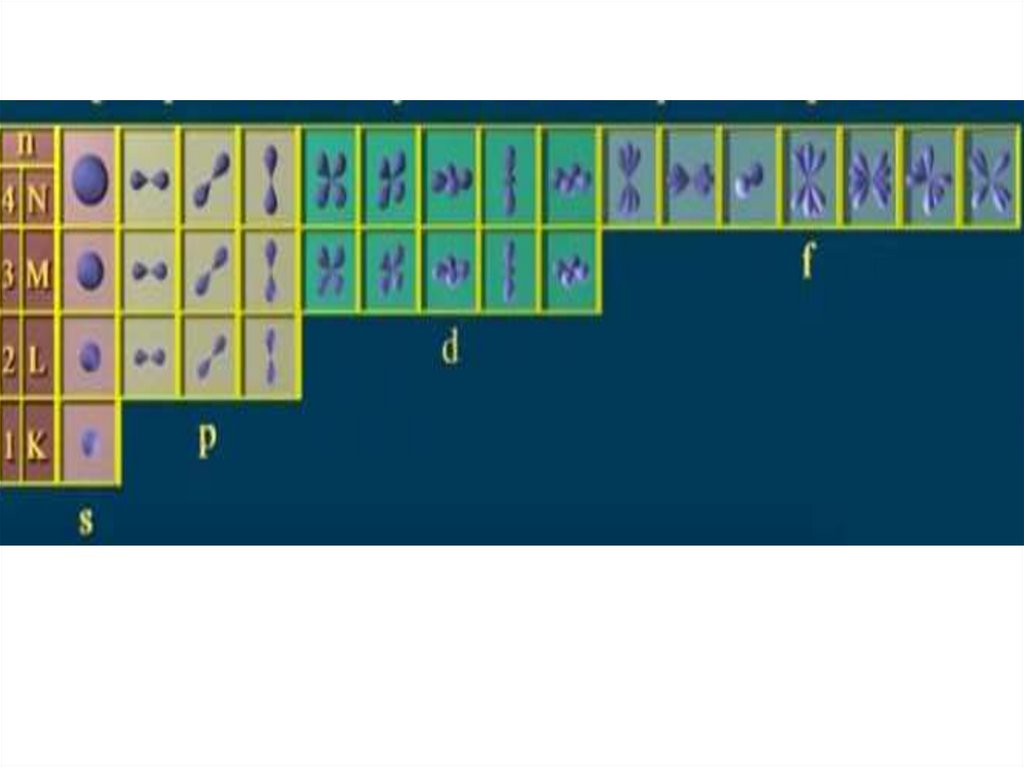
Определяет орбитальный момент импульса электрона и пространственную форму
орбитали, на которой находится электрон. может принимать только
целочисленные значения 0, 1, 2, 3…. (значения от 0 до n-1)
5.
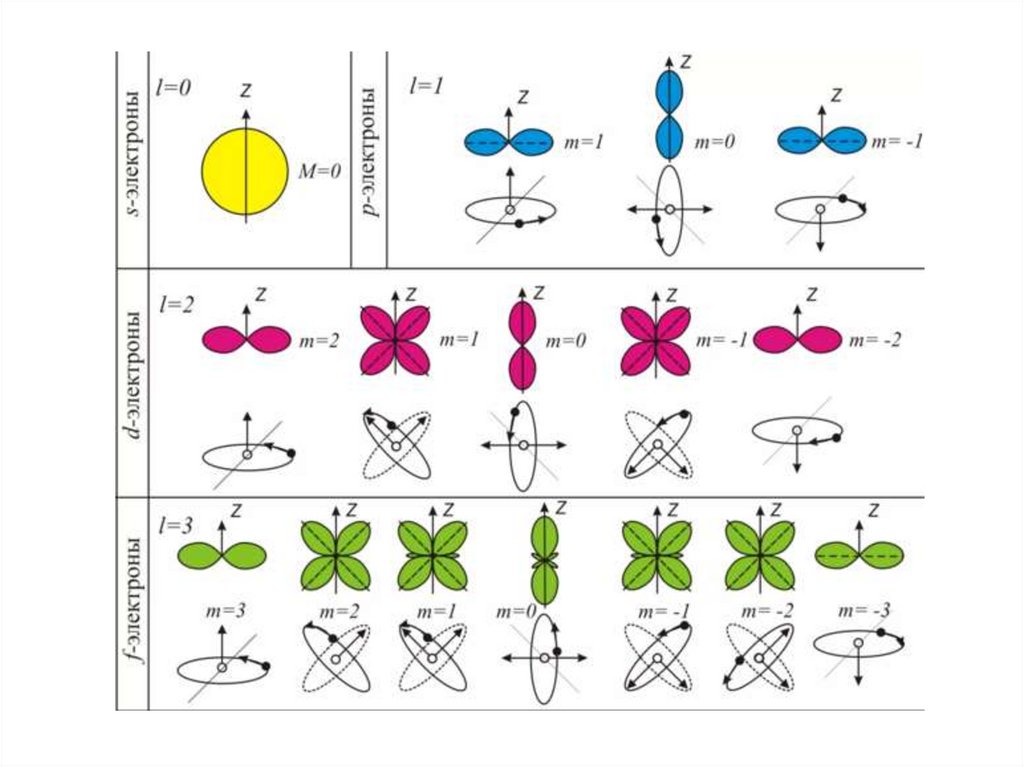
Третье квантовое число называется магнитным.Оно определяет значения проекции орбитального момента на одной из
осей, а так же пространственную ориентацию элементарных орбиталей и
их максимальное число на электронном подуровне
Проекция момента импульса электрона на какое-либо заданное направление в
пространстве z квантуется по правилу
m – магнитное квантовое число,
принимающее значения –l, -l+1,
….l (всего 2l+1 значений)
m= –l, -l+1, …,-1, 0, +1,…, + l
6.
7.
8.
9.
10.
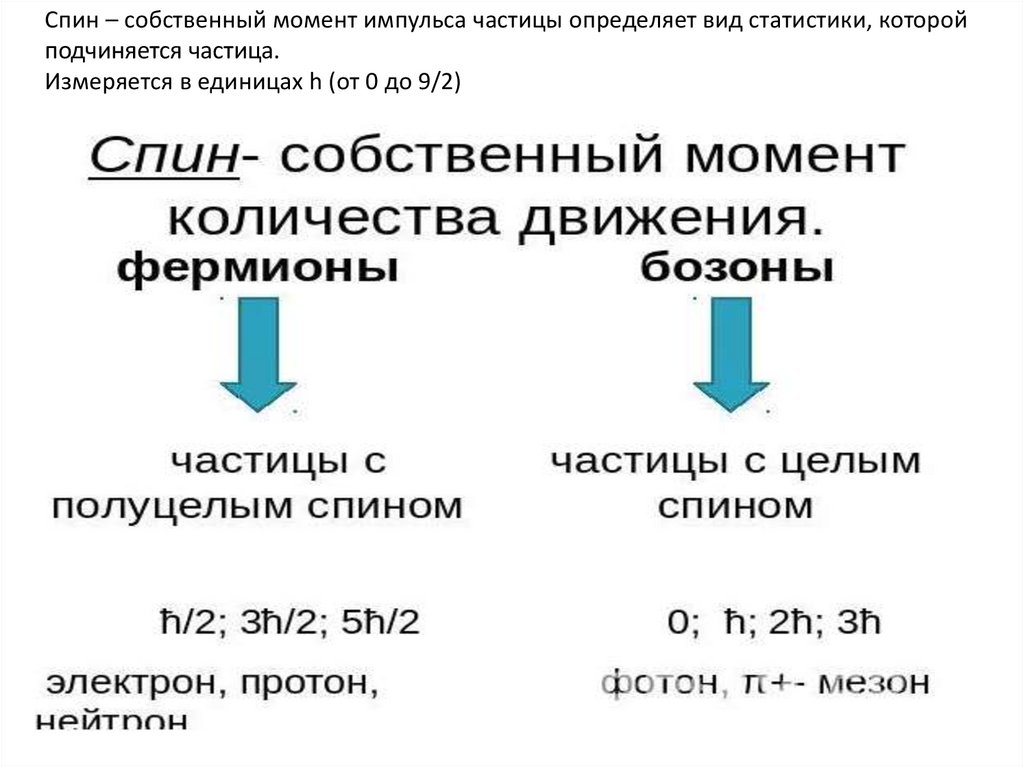
Спин – собственный момент импульса частицы определяет вид статистики, которойподчиняется частица.
Измеряется в единицах h (от 0 до 9/2)
11.
12.
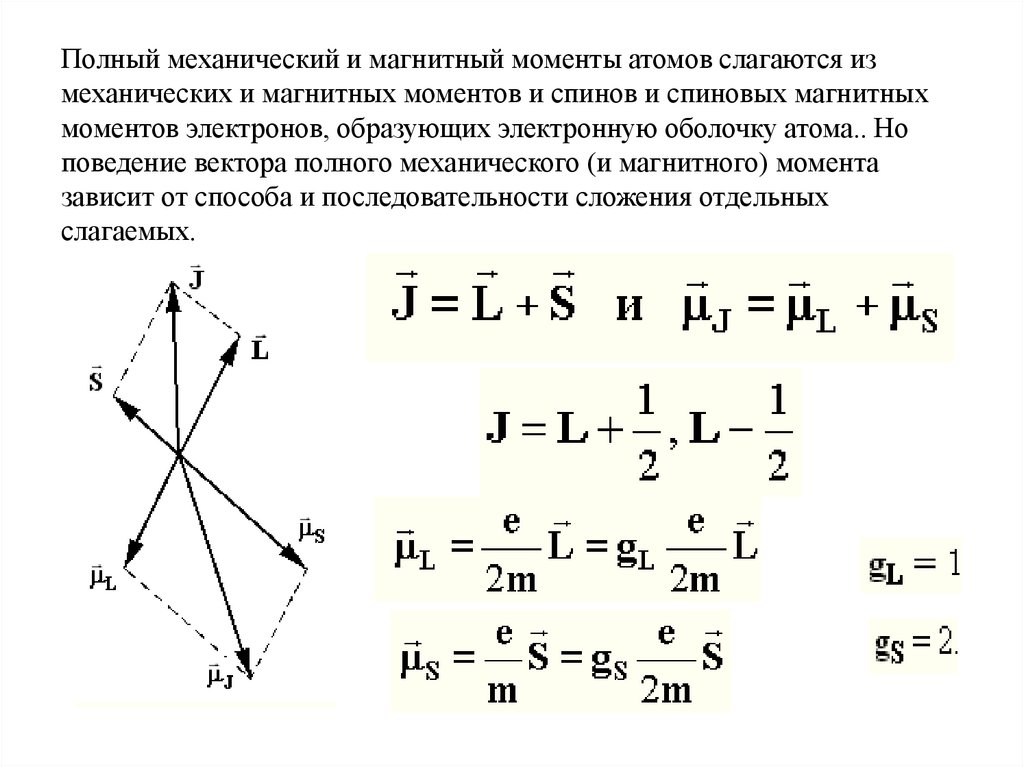
Полный механический и магнитный моменты атомов слагаются измеханических и магнитных моментов и спинов и спиновых магнитных
моментов электронов, образующих электронную оболочку атома.. Но
поведение вектора полного механического (и магнитного) момента
зависит от способа и последовательности сложения отдельных
слагаемых.
13.
Вектора L S прецессируют вокруг J. Также каксоответствующие магнитные моменты μ. Из за большой
скорости прецессии важна проекция вектора магнитного
момента μJ на направление J-μ||
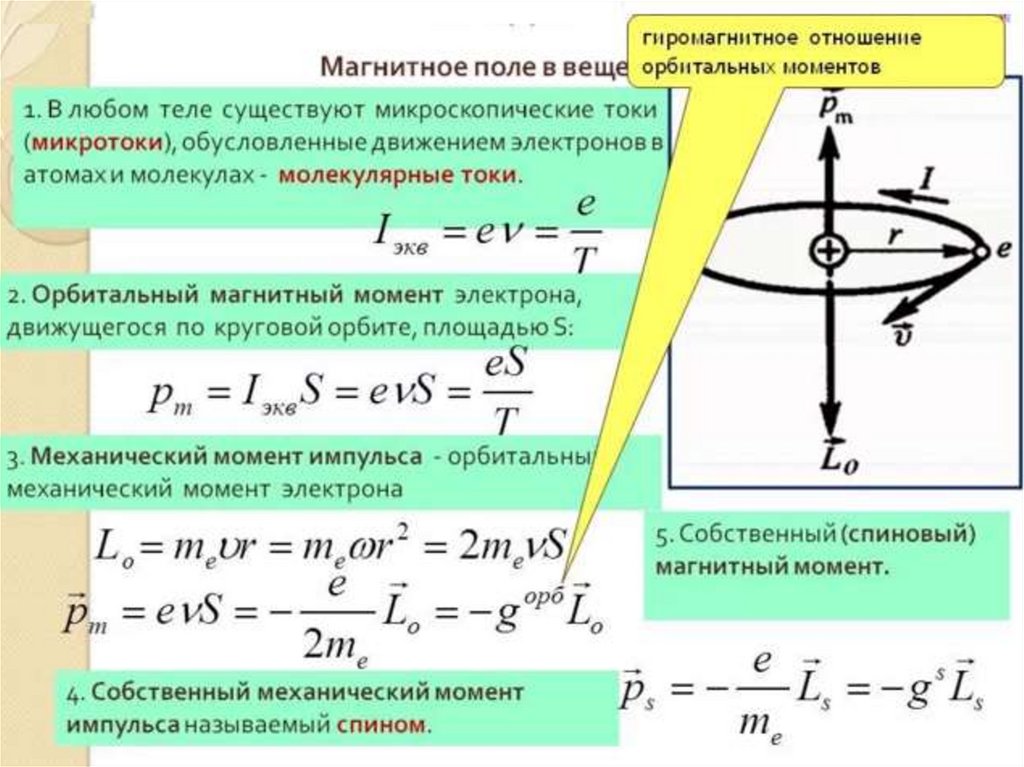
Гиромагнитное отношение (фактор Ланге)
Данные значения объясняют эффект Зеемана.







 Физика
Физика








