Похожие презентации:
Скорость химических реакций
1. Скорость химических реакций
ν = ∆С/∆tСкорость химической реакции —
это величина, которая равна отношению
изменения молярной концентрации вещества
к интервалу времени, в течение которого
произошло данное изменение.
2. I. Продолжительность процессов
1.2.
3.
4.
5.
6.
Со взрывом (доли секунд)
2H2 + O2 = 2H2O
В растворах (секунды – минуты)
NaHCO3 + CH3COOH = CH3COONa + H2O + CO2↑
Окисление быстрое – горение (минуты – часы)
CH4 + 2O2 = CO2 + 2H2O
Окисление медленное – разрушение металлов
(часы – месяцы – годы)
4Fe + 2H2O + 3O2 = 2(Fe2O3 . H2O)
Образование нефти, газа, угля (столетия –
тысячелетия)
Ядерные превращения (до миллионов лет)
3.
II.Факторы, влияющие на скорость
химических реакций
2.1. Концентрация реагирующих веществ
aA + bB = cC + dD
a.
b
ν = k[А] [B]
Скорость химической реакции прямо
пропорциональна произведению концентраций
реагирующих веществ, взятых в степенях, равных
их коэффициентам (для газовой и жидкой сред).
4.
2.2. ТемператураПри увеличении температуры процесса на каждые
10 градусов скорость реакции возрастает в 2-4
раза.
γ
νк= νн
∆to /10o
5.
Задача:Во сколько раз увеличится скорость реакции
при повышении температуры от 0оС до 40оС,
если температурный коэффициент реакции
равен 3
o – to ) /10o
o – 0o)/10o
(t
(40
ν =ν γ
=ν 3
= ν 34= 81ν
2
1
к
н
too = OoC
to1 = 1OoC
to2 = 2OoC
to3 = 3OoC
to4 = 4OoC
н
н
ν = νo
ν1=3νo
ν2=3ν1=3(3νo)=9νo
ν3=3ν2=3(9νo)=27νo
ν4=3ν3=3(27νo)=81νo
н
6. https://youtu.be/_wXahSYAbTk
7.
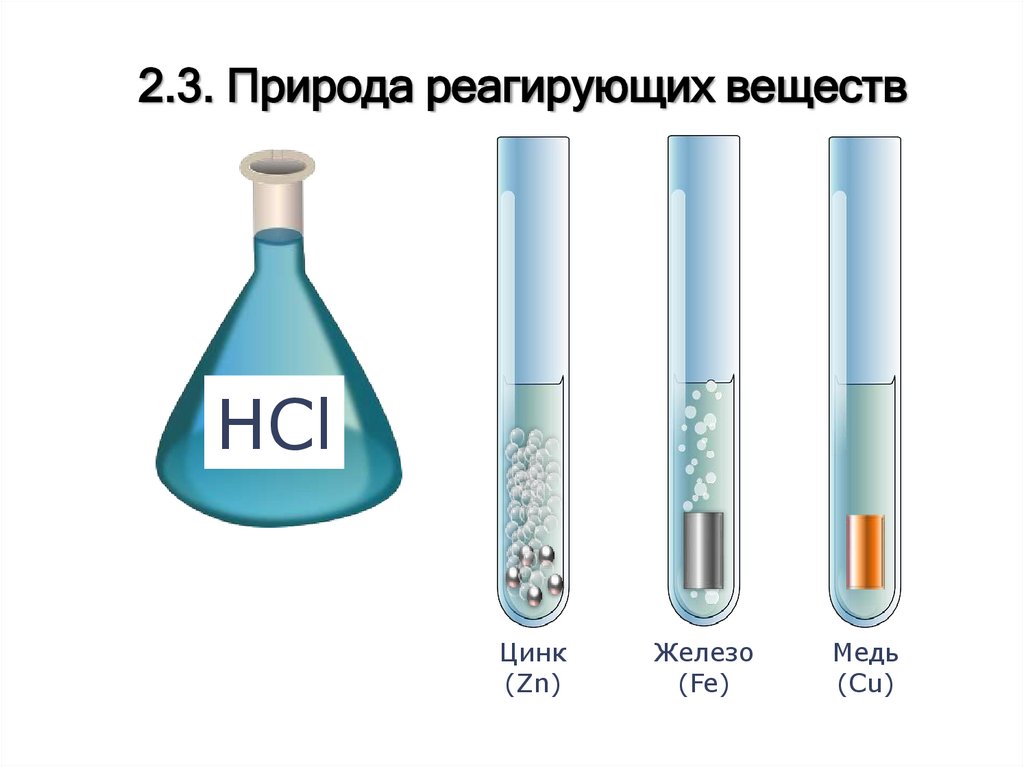
2.3. Природа реагирующих веществHCl
Цинк
(Zn)
Железо
(Fe)
Медь
(Cu)
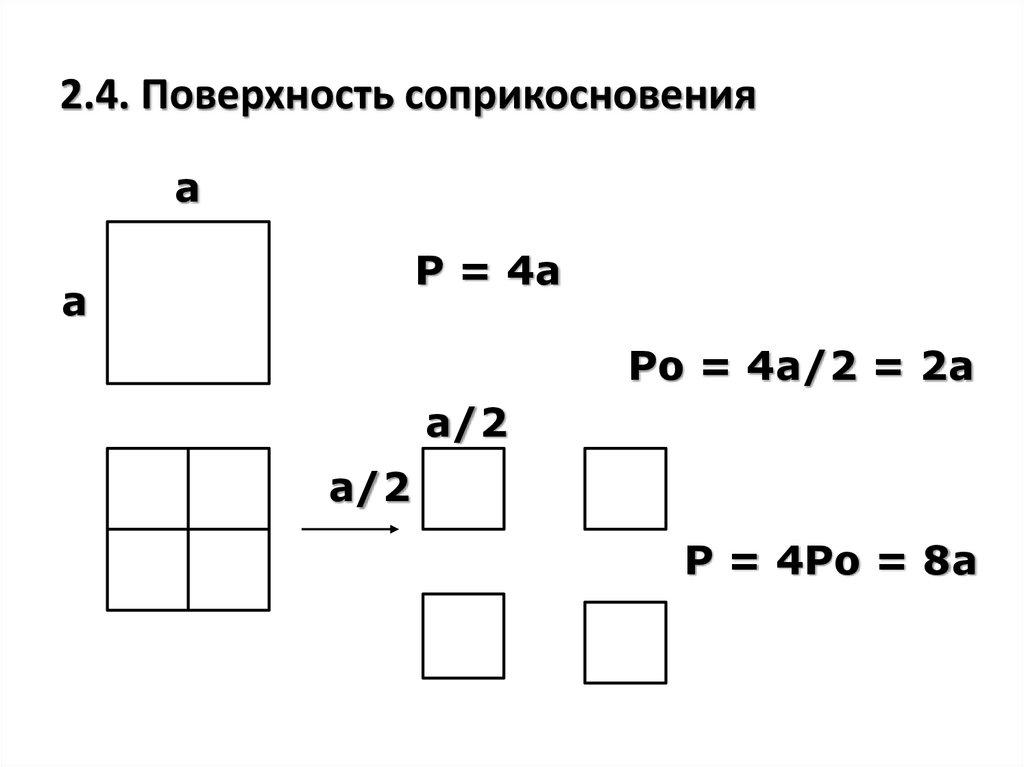
8. 2.4. Поверхность соприкосновения
аР = 4а
а
Ро = 4а/2 = 2а
а/2
а/2
Р = 4Ро = 8а
9.
Чем больше площадь поверхностисоприкосновения исходных веществ, тем
больше частиц веществ сталкиваются друг с
другом, тем выше скорость их взаимодействия,
т.е. скорость реакции.
10. 2.5. Катализаторы и ингибиторы
Катализаторы – это вещества, которыеувеличивают скорость химических
реакций в несколько раз, но сами при
этом остаются неизменными как
количественно, так и качественно.
Ингибиторы – это вещества, замедляющие
химические процессы.








 Химия
Химия








