Похожие презентации:
Химические реакции. Скорость химической реакции
1.
2.
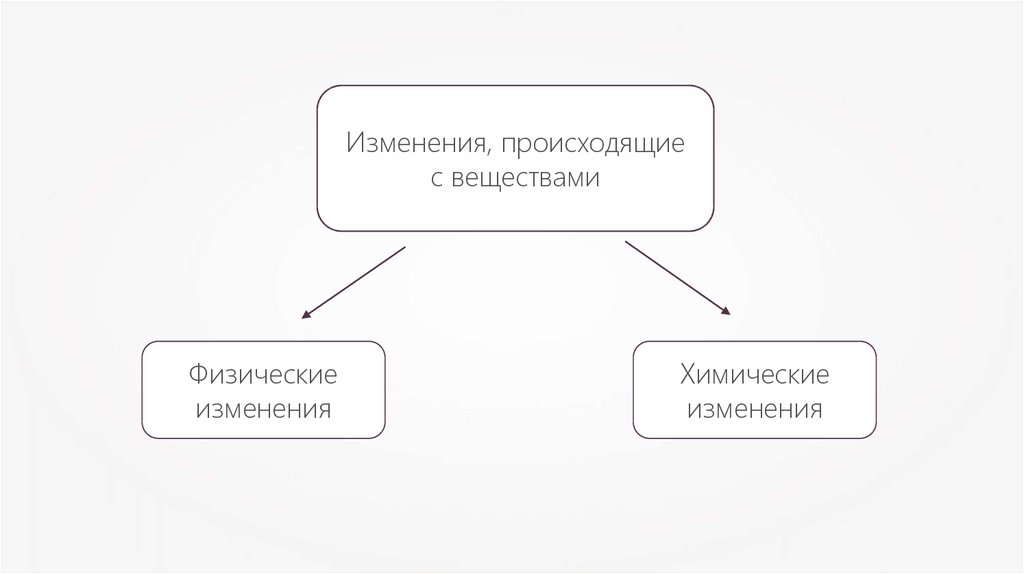
Изменения, происходящиес веществами
Физические
изменения
Химические
изменения
3.
Физические изменения — это изменения,происходящие с веществами под воздействием
различных факторов (температуры, давления),
при которых не происходит образования новых
веществ.
4.
Химические изменения — это изменения, при которыхиз исходных веществ образуются новые вещества.
Они также носят название химических реакций.
5.
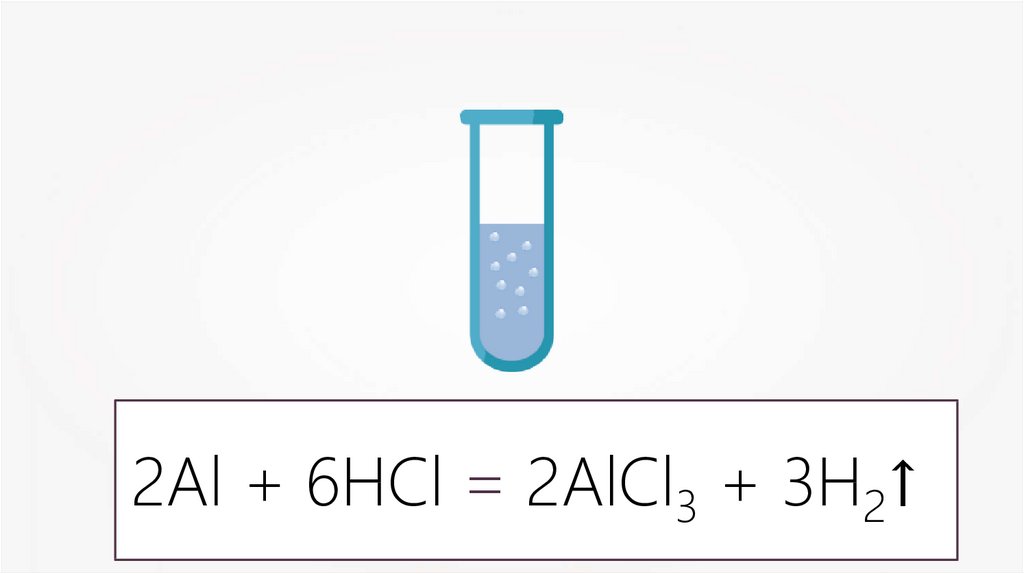
2Al + 6HCl = 2AlCl3 + 3H2↑6.
Классификация реакции на основанииразличных признаков
2Al + 6HCl = 2AlCl3 + 3H2↑
1. Число и состав исходных веществ и продуктов реакции.
2. Обратимость реакции.
3. Тепловой эффект.
4. Изменение степеней окисления элементов, образующих
вещества, участвующие в реакции.
7.
Изменение степени окисления0
+1 -1
+3
-1
0
2Al + 6HCl = 2AlCl3 + 3H2↑
8.
Классификация реакции на основанииразличных признаков
2Al + 6HCl = 2AlCl3 + 3H2↑
1. Число и состав исходных веществ и продуктов реакции.
2. Обратимость реакции.
3. Тепловой эффект.
4. Изменение степеней окисления элементов, образующих
вещества, участвующие в реакции.
5. Агрегатное состояние реагирующих веществ.
6. Участие катализатора.
9.
Катализатор — вещество, изменяющее скоростьхимической реакции.
10.
11.
Быстрое протекание реакцииAgNO3+NaCl=AgCl+NaNO3
12.
Скорость химической реакции — это изменениеконцентрации реагирующих веществ в единицу
времени.
13.
Формула концентрации химических веществ14.
Формула скорости химической реакции15.
Химическая кинетика — раздел химии,изучающий скорость химических реакций.
16.
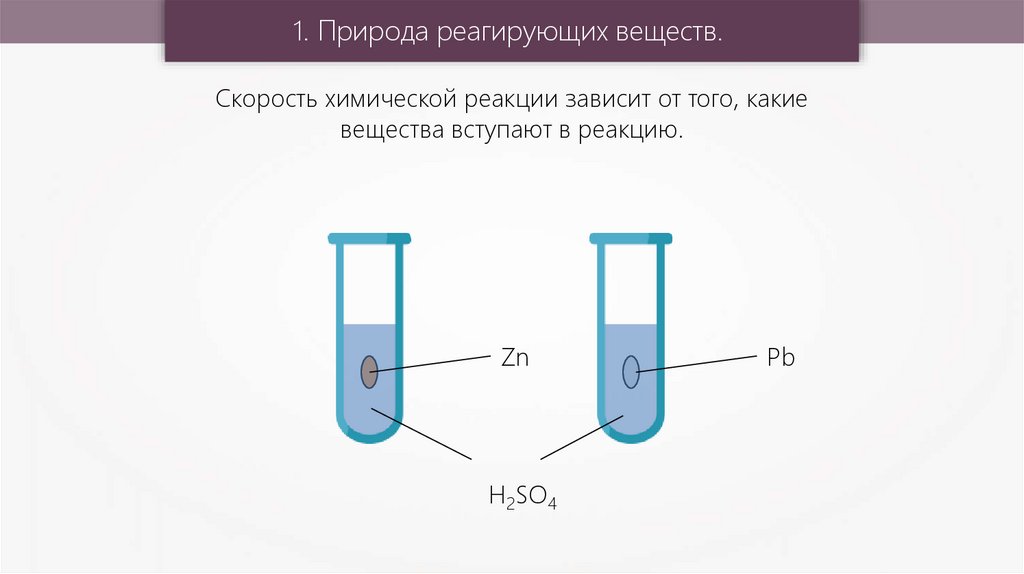
1. Природа реагирующих веществ.Скорость химической реакции зависит от того, какие
вещества вступают в реакцию.
Zn
H2SO4
Pb
17.
1. Природа реагирующих веществ.Скорость химической реакции зависит от того, какие
вещества вступают в реакцию.
Pb + H2SO4 = PbSO4 + H2↑
18.
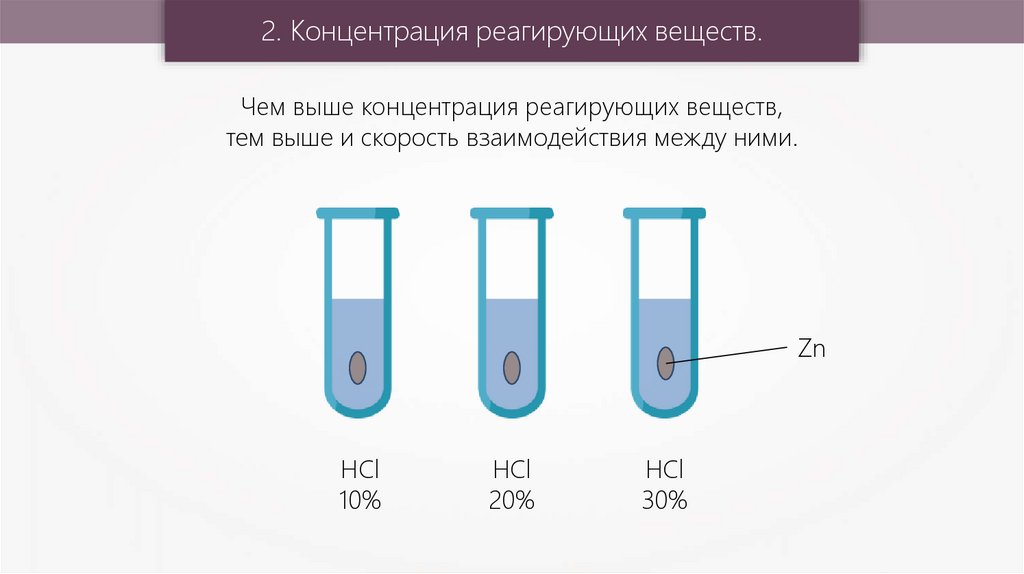
2. Концентрация реагирующих веществ.Чем выше концентрация реагирующих веществ,
тем выше и скорость взаимодействия между ними.
Zn
HCl
10%
HCl
20%
HCl
30%
19.
2. Концентрация реагирующих веществ.Чем больше площадь соприкосновения реагирующих
веществ, тем выше скорость реакции.
Zn + 2HCl = ZnCl2 + H2↑
20.
21.
22.
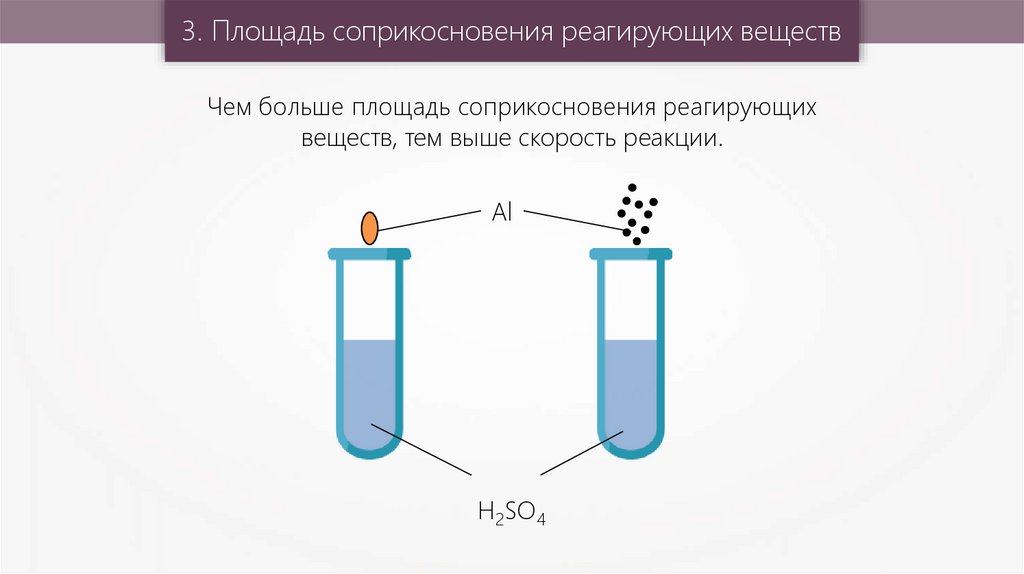
3. Площадь соприкосновения реагирующих веществЧем больше площадь соприкосновения реагирующих
веществ, тем выше скорость реакции.
Al
H2SO4
23.
3. Площадь соприкосновения реагирующих веществЧем выше температура, тем больше скорость
реакции. Проведем следующий опыт.
2Al + 3H2SO4 = Al2(SO4)3 + 3H2↑
24.
25.
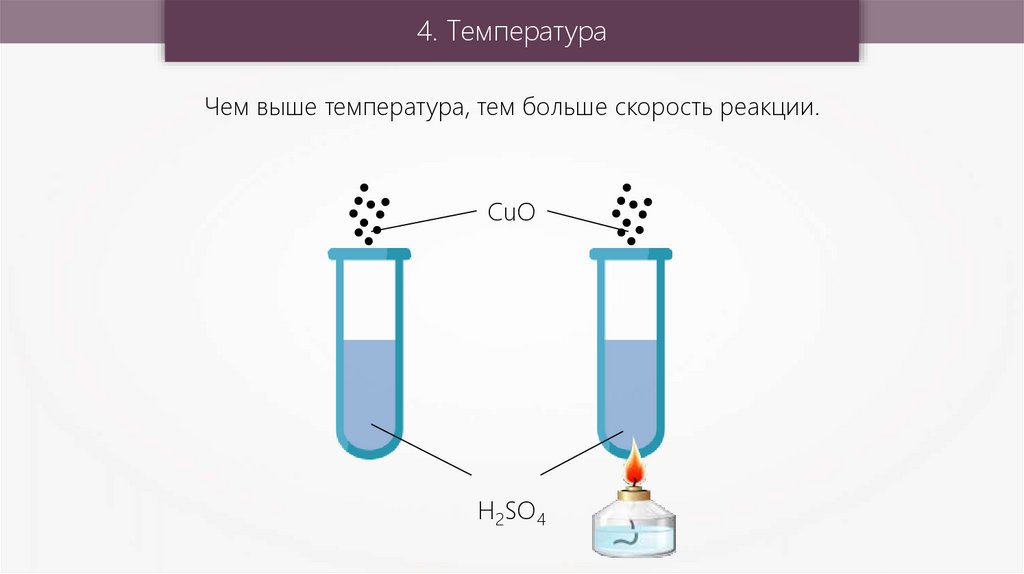
4. ТемператураЧем выше температура, тем больше скорость реакции.
CuO
H2SO4
26.
4. ТемператураЧем выше температура, тем больше скорость реакции.
CuO + H2SO4 = CuSO4 + H2O
27.
Голландский учёный.Сформулировал основное правило
возрастания скорости реакции при
повышении температуры.
При повышении температуры на
каждые 10 ̊ С скорость химической
реакции возрастает в 2 – 4 раза.
Якоб Хендрик Вант-Гофф
1852–1911 гг.
28.
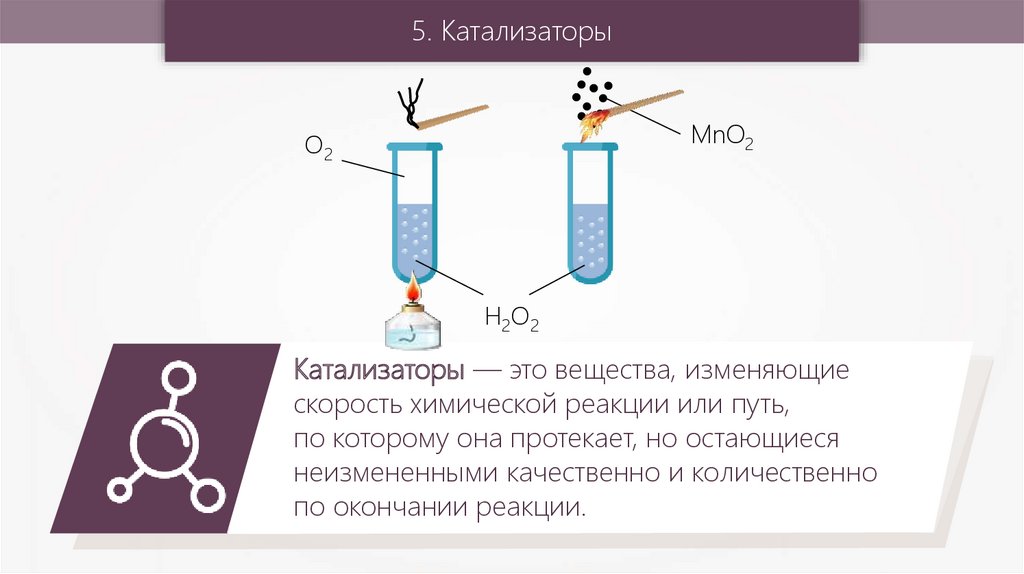
5. КатализаторыMnO2
O2
H2O2
Катализаторы — это вещества, изменяющие
скорость химической реакции или путь,
по которому она протекает, но остающиеся
неизмененными качественно и количественно
по окончании реакции.
29.
5. Катализаторы2Н2О2 = 2Н2О + О2↑
Катализаторы — это вещества, изменяющие
скорость химической реакции или путь,
по которому она протекает, но остающиеся
неизмененными качественно и количественно
по окончании реакции.
30.
В производстве серной кислотыдостаточные скорости окисления
диоксида серы SO2 в триоксид SO3
достигаются только в присутствии
катализатора — платины или оксида
ванадия.
31.
Факторы, влияющие на скоростьхимической реакции
1. Природа реагирующих веществ.
2. Концентрация реагирующих веществ.
3. Площадь соприкосновения реагирующих веществ.
4. Температура.
5. Катализаторы.
























 Химия
Химия








