Похожие презентации:
Положение в ПСХЭ
1.
(от греч. halos - соль и genes – образующий)2. Положение в ПСХЭ.
3.
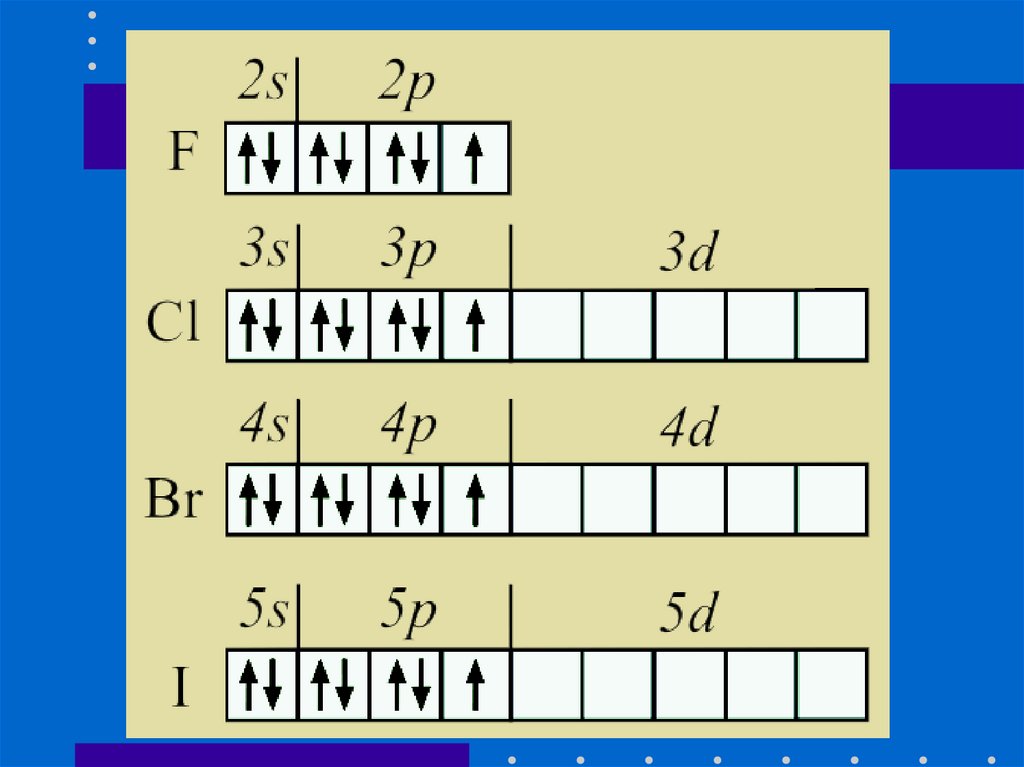
Строение атомов.4.
На внешнем энергетическом уровне у галогенов находится7 валентных электронов
5.
6.
Положение фтора в Периодическойсистеме Д.И. Менделеева
Фтор
(от
греч.
phthoros
–
разрушение), неметалл, расположен в
2 малом периоде, значит имеет 2
энергетических уровня, в VII A
группе, значит имеет 7 электронов на
внешнем энергетическом уровне,
порядковый номер 9, заряд ядра +9;
степени окисления -1 и 0
7.
Положение хлора в Периодическойсистеме Д.И. Менделеева
Хлор (от греч. Chlorum – жёлтозелёный) – хлор, неметалл; расположен в
3 малом периоде, значит имеет 3
энергетических уровня, в VII А группе,
значит имеет 7 электронов на внешнем
энергетическом уровне, порядковый
номер 17, заряд ядра +17;
степени окисления:
-1, 0, +1, +3, +4, +5, +7
8.
Положение брома в Периодическойсистеме Д.И. Менделеева
Бром (от греч. bromos - зловоние),
неметалл; расположен в 4 большом
периоде, значит имеет 4 энергетических
уровня, в VIIA группе, значит имеет 7
электронов на внешнем энергетическом
уровне, порядковый номер 35, заряд
ядра +35,
степени окисления:
-1, 0, +1, +4, +5, +7
9.
Положение йода в Периодической системеД.И. Менделеева
Йод, неметалл; расположен в 5
большом периоде, значит имеет 5
энергетических уровней, в VIIA
группе, значит имеет 7 электронов
на внешнем энергетическом уровне,
порядковый номер 53, заряд ядра
+53,
степени окисления:
-1, +1, +3, +5, +7
10.
Положение астата в Периодической системеД.И. Менделеева
Астат (от греч. astatos –неустойчивый),
неметалл; расположен в 6 большом
периоде, значит имеет 6 энергетических
уровней, в VIIA группе, значит имеет 7
электронов на внешнем энергетическом
уровне, порядковый номер 85, заряд ядра
+85
11.
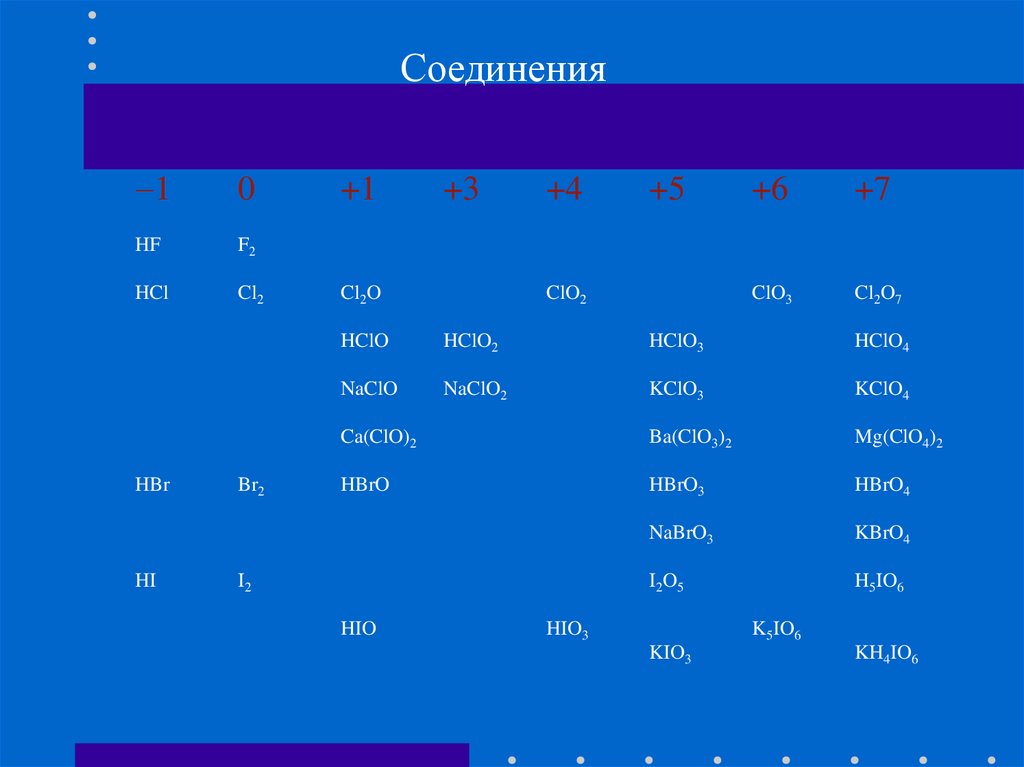
Соединения1
0
HF
F2
HCl
Cl2
HBr
HI
Br2
+1
+3
Cl2O
+4
+5
ClO2
+6
+7
ClO3
Cl2O7
HClO
HClO2
HClO3
HClO4
NaClO
NaClO2
KClO3
KClO4
Ca(ClO)2
Ba(ClO3)2
Mg(ClO4)2
HBrO
HBrO3
HBrO4
NaBrO3
KBrO4
I2O5
H5IO6
I2
HIO
HIO3
K5IO6
KIO3
KH4IO6
12. Молекулы - простых веществ
13.
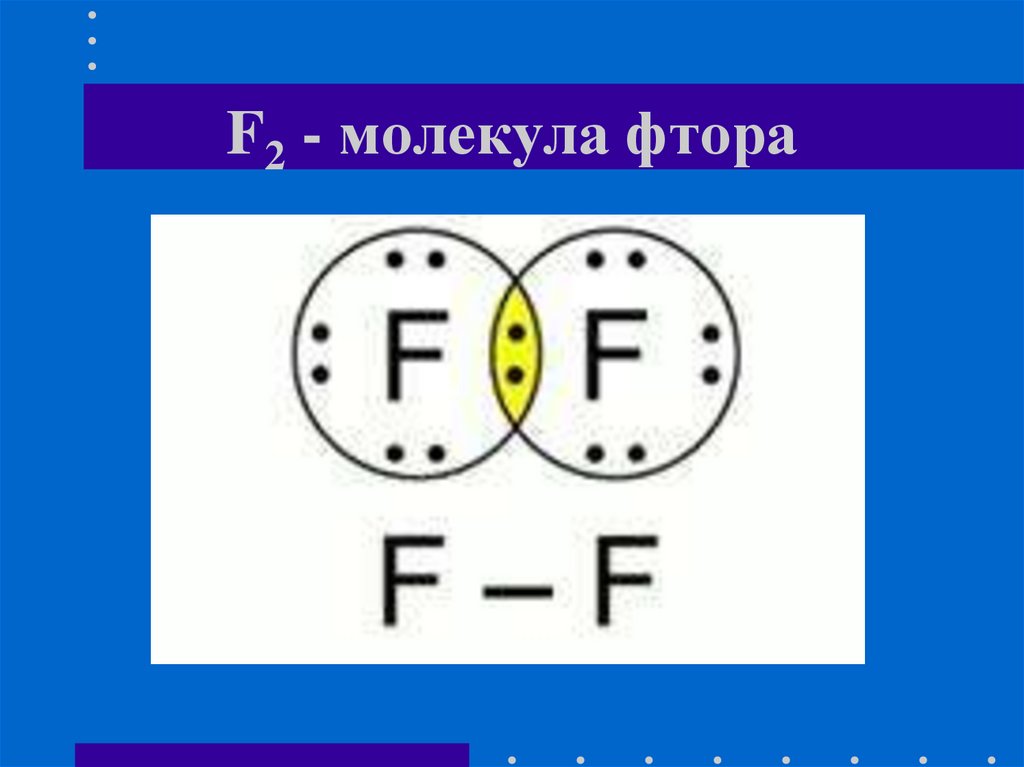
1. Г2 - общая формула галогенов- простыхвеществ.
2. Тип химической связи в молекулековалентная неполярная химическая
связь.
3. Тип кристаллической решетки молекулярная (I2- йод).
14. Фтор F Название: «фториас» - «разрушающий» Получил: в 1866 году французский химик Муассан А.
Нахождение в природеВ природе: 0,066% по массе
15.
16. F2 - молекула фтора
17.
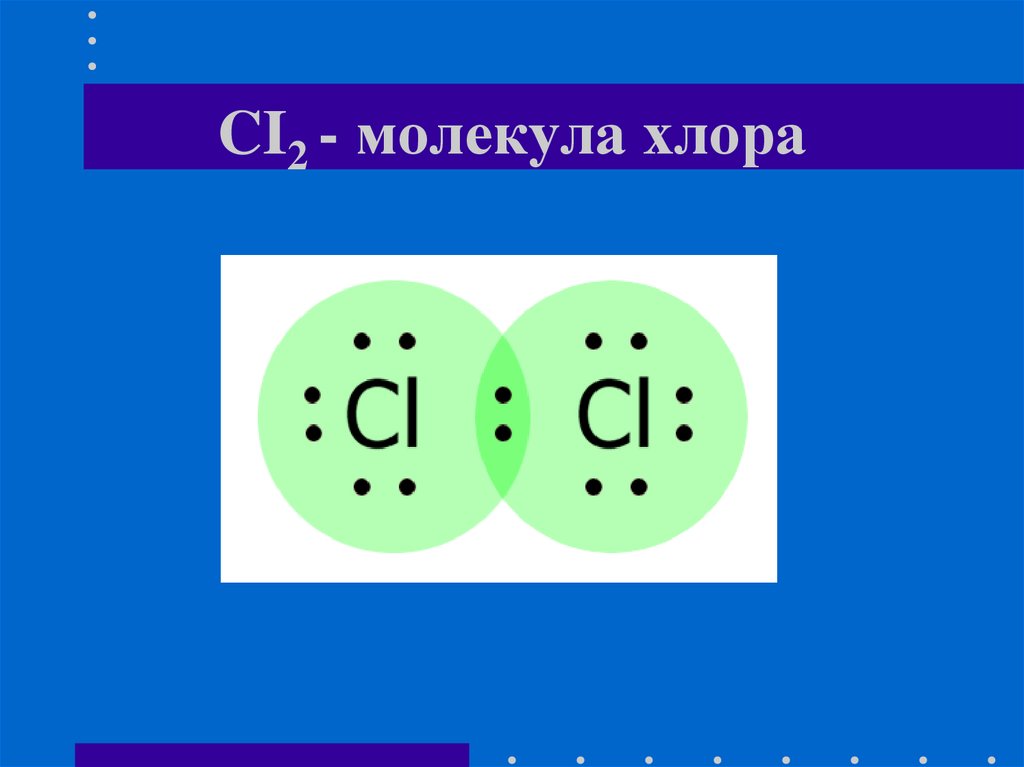
Минералы фтора18. Хлор CI2 Открыт: в 1774 году, шведским химиком К. В. Шееле
Нахождение в природеВ земной коре: 0.017 % по массе
В морской воде: NaCI, MgCI2
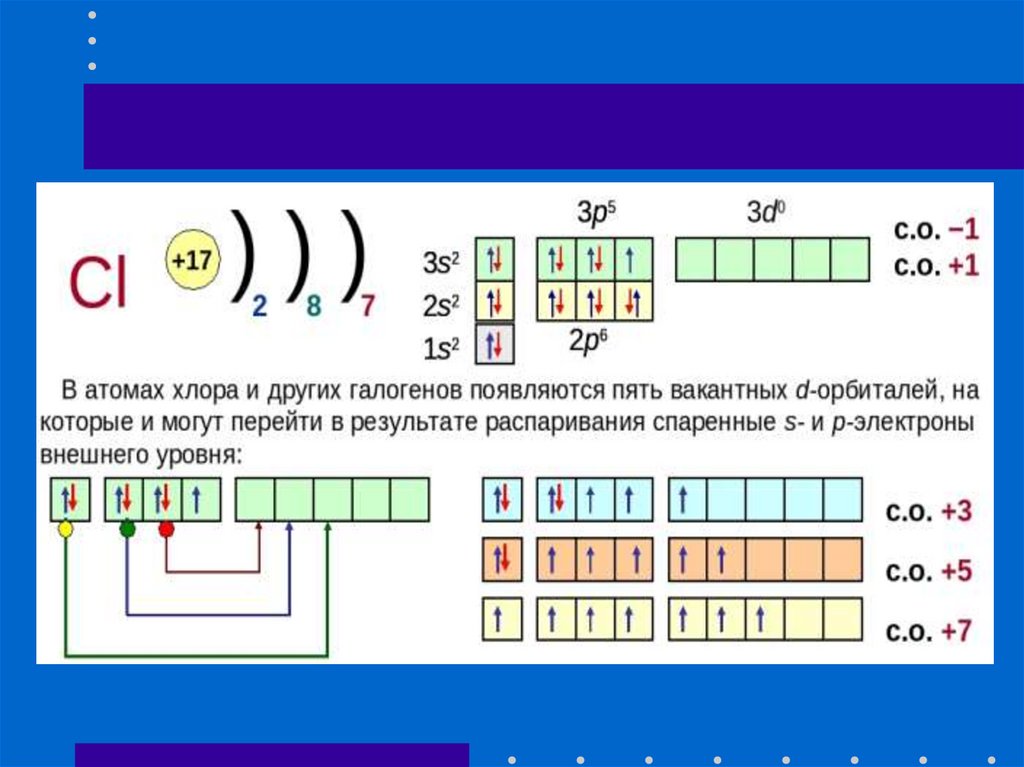
19. Распределение электронов атома хлора по энергетическим уровням
Распределение электронов атомахлора по энергетическим уровням
20.
21.
22.
Характеристика простого вещества• Тип связи: ковалентная неполярная
• Молекула двухатомная
• Изотопы: 35Cl (75,78 %) и 37Cl(24,22 %)
• Тип кристаллической решетки:
молекулярная
Молекулярная кристаллическая
решётка


















 Химия
Химия