Похожие презентации:
Галогены. Положение галогенов в ПСХЭ
1.
2.
Положение галогенов в ПСХЭГруппы элементов
Пери –
оды
I
1
Н
2
Li
3
Na
6.939
3
Литий
11 Мg
22,9898
Калий
29
Сu
85,47
Ag
196,967
ЛВС
112,40
55 Ва
132,905
Аu
[223]
Бор
Скандий
Иттрий
Сd In
114,82
Барий
80
200,59
Rа
Индий
*
138,81
Hg ТI
[226]
49
Кремний
VI
204,37
91,22
81
Sn
VII
Радий
R2О
RO
118,69
Таллий
Гафний
41
92,906
Свинец
Rf
Nb
Ниобий
73
180,948
Та
Тантал
[262]
Сера
VIII
Db
9
51,996
Хром
Фтор
34 Br
Селен
42
95,94
Мо
183.85
52 I
[263]
55,847
W
58,9332
Со
Кобальт
75
186,2
Re
Рений
44
101,07
Ru
Рутений
45
102,905
Rh
Родий
[262]
Борий
RO2
R2O5
RO3
R2O7
RH4
RH3
RH2
RH
18
58,71
39,948
Ni
Никель
36
83,80
46
106,4
Pd
Палладий
54
131,30
Ксенон
76
190,2
Оs
77
192,2
Ir
Иридий
78
195,09
Рt
Платина
Rn
85
Bh
10
20,183
Xe
Радон
Астат
107
28
4.0026
Криптон
Осмий
210
Nе
Кr
53
84 At
Сиборгий
27
126,9044
[210]
Sg
Fe
Железо
Йод
Полоний
106
Технеций
78,96
Теллур
74
[99]
26
35
Тс
43
Гелий
Аргон
79,904
Бром
2
Ar
17
Хлор
Не
Неон
35,453
Марганец
78,96
Галогены
18,9984
Cr 25
Мn
44,956
24
83 Ро
Висмут
105
32,064
Вольфрам
208,980
F
17 Cl
51 Тe
121,75
Актиний Резерфордий Дубний
R2O3
Кислород
Молибден
Сурьма
82 Вi
207,19
8
15,9994
33 Se
74,9216
Мышьяк
50 Sb
Олово
** Ас 104
88 89
138,81
[261]
Франций
Zr
Цирконий
Pb
Фосфор
32 As
72,59
О
15 S
30,9738
Ванадий
Германий
40
Азот
7
14,0067
Ti 23
V
50,942
La 72
Hf
178.49
Лантан
Ртуть
87
Y
88,905
N
14 P
28,086
31 Ge
26,9815
38 39
56 57
Углерод
Титан
Галлий
137.34
6
12,01115
Sc 22
47,90
44,956
Zn Ga
87,62
С
13 Si
26,9815
Алюминий
Кадмий
Золото
Fr
48
5
10,811
20 21
Стронций
Цезий
79
65,37
37 Sr
Серебро
Cs
40,08
Кальций
30
В
12 Al
24,312
Цинк
Рубидий
47
4
9,0122
Магний
19 Сa
39,102
107,868
Высшие
оксиды
Ве
Бериллий
Натрий
Rb
7
V
Водород
Медь
6
IV
1
63,546
5
III
1,00797
К
4
II
108
[265]
Hs
Хассий
109
[266]
Мt
Мейтнерий
RO4
86
[222]
3.
• К элементам VII группы, главной подгруппы относятсяфтор F, хлор Cl, бром Br, иод I, астат At
• Общее название - галогены (греч. «солеобразующие») большинство их соединений с металлами представляют собой
типичные соли (KCl, NaCl и т.д.).
4.
• В свободном виде не встречаютсяФлюорит
CaF2
5. Галит NaCl
6.
CильвинитKCl NaCl
7.
Нахождение галогенов в природеАпатит 3Ca(PO4 ) 2*CaF2
8.
AgI (йодаргирит)примесь к другим минералам9.
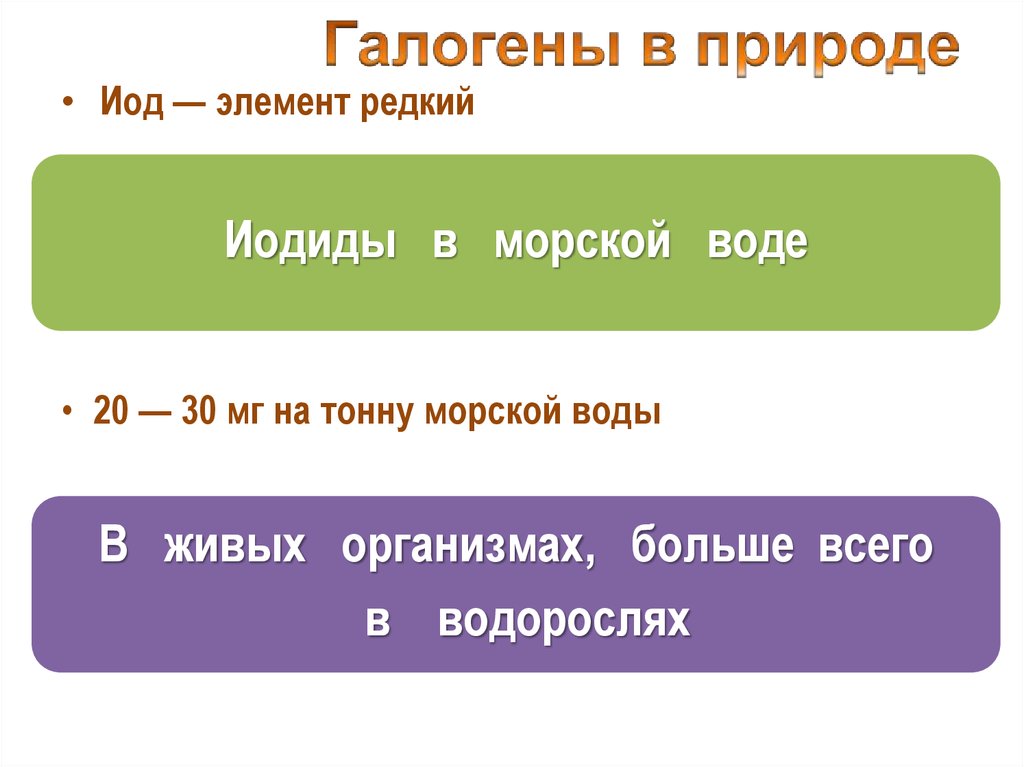
• Иод — элемент редкийИодиды в морской воде
• 20 — 30 мг на тонну морской воды
В живых организмах, больше всего
в водорослях
10. 5 кг на тонну высушенной морской капусты (ламинарии)
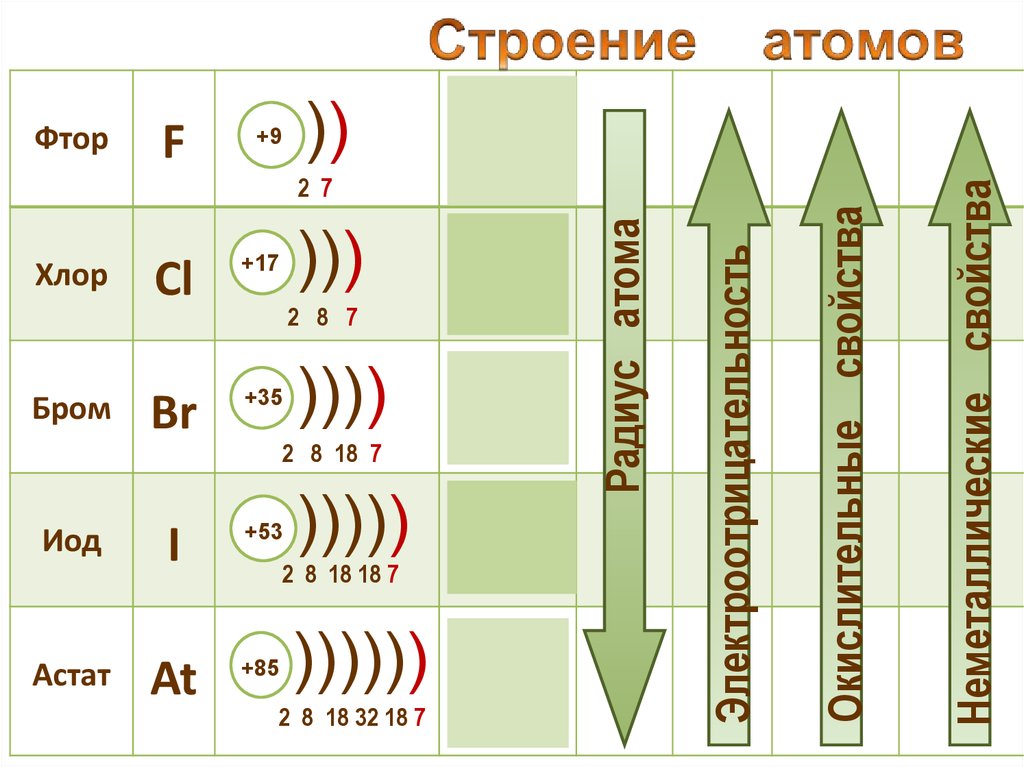
11.
F+9
))
2s22р5
Иод
I
+53
Астат
At
+85
2 8 7
))))
4s24p5
2 8 18 7
)))))
2 8 18 18 7
5s25p5
)))))) 6s 6p
2 8 18 32 18 7
2
5
Окислительные свойства
Br
+35
Бром
3s23p5
Электроотрицательность
)))
Cl
+17
Хлор
Радиус атома
2 7
Неметаллические свойства
Фтор
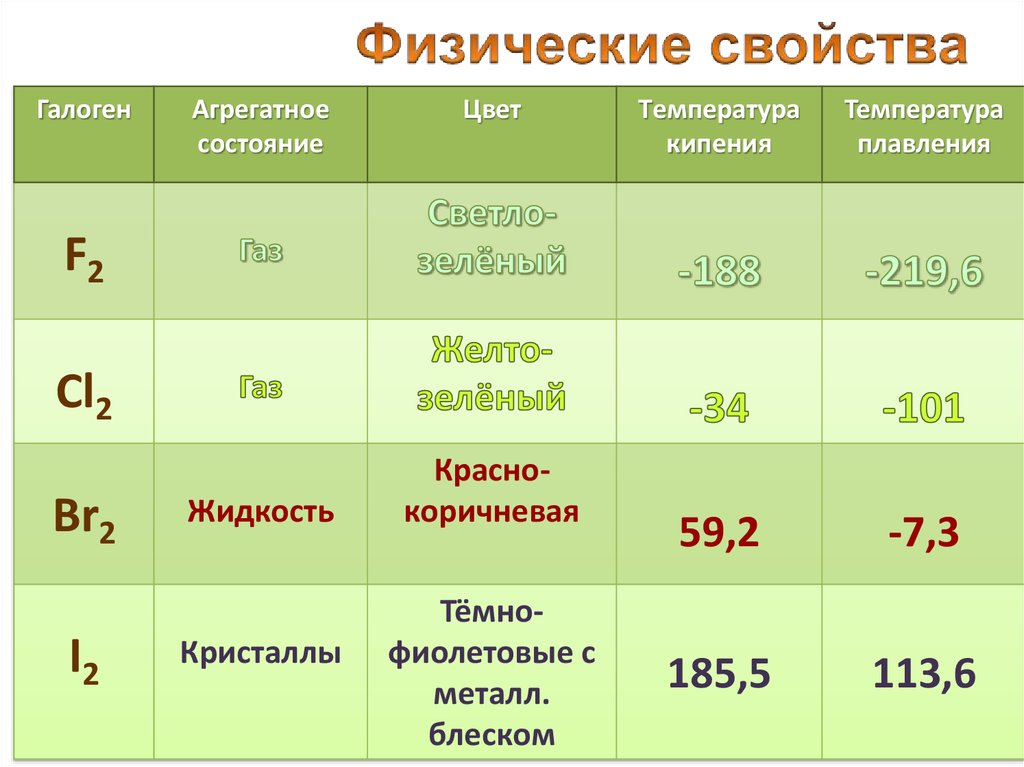
12.
ГалогенАгрегатное
состояние
Цвет
Tемпература
кипения
Температура
плавления
59,2
-7,3
185,5
113,6
F2
Cl2
Br2
I2
Жидкость
Кристаллы
Краснокоричневая
Тёмнофиолетовые с
металл.
блеском
13. Галогены
14.
918,998
7
2
• Название "фтор" (от греческого phthoros разрушение, гибель)
• В свободном состоянии фтор был получен
26 июня 1886 г. французским химиком
Муассаном.
• Это зеленовато-желтый газ,
немного тяжелее воздуха, с
характерным
запахом
и
необыкновенной химической
активностью.
15.
1735,453
7
8
2
• Хлор был открыт шведским химиком
Карлом Шееле в 1774 г.
• в 1810 году сэр Гемфри Дэви назвал газ
"хлорином"(Chlorine), от греческого "зелёный".
• Этот термин используется в английском
языке,
а в других языках закрепилось
название "хлор".
• Газ желто-зеленого цвета
с резким запахом, ядовит
• в 2,5 раза тяжелее воздуха
16.
3579,9
7
18
8
2
79Вr
(50,56%)
81Вr
(49,44%)
• от греч. bromos – зловоние
• единственный неметалл, жидкий при
комнатной температуре
• тяжелая
красно-бурая
жидкость
с
неприятным запахом
• пары брома имеют желто-бурый цвет
• при температуре –7,25° C бром затвердевает,
превращаясь в красно-коричневые игольчатые
кристаллы со слабым металлическим блеском
17.
53126,9
7
18
18
8
2
• от греч. iodes—имеющий фиалковый цвет
• в парообразное состояние переходит при
комнатной t°, не плавясь (сублимация);
• пары -фиолетового цвета
Иод был открыт в 1811 г. Куртуа в золе
морских водорослей, а с 1815 г. ГейЛюссак стал рассматривать его как
химический элемент
Известны 37 изотопов иода с
массовыми числами
от 108 до 144.
18.
• Превращение в пары, минуя жидкоесостояние
19.
• Молекулы галогенов состоят из двух атомов.Cl + Cl → Cl Cl
• Связь – ковалентная неполярная
20.
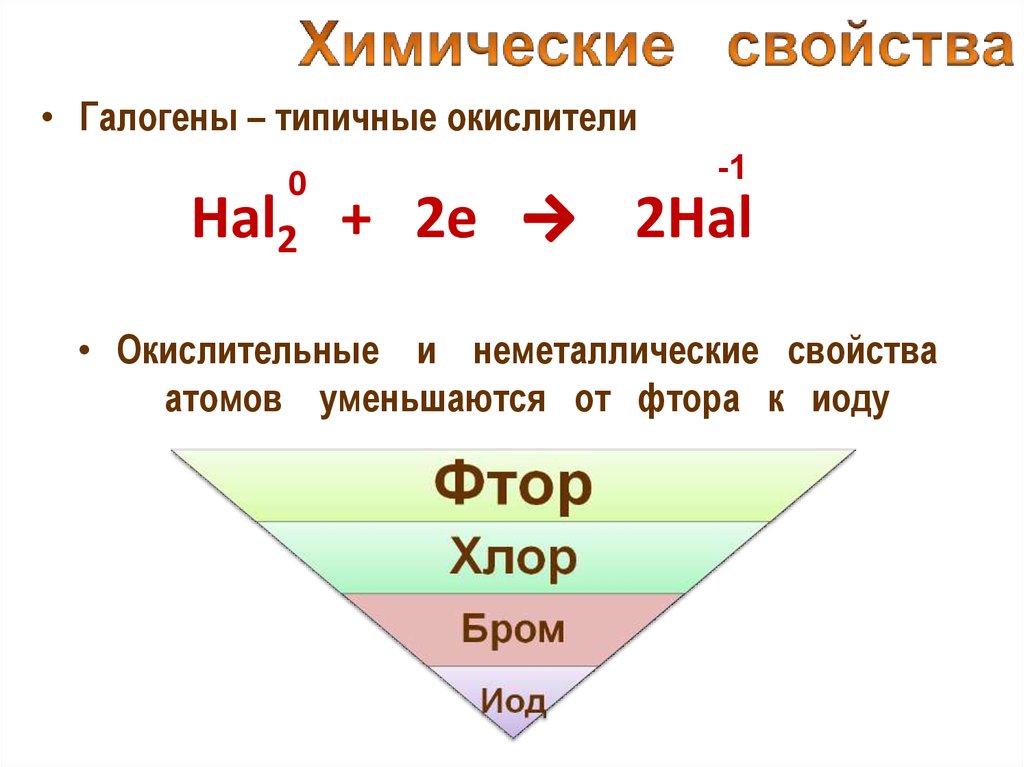
• Галогены – типичные окислители0
Hal2 + 2e
-1
2Hal
• Окислительные и неметаллические свойства
атомов уменьшаются от фтора к иоду
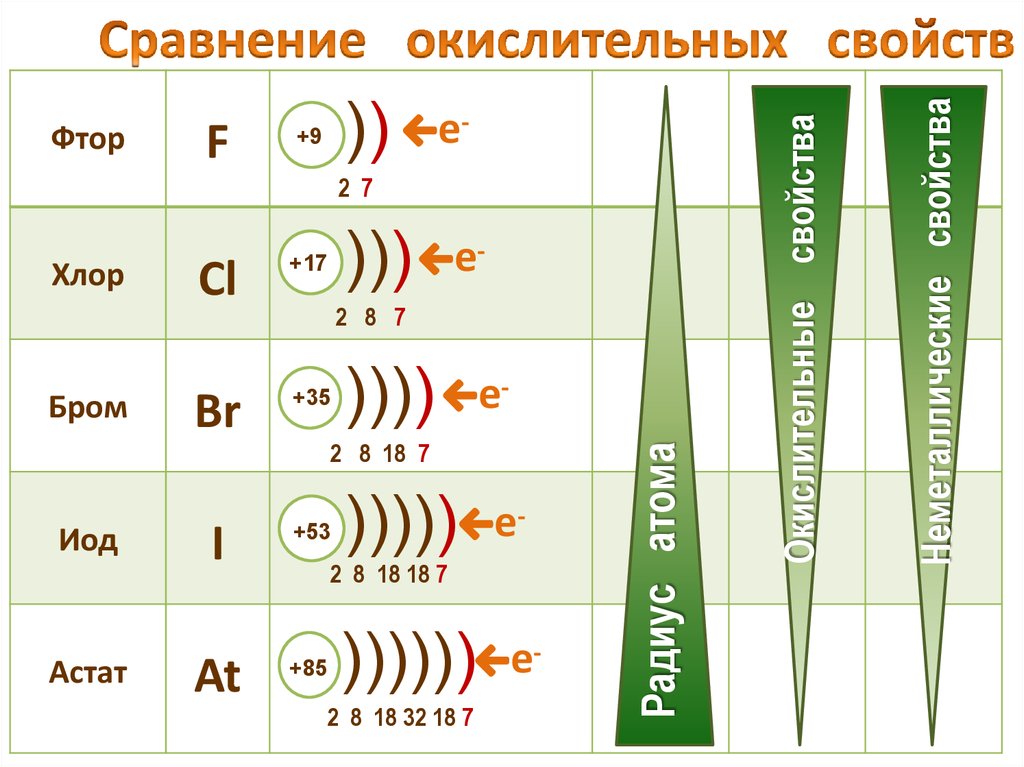
21. Сравнение окислительных свойств
е-2 7
)))
Cl
+17
Br
+35
Иод
I
+53
Астат
At
+85
Бром
2 8 7
))))
е-
2 8 18 7
)))))
е-
2 8 18 18 7
))))))
2 8 18 32 18 7
е-
Радиус атома
Хлор
е-
Неметаллические свойства
F
))
+9
Окислительные свойства
Фтор
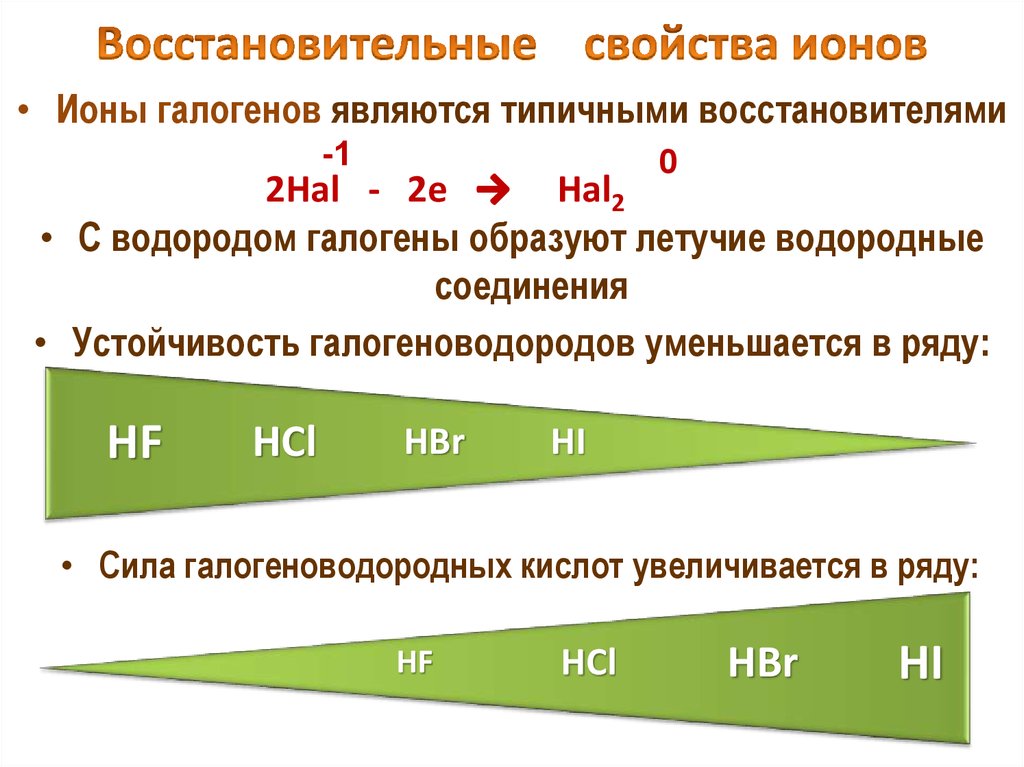
22. Восстановительные свойства ионов
• Ионы галогенов являются типичными восстановителями-1
0
2Hal - 2e
Hal2
• С водородом галогены образуют летучие водородные
соединения
• Устойчивость галогеноводородов уменьшается в ряду:
HF
HCl
HBr
HI
• Cила галогеноводородных кислот увеличивается в ряду:
HF
HCl
HBr
HI
23.
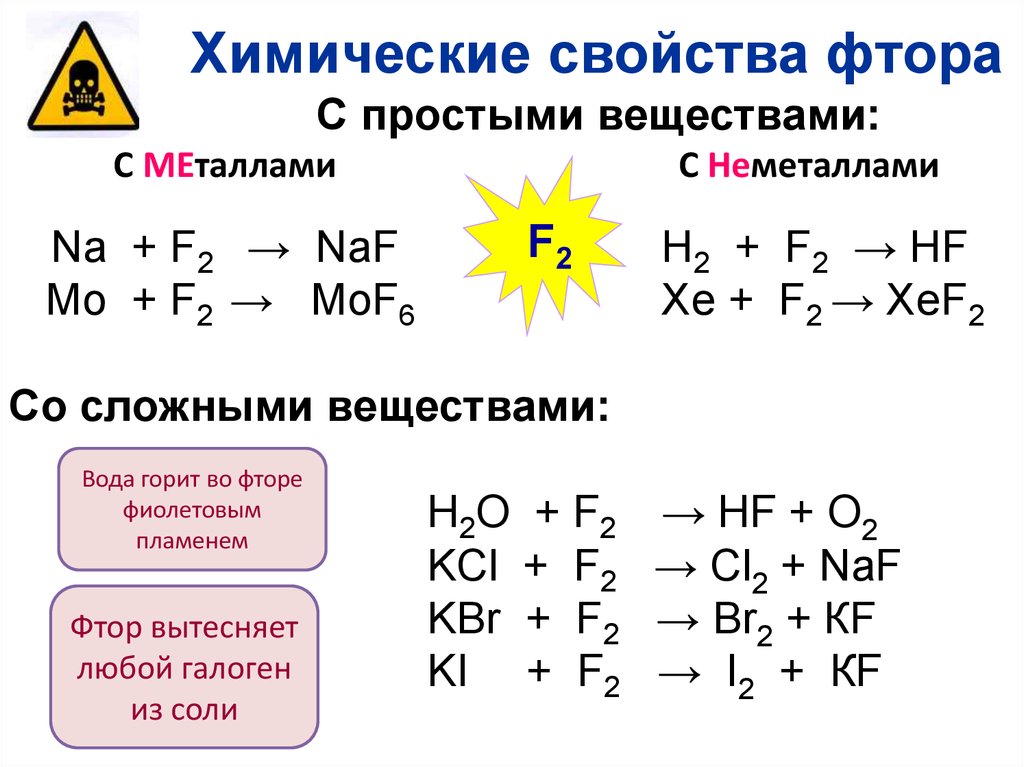
Химические свойства фтораС простыми веществами:
С МЕталлами
Na + F2 → NaF
Mo + F2 → MoF6
С Неметаллами
F2
H2 + F2 → HF
Xe + F2 → XeF2
Со сложными веществами:
Вода горит во фторе
фиолетовым
пламенем
Фтор вытесняет
любой галоген
из соли
H2O + F2
KCl + F2
KBr + F2
KI + F2
→ HF + O2
→ Cl2 + NaF
→ Br2 + КF
→ I2 + КF
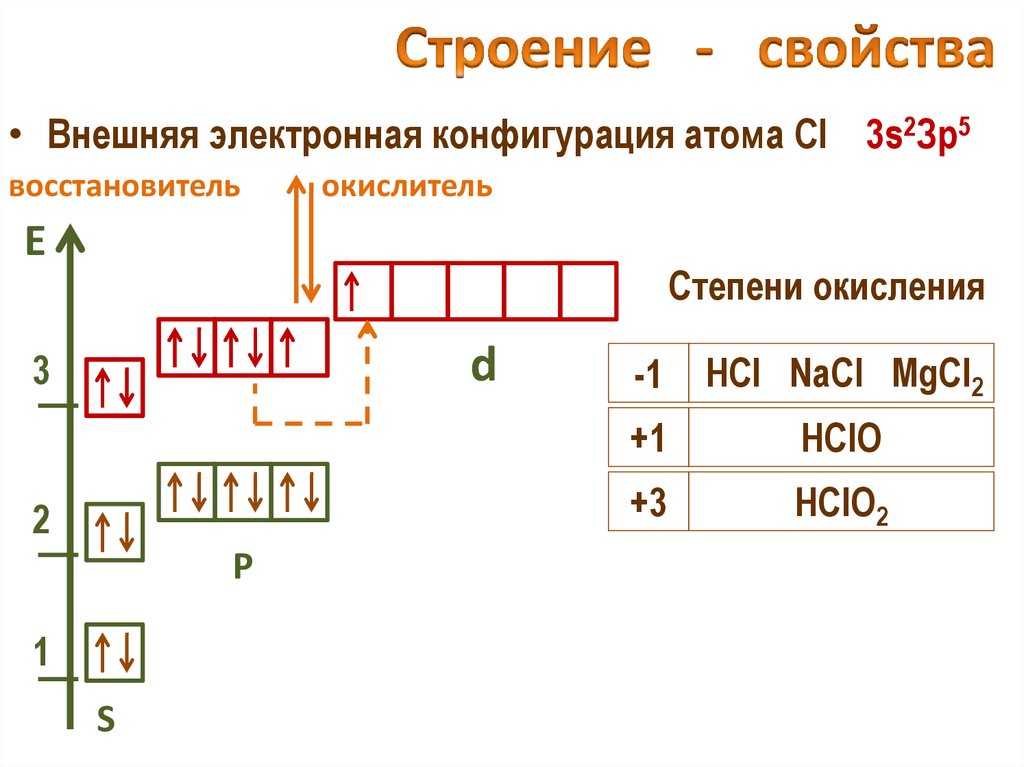
24. Строение - свойства
• Внешняя электронная конфигурация атома Cl 3s2Зр5восстановитель
окислитель
Е
Степени окисления
d
3
2
Р
1
S
-1
HCl NaCl MgCl2
+1
HClO
+3
HClO2
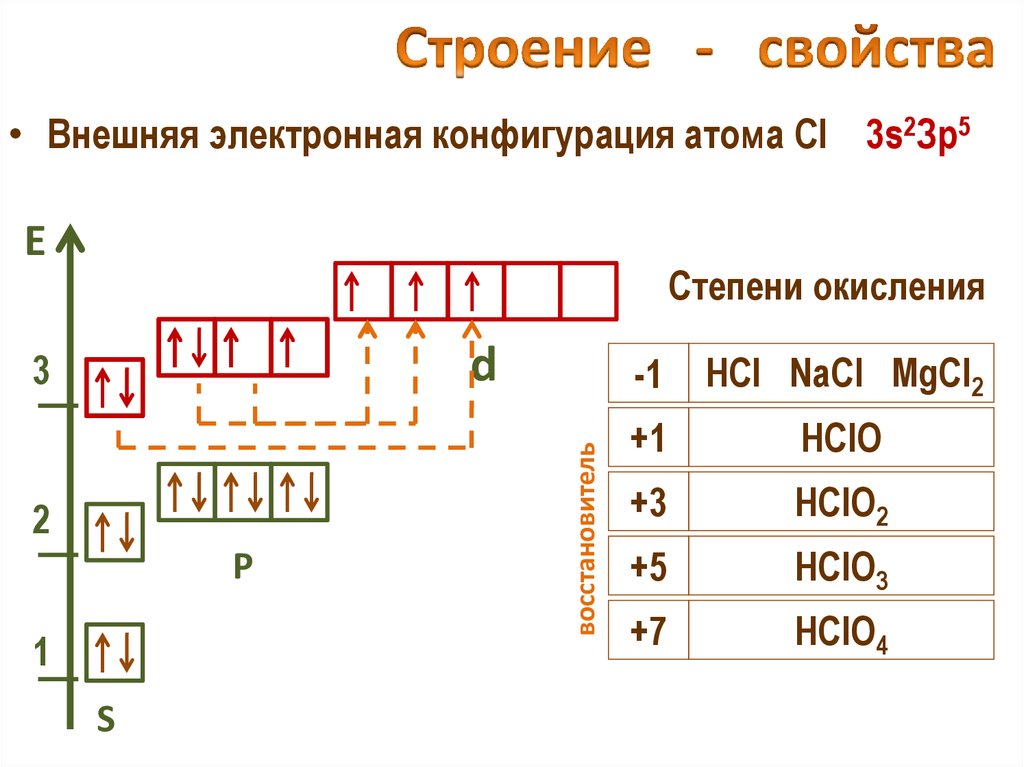
25. Строение - свойства
• Внешняя электронная конфигурация атома Cl 3s2Зр5Е
Степени окисления
2
Р
1
S
восстановитель
d
3
-1
HCl NaCl MgCl2
+1
HClO
+3
HClO2
+5
HClO3
+7
HClO4
26.
1. Взаимодействие с металламиХлор непосредственно реагирует почти со
всеми металлами (с некоторыми только в
присутствии влаги или при нагревании):
-1
2Na + Cl2
2NaCl
2Fe + 3Cl2
-1
2FeCl3
2. Взаимодействие с неметаллами
C неметаллами (кроме углерода, азота,
кислорода и инертных газов), образует
соответствующие хлориды.
Cl2 + H2
5Cl2 + 2P
-1
2HCl
-1
2PCl5
27.
3. Взаимодействие с водойс образованием смеси кислот
0
Cl2 + H2О
-1
+1
HCl + HClO
соляная
хлорноватистая
4. Взаимодействие с солями других галогенов
более активные галогены вытесняют менее активные из
0
-1
-1
0
растворов их солей
Cl2 + 2NaBr
2NaCl + Br2
5. Взаимодействие с растворами щелочей
с образованием солей
2NaOH + Cl2
6NaOH + 3Cl2
NaCl + NaClO + H2O
t
5NaCl + NaClO3 + 3H2O
28.
1. В промышленности: электролиз расплава илираствора хлорида натрия
2NaCl
2Na + Cl2
2. В лаборатории:
4 HСl + MnO2
16 HСl + 2KMnO4
MnCl2 + Cl2 + 2H
H2O
2KСl + 2MnCl2 + 5Cl2 + 8H2O
29.
Определение галогенид-ионовОпределить в какой пробирке находится раствор хлорида,
бромида, иодида, фторида
I
II
III
IV
?
30.
Определение галогенид-ионовДобавим нитрат серебра.
Уравнения реакций:
AgNO3 + MeCl
I
II
AgCl AgBr
III
AgI
AgCl
AgNO3 + MeBr
AgBr
AgNO3 + MeI
AgI
IV AgNO
AgF
3
+ MeF
+ MeNO3
+ MeNO3
+ MeNO3
AgF + MeNO3
растворим
AgCl-белый осадок
AgBr-светло-желтый
AgI-желтый
AgF-растворим
31.
Химические свойства галогеновХлор хвалился: «Нет мне равных!
Галоген я - самый главный.
Зря болтать я не люблю:
Всё на свете отбелю!»
Йод красой своей гордился,
Твердым был, но испарился.
Фиолетовый как ночь,
Далеко умчался прочь.
Бром разлился океаном,
Хоть зловонным. Но румяным.
Бил себя он грозно в грудь:
«Я ведь бром! Не кто-нибудь!..»
Фтор молчал и думал:
«Эх!.. Ведь приду – окислю всех…»
32.
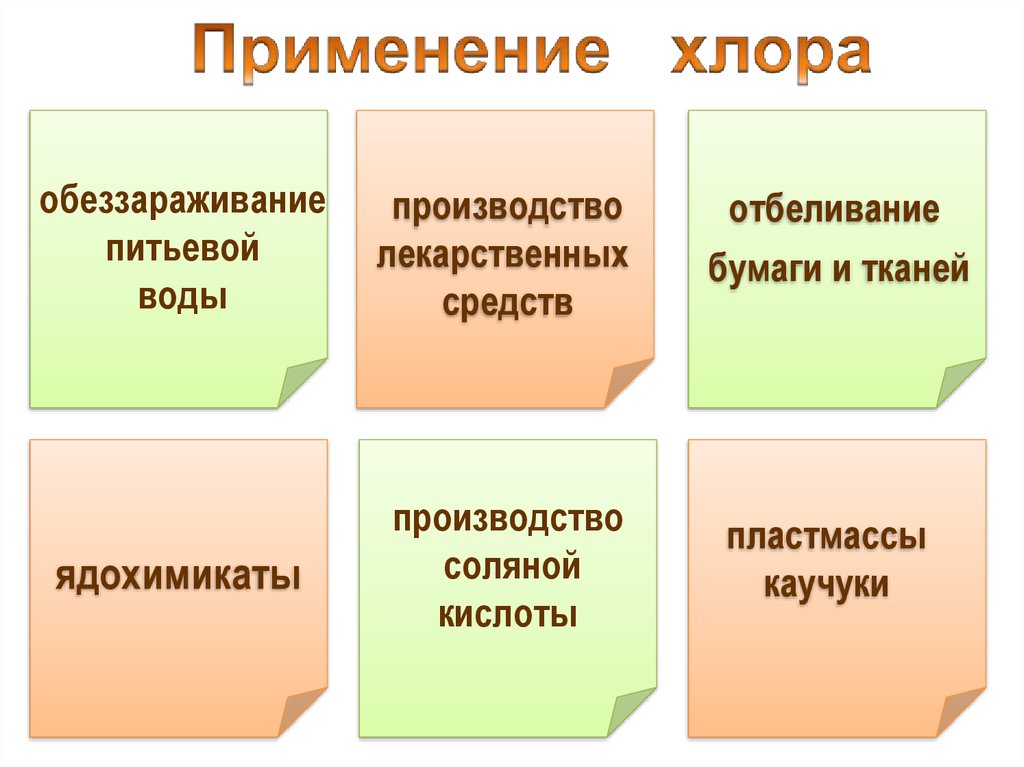
обеззараживаниепитьевой
воды
производство
лекарственных
средств
ядохимикаты
производство
соляной
кислоты
отбеливание
бумаги и тканей
пластмассы
каучуки
33.
В медицине- 5 % спиртовой раствор йода используется для
дезинфекции кожи вокруг повреждения
- В рентгенологических и томографических
исследованиях применяются йодсодержащие
контрастные препараты
В технике
- Галоге́нная ла́мпа — лампа накаливания, в
баллон которой добавлены пары галогенов
(брома или йода)
Лазерный
термоядерный
синтез
иодорганические соединения применяются для
производства сверхмощных газовых лазеров на
возбужденных атомах






















 Химия
Химия








