Похожие презентации:
Биохимия мышц
1.
Биохимия мышцАвтор-составитель :
Проф. Е.О. Данченко
ВГУ имени П.М. Машерова
2.
Биохимические функции мышцмышечное сокращение и расслабление,
регуляция этих процессов;
энергетическое обеспечение мышечной
деятельности;
метаболизм, обеспечивающий
осуществление биохимических функций
мышц.
3.
4.
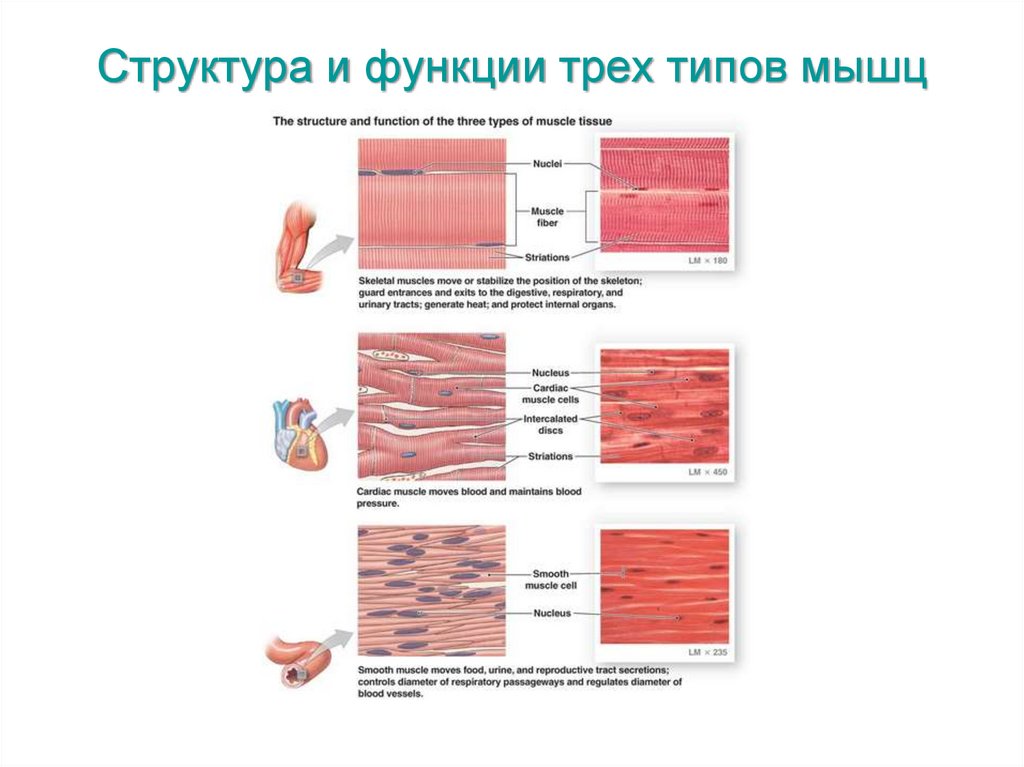
Структура и функции трех типов мышц5.
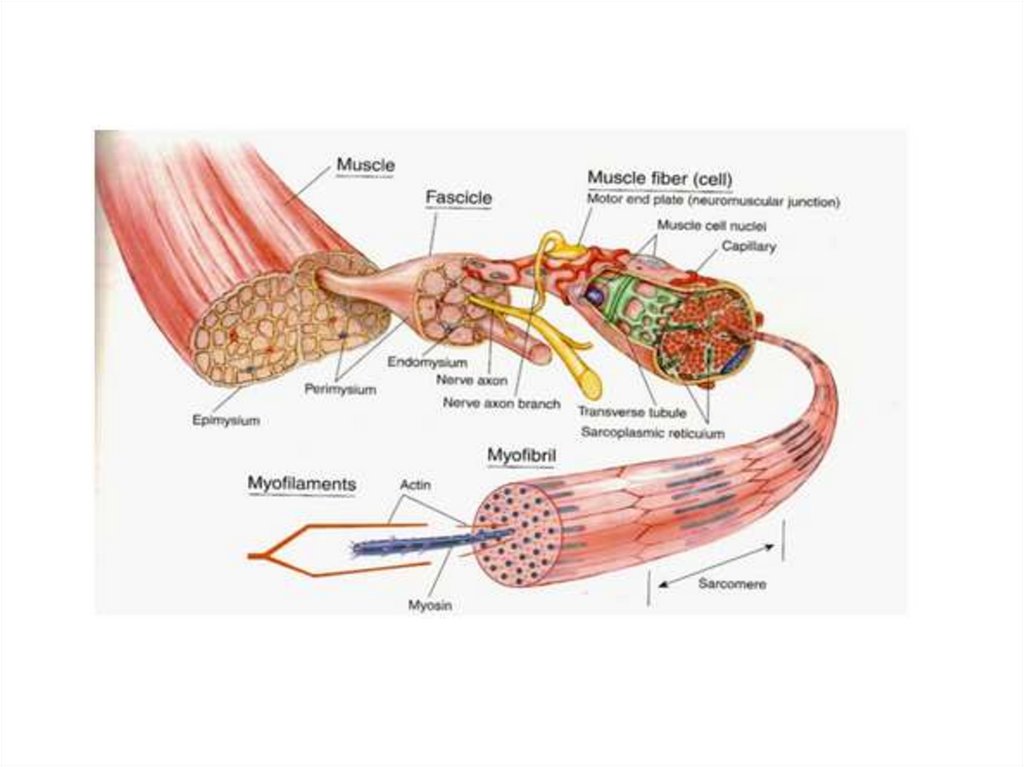
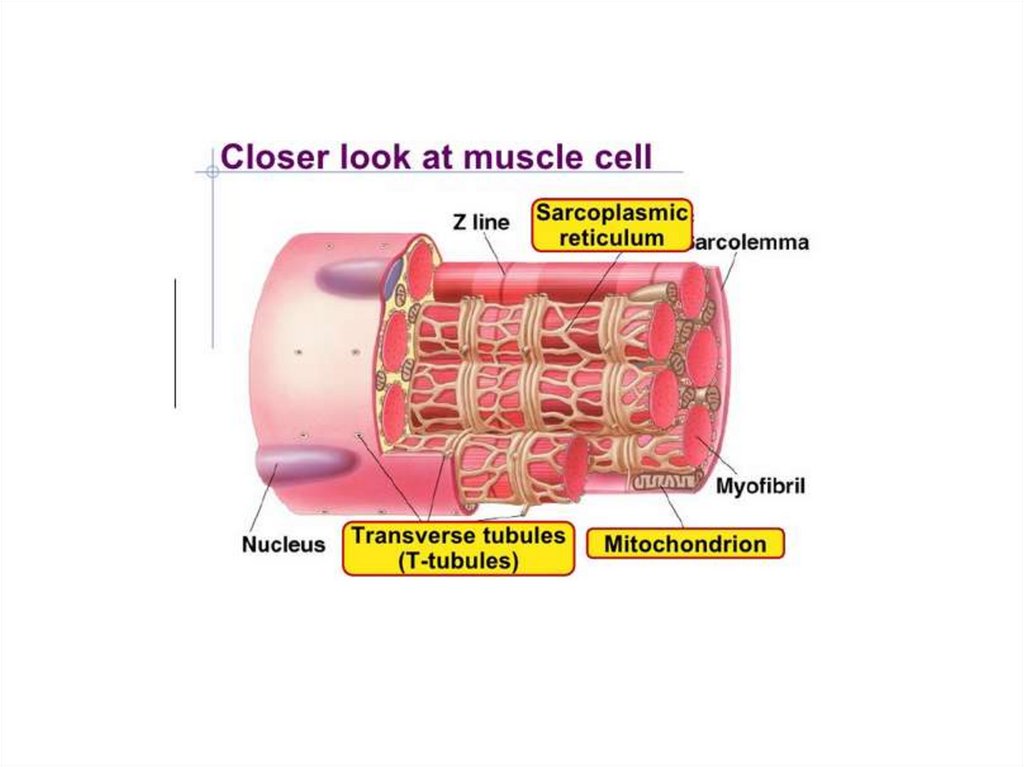
Типы волокон скелетных мышцМышечное волокно - структурная
единица мышечной ткани, которое состоит из:
миофибрилл (сократительных элементов)
митохондрий (энергопродукция)
ядер (регуляция)
сарколемы (соединительно-тканной оболочки)
саркоплазматический или эндоплазматический
ретикулум (депо Са2+, необходимого для
возбуждения миофибриллы)
капилляры (поставка питательных веществ и
кислорода)
6.
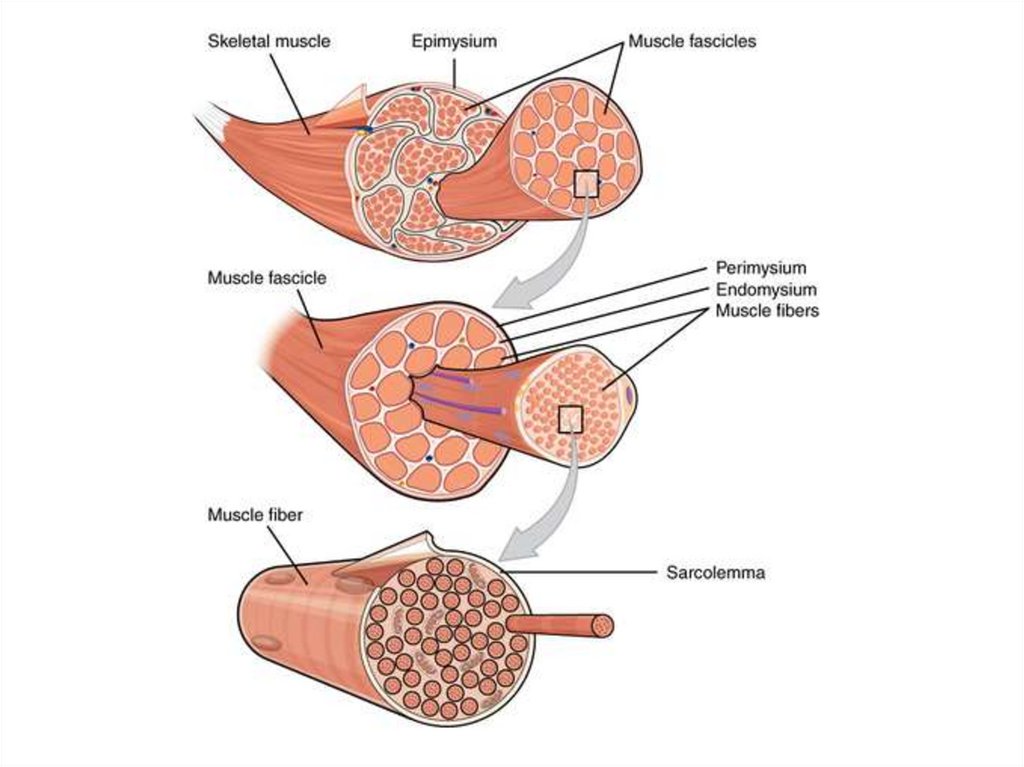
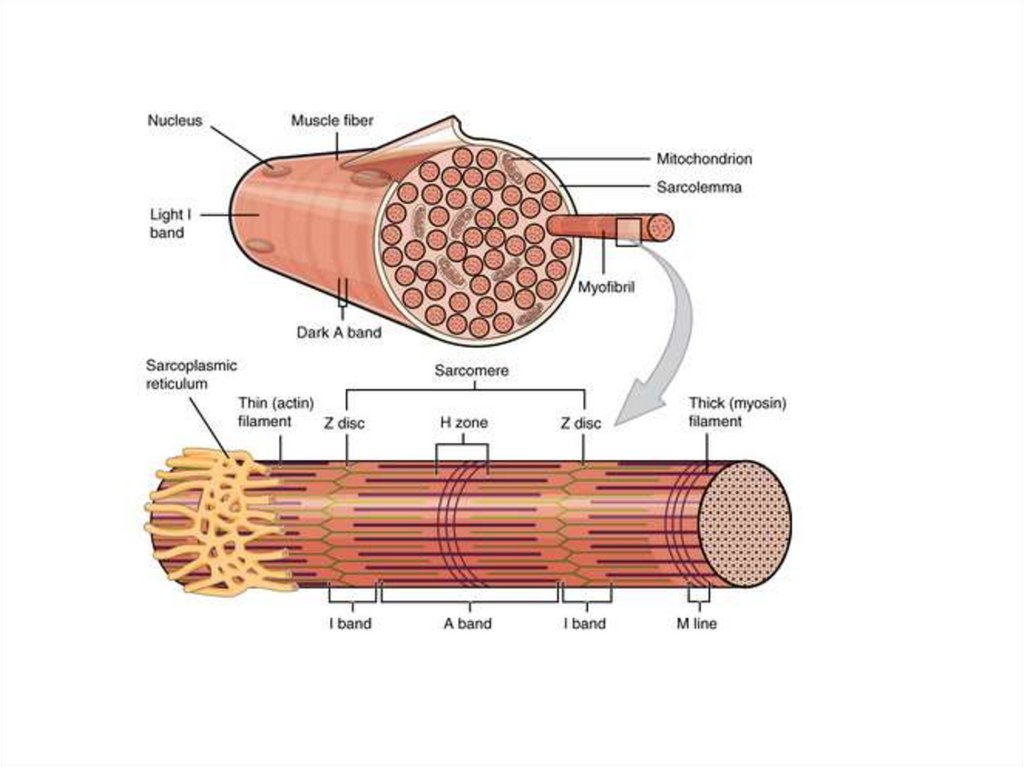
Строение мышцСкелетная мышца состоит из пучков
параллельно упакованных мышечных
клеток, или волокон (диаметр 50-100 мкм).
Каждое волокно – это одна многоядерная
клетка, у которой ядра располагаются
снаружи, а все тело заполнено
миофибриллами (диаметр 1 мкм).
Миофибриллы – органеллы клеток
поперечнополосатых мышц,
обеспечивающие их сокращение.
7.
Миофибриллы состоят состоят из толстыхи тонких микрофиламентов (нитей).
Основным белком толстых нитей является
миозин, тонкие нити содержат белки трех
типов: актин, тропомиозин и тропониновый
комплекс.
При исследовании мышечных волокон и
миофибрилл под световым микроскопом,
отмечается чередование в них темных и
светлых участков – дисков.
8.
9.
10.
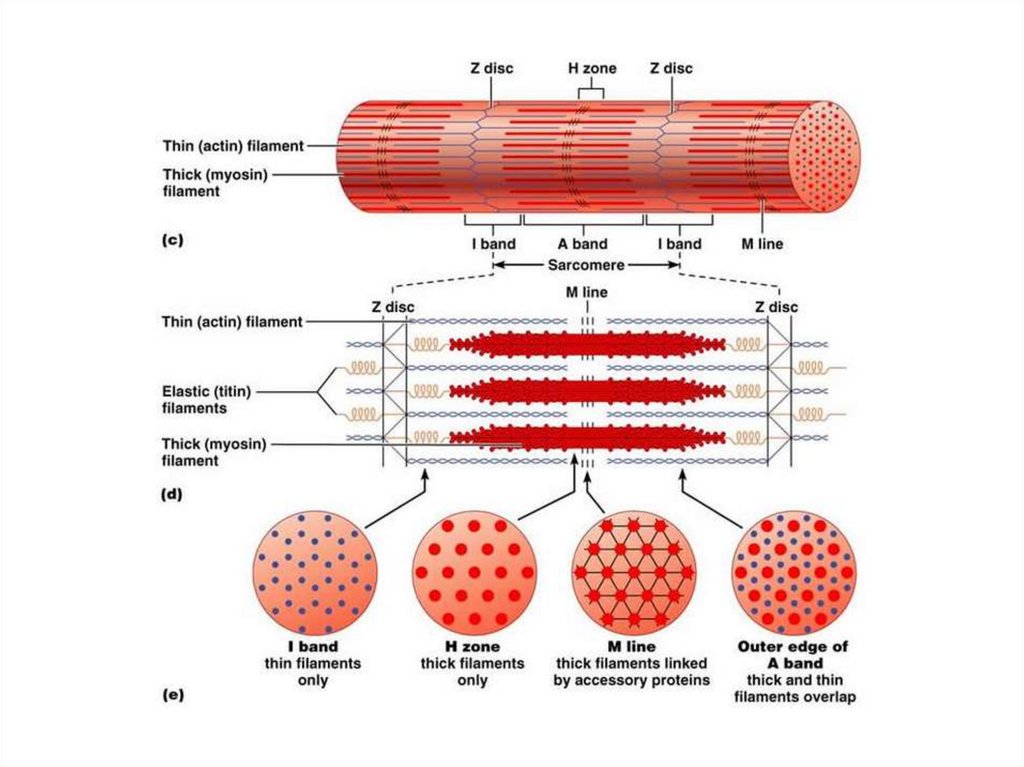
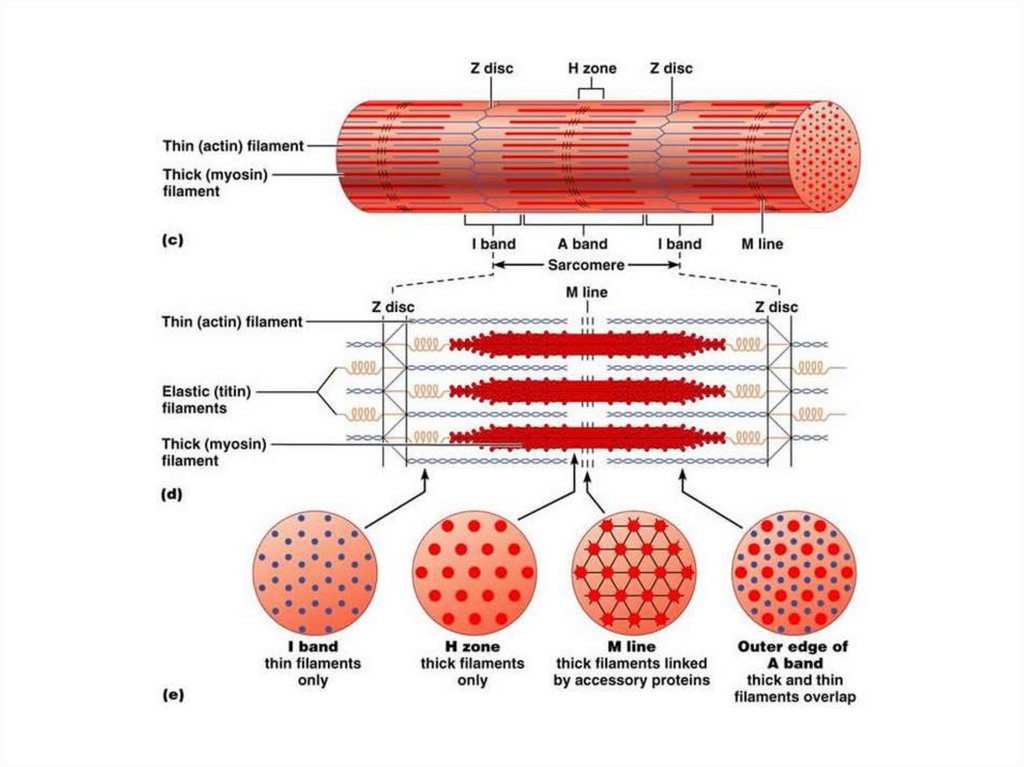
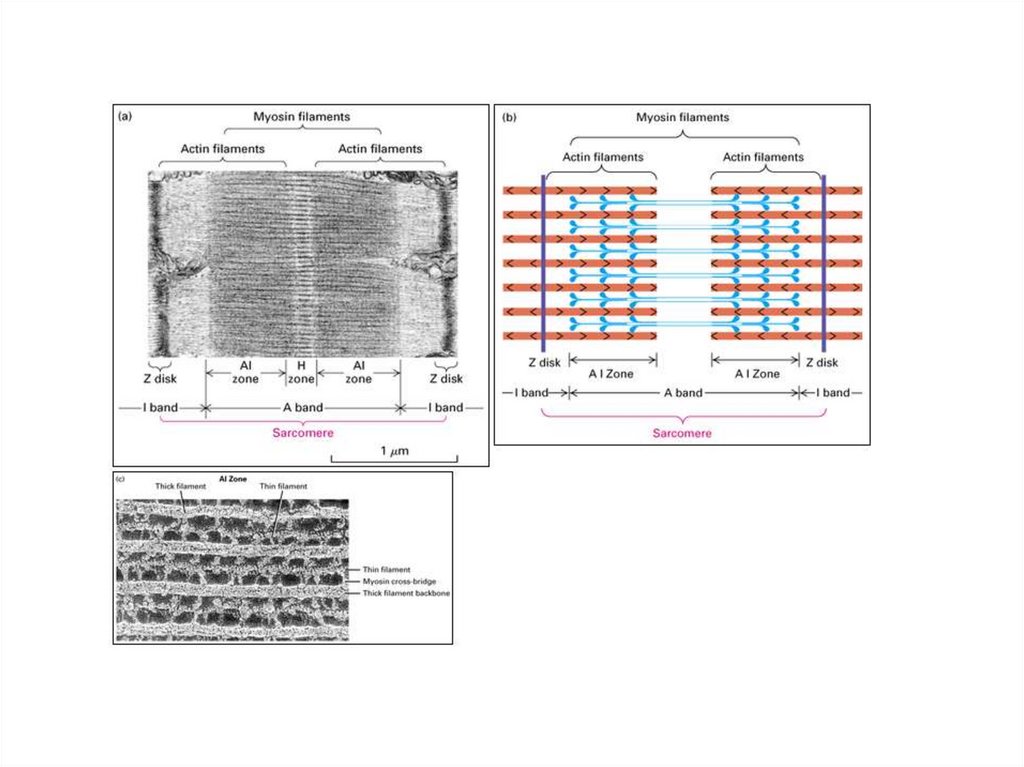
Темные диски отличаются двойнымлучепреломлением и называются
анизотропными дисками, или А-дисками.
Светлые диски не обладают двойным
лучепреломлением и называются изотропными,
или I-дисками.
В середине диска А имеется более светлый
участок – Н-зона, где содержатся только
толстые нити белка миозина.
В середине Н-зоны (значит и А-диска)
выделяется более темная М-линия, состоящая
из миомезина (необходим для сборки толстых
нитей и их фиксации при сокращении).
11.
В середине диска I расположена плотнаялиния Z, которая построена из белковых
фибриллярных молекул.
Z-линия соединена с соседними
миофибриллами с помощью белка десмина, и
поэтому все названные линии и диски
соседних миофибрилл совпадают и создается
картина поперечнополосатой исчерченности
мышечного волокна.
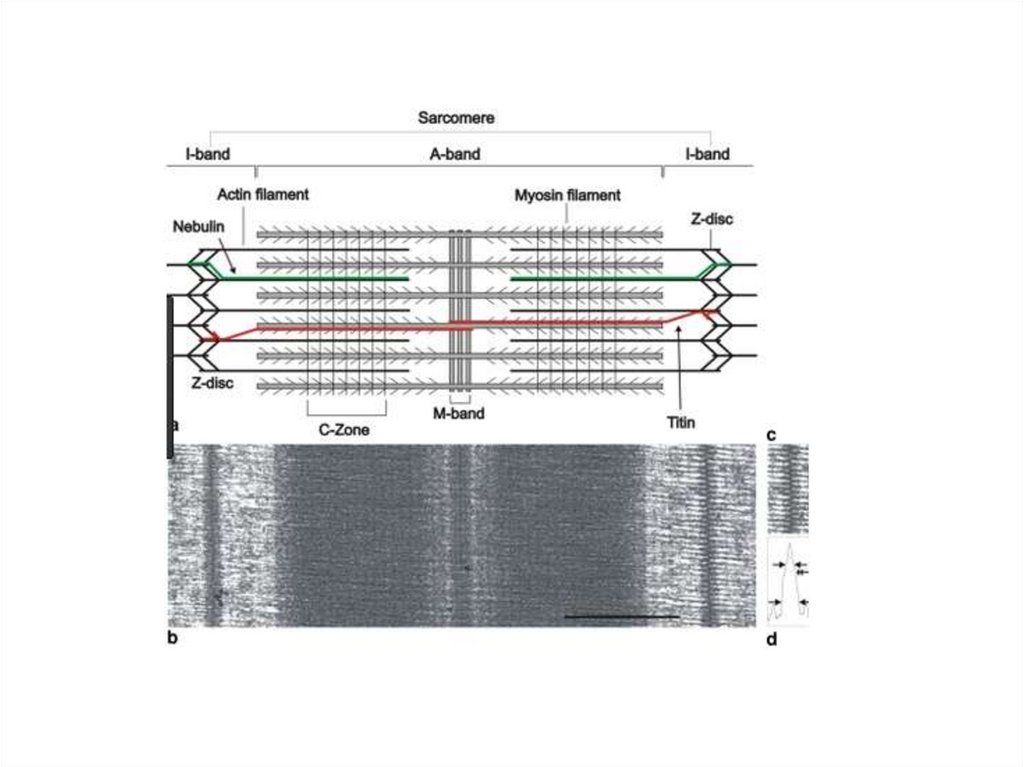
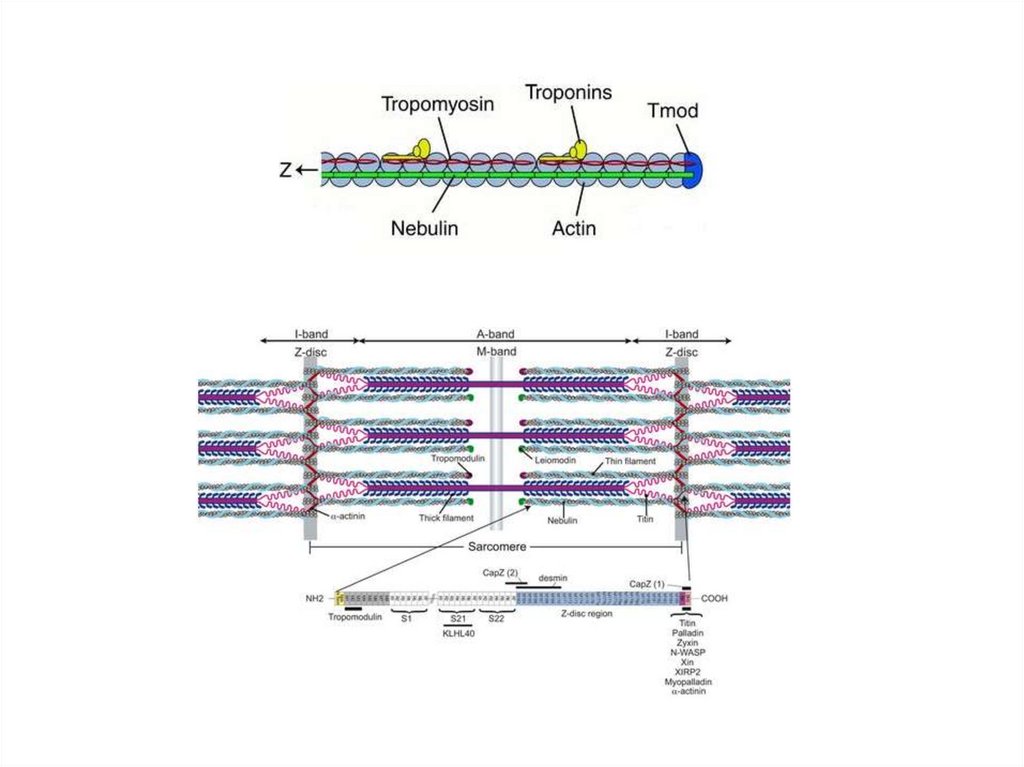
Структурной единицей миофибриллы является
саркомер (S) — это пучок миофиламентов,
заключенный между двумя Z-линиями.
Миофибрилла состоит из множества
саркомеров
12.
13.
14.
Строение миофибриллы15.
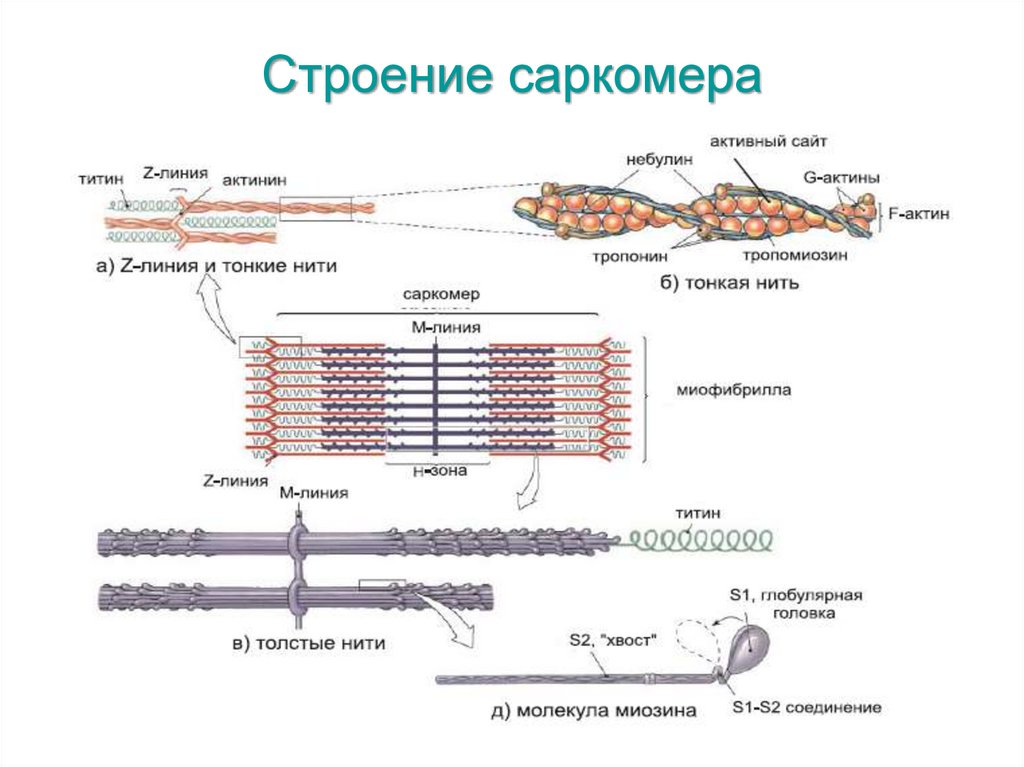
Строение саркомера16.
17.
18.
19.
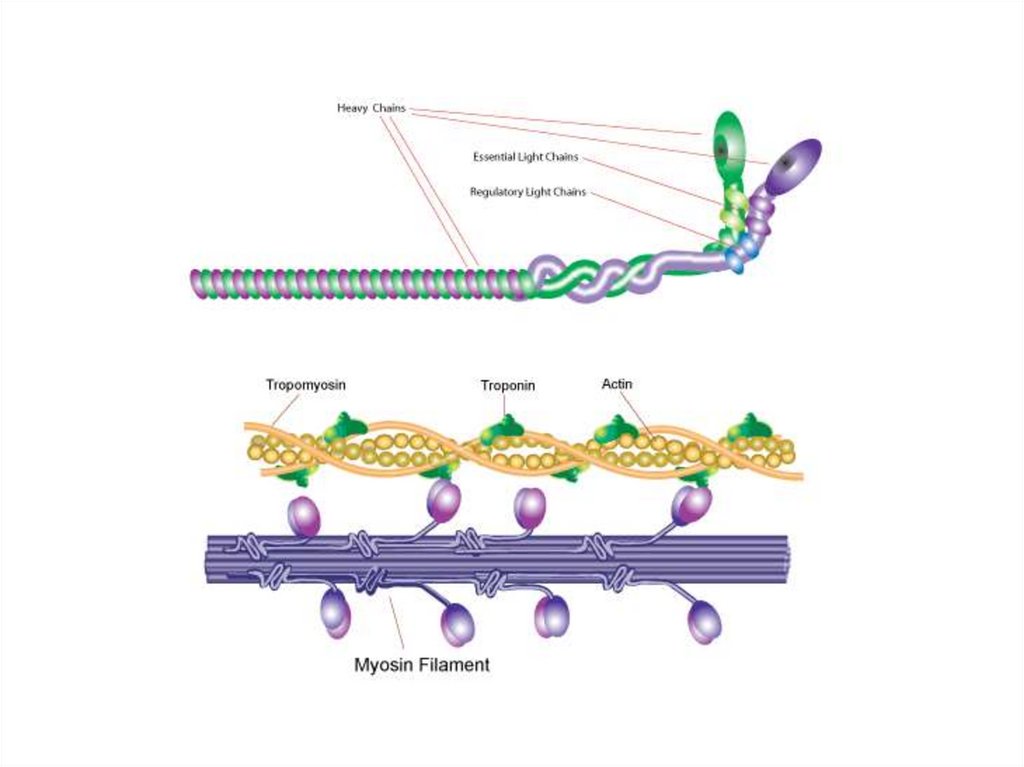
МиозинМиозин составляет 55% от общего количества
мышечных белков, образует толстые нити
(филаменты) миофибрилл. Это
асимметричный гексамер.
В молекуле миозина различают длинную
фибриллярную часть, состоящую из двух
переплетенных спиралей, каждая из которых
имеет на одном конце глобулярную
«головку».
Гексамер включает одну пару тяжелых цепей
(G) цепей и две пары легких (L) цепей,
связанных с глобулярными головками.
20.
В физиологических условиях (оптимальныеpH, температура, концентрация солей)
молекулы миозина спонтанно
взаимодействуют между собой своими
стержневыми участками ("конец в конец", "бок
в бок") с помощью слабых типов связей.
Взаимодействуют только стержни, головки
остаются свободными.
Основной функцией фибриллярной части
молекулы миозина является способность
образовывать хорошо упорядоченные пучки
миозиновых филаментов или толстые
протофибриллы с выступающими в разные
стороны головками.
21.
Головка молекулы миозина обладает Са2+зависимой АТФ-азной активностью и имеетактинсвязывающий центр, поэтому они
обеспечивают гидролиз АТФ и
взаимодействие с актиновыми филаментами.
Легкие цепи регулируют активность.
Приблизительно 400 молекул миозина
объединяются в толстый филамент.
Половина молекул перевернута головками к
одному концу филамента, а вторая половина
– к другому.
22.
23.
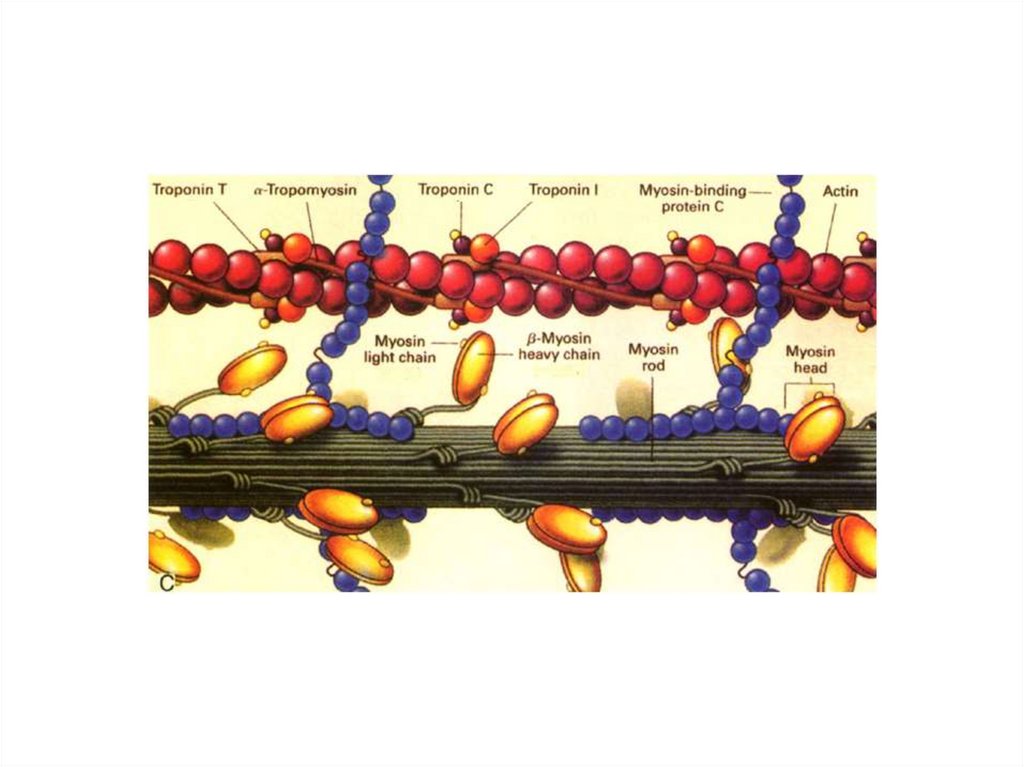
Тонкие филаменты (нити)К белкам тонких нитей относятся: актин,
тропомиозин, тропонин
Основным белком тонких нитей является актин.
Актин имеет центры связывания с миозином.
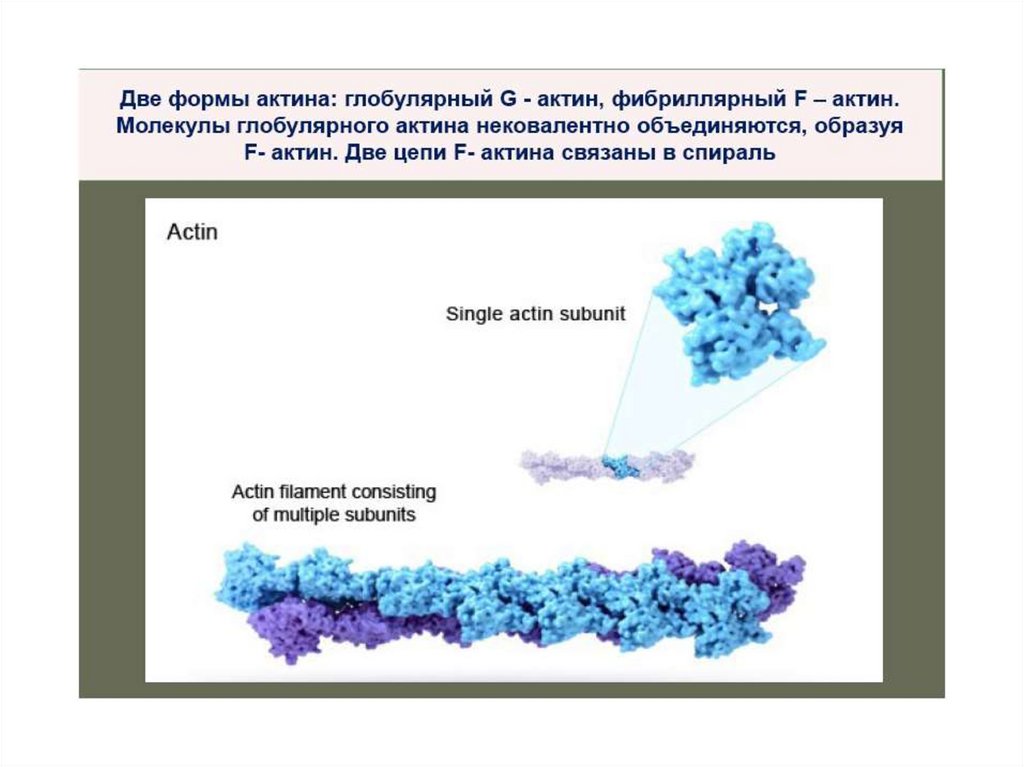
Актин бывает в двух формах: мономерный
глобулярный G-актин и фибриллярный – Fактин.
F-актин образуется при полимеризации Gактина; это двухцепочечная спираль из
мономеров G-актина.
G и F актины не обладают каталитической
активностью.
24.
25.
Тропомиозин – двухцепочечнаяпалочковидная молекула (м.м. 70 кДа).
Располагается в желобке между цепями Fактина и в покое закрывает места связывания
с головками миозина.
Тропонин (м.м. 76 кДа) состоит из трех
субъединиц, взаимодействие Ca2+ с которыми
открывает места связывания головок
миозина с мономерами F-актина.
26.
ТропонинТропонин Т (ТnТ) связывается с тропомиозином.
Тропонин I (Тnl) ингибирует взаимодействие
между F-актином с миозином и связывается с
другими компонентами тропонина.
Тропонин С (ТnС) – это кальций-связывающий
белок, структура и функции которого подобны
широко распространенному в природе белку
кальмодулину.
27.
Тропонин С, как и кальмодулин, связываетчетыре иона Са++ на молекулу белка.
Тонкий филамент поперечнополосатой мышцы
состоит из F-актина, тропомиозина и трех
тропониновых компонентов ТnТ, Тnl и ТnС
28.
29.
30.
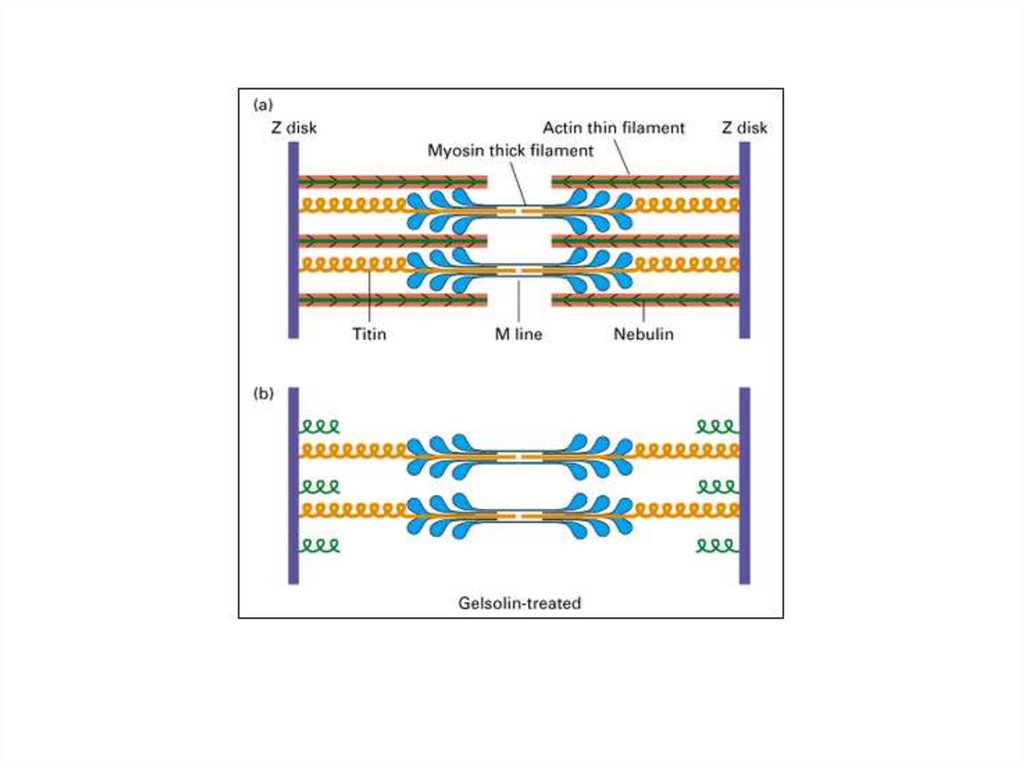
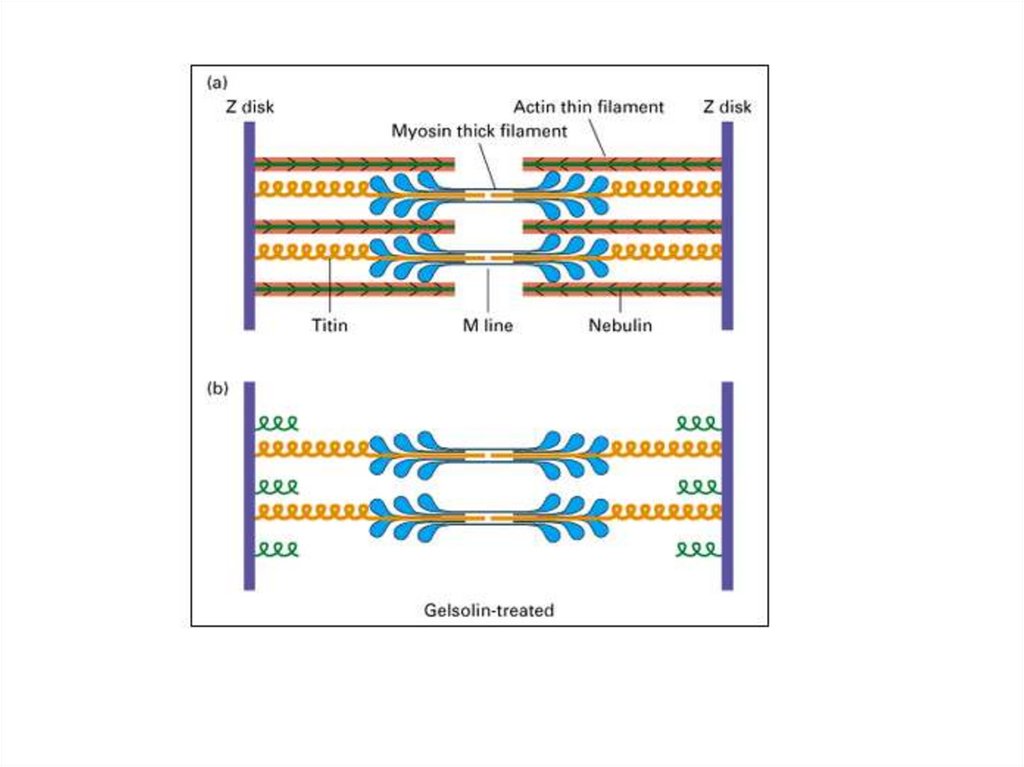
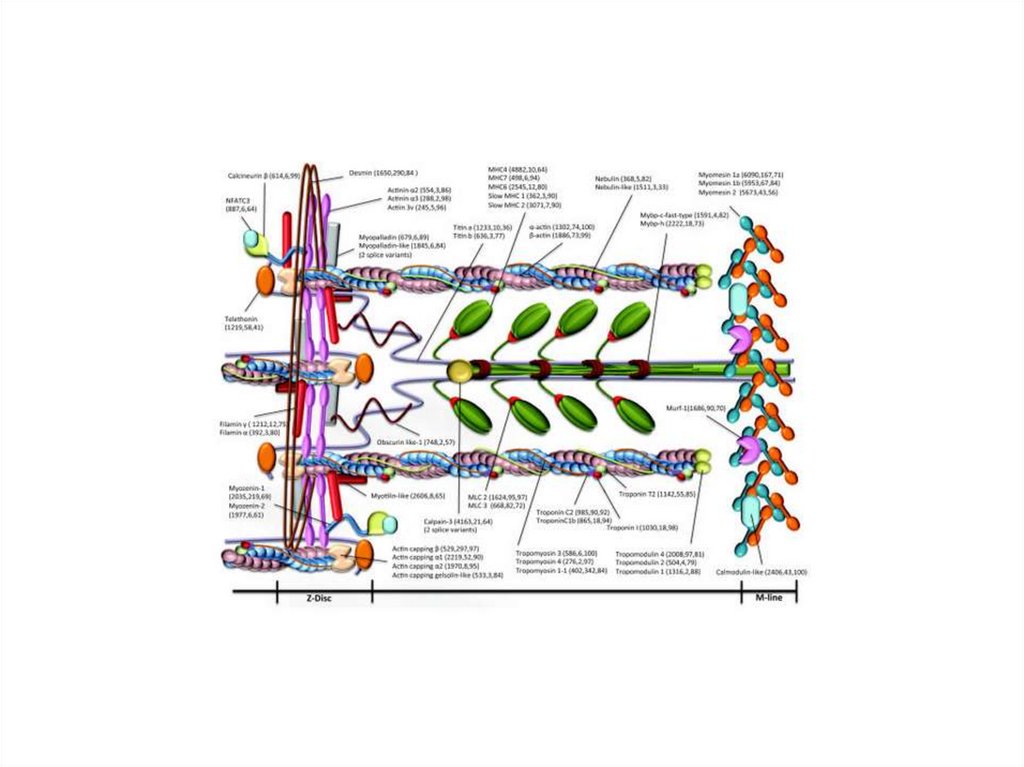
ТитинТитин (коннектин) - самый большой из
известных белков.
Период полураспада (время, требующееся для
исчезновения половины содержащегося белка в
клетке после его синтеза) равен примерно 30
часам.
Титин — это большой белок поперечнополосатых мышц, который связывает Z-диск и
М-линию саркомера, одиночная молекула
титина тянется вдоль половины его длины
саркомера.
Титин служит матрицей для правильной сборки
белков, входящих в состав саркомера.
31.
32.
НебулинНебулин – гигантский белок с м.м. 600-900
кДа.
Ассоциирован с тонкими актиновыми
филаментами (связывает примерно 200
мономеров F-актина).
Действует как «линейка» тонкой нити и
регулирует длину актиновых нитей, а,
следовательно, и размер саркомеров.
Регулирует актин-миозиновое взаимодействие
путем ингибирования АТФ-азной активности.
33.
34.
35.
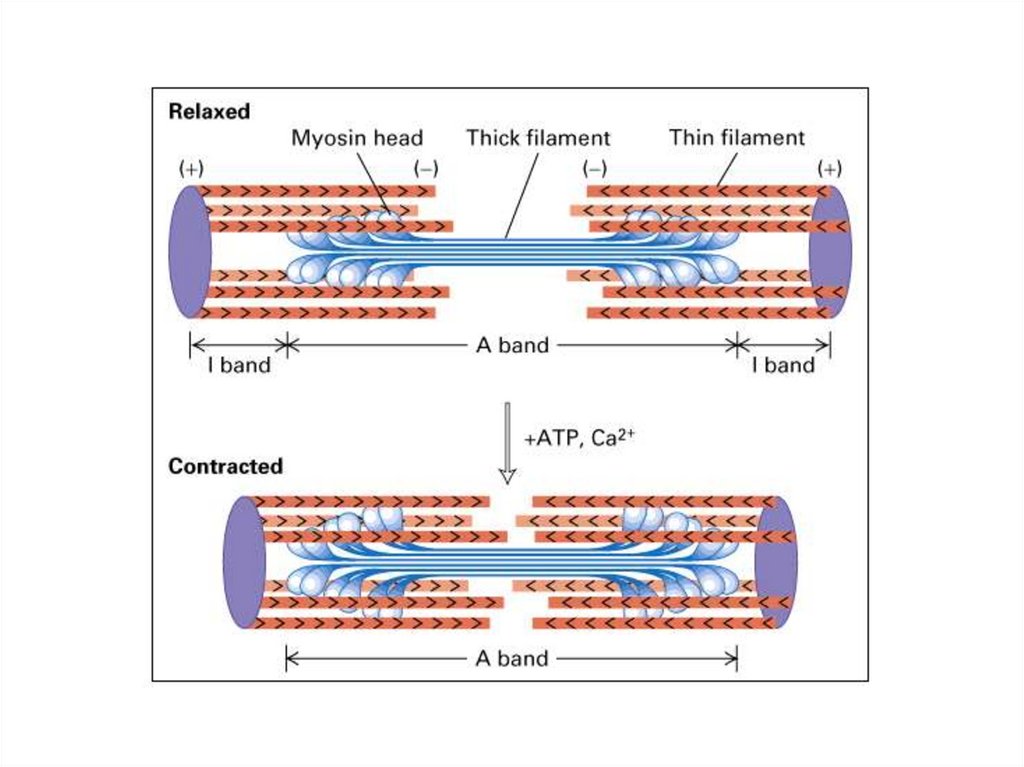
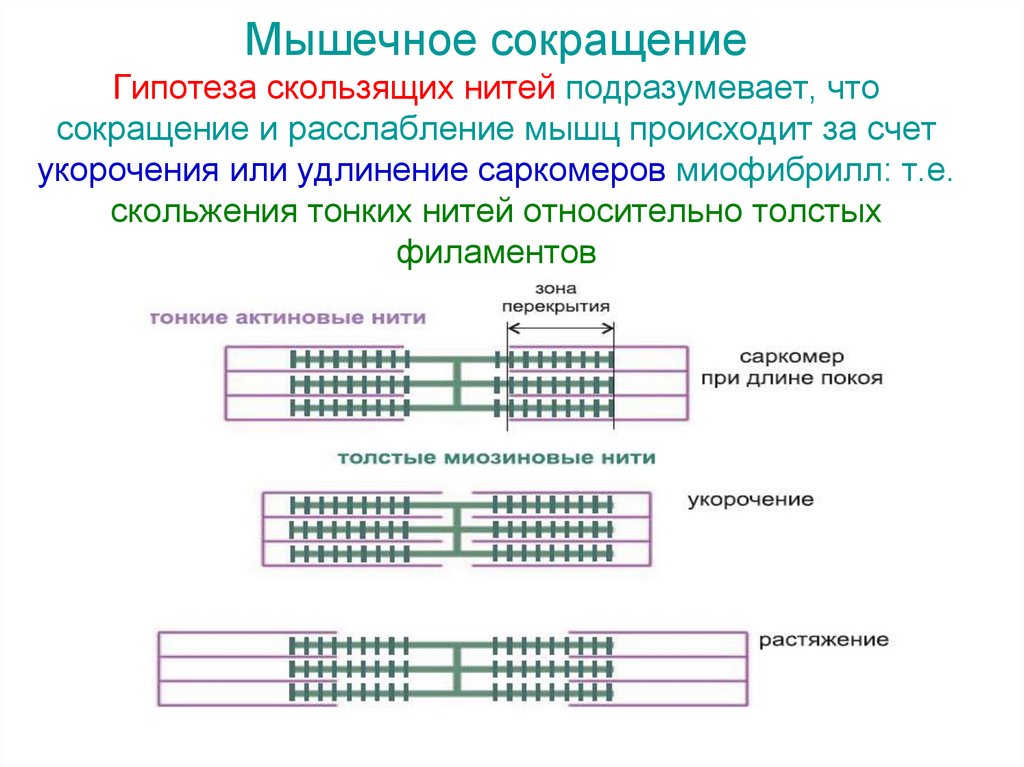
Мышечное сокращениеГипотеза скользящих нитей подразумевает, что
сокращение и расслабление мышц происходит за счет
укорочения или удлинение саркомеров миофибрилл: т.е.
скольжения тонких нитей относительно толстых
филаментов
36.
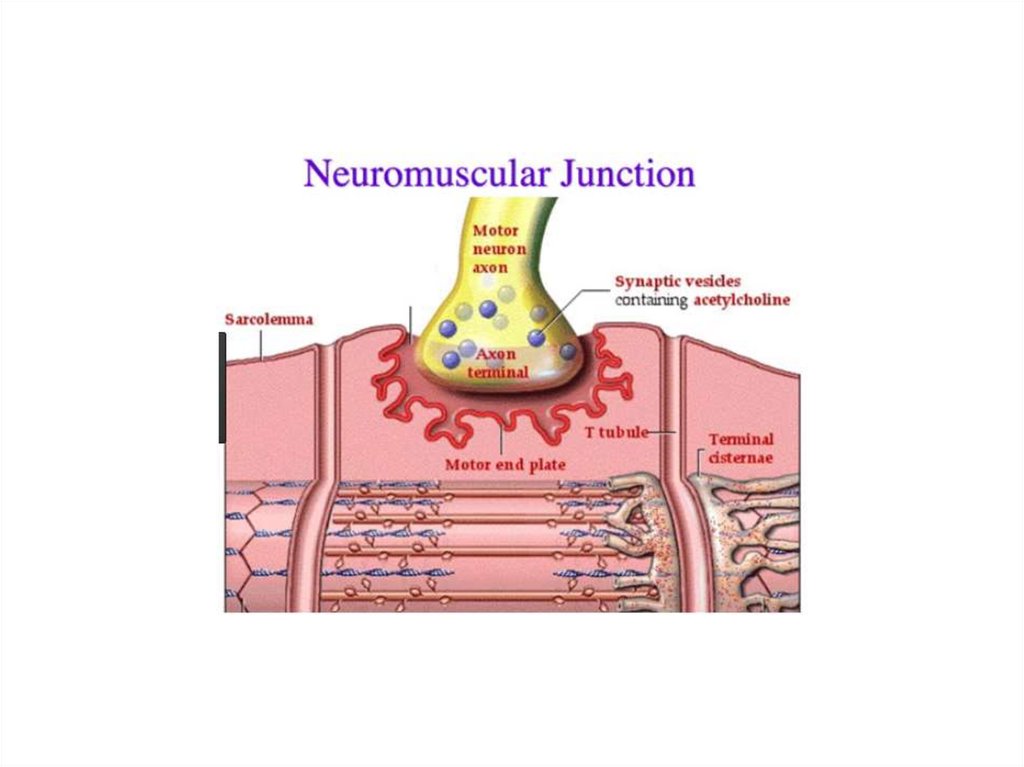
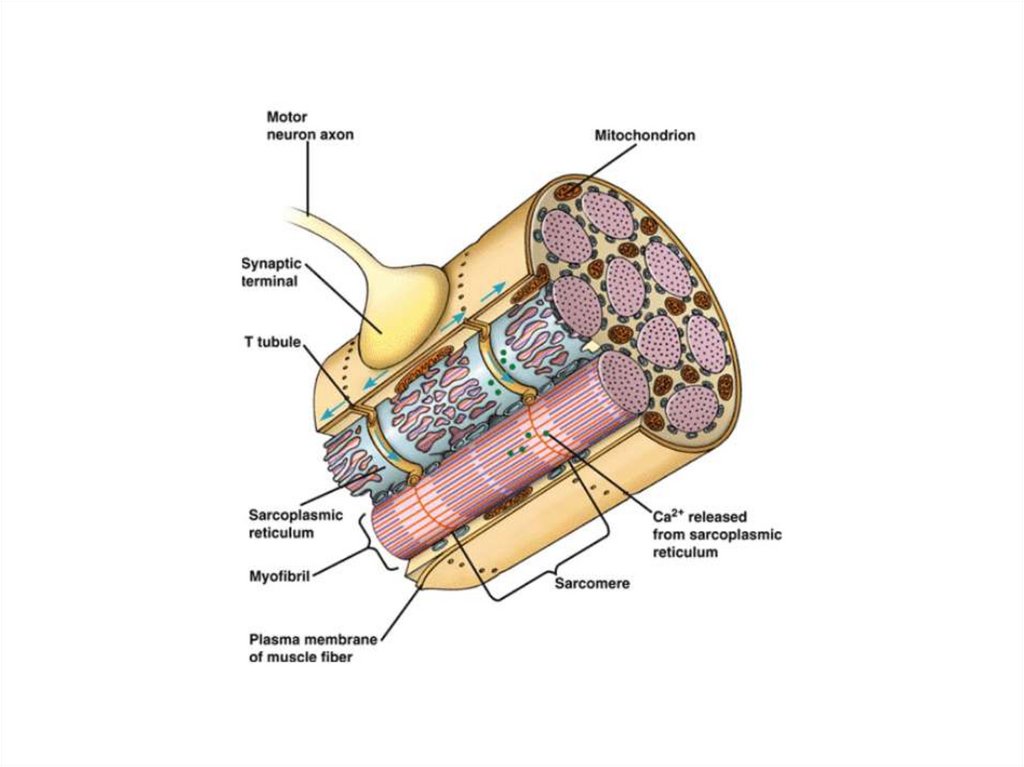
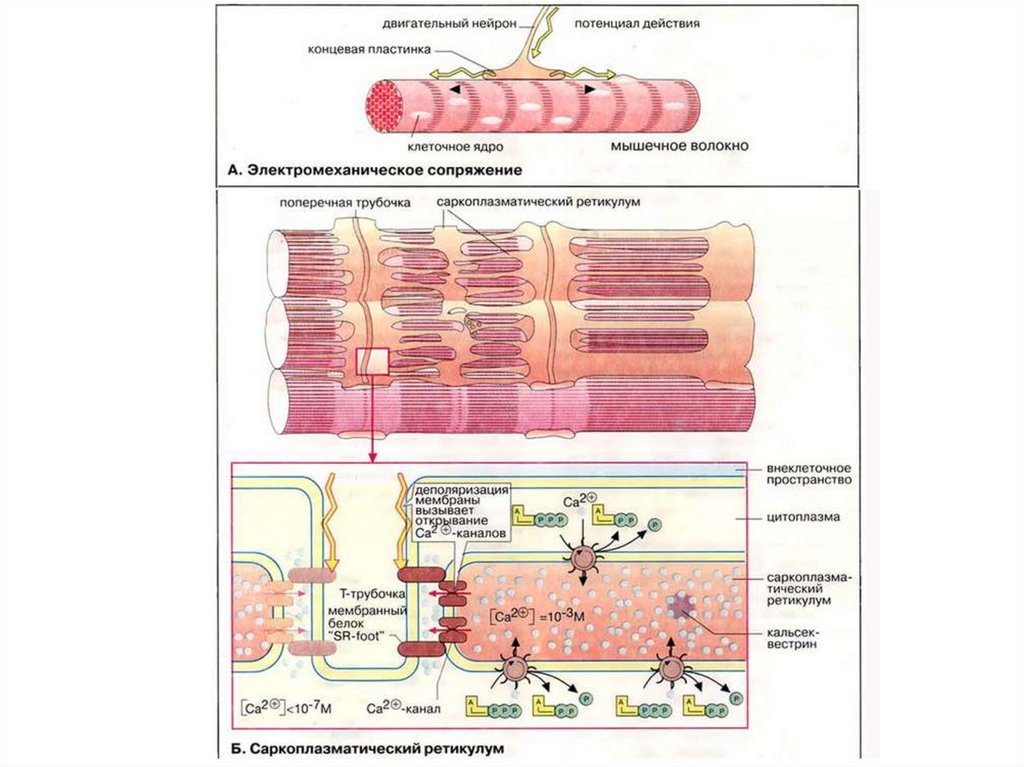
Механизм мышечного сокращенияСокращением мышечного волокна управляют
двигательные нейроны (мотонейроны).
Аксоны мотонейронов подведены к мышце
Мотонейроны выделяют в нервно-мышечные
синапсы нейромедиатор ацетилхолин.
Ацетилхолин диффундирует через
синаптическую щель и взаимодействует с
холинэргическими рецепторами
плазматической мембраны мышечных клеток.
37.
Открываются трансмембранные ионныеканалы, происходит деполяризация клеточной
мембраны.
Потенциал действия быстро распространяется
по всем направлениям, возбуждая все
мышечные клетки.
Цикл сокращения мышечного волокна
реализуется в течение нескольких
миллисекунд.
38.
39.
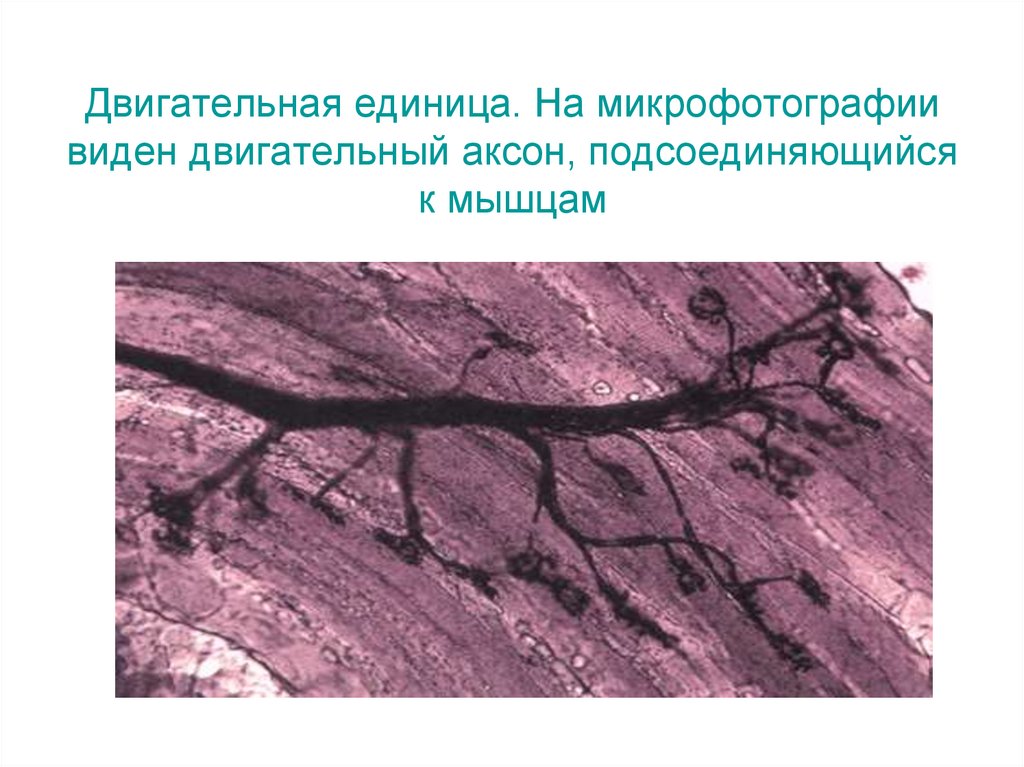
Двигательная единица. На микрофотографиивиден двигательный аксон, подсоединяющийся
к мышцам
40.
Механизм мышечного сокращениявключает следующие этапы:
А. Электрохимическое преобразование:
1. Генерация ПД (потенциала действия).
2. Распространение ПД по Т-системе.
3. Электрическая стимуляция зоны контакта Тсистемы и саркоплазматического ретикулума,
активация ферментов, образование
инозитолтрифосфата, повышение
внутриклеточной концентрации ионов Са2+.
41.
Б. Хемомеханическое преобразование:4. Взаимодействие ионов Са2+ с тропонином,
освобождение активных центров на
актиновых филаментах.
5. Взаимодействие миозиновой головки с
актином, вращение головки и развитие
эластической тяги.
6. Скольжение нитей актина и миозина
относительно друг друга, уменьшение
размера саркомера, развитие напряжения
или укорочение мышечного волокна.
42.
В цитозоле покоящихся клеток концентрацияСа2+ очень низка (менее 10-5 моль).
В саркоплазматическом ретикулуме (СПР) –
существенно выше (около 10~-3 моль).
Высокая концентрация Са2+ в CПP
поддерживается Са2+-АТФ-азами и
специальным белком кальсеквестрином,
который содержит много кислых аминокислот и
прочно связывает ионы Са2+.
Переносу потенциала действия на CПP
индивидуальной миофибриллы способствуют
поперечные трубочки Т-системы.
43.
Деполяризация плазматической мембраныпередается через Т-трубочки на потенциалуправляемый мембранный белок "SR-foot"
прилегающей мембраны CПP.
SR-foot открывает Са2+-каналы.
Ионы Са2+ выбрасываются из CПP в
пространство между филаментами актина и
миозина до уровня >10-5 моль.
Выброс Са2+ запускает механизм процесса
сокращения миофибрилл.
44.
45.
46.
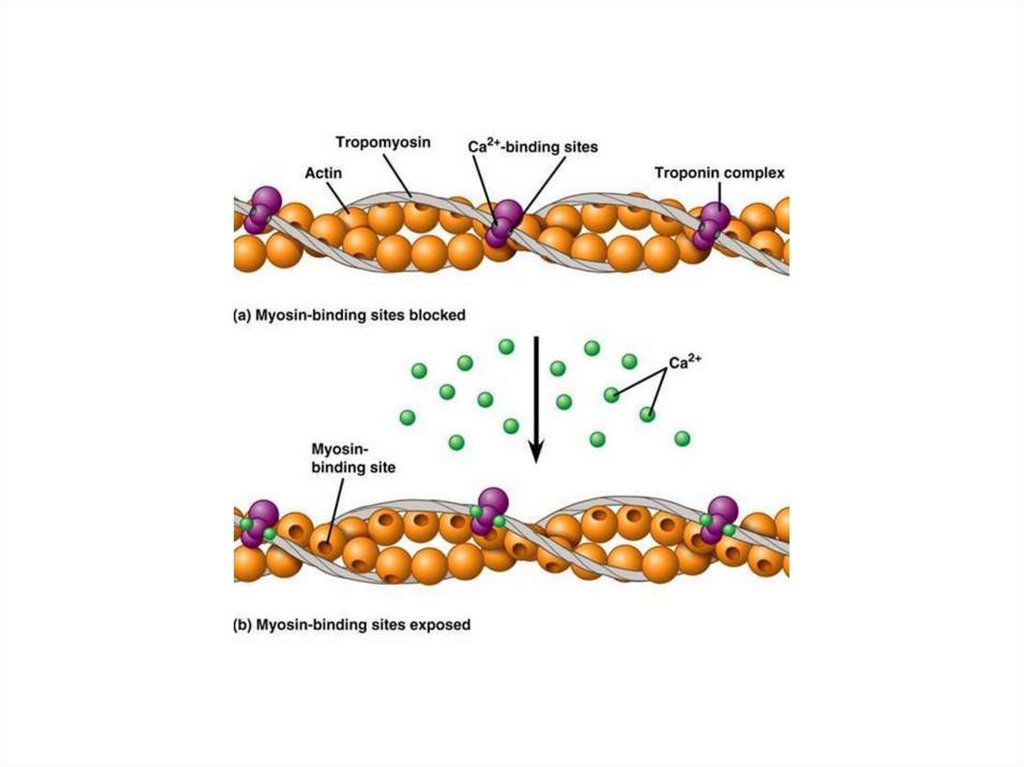
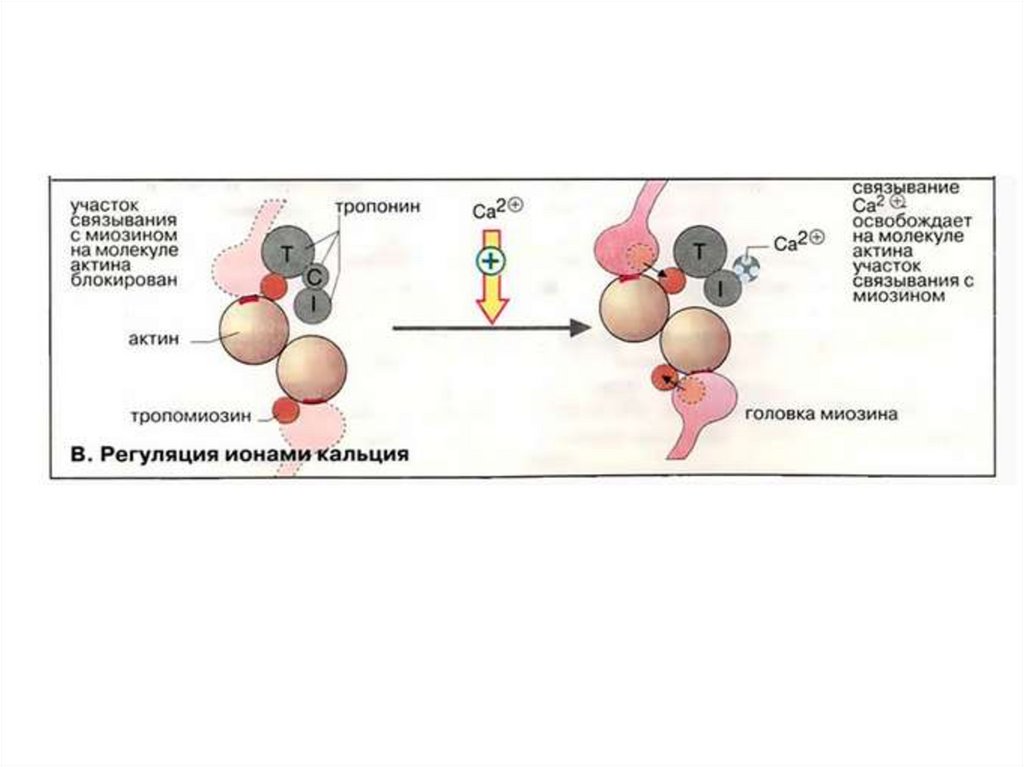
В расслабленной скелетной мышце комплекстропонина (субъединицы = Т, С, I) с
тропомиозином препятствует
взаимодействию миозиновых головок с
актином.
!Быстро поступивший в цитоплазму Са2+
связывается с С-субъединицей тропонина.
Это приводит к конформационной
перестройке в тропонине и тропонинтропомиозиновый комплекс разрушается.
На молекуле актина освобождается участок
связывания с миозином. Это инициирует цикл
мышечного сокращения.
47.
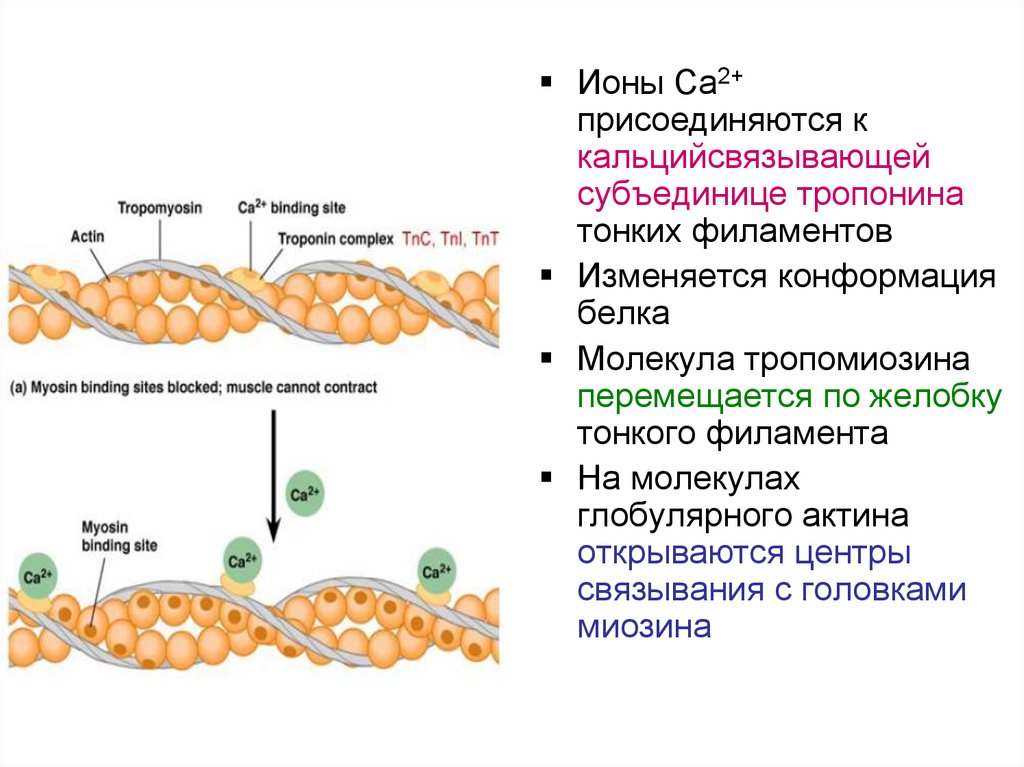
Ионы Са2+присоединяются к
кальцийсвязывающей
субъединице тропонина
тонких филаментов
Изменяется конформация
белка
Молекула тропомиозина
перемещается по желобку
тонкого филамента
На молекулах
глобулярного актина
открываются центры
связывания с головками
миозина
48.
49.
50.
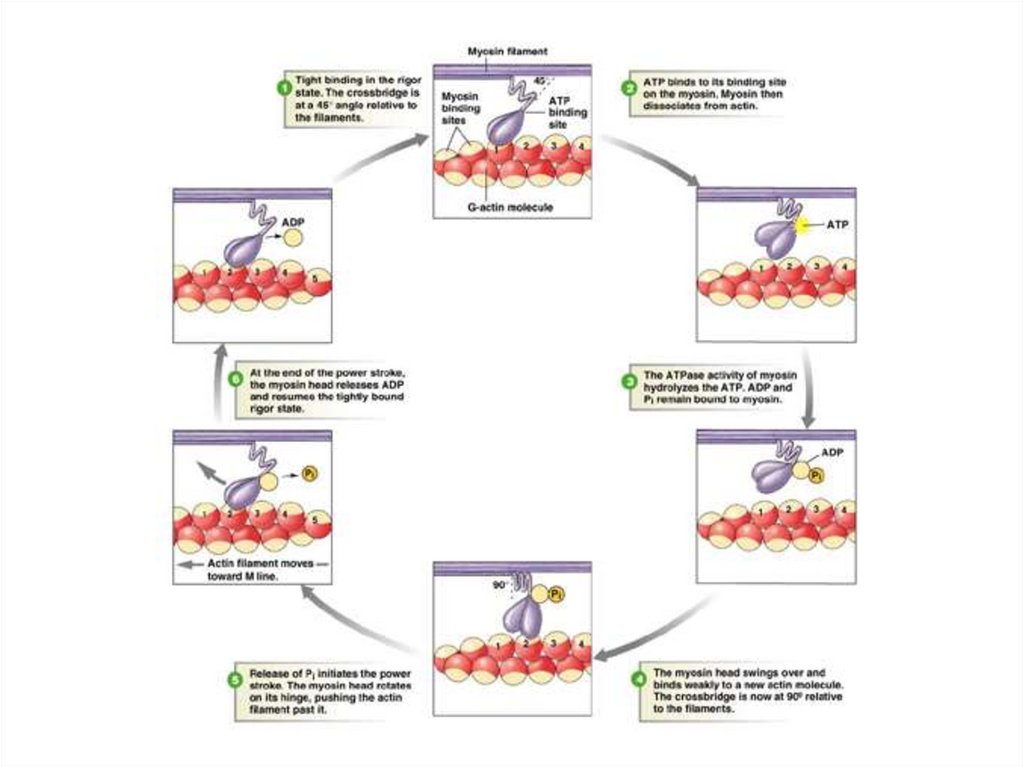
Сокращение мышечных волокон обусловленопродольным скольжением толстых миозиновых
и тонких актиновых филаментов относительно
друг друга
Осуществляется следующий цикл реакций:
1. Головка
молекулы
миозина
прочно
связывается с открытым участком актиновой
нити,
затем
Са2+
инициирует
взаимодействие головки с АТФ и головка
отделяется от актиновой нити (комплекс
миозин-АТФ обладает низким сродством к
актину
51.
2. Са2+-зависимая АТФ-аза головки миозинагидролизует АТФ, но оба продукта реакции
(АДФ и Рн) близко друг от друга.
3. Энергия, выделяющаяся при гидролизе
АТФ, вызывает аллостерические изменения
в миозиновой головке и головка образует
новый мостик с соседней молекулой актина.
4. Актин ускоряет выброс продуктов АТФ-азной
реакции из активного центра миозина. Это
приводит к изменению конформации головки
миозина, которая действует подобно «гребку
весла»
52.
5. Во время «гребка» миозиновые головкиотклоняются на определенный угол от оси и
перемещают миозиновый филамент вдоль
актинового филамента по направлению к Zдиску.
6. АДФ и Рн отсоединяются от миозина. Цикл
повторяется до тех пор, пока имеется АТФ.
7. В отсутствии последующего стимулирования
АТФ-зависимые кальциевые насосы
мембраны СПР быстро снижают
концентрацию ионов Са2+ до исходного
уровня.
53.
54.
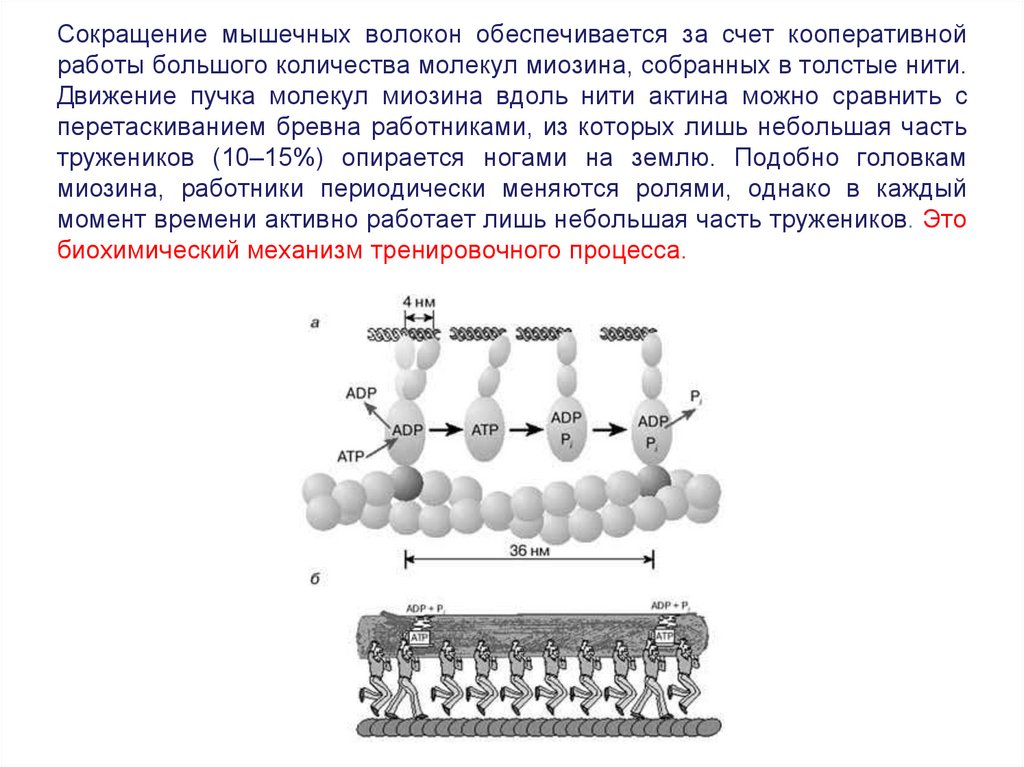
Сокращение мышечных волокон обеспечивается за счет кооперативнойработы большого количества молекул миозина, собранных в толстые нити.
Движение пучка молекул миозина вдоль нити актина можно сравнить с
перетаскиванием бревна работниками, из которых лишь небольшая часть
тружеников (10–15%) опирается ногами на землю. Подобно головкам
миозина, работники периодически меняются ролями, однако в каждый
момент времени активно работает лишь небольшая часть тружеников. Это
биохимический механизм тренировочного процесса.
55.
Модель акто-миозинового комплекса:весла как головки миозина обеспечивают перемещение
лодки




























 Биология
Биология








