Похожие презентации:
Окислительно- восстановительные реакции
1.
Окислительно – восстановительныереакции
2.
Окислительно-восстановительные реакции (ОВР) — этохимические реакции, сопровождающиеся изменением степени
окисления у атомов реагирующих веществ.
При этом происходит передача электронов от восстановителя к
окислителю.
Реакции ОВР лежат в основе электрохимических процессов –
электролиза, гальванических элементов, коррозии
3.
Определение степеней окисления элементовДля правильного составления реакций ОВР основным моментом
является определение степеней окисления элементов и нахождения
тех, которые изменили степень окисления.
Степень окисления – это условная величина, взятая из
предположения, что атом может отдавать или принимать
определенное число электронов.
Электрон – частица имеющая отрицательный заряд. Т.е. если
атом отдает электроны, то он приобретает положительный заряд
(положительная степень окисления), если принимает, то
приобретает отрицательный заряд (отрицательная степень
окисления)
4.
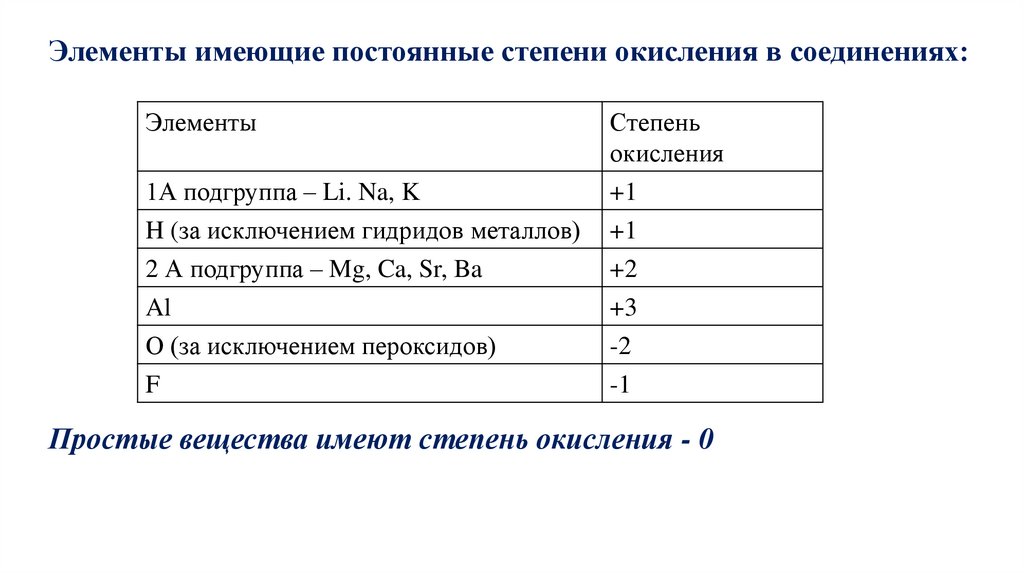
Элементы имеющие постоянные степени окисления в соединениях:Элементы
1А подгруппа – Li. Na, K
Степень
окисления
+1
H (за исключением гидридов металлов)
2 А подгруппа – Mg, Ca, Sr, Ba
Al
+1
+2
+3
О (за исключением пероксидов)
F
-2
-1
Простые вещества имеют степень окисления - 0
5.
Определение степеней окисления элементовВ соединении сумма положительного и отрицательного зарялов с
учетом индекса должна быть равна 0.
Примеры:
Определить степень окисления /марганца в соединении KMnO4
Степень окисления калия и кислорода постоянны (слайд 4),
умножаем степень окисления кислорода -2, на индекс при
кислороде, степень окисления калия +1, значит марганец имеет
такую степень окисления, чтобы сумма была равна 0.
7 2
+1 +Х-8=0 → Х=7
K Mn O 4
Для определения степени окисления можно использовать степень
окисления кислотных остатков из таблицы растворимости
6.
Восстановитель – это элемент, который отдает электроны. К типичным восстановителям относятся:1) простые вещества, атомы которых обладают малой электроотрицательностью (металлы);
2) анионы, в которых элемент имеет максимальную отрицательную степень окисления – Cl¯, S2─ (HCl,
H2S и т.д.);
3) анионы, в которых электроположительный элемент не имеет предельной положительной степени
окисления – SO32─, NO2¯ (Na2SO3, NaNO2 и т.д.);
4) катионы, у которых степень окисления может возрасти – Ge2+, Sn2+, Fe2+;
5) некоторые вещества при высоких температурах – С, CO, H2 .
Окислитель – это элемент, который принимает электроны. К типичным окислителям относятся:
1) простые вещества, атомы которых обладают большой электроотрицательностью (элементы VI и VII
групп);
2) анионы, в которых электроположительный элемент имеет наибольшую степень окисления – CrO42─,
Cr2O72─, NO3¯, MnO4¯, SO42─, ClO3¯, ClO4¯ (K2CrO4, K2Cr2O7, HNO3, KMnO4, KClO3 и т.д.)
! Растворы кислот более сильные окислители, чем растворы их солей (так, например, KNO3 почти не
проявляет окислительных свойств, в то время как азотная кислота сильный окислитель).
3) катионы в высшей степени окисления – Pb4+, Fe3+, Tl3+.
Вещества, содержащие элементы в промежуточных степенях окисления, могут быть как окислителями,
так и восстановителями.
7.
I. Метод электронного баланса.При составлении уравнений определяют:
1. Степени окисления всех элементов.
2. Определяют элементы, меняющие степени окисления.
3. Составляют уравнения электронного баланса.
4. Вводят дополнительные множители, так как число отданных и принятых
электронов должно быть одинаково.
5. Основываясь на них, подбирают стехиометрические коэффициенты
окислителя и восстановителя.
6. Уравнивают атомы металлов, не изменивших степени окисления.
7. Уравнивают ионы кислотных остатков, не изменивших степени окисления.
8. Проверка правильности расстановки коэффициентов осуществляется
подсчетом общего числа атомов кислорода слева и справа.
Пример 1:
0
+ 7+ 2+ 2+ + + 2K Mn O 4 + H Cl Cl 2 + Mn Cl 2 + K Cl + H 2 O
Mn 7 + +5ē Mn 2 +
2 окислитель, реакция восстановления
2Cl¯ 2ē Cl20
5 восстановитель, реакция окисления
2KMnO4 + 16HCl = 5Cl2 + 2KCl + 2MnCl2 + 8H2O
8.
Типы реакций ОВР1.
Реакции
диспропорционирования
(самоокисления
самовосстановления), в них один и тот же элемент выступает в качестве
окислителя и восстановителя.
+ 7+ 22+ t
K C lO3
K ClO + K Cl
4
+ 5+ 2-
2
1 окислитель
Cl5+ + 6ē Cl¯
6
3 восстановитель
Cl5+ 2ē Cl7+
4K Cl O 3 = 3 KCl O 4 + K Cl
2. Реакции контрдиспропорционирования, в которых один и тот же
элемент, в разных степенях окисления, окисляется и восстанавливается до
элемента в одной и той же степени окисления
+
2-
4+ 2-
0
H S + S O S+H O
2
2
2
1 окислитель
S4+ + 4ē S0
2 восстановитель
S2 2ē S0
9.
3. Реакции внутримолекулярного окисления и восстановления, реакциив которых окислитель и восстановитель входят в состав одного и того же
соединения.
2+ 5+ 22+ 2- 4+ 20
t
Pb(N O )2 PbO + N O 2 +O 2
3
4 окислитель
N5+ + 1ē N4+
1 восстановитель
2O2 4ē O2
2Pb(NO 3 ) 2 2PbO + 4NO 2 + O 2
10.
Возможностьсамопроизвольного
протекания
окислительновосстановительной реакции при стандартных условиях определяется по
стандартным окислительно-восстановительным потенциалам окислителя и
восстановителя (приложение 2). Данные значения потенциалов для
полуреакций приводятся в справочниках. Реакция считается возможной при
положительной разности потенциалов между окислителем и восстановителем:
Е0окислит. Е0восстан. > 0
При разности потенциалов больше 0,4 В реакция протекает практически
необратимо.
K + MnO 4 ¯ + Na+NO2¯ + H2+SO42─ Mn2+SO42─ + Na+NO3¯ + H2O
MnO 4 ¯+8H + +5ē Mn 2 + + 4H 2 O 2 окислитель Е 0 = +1,53 В
0
¯
¯
+
5
восстановитель
Е
=+ 0,84 В
NO 2 + H 2 O 2ē NO 3 + 2H
2KMnO 4 +5NaNO 2 +3H 2 SO 4 =2MnSO 4 +5NaNO 3 + K 2 SO 4 + 3H 2 O
Е0окислит. Е0восстан = 1,53 – 0,84 = 0,69 В
11.
Вопросы для самоконтроля. В каком из указанных веществ бром может быть только восстановителем:
1) Br2
2) KBrO
3) KBr
4) KBrO2 5) KBrO3
В каком из указанных веществ марганец может быть только окислителем:
1) Mn 2) MnO2 3) KMnO4 4)K2MnO4
5) MnCl2
2. Какая из указанных реакций относится к окислительно-восстановительной:
1) H2S + HNO3 → H2SO4 + NO + H2O
2) Na2CO3 + HCl → NaCl + H2O + CO2
3) SbCl3 + H2O → SbOHCl2 + HCl
4) Bi(OH)3 + HNO3 → Bi(NO3)3 + H2O
5) H2S + ZnCl2 → ZnS + HCl
3. Составьте уравнение окислительно-восстановительной реакции методом
электронного баланса:
1) K2S + KMnO4 + H2SO4 S + K2SO4 + MnSO4 + H2O
2) As + HNO3(конц) H3AsO4 + NO2 + H2O
3) KClO3 + MnO2 + KOH K2MnO4 + KCl + H2O
4) Sn + HNO3 (разб.) → Sn(NO3)2 + N2O + H2O
4. Расставьте коэффициенты в окислительно-восстановительной реакции
методом полуреакций, укажите окислитель и восстановитель, определите
направленность процесса
K2Cr2O7 + KCl + H2SO4 → Cl2 + Cr2(SO4)3 + K2SO4 + H2O










 Химия
Химия








