Похожие презентации:
Окислительно-восстановительные реакции. Классификация ОВР
1.
Окислительновосстановительные реакции.Классификация ОВР
2.
К концу XVIII в. широкое распространение в химииполучила кислородная теория окисления.
Окисление – это процесс соединения вещества с
кислородом, а восстановление – это процесс отнятия у него
кислорода.
Согласно теории в химических реакциях, протекающих с
изменением степеней окисления атомов, происходит
передача электронов от одних частиц к другим.
3.
4.
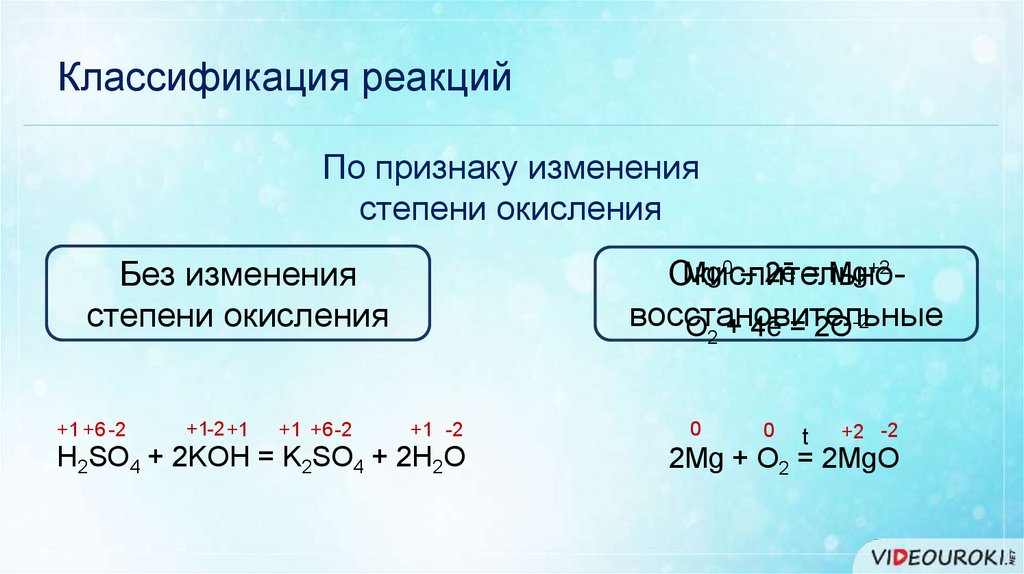
Классификация реакцийПо признаку изменения
степени окисления
Mg0 – 2ē = Mg+2
Окислительновосстановительные
O + 4ē = 2O-2
Без изменения
степени окисления
+1 +6 -2
+1-2 +1
+1 +6 -2
2
+1 -2
H2SO4 + 2KOH = K2SO4 + 2H2O
0
0
t
+2 -2
2Mg + O2 = 2MgO
5.
00
t
+3 -1
2Fe + 3Cl2 = 2FeCl3
6.
00
t
+3 -1
2Fe + 3Cl2 = 2FeCl3
0
0
+3-1
2Al + 3I2 = 2AlI3
7.
+7-1 t
+2
0
2KMnO4 + 16HCl = 2KCl + 2MnCl2 + 5Cl2 + 8H2O
2Cl-1 – 2ē = Cl20
Окисление, восстановитель
Mn+7 + 5ē = Mn+2 Восстановление, окислитель
Cl2
Хлор
0
0
t
+2 -2
2Mg + O2 = 2MgO
8.
ОкислительВосстановитель
Элемент с высшей степенью
окисления
Элемент с низшей степенью
окисления
-3
+7
KMnO4
+4
+4
Na2SO3
NH3
+6
Na2SO3 + KMnO4 + H2SO4 → Na2SO4 + MnSO4 + K2SO4 + H2O
В-ль
+4
0
Na2SO3 + H2S + HCl → S + NaCl + H2O
Ок-ль
9.
Важнейшие окислители и восстановителиВажнейшие
окислители
Вещества-неметаллы:
F2 , O2 .
Сложные вещества:
KMnO4, K2Cr2O7,
HNO3 и её соли, H2SO4 конц.,
PbO2, HСlO4 и её соли.
Важнейшие
восстановители
10.
Отбеливание тканей, бумаги11.
PbS + 4H2O2 = PbSO4 + 4H2O12.
Важнейшие окислители и восстановителиВажнейшие
окислители
Важнейшие
восстановители
Вещества-неметаллы:
Вещества-металлы:
F2 , O2 .
щелочные и
щелочноземельные металлы,
Mg, Al, Zn.
Сложные вещества:
KMnO4, K2Cr2O7,
HNO3 и её соли, H2SO4 конц.,
PbO2, HСlO4 и её соли.
Сложные вещества:
CH4, SiH4, NH3, PH3, Na3N,
Ca3P2, H2S, сульфиды металлов,
HBr, HCl, HI, NaH, CaH2.
13.
Окислители и восстановителиОкислители
Восстановители
Cl2, Br2, HСlO и её соли,
H2, C, CO,
KСlO3, MnO2, FeCl3.
Na2SO3, FeSO4.
-4, -3, -2, -1, 0, +1, +2, +3, +4, +5, +6, +7, +8
Окисление
Восстановление
14.
Классификация ОВРМежмолекулярные окислительно-восстановительные реакции – реакции, в
которых окислитель и восстановитель входят в состав различных веществ.
+3
-1
+2
0
FeCl3 + KI → FeCl2 + I2 + KCl
Fe – окислитель
I – восстановитель
15.
Классификация ОВРВнутримолекулярные окислительно-восстановительные реакции – это
реакции, в которых окислитель и восстановитель входят в состав одного
вещества.
+6
0
-3
+3
(NH4)2Cr2O7 → N2 + Cr2O3 + H2O
N – восстановитель
Cr – окислитель
16.
Классификация ОВРРеакции самоокисления-самовосстановления, или
диспропорционирования, – это реакции, в которых один и тот же элемент и
окисляется, и восстанавливается.
+4
+5
+3
NO2 + H2O → HNO3 + HNO2
N – восстановитель
N – окислитель
17.
Составление ОВР:1) записать схему химической реакции;
2) расставить степени окисления атомов элементов, выделить
элементы, которые изменили свои степени окисления, определить
окислитель и восстановитель;
3) определить число отданных и принятых
электронов, составить электронный баланс;
4) подобрать коэффициенты в уравнении
реакции.
18.
Составление ОВР-2
0
+4
-2
2 H2S + 3 O2 → 2 SO2 + 2 H2O
S-2 – 6ē = S+4
6
2
восстановитель
3
окислитель
12
O20 + 2 ∙ 2ē = 2O-2 4
2H2S + 3O2 = 2SO2 + 2H2O
19.
Составление ОВР+5
0
+2
0
12HNO3 + 5 Mg = 5 Mg(NO3)2 + N2 + 6 H2O
N+5 + 5ē = N0
5
2
окислитель
5
восстановитель
10
Mg0 – 2ē = Mg+2
2
20.
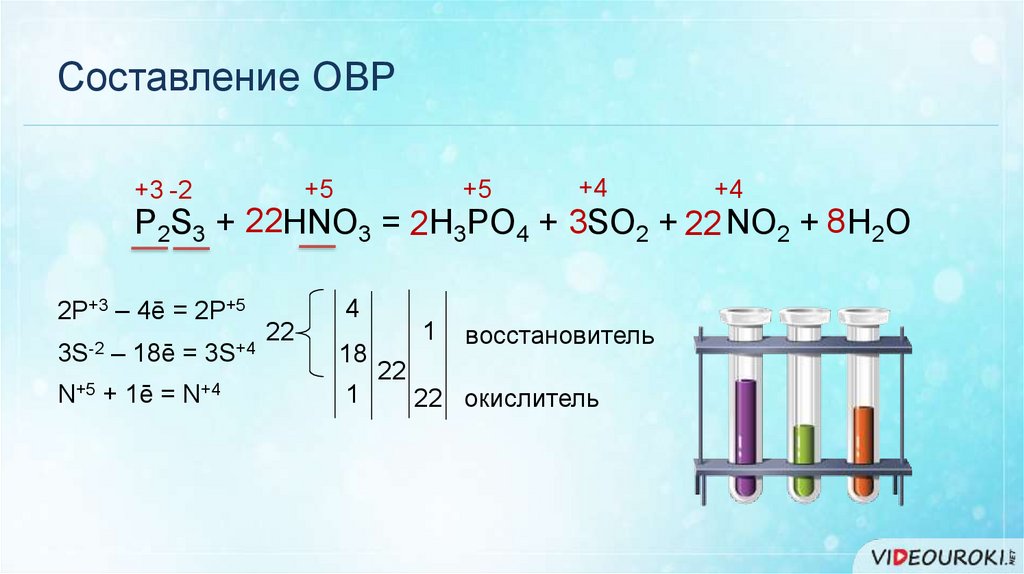
Составление ОВР+5
+3 -2
+5
+4
+4
P2S3 + 22HNO3 = 2H3PO4 + 3SO2 + 22 NO2 + 8 H2O
2P+3 – 4ē = 2P+5
3S-2
N+5
– 18ē =
+ 1ē =
3S+4
N+4
22
4
18
1
1
22
восстановитель
22 окислитель
21.
Составление ОВР+7
+2
2KMnO4 + 5Na2SO3 + 3H2SO4 = 2MnSO4 + 5Na2SO4 + K2SO4 + 3H2O
+7
+4
2KMnO4 + 3Na2SO3 + H2O = 2MnO2 + 3Na2SO4 + 2KOH
+7
+6
2KMnO4 + Na2SO3 + 2KOH = 2K2MnSO4 + Na2SO4 + H2O
22.
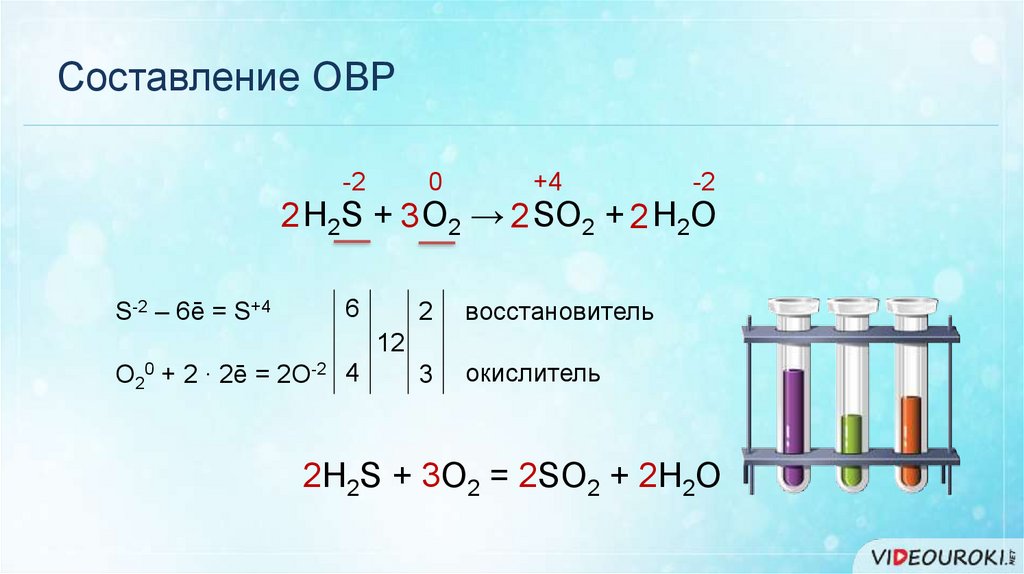
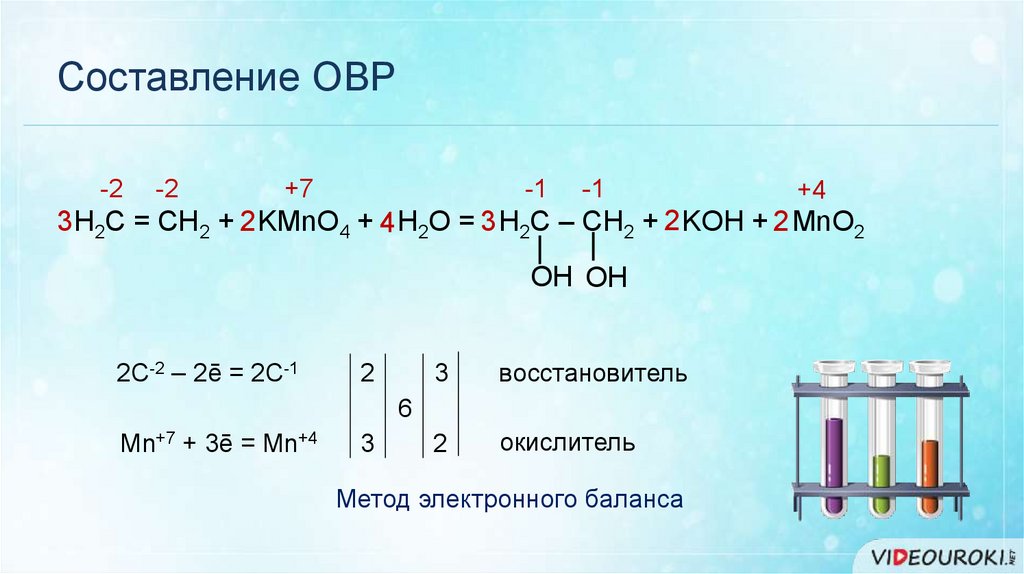
Составление ОВР-2
-2
+7
-1
-1
+4
3 H2C = CH2 + 2 KMnO4 + 4 H2O = 3 H2C – CH2 + 2 KOH + 2 MnO2
|
|
OH OH
2C-2 – 2ē = 2C-1
2
3
восстановитель
2
окислитель
6
Mn+7 + 3ē = Mn+4
3
Метод электронного баланса
23.
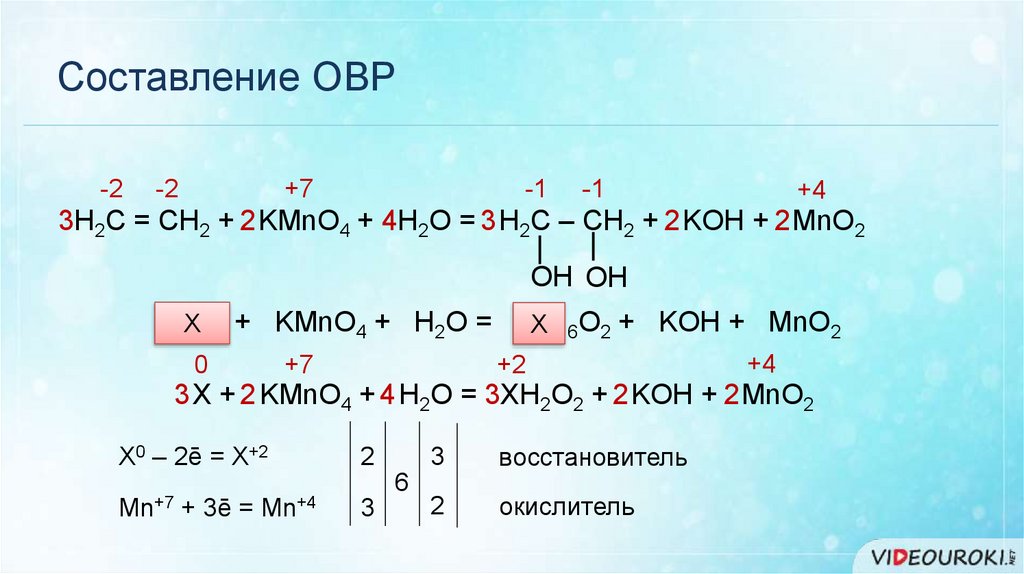
Составление ОВР-2
-2
+7
-1
-1
+4
3H2C = CH2 + 2 KMnO4 + 4H2O = 3 H2C – CH2 + 2 KOH + 2 MnO2
|
|
OH OH
СХ
2H4 + KMnO4 + H2O = CХ
2H6O2 + KOH + MnO2
0
+7
+2
+4
3 X + 2 KMnO4 + 4 H2O = 3XH2O2 + 2 KOH + 2 MnO2
Х0 – 2ē = Х+2
Mn+7
+ 3ē =
2
3
восстановитель
2
окислитель
6
Mn+4
3
24.
Обмен веществДыхание
Фотосинтез
25.
ГниениеБрожение
26.
Получение аммиакаПолучение металлов
Получение кислот
27.
Получениефотографий
28.
Горение природногогаза
Ржавление железа
Потемнение серебра
29.
Окислительно-восстановительныереакции.
Важнейшие окислители и
восстановители.
Метод электронного баланса при
расстановке коэффициентов в
уравнениях химических реакций.
Роль окислительновосстановительных процессов в
природе и на производстве.
























 Химия
Химия








