Похожие презентации:
Черный ящик. Карбоновые кислоты. Общие свойства карбоновых кислот
1. Черный ящик
ЧЕРНЫЙ ЯЩИКВ черном ящике находится удивительное, но хорошо вам
знакомое вещество. Название этого вещества древними
греками отождествлялось с самим представлением о кислом.
Нам оно хорошо известно в жидком агрегатном состоянии, но
при охлаждении ниже 17 0С превращается в бесцветные
кристаллы, похожие на лед.
Ответ: уксусная кислота
2. Черный ящик
ЧЕРНЫЙ ЯЩИКВ черном ящике находится вещество,
которым богаты плоды цитрусовых.
В мякоти апельсина его около 2%, в
лимоне – 6% из которых и было
впервые выделено в 1784 г. К. Шееле.
Ответ: лимонная кислота
3. Черный ящик
ЧЕРНЫЙ ЯЩИКВпервые
эта кислота была получена алхимиком
Агриколой, который наблюдал при прокаливании в
янтаре похожие на соль белый налет этого вещества,
в настоящее время используется в медицине.
Ответ: янтарная кислота – НООС-СН2-СН2-СООН.
Янтарная кислота - настоящий подарок для нас. Это
естественное вещество, которое присутствует в
организме, вырабатывается им. При приёме внутрь не
вызывает привыкания и не вызывает особых побочных
эффектов, укрепляет иммунитет, усиливает клеточное
дыхание, способствует усвоению кислорода клетками.
4. Черный ящик
ЧЕРНЫЙ ЯЩИКМедицинское антисептическое средство.
Сок вызывает гибель стафилококков,
Ответственных за воспалительные процессы.
Благодаря своим свойствам используется
как пищевая добавка
Ответ: бензойная кислота
5. Карбоновые кислоты. Общие свойства карбоновых кислот.
КАРБОНОВЫЕ КИСЛОТЫ. ОБЩИЕСВОЙСТВА КАРБОНОВЫХ КИСЛОТ.
Ум заключается не только в знаниях,
но и в умении применять знания в деле…
Аристотель.
Методическая разработка урока
Раздаточный материал для учащихся
6. Задание Рассмотрите формулы кислот:
ЗАДАНИЕРАССМОТРИТЕ ФОРМУЛЫ КИСЛОТ:
CH3COOH
НООС-СН2-СН2-СООН
H2C = CH - COOH
COOH
7.
Все карбоновые кислоты имеют функциональнуюгруппу.
Что называется карбоновыми
кислотами?
8. Общая формула одноосновных кислот предельного ряда
ОБЩАЯ ФОРМУЛА ОДНООСНОВНЫХ КИСЛОТПРЕДЕЛЬНОГО РЯДА
СnH2n+1COOН
где n может быть равно нулю.
9. Классификация карбоновых кислот
КЛАССИФИКАЦИЯ КАРБОНОВЫХ КИСЛОТВ зависимости от числа
карбоксильных групп:
● одноосновные
● двухосновные
● многоосновные
10.
2) В зависимости отприроды радикала
● предельные – пропионовая
● непредельные – акриловая
● ароматические – бензойная
11.
Карбоновые кислоты в природе12. Номенклатура карбоновых кислот
НОМЕНКЛАТУРА КАРБОНОВЫХ КИСЛОТ13. Зависимость физических свойств карбоновых кислот от строения молекулы:
Низшие карбоновые кислоты – жидкости; высшие – твердые веществаЧем больше относительная молекулярная масса кислоты, тем меньше ее
запах.
С увеличением относительной молекулярной массы кислоты
растворимость уменьшается
Чем больше относительная масса кислоты, тем выше температура
кипения
14.
предельные одноосновные карбоновые кислоты,Как происходит перераспределение электронной
плотности в карбоксильной группе?
В чем заключается взаимное влияние атомов в
молекулах карбоновых кислот?
Как это будет отражаться на химических свойствах
карбоновых кислот?
15.
Химические свойства карбоновых кислот.Группа 1. Исследование химических свойств уксусной
кислоты общих со свойствами минеральных кислот.
(Взаимодействие с металлами и действие на
индикатор).
Лабораторная работа.
Свойства уксусной кислоты в сравнении со свойствами
соляной кислоты.
Помните о правилах безопасности
При работе с неорганическими и органическими веществами
№
опыта
Уксусная
кислота
1
2
Соляная
кислота
3
4
действие
наблюдение
Взаимодействие
уксусной кислоты
лакмусом
с
Взаимодействие
уксусной кислоты
цинком
с
Взаимодействие
соляной кислоты
лакмусом
с
Взаимодействие
соляной кислоты
цинком
с
уравнение реакции
16.
Уксуснаякислота
Соляная
кислота
№
опыта
действие
наблюдение
уравнение реакции
1
Взаимодействие
уксусной кислоты с
порошком
оксида
магния
СH3COOH+MgО →
2
Взаимодействие
уксусной кислоты с
лакмусом и раствором
гидроксида натрия
СH3COOH+NaОН →
3
Взаимодействие соляной
кислоты с порошком
оксида магния
HCl+MgО →
4
Взаимодействие соляной
кислоты с лакмусом и
раствором гидроксида
натрия
HCl+NaОН →
17.
Химические свойства карбоновых кислот.Группа 1. Исследование химических свойств уксусной кислоты
общих со свойствами минеральных кислот. (Взаимодействие с
металлами и действие на индикатор).
Лабораторная работа.
Свойства уксусной кислоты в сравнении со свойствами
соляной кислоты.
Проверьте правильность заполнения таблицы
Уксусная
кислота
Соляная
кислота
№
опыта
действие
наблюдение
1
Взаимодействие уксусной
кислоты с лакмусом
Лакмус окрасился
красный цвет
2
Взаимодействие уксусной
кислоты с цинком
Выделение газа
3
Взаимодействие соляной
кислоты с лакмусом
Лакмус окрасился
красный цвет
4
Взаимодействие соляной
кислоты с цинком
Выделение газа
уравнение реакции
в
2СH3COOH+Zn=
Zn (CH3COО)2+H2
2Н+ + Zn = Zn 2+ + Н2
в
2HCl+Zn=ZnCl2+H2
2Н+ + Zn = Zn2+ + Н2
18.
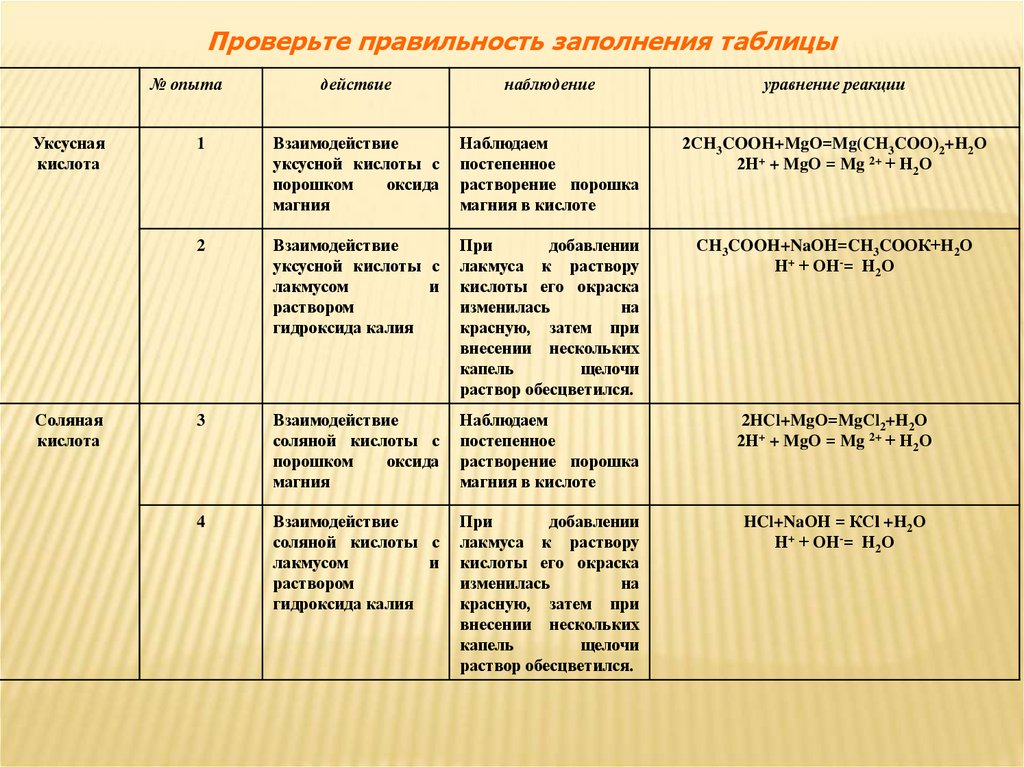
Проверьте правильность заполнения таблицы№ опыта
Уксусная
кислота
Соляная
кислота
действие
наблюдение
уравнение реакции
1
Взаимодействие
уксусной кислоты с
порошком
оксида
магния
Наблюдаем
постепенное
растворение порошка
магния в кислоте
2СH3COOH+MgО=Mg(CH3COО)2+H2О
2Н+ + MgО = Mg 2+ + Н2О
2
Взаимодействие
уксусной кислоты с
лакмусом
и
раствором
гидроксида калия
При
добавлении
лакмуса к раствору
кислоты его окраска
изменилась
на
красную, затем при
внесении нескольких
капель
щелочи
раствор обесцветился.
СH3COOH+NaОН=CH3COОК+H2О
Н+ + ОН-= Н2О
3
Взаимодействие
соляной кислоты с
порошком
оксида
магния
Наблюдаем
постепенное
растворение порошка
магния в кислоте
2HCl+MgО=MgСl2+H2О
2Н+ + MgО = Mg 2+ + Н2О
4
Взаимодействие
соляной кислоты с
лакмусом
и
раствором
гидроксида калия
При
добавлении
лакмуса к раствору
кислоты его окраска
изменилась
на
красную, затем при
внесении нескольких
капель
щелочи
раствор обесцветился.
HCl+NaОН = КCl +H2О
Н+ + ОН-= Н2О
19. Тест «пятерочка»
ТЕСТ «ПЯТЕРОЧКА»а
1
2
3
4
5
б
в
г
д
20. Тест «пятерочка»
ТЕСТ «ПЯТЕРОЧКА»а
1
2
3
4
5
б
в
г
д
21. Какой информацией я владею после урока по данной теме:
КАКОЙ ИНФОРМАЦИЕЙ Я ВЛАДЕЮ ПОСЛЕУРОКА ПО ДАННОЙ ТЕМЕ:
Знаю состав карбоновых кислот.
Знаю названия и классификацию
карбоновых кислот.
Могу(исходя из электронного
строения)объяснить силу кислоты
Могу описать физические свойства кислот
Могу сравнить органические и
минеральные кислоты по химическим
свойствам
22. Домашнее задание
ДОМАШНЕЕ ЗАДАНИЕ&30, до стр.192 .
Упр. 2,3 стр.194.






















 Химия
Химия








