Похожие презентации:
Введенhя в біохімію. Будова та властивості амінокислот
1.
ВВЕДЕНHЯ В БІОХІМІЮ.БУДОВА ТА ВЛАСТИВОСТІ
АМІНОКИСЛОТ
2.
Біохімія – це наука, яка вивчаєхімічний склад, структуру,
перетворення речовин та
енергії, що відбуваються у
живих клітинах (організмі).
3.
Задачі біохімії – 1) Досягти повногорозуміння на молекулярному рівні природи усіх
хімічних реакцій, які пов’язані з
життєдіяльністю клітин. Для вирішення цієї
задачі необхідно розробити методи одержання
різноманітних компонентів клітини, визначити
їх структуру, та з’ясувати їх функцію.
2) Розробити методи та засоби цілеспрямованого впливу на організми з метою поліпшення
стану здоров я людини, підвищення продуктивності тварин.
Об’єкти досліджень – усі живі істоти від мікроорганізмів
до людини.
Біохімія складається з 2х частин:
1) статична біохімія (це аналіз хімічного складу живих організмів);
2) динамічна біохімія (вивчає сукупність перетворення речовин і
енергії в організмі);
4.
Вміст у клітині хімічних сполук(у % на сиру масу)
ВОДА
75-85
БІЛКИ
10-20
ЛІПІДИ
1-5
ВУГЛЕВОДИ
0,2-2
НУКЛЕЇНОВІ КИСЛОТИ
1-2
НИЗЬКОМОЛЕКУЛЯРНІ ОРГАНІЧНІ СПОЛУКИ 0,1- 0,5
НЕОРГАНІЧНІ РЕЧОВИНИ (катіони Na+, K+, Ca2+, Mg2+,
Zn2+,Fe2+ та аніони PO32-,Cl-,SO42-, HCO3-)
1- 1,5
5.
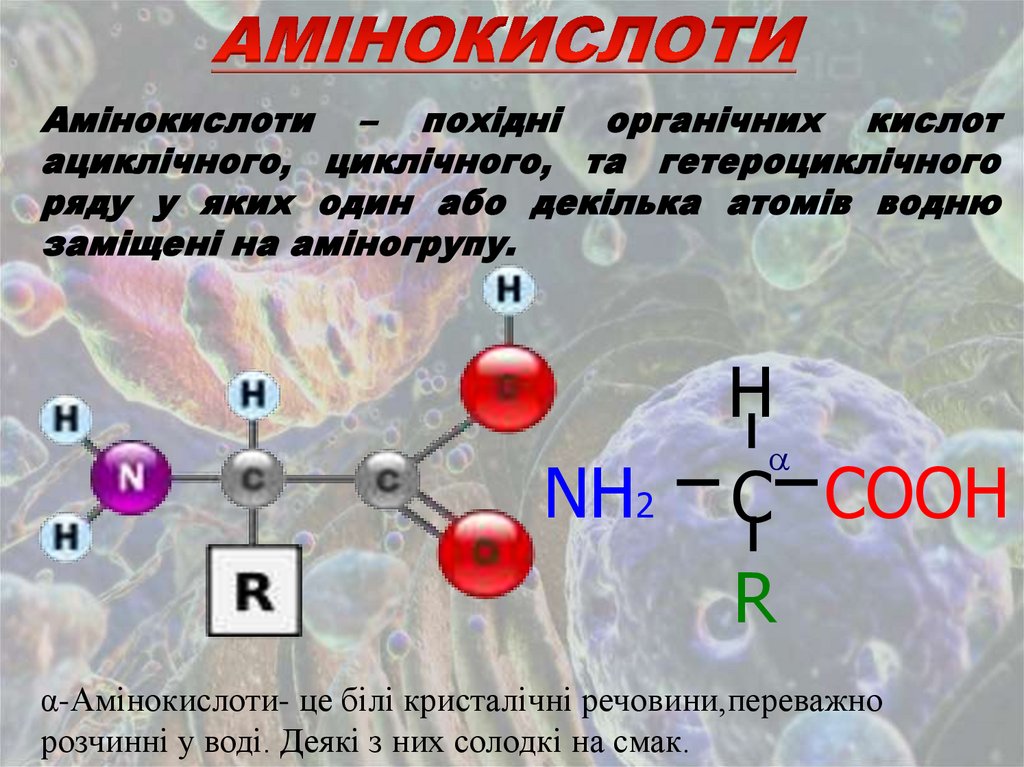
Амінокислоти – похідні органічних кислотациклічного, циклічного, та гетероциклічного
ряду у яких один або декілька атомів водню
заміщені на аміногрупу.
H
NH2
C COOН
R
α-Амінокислоти- це білі кристалічні речовини,переважно
розчинні у воді. Деякі з них солодкі на смак.
6.
Усі амінокислоти, що входять до складу білків, є αамінокислотами, оскільки їх аміногрупа перебуває у αположенні, тобто поряд з карбоксильною групою.Усі амінокислоти, за винятком гліцину, мають асиметричний
атом вуглецю (тобто атом вуглецю з чотирма різними
замісниками) і тому є оптично активними сполуками тобто
обертають площину поляризованого світла. Амінокислоти, що
містяться в білках, належать до L-ряду. L-конфігурація – це
коли аміногрупа розташована зліва, D-конфігурація –
аміногрупа розташована зправа.
Для розділення АК на оптичні антиподи користуються
мікробіологічними та ферментативними методами аналізу.
Синтетичні АК є рацематами, тобто сумішами D і L - форм.
Амінокислоти – амфотерні електроліти, оскільки аміногрупа
має основні властивості, а карбоксильна – кислотні. У водних
розчинах в інтервалі рН 4-9 амінокислоти існують переважно у
вигляді біполярних іонів, які називаються цвітер-іонами.
7.
H₂N─CH2─COOH ↔H₃N⁺─CH2─COO‾
(цвітер-іон - біполярний іон)
У водних розчинах амінокислоти виявляють властивості
амфотерних електролітів (амфолітів) :
H₃N⁺─CH─COO‾
+H⁺
H₃N⁺─CH─COOH
I
↔
І
R
R
H₃N⁺─CH─COO‾ +OH‾
H₂N─CH─COO‾
I
↔
I
+H₂O
R
R
В природі – 200 амінокислот; в організмі людини
– 80; але тільки 20 амінокислот кодуються
геномом, входять до складу білків і називаються
протеїногенними або природними.
До 1935 р. стала відома будова всіх АК, які
входять до складу білків.
8.
Назва протеїногенної амінокислотиФормула
тривіальна
за IUPAC
H2N–CH2–COOH
Гліцин або
глікокол(Gly)
Аміноетанова
CH3–CH(NH2)–COOH
Аланін (Ala)
2-Амінопропанова
(CH3)2CH–CH(NH2)–COOH
Валін*(Val)
2-Аміно-3-метилбутанова
(CH3)2CH–CH2–CH(NH2)– COOH
Лейцин*(Leu)
2-Аміно-4-метилпентанова
CH3–CH2–CH(CH3)–CH(NH2)–
COOH
Ізолейцин*
(Ileu)
2-Аміно-3-метилпентанова
C6H5–CH2–CH(NH2)–COOH
Фенілаланін*
(Phe)
2-Аміно-3-фенілпропанова
n–HO–C6H4–CH2–CH(NH2)–COOH
Тирозин*(Tyr)
2-Аміно-3-(4гідроксифеніл)-пропанова
9.
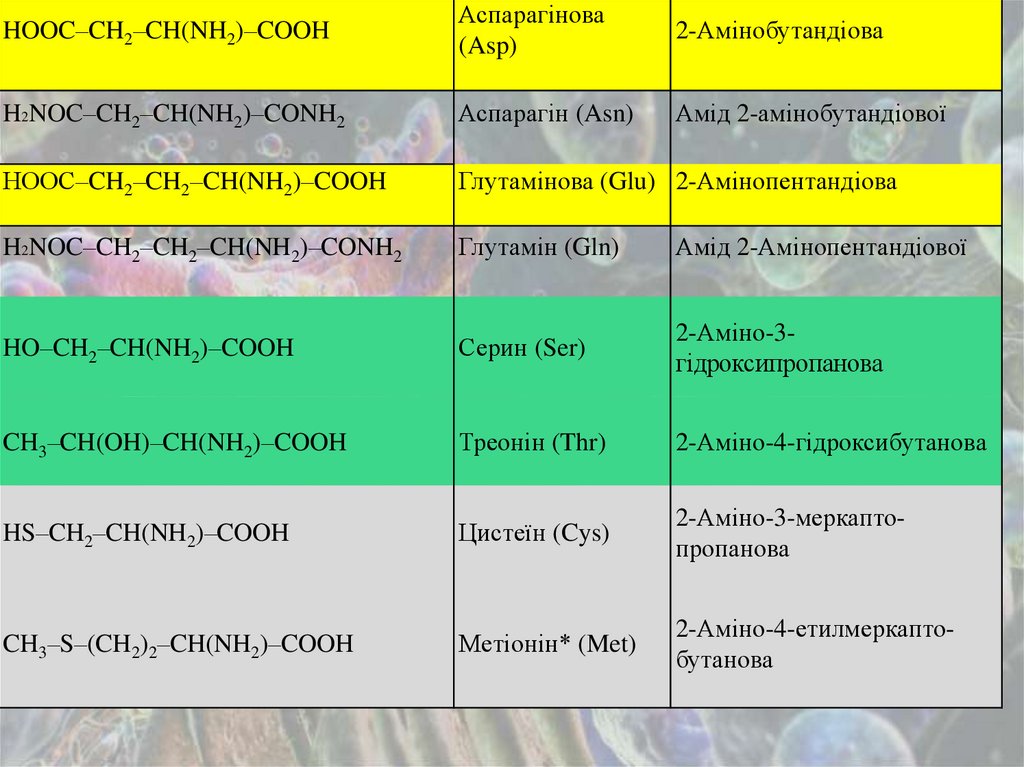
HOOC–CH2–CH(NH2)–COOHАспарагінова
(Asp)
2-Амінобутандіова
H2NOC–CH2–CH(NH2)–CONH2
Аспарагін (Asn)
Амід 2-амінобутандіової
НOOC–CH2–CH2–CH(NH2)–COOH
Глутамінова (Glu) 2-Амінопентандіова
H2NOC–CH2–CH2–CH(NH2)–CONH2
Глутамін (Gln)
Амід 2-Амінопентандіової
HO–CH2–CH(NH2)–COOH
Серин (Ser)
2-Аміно-3гідроксипропанова
CH3–CH(OH)–CH(NH2)–COOH
Треонін (Thr)
2-Аміно-4-гідроксибутанова
HS–CH2–CH(NH2)–COOH
Цистеїн (Cys)
2-Аміно-3-меркаптопропанова
CH3–S–(CH2)2–CH(NH2)–COOH
Метіонін* (Met)
2-Аміно-4-етилмеркаптобутанова
10.
CH2 CH COOHN
NH
NH2
(His)
H2N–(CH2)4–CН(NH2)–COOH
H2N-C-NH-(CH2)3-CH-COOH
NH2
NH
CH2CH COOH
NH2
NH
NH
Гістидин
COOH
Лізин* (Lys)
α-Амино-βімідазолілпропіоновая
кислота
2,6-Діаміногексанова
δ-Гуанідин-αАргінін (Arg) аміновалеріанова
кислота
Триптофан*
(Trp)
2-Аміно-3індолілпропанова
Пролін (Pro)
2-Піролідинкарбонова
11.
Види класифікації амінокислотКласифікація
Принцип розділення
Хімічна структура «бічного
радикала»
(аліфатичні: діаміномонокарбонові,
Структурна моноамінодикарбонові,моноаміномонокарбонові,
циклічні: ароматичні та
гетероциклічні)
Здатність синтезуватися в
організмі
Біологічна
(замінні, незамінні, напівзамінні)
Заряд «бічного радикала»
Фізикохімічна
(кислі, основні, нейтральні)
Класифікація Полярність «бічного радикала»
за полярністю (полярні, неполярні, заряджені)
12.
АмінокислотиНезамінні
Замінні
Напівзамінні
13.
Замінні амінокислоти - цеамінокислоти, які можуть синтезуватися
в організмі людини з продуктів обміну
речовин.
До них належать:
• Гліцин
• Аланін
• Серин
• Глутамінова к-та
• Глутамін
• Аспарагінова к-та
• Аспарагін
• Аргінін
• Пролін
• Цистин
• Тирозин
14.
Незамінні амінокислоти –це амінокислоти, які
не можуть
синтезуватися у організмі і повинні
обов'язково надходити з їжею. Їх
синтезують рослини, гриби, бактерії
а саме:
• Ізолейцин
• Лейцин
• Метіонін
• Лізин
• Фенілаланін
• Треонін
• Триптофан
• Валін
• Гістидин, тирозин, аргінін (для дітей)
15.
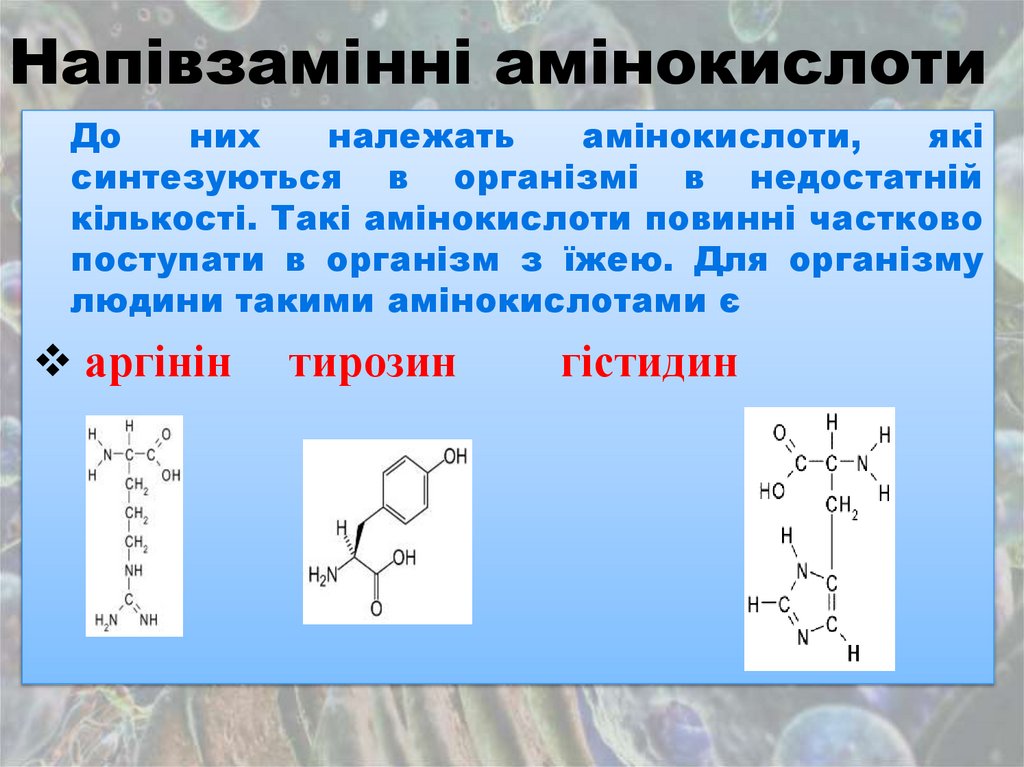
Напівзамінні амінокислотиДо
них
належать
амінокислоти,
які
синтезуються в організмі в недостатній
кількості. Такі амінокислоти повинні частково
поступати в організм з їжею. Для організму
людини такими амінокислотами є
аргінін
тирозин
гістидин
16.
Вміст незамінних амінокислот уїжі
• Аргінін міститься у насінні гарбуза, свинині, яловичині, арахісі,
кунжуті, йогурті, швейцарському сирі;
• Валін у зернових, м'ясі, грибах, молочних продуктах, арахісі, сої;
• Гістидин у тунці, лососі, свинячій вирізці, яловичому філе,
курячих грудках, соєвих бобах, арахісі, сочевиці;
• Ізолейцин міститься у мигдалі, кеш'ю, курячому м'ясі,
турецькому горосі ( нут), яйцях, рибі, сочевиці, печінці, м'ясі,
житі, у більшості насіння, сої;
• Лейцин міститься у м'ясі, рибі, бурому рисі, сочевиці, горіхах,
більшості насіння;
• Лізин міститься у рибі, м'ясі, молочних продуктах, пшениці,
горіхах, у амаранті;
17.
Вміст незамінних амінокислот у їжі• Метіонін міститься у молоці, м'ясі, рибі, яйцях, бобах,
квасолі, сочевиці і сої;
• Треонін міститься у молочних продуктах та яйцях, у
помірних кількостях - у горіхах і бобах;
• Триптофан міститься у вівсі, бананах, сушених фініках,
арахісі, кунжуті, кедрових горіхах, молоці, йогурті, сирі,
рибі, курці, індичці, м'ясі;
• Фенілаланін міститься у яловичині, курячому м'ясі, рибі,
соєвих бобах, яйцях, сирі, молоці. Також є складовою
частиною синтетичного цукрозамінника - аспартаму, котрий
активно використовується в харчовій промисловості.
18.
Незамінні амінокислоти у продуктахАмінокислоти
Вміст незамінних амінокислот
( г/100 г білка)
Жіноче молоко
Курине яйце
М’ясо
Триптофан
Лізин
Метіонін
Треонін
Ізолейцин
Лейцин
Фенилаланін
Аргінін
Гістидін
Валін
1,9
7,2
2,1
4,6
5,2
12,1
5,9
5,0
2,7
5,5
1,2
6,4
2,5
4,4
5,2
8,2
4,1
6,4
3,5
5,6
1,7
7,8
3,1
5,0
6,6
9,2
5,8
6,6
2,4
7,4
19.
Деякіхімічні
амінокислот
властивості
α-
Хімічні властивості α-амінокислот в основному визначаються
функціональними групами
- карбоксильна група, аміногрупа і функціональні групи бічного
радикала.
Реакції , які проходять за карбоксильною групою:
утворення естерів, солей, амідів, галогенангідридів
декарбоксилювання, утворення амідів та ін.
Реакції, які проходять за аміногрупою:солеутворення з
кислотами, алкілування, ацилювання, гуанідилювання,
взаємодія з формальдегідом, взаємодія з нітритною
кислотою (реакція Ван-Слайка) та ін.
Зупинимося на хімічних особливостях, цікавих з
біохімічної точки зору.
20.
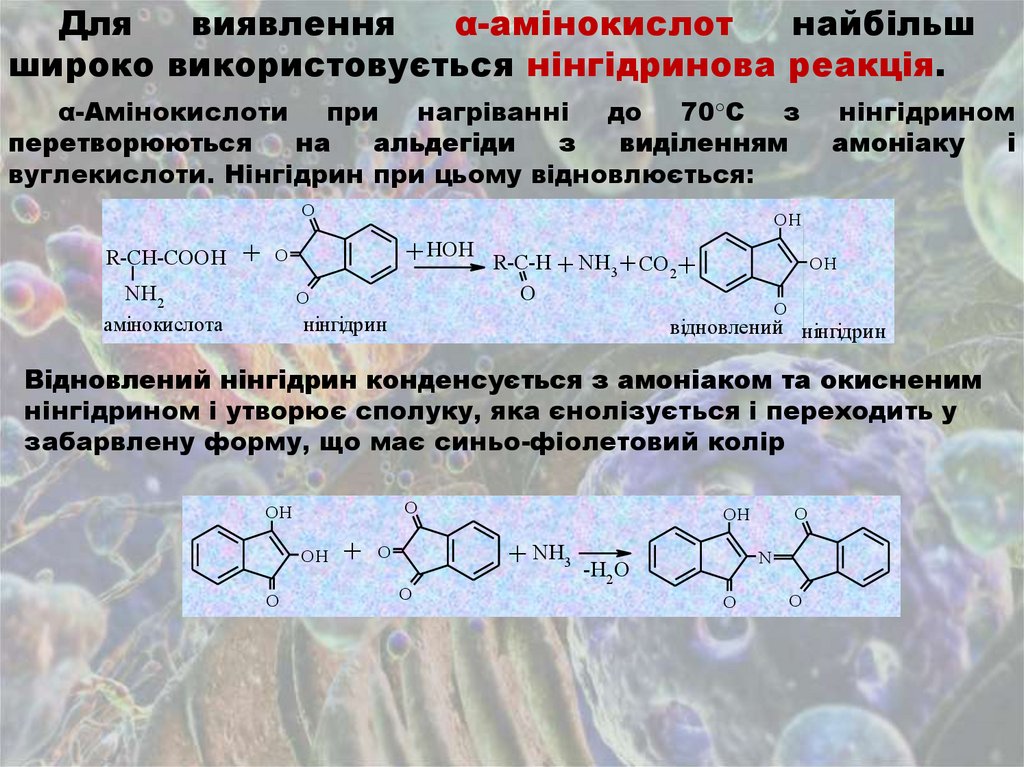
Длявиявлення
α-амінокислот
найбільш
широко використовується нінгідринова реакція.
α-Амінокислоти при нагріванні до 70°С з
перетворюються
на
альдегіди
з
виділенням
вуглекислоти. Нінгідрин при цьому відновлюється:
O
R-CH-COOH
OH
+ HOH R-C-H + NH3 + CO +
+ O
NH2
амінокислота
нінгідрином
амоніаку
і
O
O
OH
2
O
нінгідрин
відновлений нінгідрин
Відновлений нінгідрин конденсується з амоніаком та окисненим
нінгідрином і утворює сполуку, яка єнолізується і переходить у
забарвлену форму, що має синьо-фіолетовий колір
O
OH
OH
O
+ O
+ NH3 -H O
O
O
OH
N
2
O
O
21.
• Якісні реакції на α-амінокислотиУніверсальна (на всі амінокислоти) з нінгідрином
(синьо-фіолетове забарвлення)
Ксантопротеїнова (реакція Мульдера).
характерна на амінокислоти з бензольним кільцем при взаємодії з
нітратною кислотою утворюється сполука жовтого кольору
(фенілаланін, тирозин).
Реакція Мілона сумішшю меркурію нітратів і нітритів,
розчинених в концентрованій нітратній кислоті діють на
амінокислоту тирозин, утворюється сполука вишневого кольору
Реакція Адамкевича
характерна на амінокислоту триптофан + гліоксилова кислота і
Н2SO4 утворюється червоно-фіолетове забарвлення.
Реакція Фоля
на амінокислоти, які мають в своєму складі сірку (цистеїн, цистин).
Реакція з ацетатом плюмбуму в лужному середовищі. Утворюється
осад чорного кольору РbS.
Реакція на аргінін (реакція Сакагучі).
реакція на гуанідинове угруповання. Окиснення в лужному
середовищі натрію гіпобромітом в присутності α-нафтолу
Утворюється продукт конденсації червоного кольору.
22.
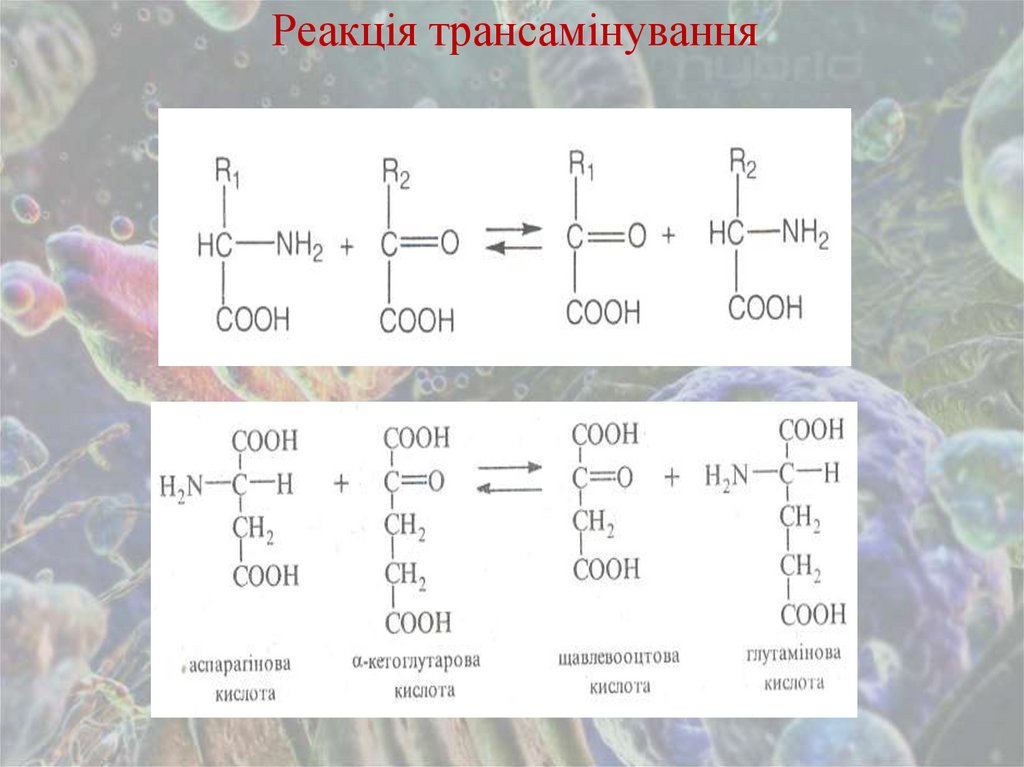
Реакція трансамінування23.
• Утворення комплексних солей – цереакція амінокислот з ІІ валентними
металами (Mn, Mg, Cu, Zn, Fe).
R1-CH-COO
NH2
Cu
NH2
OOC-CH-R2
• з формальдегідом - утворюються метиленові
похідні амінокислот (реакція формального
титрування). Цей метод застосовується для
визначення вільних амінокислот.
R-CH-COOH
NH2
+
O
H-C-H
- H2O
R-CH-COOH
N=CH2
24.
РЕАКЦІЯМЕЛАНОЇДИНОУТВОРЕННЯ
(РЕАКЦІЯ МАЙЯРА)
• Це хімічна реакція взаємодії амінокислоти
з вуглеводами, яка проходить при високих
температурах – 120-170 градусів.
• Утворюються
речовини
від
світлокоричневого до чорного кольору –
меланоїдини.
• Реакція
використовується
у
харчовій
промисловості
для надання
смаку,
запаху, кольору.
25.
HH
H
H
|
H
OH
|
H3C
CH
C
C
H
NH2
COOH
+
H3C
H
C
C
120OC
OH
OH
O
H3C
H3C
H
H
|
OH
H
H
O
O
+
C
H
+
C
H
O
NH3
H
CH2OH
H
H
H
|
H
OH
|
H3C
CH
C
C
H
NH2
COOH
+
H3C
H
H3C
C
H
120OC
OH
OH
O
H3C
C
H
H
|
OH
H
H
O
O
+
C
H
HOH2N
O
CO2
+
C
+
H
H
+
R
C
NH2
COOH
NH3
26.
РЕАКЦІЯ МЕЛАНІНОУТВОРЕННЯЦе реакція ферментативного окиснення
амінокислот.
• Потемніння
борошна
у
процесі
приготування
виробів
відбувається
внаслідок утворення темнозабарвлених
сполук — меланінів (продуктів окиснення
киснем повітря амінокислот тирозину і
фенілаланіну
під
дією
ферменту
поліфенолоксидази
(тирозинази).
Саме
меланіни, що утворилися, забарвлюють як
тісто, так і м'якушку хліба в сірий колір. У
протіканні цієї реакції основна роль
належить
вмісту
вільного
тирозину.
Фермент поліфенолоксидаза у борошні
завжди присутній у достатній кількості.
27.
Шляхи одержанняамінокислот
• 1. Хімічний синтез (амінокислоти оптично активні
ізомери) Утворюється рацемічна суміш.
синтез з використанням галогензаміщених
карбонових кислот
CH2ClCOOH + 2NH3 → NH2 —CH2COOH +
NH4Cl
• 2. Мікробіологічний синтез.
• 3.Гідроліз білків.Розрізняють кислотний, основний
та ферментативний гідроліз.
28.
Амінокислотний скорПовноцінність білкових речовин визначають за
амінокислотним складом, за допомогою
амінокислотного скору. Скор виражають у
відсотках або безрозмірною величиною, що
представляє собою відношення вмісту незамінної
амінокислоти (А.К.) в досліджуваному білку до її
кількості в еталонному білку.
• лімітуюча кислота - амінокислота з найменшим
скором.
• лімітуючі -усі амінокислоти, скор яких менше
100%, а амінокислота з найменшим скором – є
основною лімітуючою АК.
• повноцінні білки - білки, які мають всі незамінні
амінокислоти
29.
Формула для розрахункуамінокислотного скору
30.
Пептиди• Пептидами називають
низькомолекулярні білкові речовини які
містять 2-10 залишків амінокислот і
мають високу біологічну активність
• Олігопептид – включає до 10 амінокислот
Виконують функції :
• - ефекторів (речовини, які активують дію
ферментів)
• -регуляторів процесів метаболізму
зокрема гормональні функції.
31.
Класифікація природнихпептидів:
•пептиди, що мають гормональну активність
(вазопресин, окситоцин, кортикотропін, глюкагон)
•пептиди, що беруть участь у травленні (гастрингормон, регулює секрецію шлункового сока та
секретин)
•пептиди, що походять з α2 –глобулінів сироватки
крові (ангіотензин, брадикінін, калідин)
•нейропептиди містяться переважно в головному
мозку (ендорфіни, пептиди пам яті, сну).
•пептидні антибіотики (граміцидин, актиноміцин)
• алкалоїди
32.
ГлутатіонЗа будовою глутатіон – трипептид, який складається
з таких амінокислот: глутамінова кислота, цистеїн,
гліцин.
-L-глутаміл-L-цистеїлгліцин.
Перехід з відновленої сульфгідрильної (GSH)
форми в окислену дисульфідну (GSSG)
33.
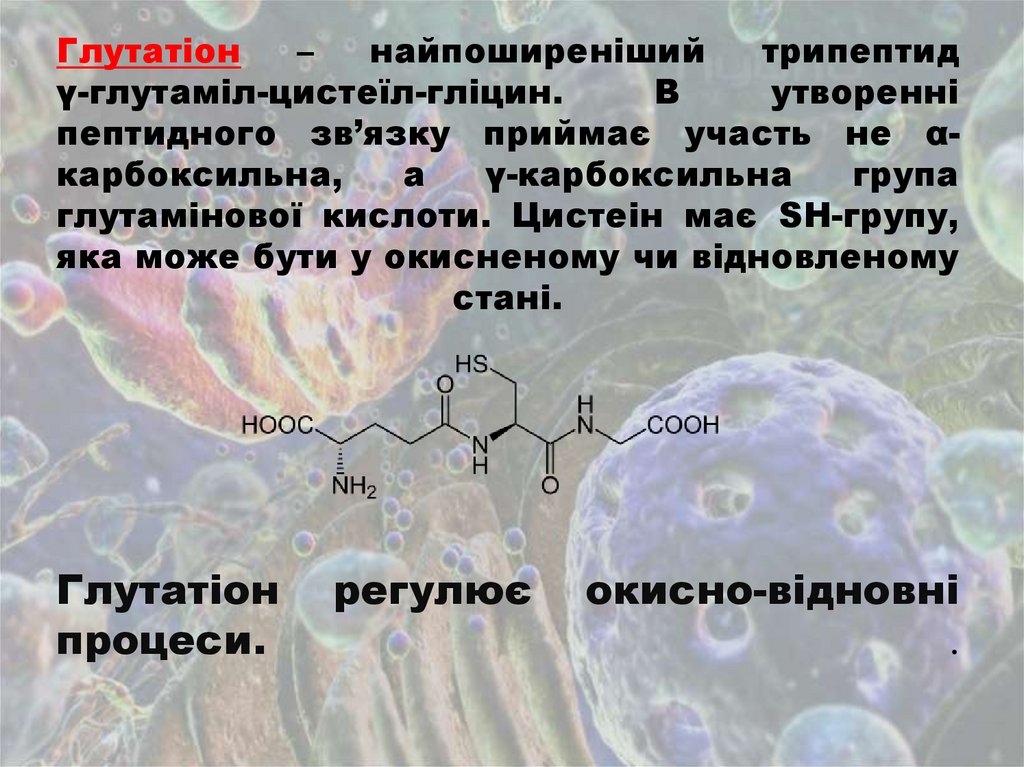
Глутатіон–
найпоширеніший
трипептид
γ-глутаміл-цистеїл-гліцин.
В
утворенні
пептидного зв’язку приймає участь не αкарбоксильна,
а
γ-карбоксильна
група
глутамінової кислоти. Цистеін має SH-групу,
яка може бути у окисненому чи відновленому
стані.
Глутатіон
процеси.
регулює
окисно-відновні
.
34.
Біологічна роль глутатіону• реалізується як за рахунок активації GSН-залежних
ферментів, так і системою 2GSH-GSSG
•захист від активних форм кисню (розкладання пероксиду водню)
• відновлення та ізомеризація дисульфідних зв'язків;
• впливає на активність багатьох ензимів;
• підтримує оптимальний стан біомембран.Транспорт
амінокислот через клітинні мембрани;
• реалізація коферментних функцій;
• участь в обміні ейкозаноїдів;
• функціонування в якості резерву цистеїну;
• участь в біосинтезі нуклеїнових кислот;
• участь в метаболізмі ксенобіотиків(чужорідних для організму
речовин, наприклад ліків);
• підвищення резистентності клітин до інтоксикацій;
• стимуляція проліферації -процесу ділення клітин, що призводить
до збільшення об’єму тканини;
• бере участь в згортанні і деградації білків шляхом
утворення і розриву дисульфідних містків.


























 Химия
Химия








