Похожие презентации:
Непредельные углеводороды
1.
2.
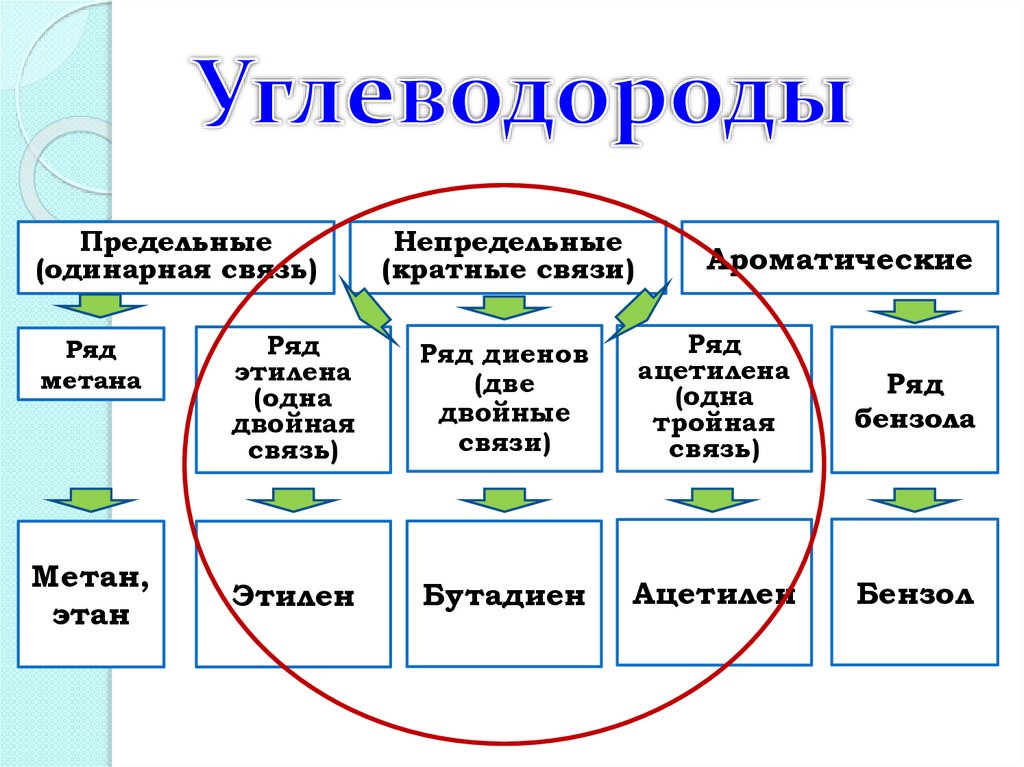
Предельные(одинарная связь)
Ряд
метана
Метан,
этан
Непредельные
(кратные связи)
Ароматические
Ряд
этилена
(одна
двойная
связь)
Ряд диенов
(две
двойные
связи)
Ряд
ацетилена
(одна
тройная
связь)
Ряд
бензола
Этилен
Бутадиен
Ацетилен
Бензол
3.
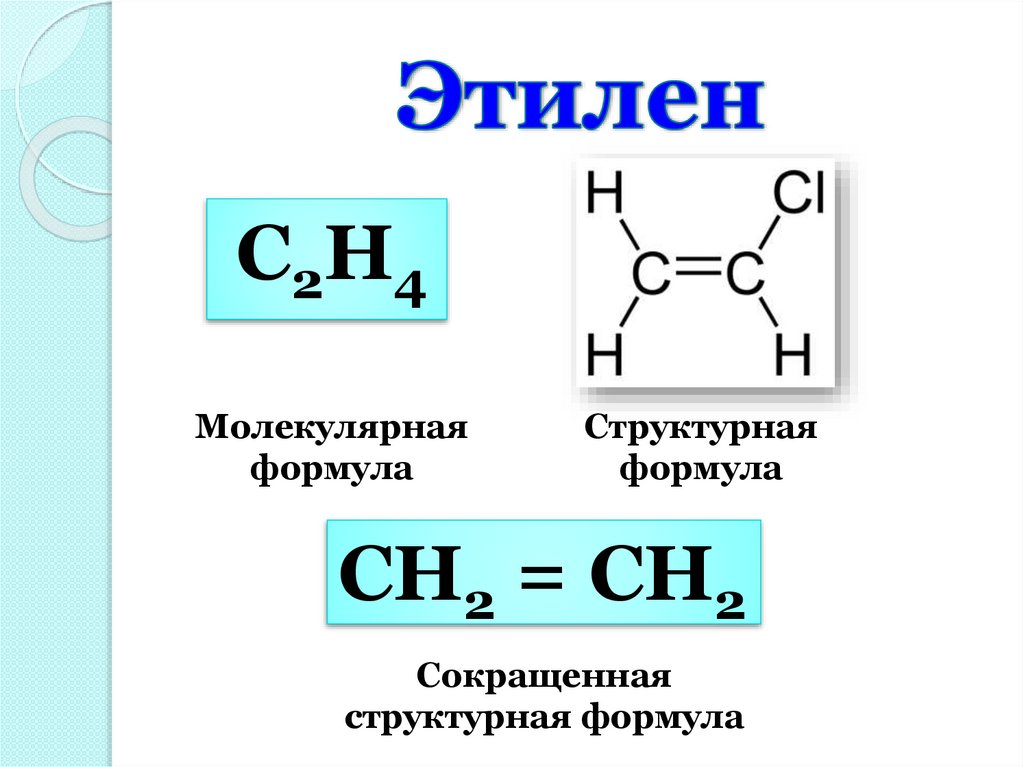
С 2Н 4Молекулярная
формула
Структурная
формула
СН2 = СН2
Сокращенная
структурная формула
4.
5.
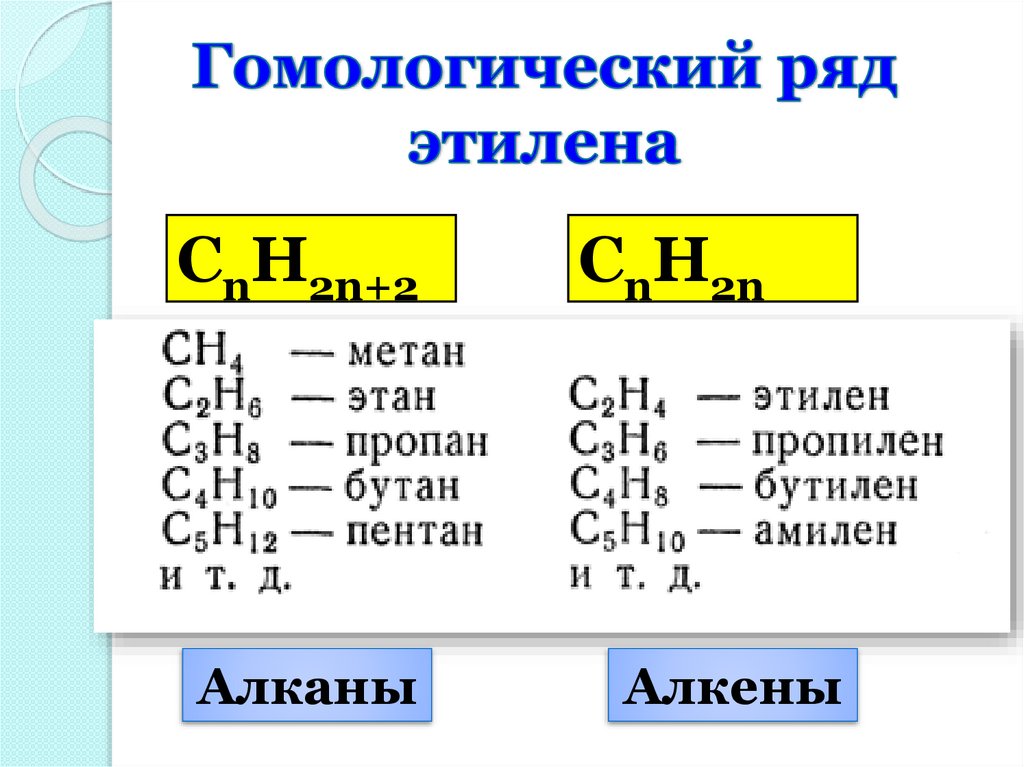
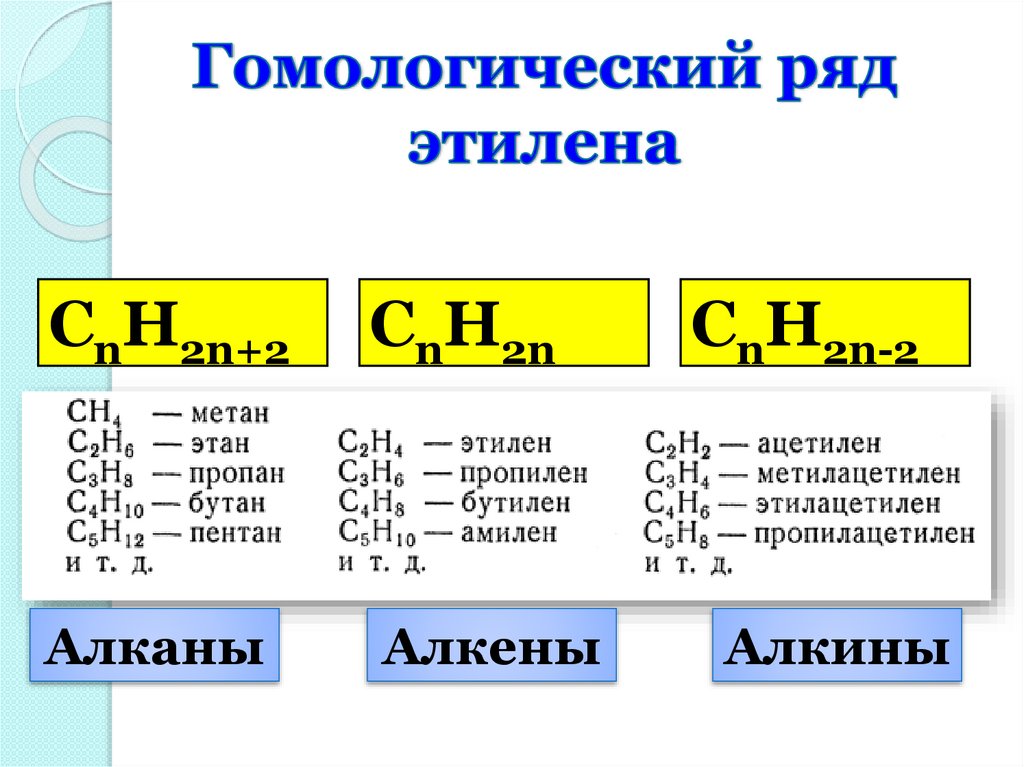
СnH2n+2Алканы
СnH2n
Алкены
6.
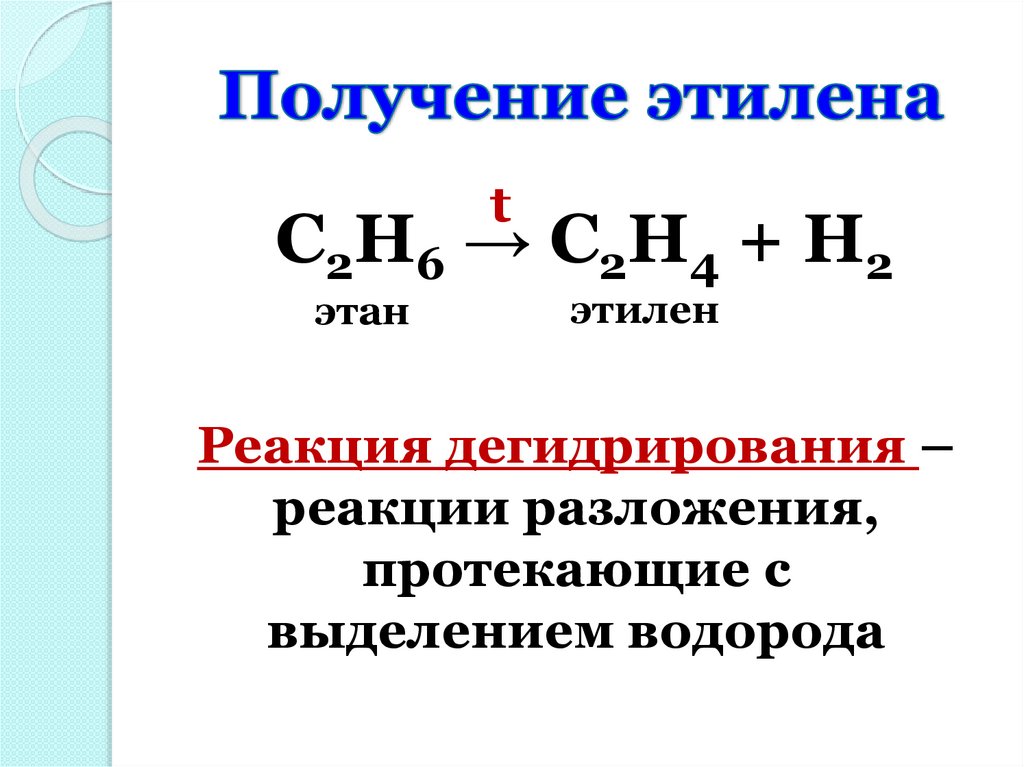
tC2H6 → C2H4 + H2
этан
этилен
Реакция дегидрирования –
реакции разложения,
протекающие с
выделением водорода
7.
БесцветныйБез
газ;
запаха;
Немного легче воздуха;
Плохо растворим в воде;
Очень горюч.
8.
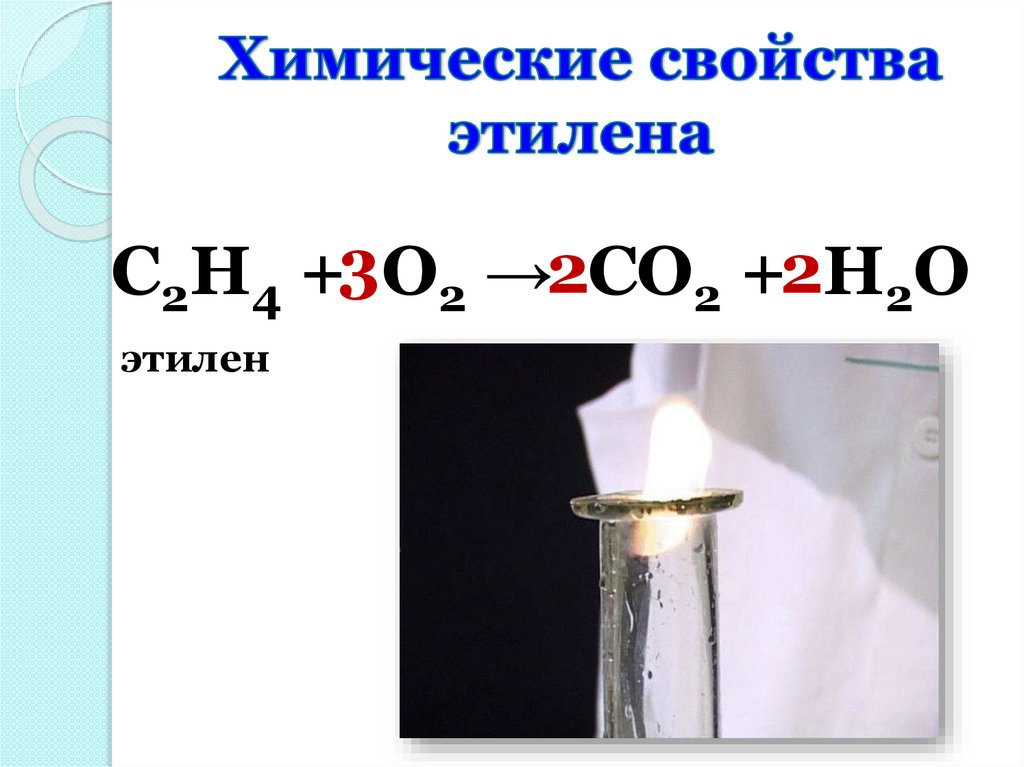
C2H4 +3O2 →2CO2 +2H2Oэтилен
9.
tCH2 = CH2 + H2 → C2H6
этилен
этан
Реакция гидрирования –
реакции присоединения,
протекающие с
присоединением водорода
10.
CH2 = CH2 + Br2 → BrCH2 - CH2Brэтилен
дибромэтан
C2H4 + Br2 → C2H4Br2
Качественная реакция на
этилен–
обесцвечивание брома
11.
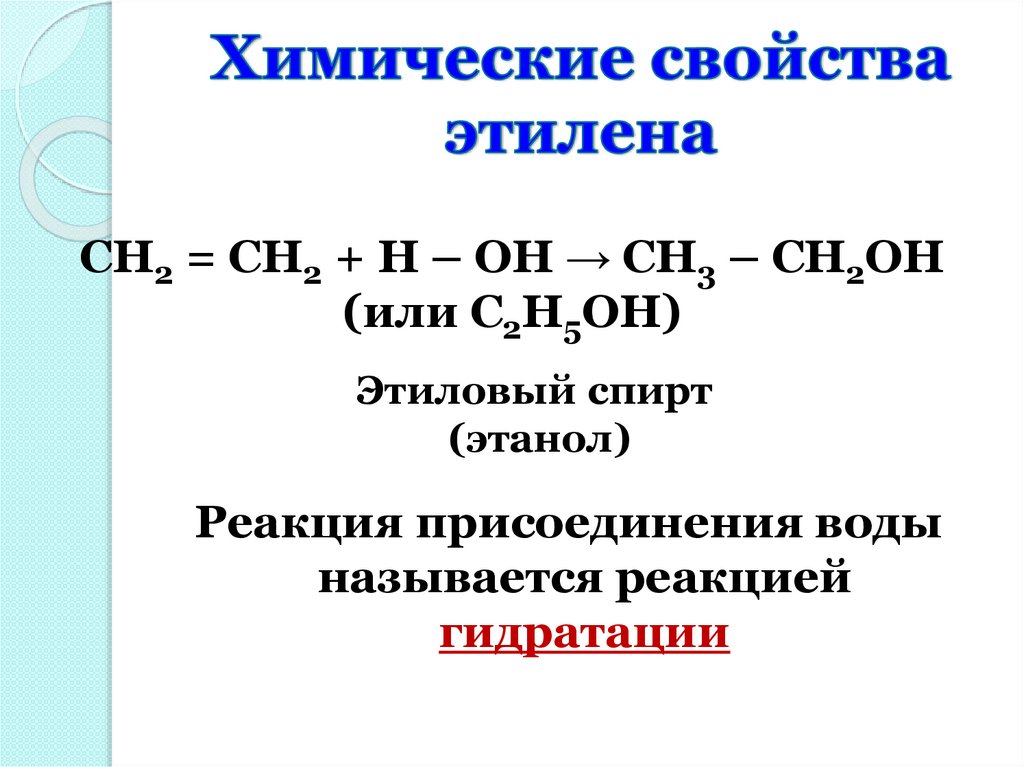
CH2 = CH2 + H – OH → CH3 – CH2OH(или С2Н5ОН)
Этиловый спирт
(этанол)
Реакция присоединения воды
называется реакцией
гидратации
12.
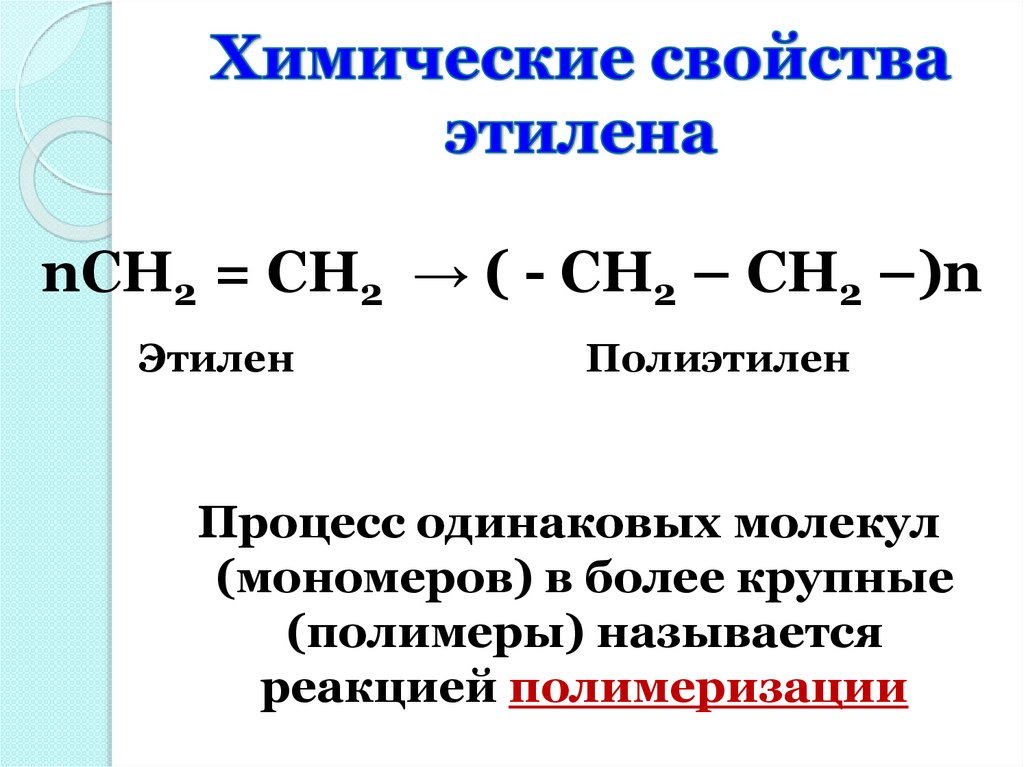
nCH2 = CH2 → ( - CH2 – CH2 –)nЭтилен
Полиэтилен
Процесс одинаковых молекул
(мономеров) в более крупные
(полимеры) называется
реакцией полимеризации
13.
Свойство1. Полимеризация
2.
Галогенирование
3. Гидрогалогенирование
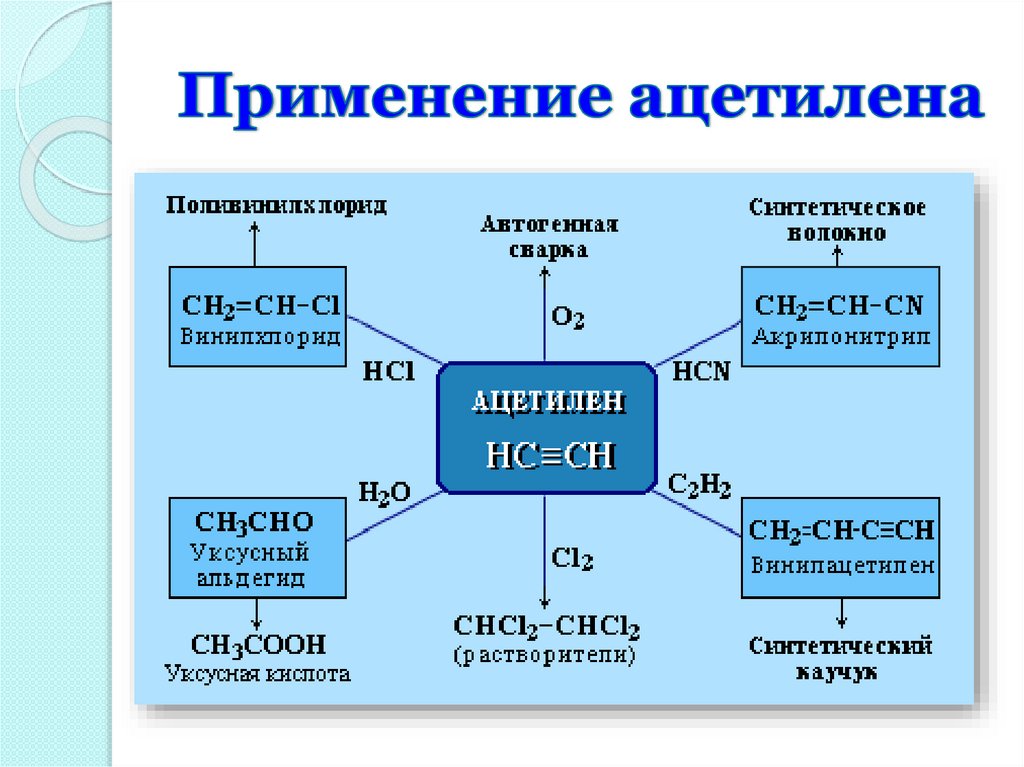
Применение
Производство
полиэтилена, пластмасс
Получение
растворителей
Для местная анестезия,
получения растворителей, в с/х для
обеззараживания
зернохранилищ
Пример
14.
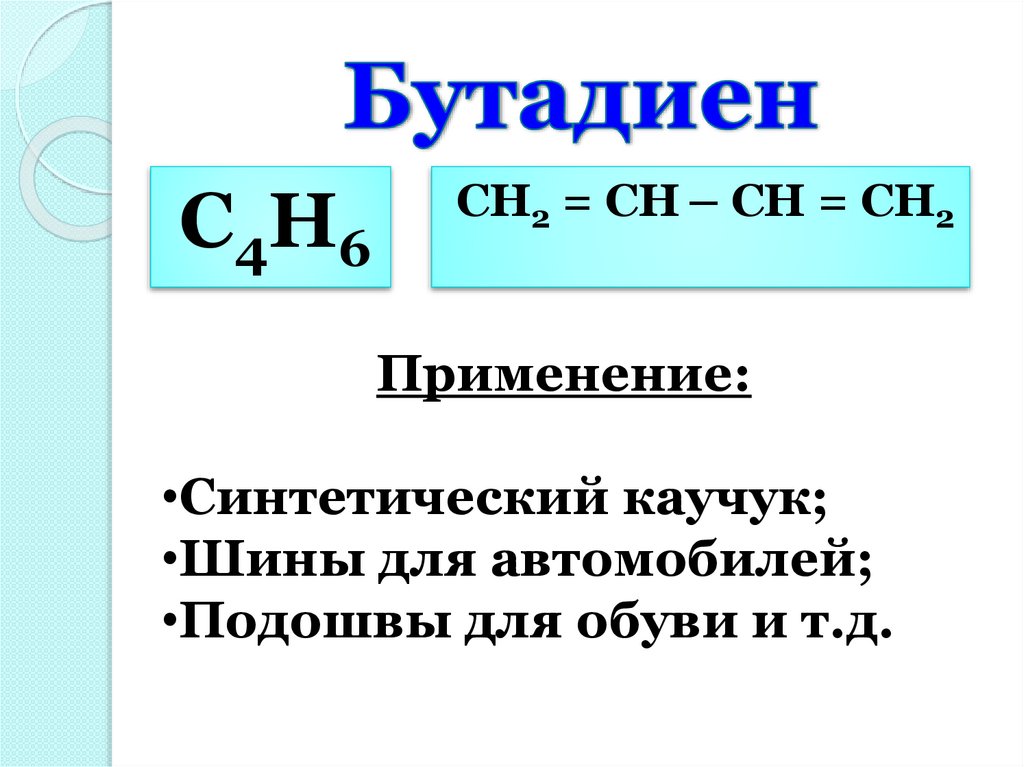
С 4 Н6CH2 = CH – CH = CH2
Применение:
•Синтетический каучук;
•Шины для автомобилей;
•Подошвы для обуви и т.д.
15.
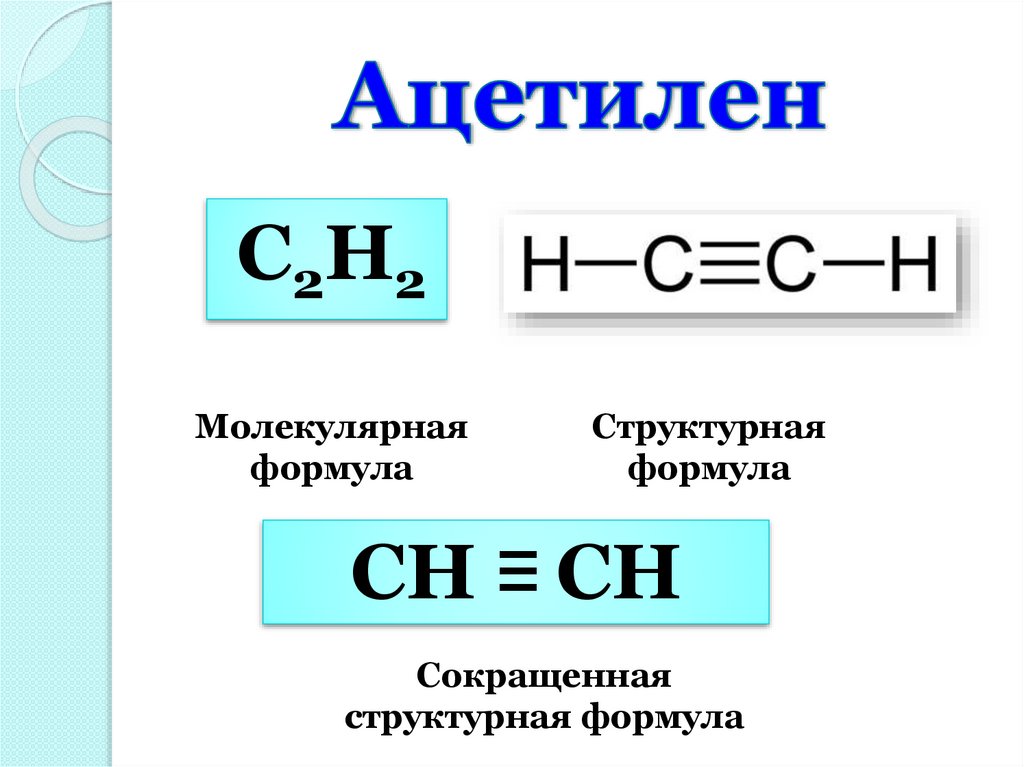
С2Н2Молекулярная
формула
Структурная
формула
СН ≡ СН
Сокращенная
структурная формула
16.
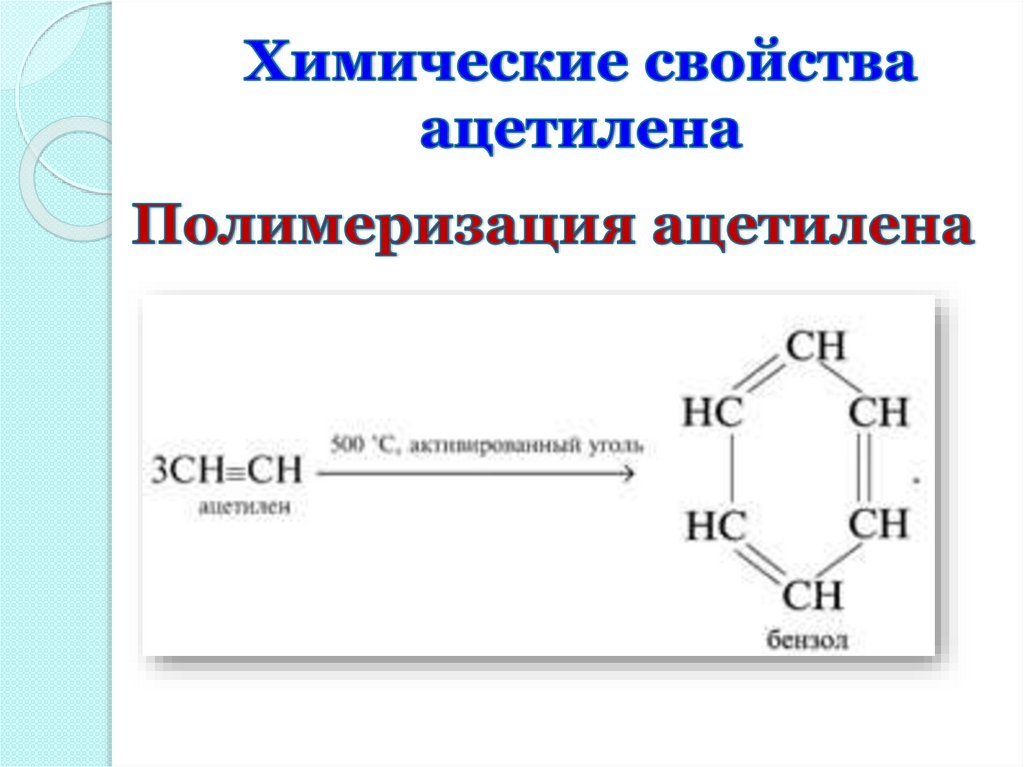
17.
СnH2n+2СnH2n
Алканы
Алкены
СnH2n-2
Алкины
18.
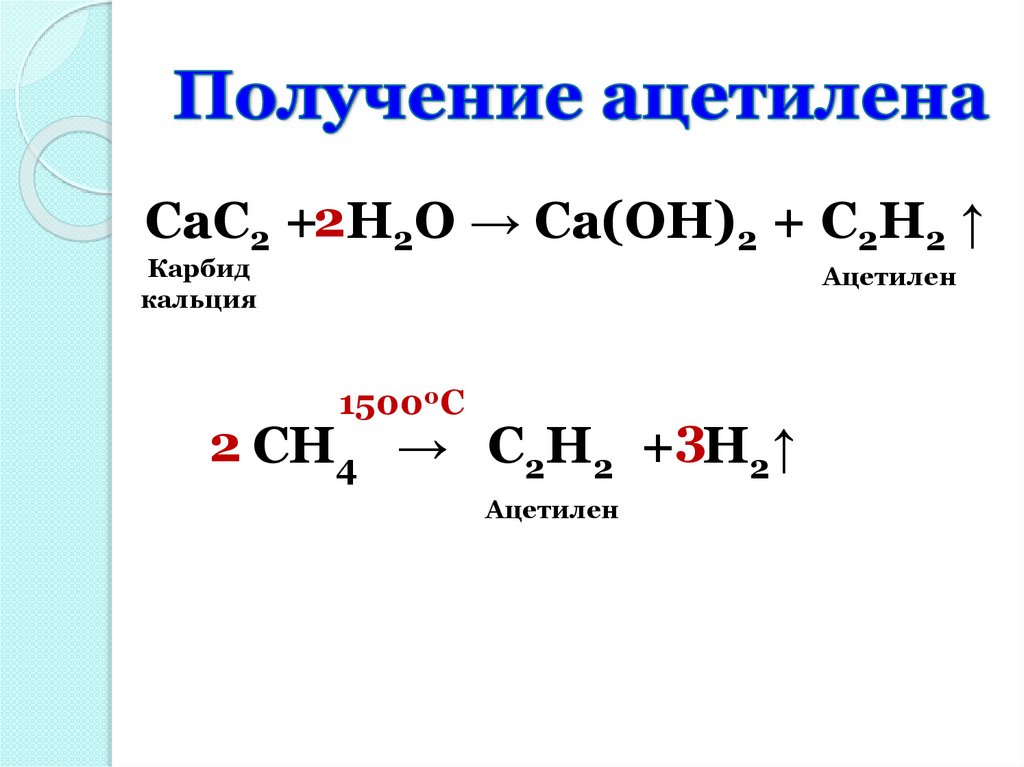
CaC2 +2H2O → Ca(OH)2 + C2H2 ↑Карбид
кальция
Ацетилен
15000C
2 CH4 → C2H2 +3H2↑
Ацетилен
19.
Газбез цвета и запаха;
Немного легче воздуха;
В составе технического
ацетилена имеется смесь
аммиака и фосфина,
поэтому он имеет
неприятный запах.
20.
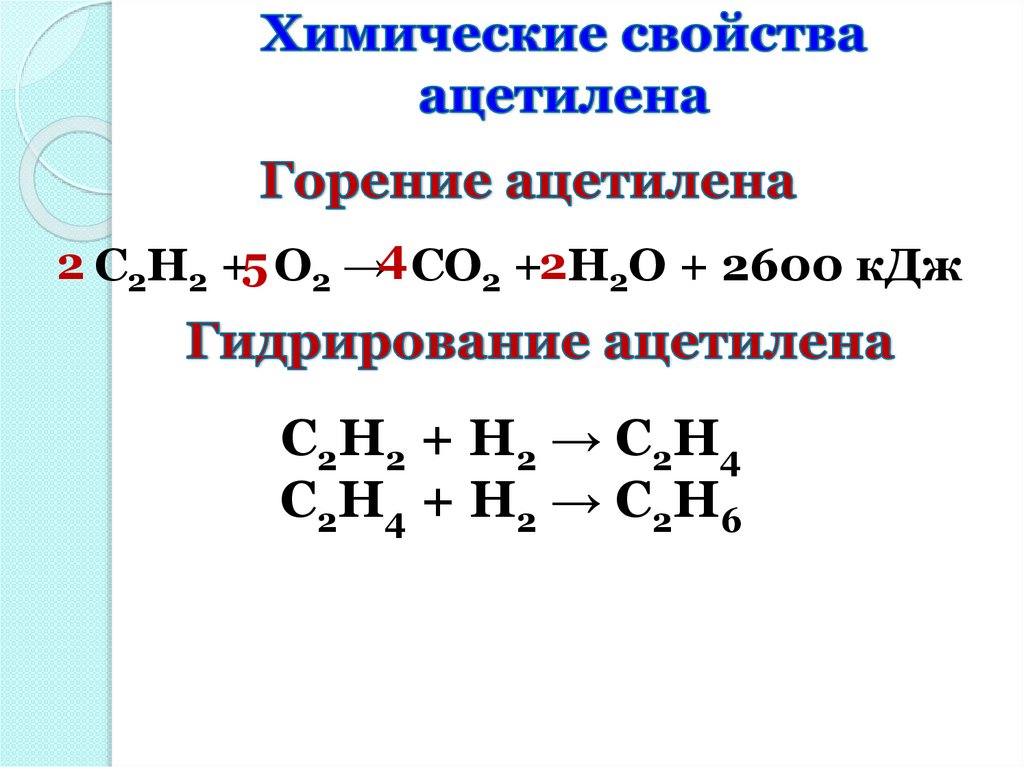
2 C2H2 +5 O2 →4 CO2 +2H2O + 2600 кДжC2H2 + Н2 → С2Н4
C2H4 + Н2 → С2Н6
21.
22.
23.
§46, 47 прочитать;
Стр. 208 № 6 – 7.







 Химия
Химия








