Похожие презентации:
Закрепление и обобщение знаний о предельных и непредельных углеводородах
1.
ТЕМА УРОКА:«Закрепление и обобщение
знаний о предельных и
непредельных углеводородах».
КЛАСС 10 В, МОУ Гимназия № 1
Учитель: Щербатых Н.В.
2.
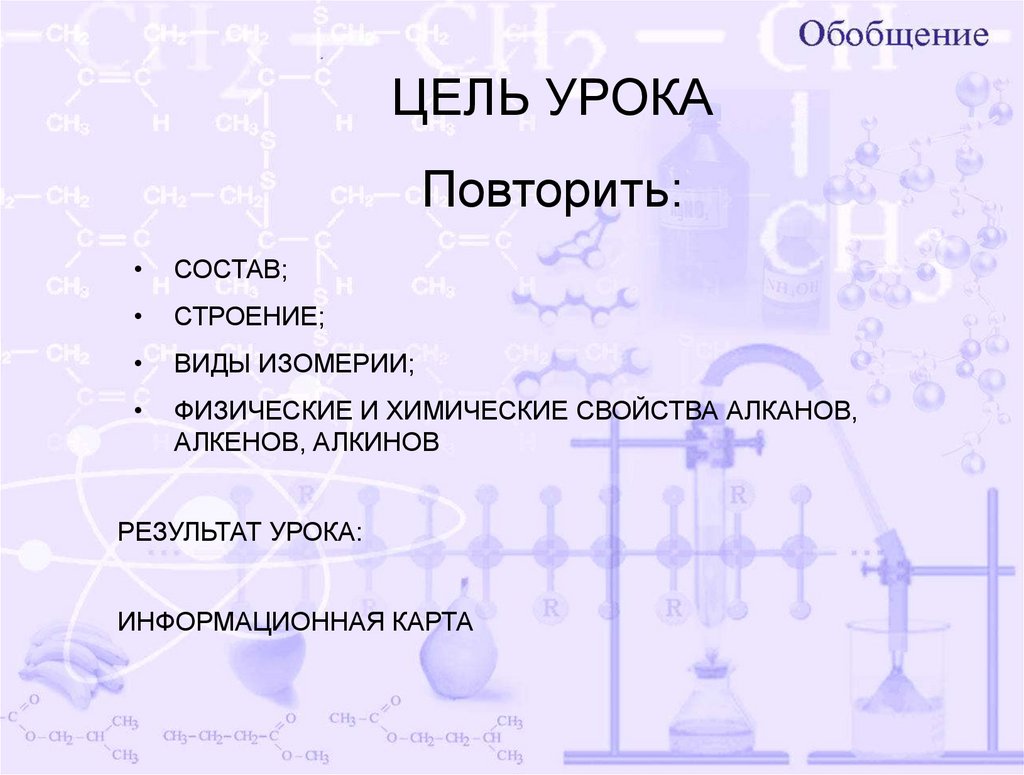
ЦЕЛЬ УРОКАПовторить:
СОСТАВ;
СТРОЕНИЕ;
ВИДЫ ИЗОМЕРИИ;
ФИЗИЧЕСКИЕ И ХИМИЧЕСКИЕ СВОЙСТВА АЛКАНОВ,
АЛКЕНОВ, АЛКИНОВ
РЕЗУЛЬТАТ УРОКА:
ИНФОРМАЦИОННАЯ КАРТА
3.
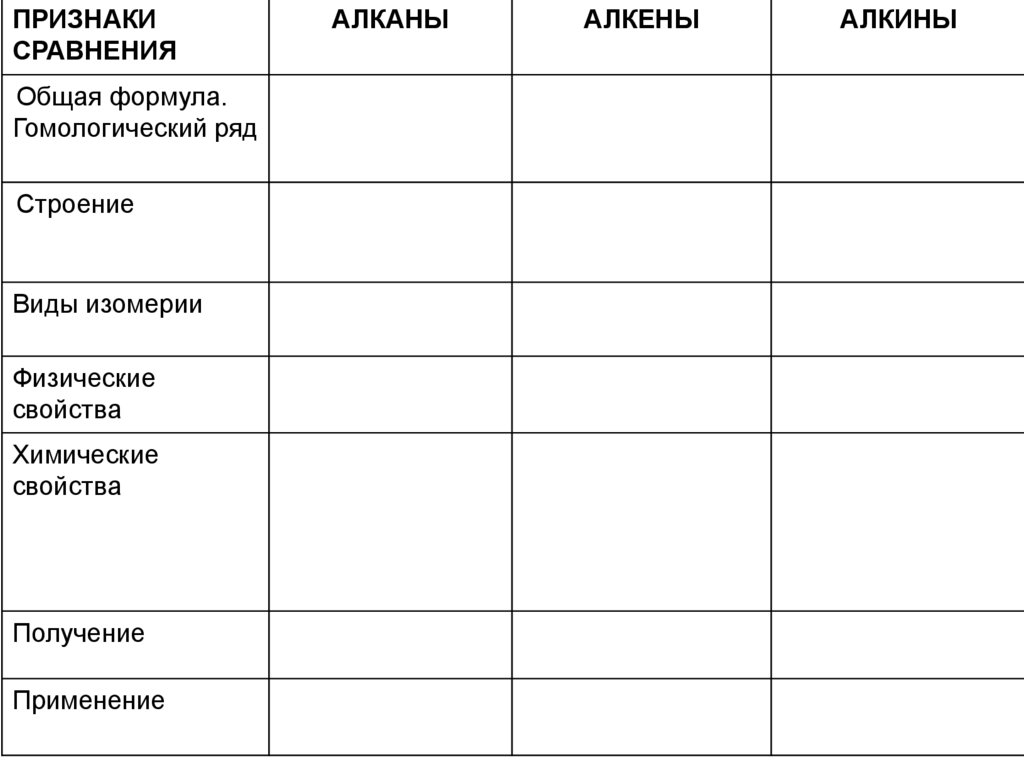
ПРИЗНАКИСРАВНЕНИЯ
Общая формула.
Гомологический ряд
Строение
Виды изомерии
Физические
свойства
Химические
свойства
Получение
Применение
АЛКАНЫ
АЛКЕНЫ
АЛКИНЫ
4. Решение задач на вывод молекулярной формулы
Задание 1Решение задач на вывод
молекулярной формулы
Задача1.Найдите молекулярную формулу
углеводорода массой 4,2 г, если при его сгорании
образуется 13,2 г углекислого газа и 5,4 г воды.
Плотность 1,25 г/л.
• Задача 2. Найдите молекулярную углеводорода,
массовая доля углерода в котором составляет
81,8%. Относительная плотность углеводорода по
воздуху равна 1,517.
• Задача3.Найдите молекулярную формулу
углеводорода, массовая доля углерода в котором
90%, а водорода 10%
5.
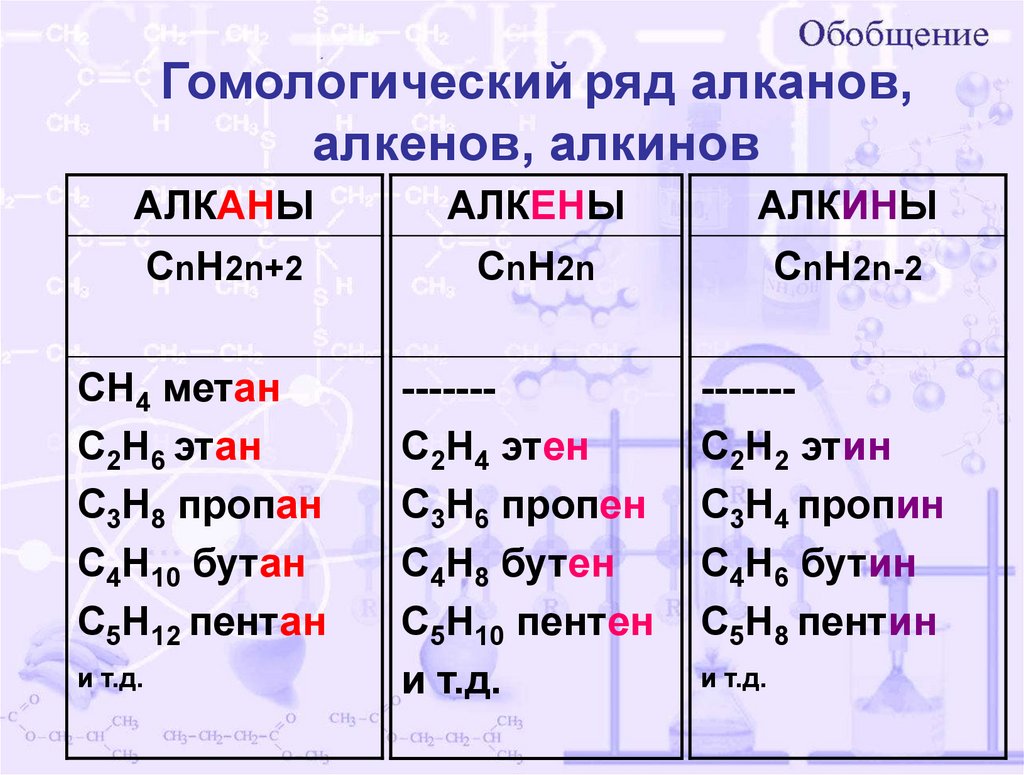
Гомологический ряд алканов,алкенов, алкинов
АЛКАНЫ
АЛКЕНЫ
АЛКИНЫ
CnH2n+2
CnH2n
CnH2n-2
CH4 метан
C2H6 этан
C3H8 пропан
C4H10 бутан
С5H12 пентан
и т.д.
------C2H4 этен
C3H6 пропен
C4H8 бутен
С5H10 пентен
и т.д.
------C2H2 этин
C3H4 пропин
C4H6 бутин
С5H8 пентин
и т.д.
6.
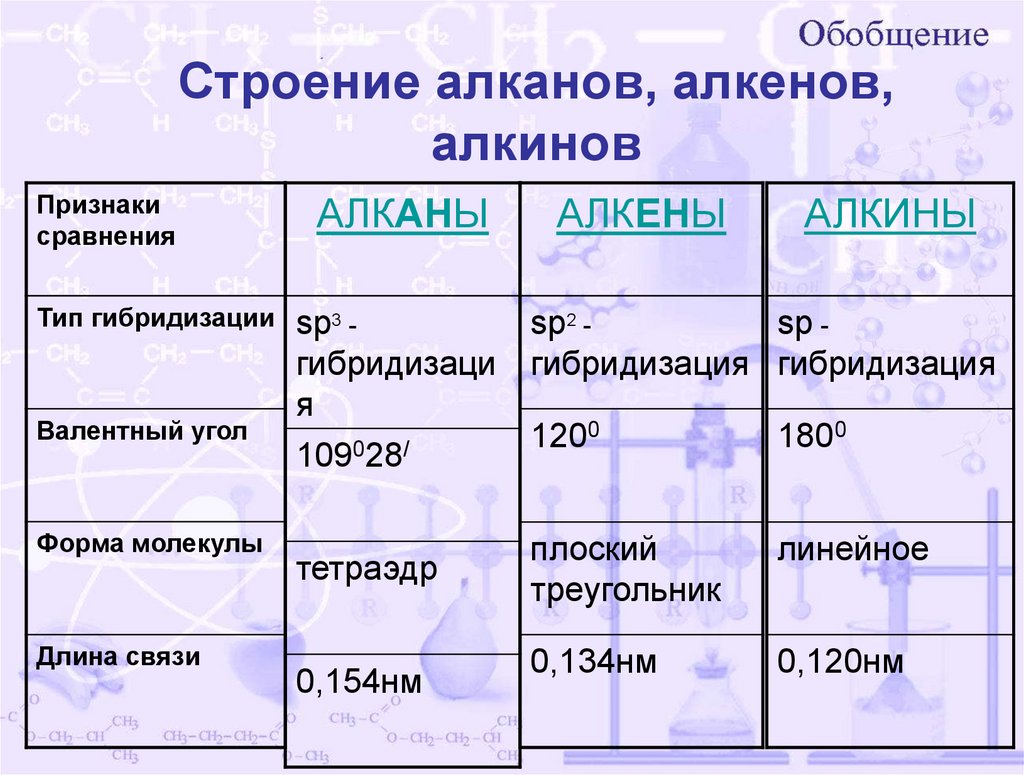
Строение алканов, алкенов,алкинов
Признаки
сравнения
Тип гибридизации
Валентный угол
Форма молекулы
Длина связи
АЛКАНЫ
АЛКЕНЫ
АЛКИНЫ
sp3 sp2 sp гибридизаци гибридизация гибридизация
я
0
0
120
180
109028/
тетраэдр
0,154нм
плоский
треугольник
линейное
0,134нм
0,120нм
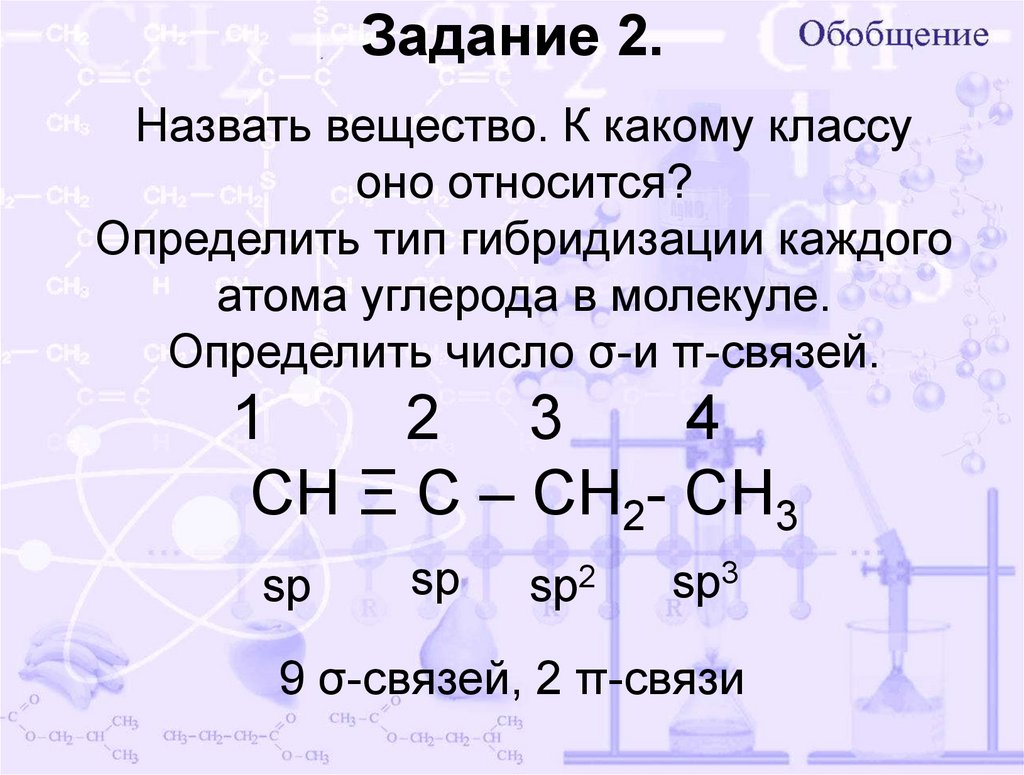
7. Задание 2.
Назвать вещество. К какому классуоно относится?
Определить тип гибридизации каждого
атома углерода в молекуле.
Определить число σ-и π-связей.
1
2 3
4
СН Ξ С – СН2- СН3
sp
sp
sp2
sp3
9 σ-связей, 2 π-связи
8.
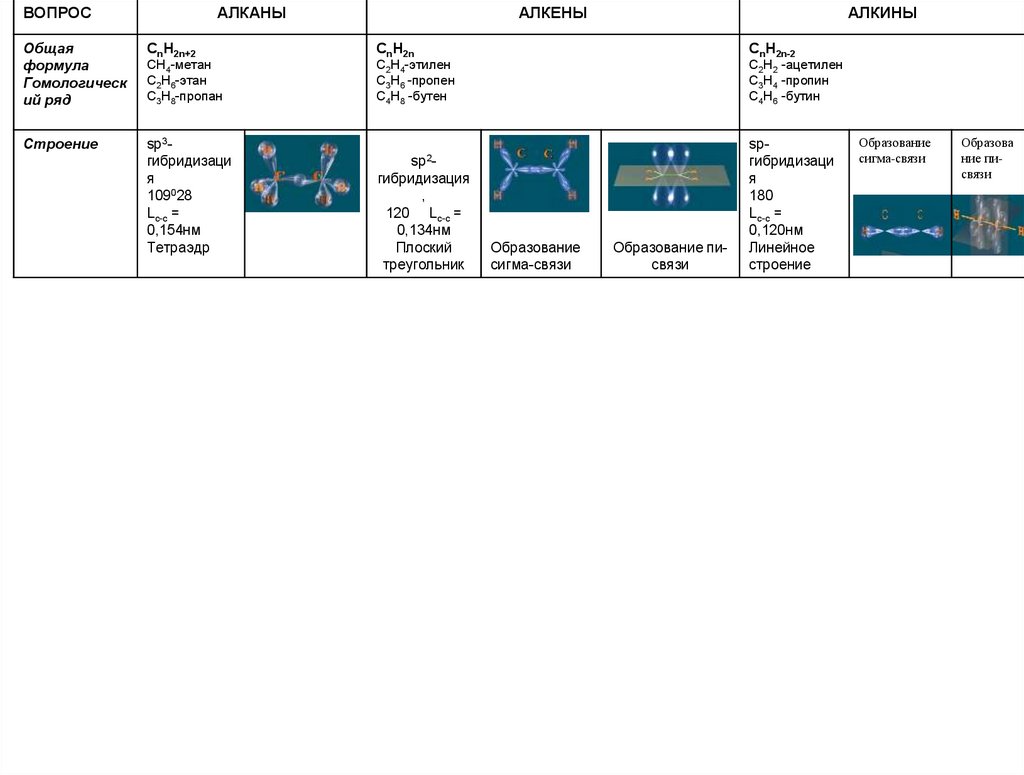
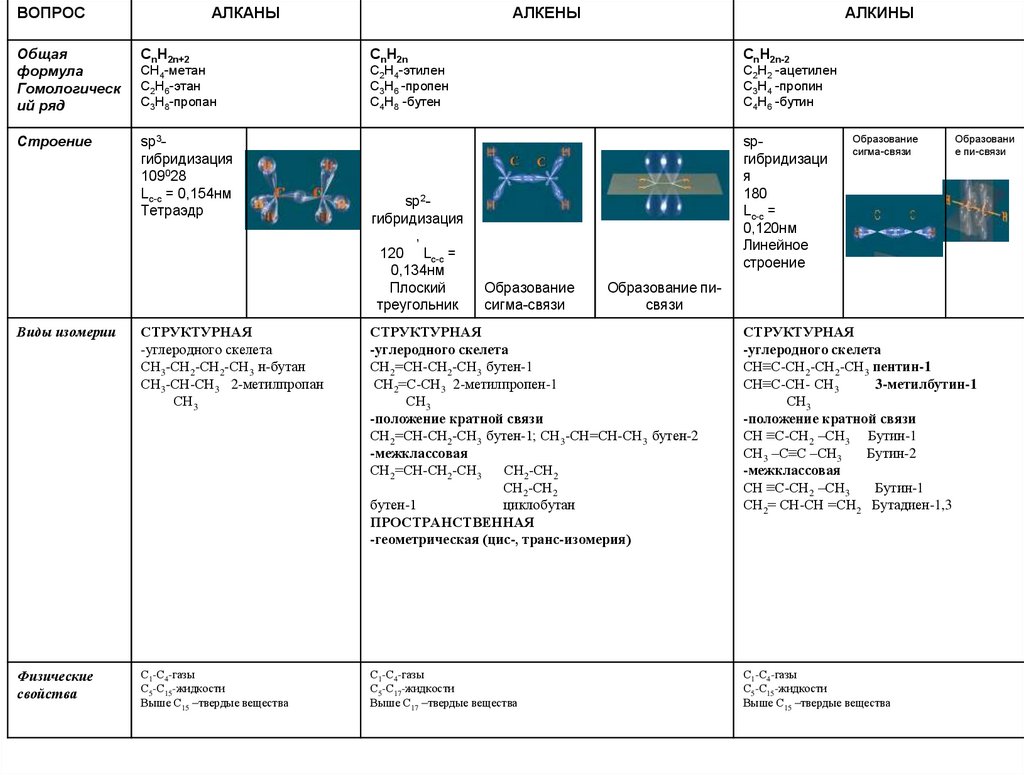
ВОПРОСАЛКАНЫ
АЛКЕНЫ
АЛКИНЫ
Общая
формула
Гомологическ
ий ряд
CnH2n+2
CnH2n
CnH2n-2
CH4-метан
C2H6-этан
C3H8-пропан
C2H4-этилен
C3H6 -пропен
C4H8 -бутен
C2H2 -ацетилен
C3H4 -пропин
C4H6 -бутин
Строение
sp3гибридизаци
я
109028
Lc-c =
0,154нм
Тетраэдр
sp2гибридизация
,
120 Lc-c =
0,134нм
Плоский
треугольник
Образование
сигма-связи
Образование писвязи
spгибридизаци
я
180
Lc-c =
0,120нм
Линейное
строение
Образование
сигма-связи
Образова
ние писвязи
9.
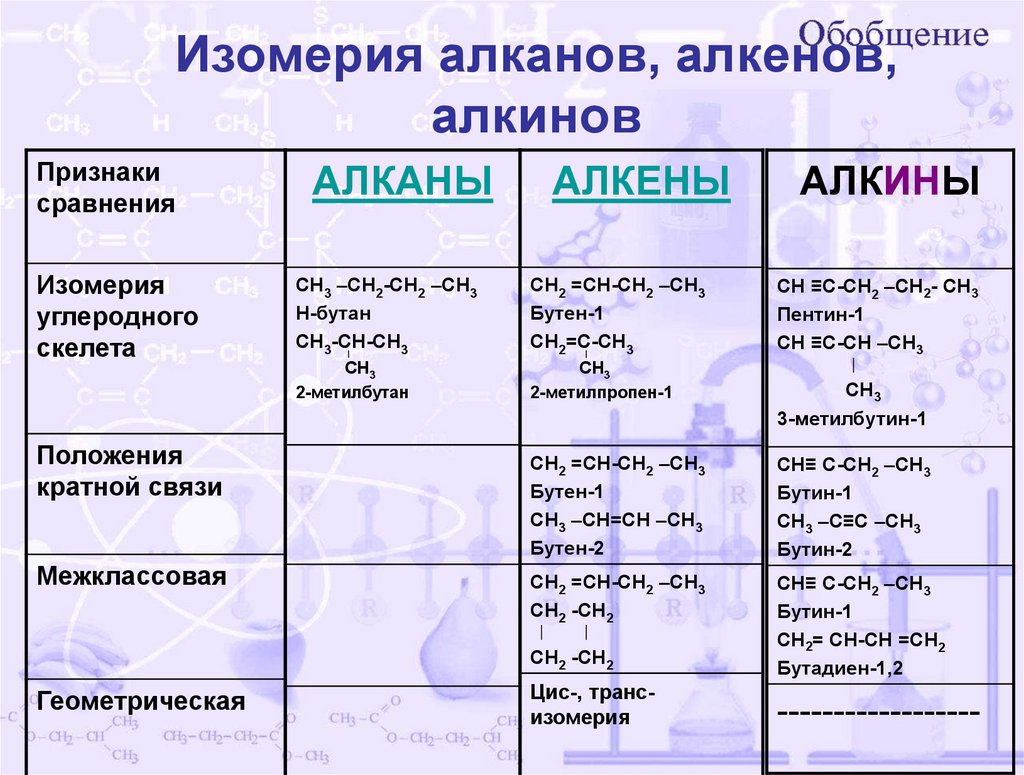
Изомерия алканов, алкенов,алкинов
Признаки
сравнения
Изомерия
углеродного
скелета
Положения
кратной связи
Межклассовая
Геометрическая
АЛКАНЫ
АЛКЕНЫ
СН3 –СН2-СН2 –СН3
Н-бутан
СН3-СН-СН3
СН2 =СН-СН2 –СН3
Бутен-1
СН2=С-СН3
СН3
2-метилбутан
СН3
2-метилпропен-1
АЛКИНЫ
СН ≡С-СН2 –СН2- СН3
Пентин-1
СН ≡С-СН –СН3
СН3
3-метилбутин-1
СН2 =СН-СН2 –СН3
Бутен-1
СН3 –СН=СН –СН3
Бутен-2
СН≡ С-СН2 –СН3
Бутин-1
СН3 –С≡С –СН3
Бутин-2
СН2 =СН-СН2 –СН3
СН2 -СН2
СН2 -СН2
СН≡ С-СН2 –СН3
Бутин-1
СН2= СН-СН =СН2
Бутадиен-1,2
Цис-, трансизомерия
------------------
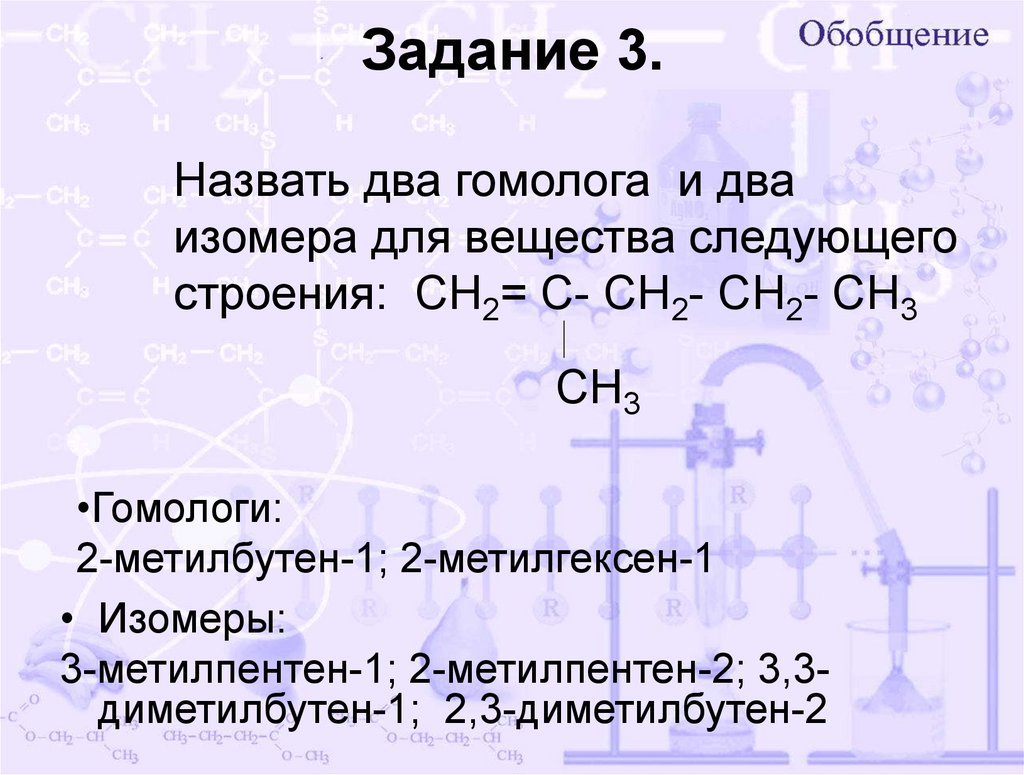
10. Назвать два гомолога и два изомера для вещества следующего строения: СН2= С- СН2- СН2- СН3 СН3
Задание 3.Назвать два гомолога и два
изомера для вещества следующего
строения: СН2= С- СН2- СН2- СН3
СН3
•Гомологи:
2-метилбутен-1; 2-метилгексен-1
• Изомеры:
3-метилпентен-1; 2-метилпентен-2; 3,3диметилбутен-1; 2,3-диметилбутен-2
11. Задание 4
СН4Задание 4
Черный ящик №1
Этот газ вместе с водородом составлял основу
«светильного газа», который употребляли для
освещения городских улиц в 19 веке в Лондоне
и для бытовых нужд. Что это за газ? Назовите
его основные физические свойства.
12. Задание 5
С2 Н4Задание 5
Черный ящик №2
Немецкий алхимик, врач и изобретатель-фантазер
Иоган-Иохим Бехер в 1666 году проводил опыты с
серной кислотой . В одном из опытов он вместо
добавления к нагретой концентрированной серной
кислоте еще одной ее порции в рассеянности
прилил этанол. Бехер увидел сильное вспенивание
раствора с выделением неизвестного газа,
похожего на метан. В отличие от метана новый газ
горел светящимся пламенем. Новый газ назвали
«маслородным газом». Что это за газ?. Написать
уравнения химических реакций, о которых шла
речь.
13. Задание 6
С2 Н2Задание 6
Черный ящик №3
В 1862г немецкий химик Велер пытался
выделить металлический кальций из
извести(карбоната кальция) путем длительного
прокаливания смеси, состоящей из извести и
угля. Он получил спекшуюся массу сероватого
цвета, в которой признаков металла не
обнаружил. С огорчением Велер выбросил эту
массу как ненужный продукт на свалку во
дворе. Во время дождя лаборант Велера
заметил выделение какого-то газа из
выброшенной каменистой массы. Что это за
газ? Напишите уравнения химических реакций,
приведенных в тексте.
14.
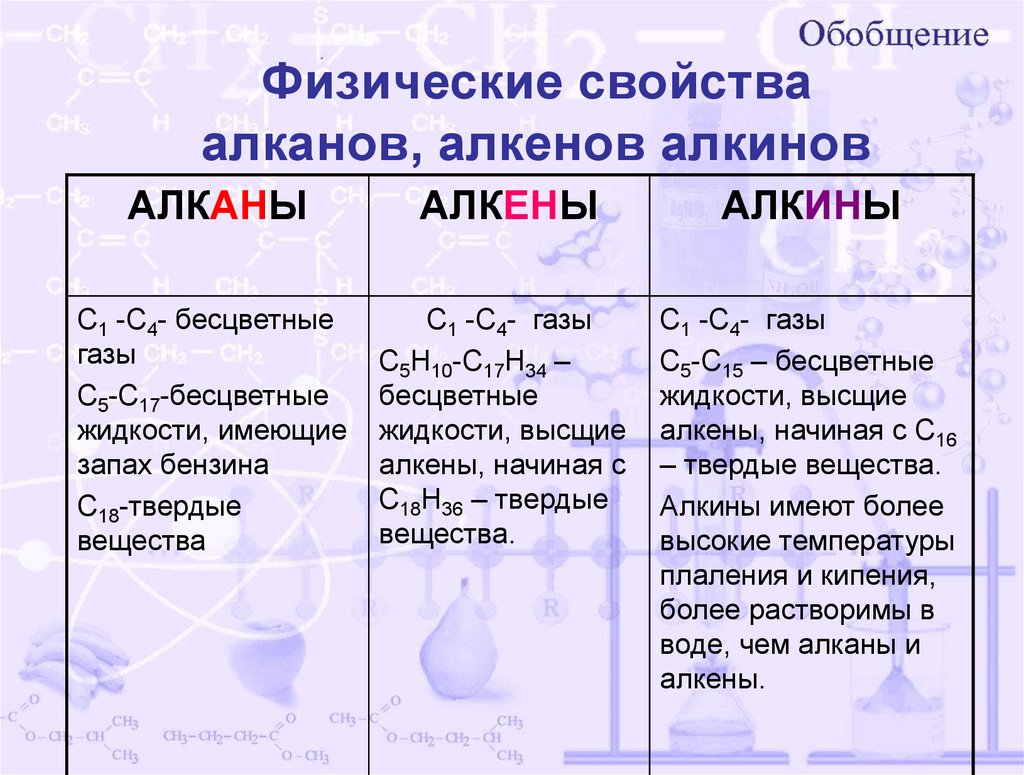
Физические свойстваалканов, алкенов алкинов
АЛКАНЫ
АЛКЕНЫ
АЛКИНЫ
С1 -С4- бесцветные
газы
С5-С17-бесцветные
жидкости, имеющие
запах бензина
С18-твердые
вещества
С1 -С4- газы
С5Н10-С17Н34 –
бесцветные
жидкости, высщие
алкены, начиная с
С18Н36 – твердые
вещества.
С1 -С4- газы
С5-С15 – бесцветные
жидкости, высщие
алкены, начиная с С16
– твердые вещества.
Алкины имеют более
высокие температуры
плаления и кипения,
более растворимы в
воде, чем алканы и
алкены.
15.
ВОПРОСАЛКАНЫ
АЛКЕНЫ
АЛКИНЫ
Общая
формула
Гомологическ
ий ряд
CnH2n+2
CnH2n
CnH2n-2
CH4-метан
C2H6-этан
C3H8-пропан
C2H4-этилен
C3H6 -пропен
C4H8 -бутен
C2H2 -ацетилен
C3H4 -пропин
C4H6 -бутин
Строение
sp3гибридизация
109028
Lc-c = 0,154нм
Тетраэдр
sp2гибридизация
,
120 Lc-c =
0,134нм
Плоский
треугольник
spгибридизаци
я
180
Lc-c =
0,120нм
Линейное
строение
Образование
сигма-связи
Образование
сигма-связи
Образовани
е пи-связи
Образование писвязи
Виды изомерии
СТРУКТУРНАЯ
-углеродного скелета
СН3-СН2-СН2-СН3 н-бутан
СН3-СН-СН3 2-метилпропан
СН3
СТРУКТУРНАЯ
-углеродного скелета
СН2=СН-СН2-СН3 бутен-1
СН2=С-СН3 2-метилпропен-1
СН3
-положение кратной связи
СН2=СН-СН2-СН3 бутен-1; СН3-СН=СН-СН3 бутен-2
-межклассовая
СН2=СН-СН2-СН3
СН2-СН2
СН2-СН2
бутен-1
циклобутан
ПРОСТРАНСТВЕННАЯ
-геометрическая (цис-, транс-изомерия)
СТРУКТУРНАЯ
-углеродного скелета
СН≡С-СН2-СН2-СН3 пентин-1
СН≡С-СН- СН3
3-метилбутин-1
СН3
-положение кратной связи
СН ≡С-СН2 –СН3 Бутин-1
СН3 –С≡С –СН3
Бутин-2
-межклассовая
СН ≡С-СН2 –СН3
Бутин-1
СН2= СН-СН =СН2 Бутадиен-1,3
Физические
свойства
С1-С4-газы
С5-С15-жидкости
Выше С15 –твердые вещества
С1-С4-газы
С5-С17-жидкости
Выше С17 –твердые вещества
С1-С4-газы
С5-С15-жидкости
Выше С15 –твердые вещества
16.
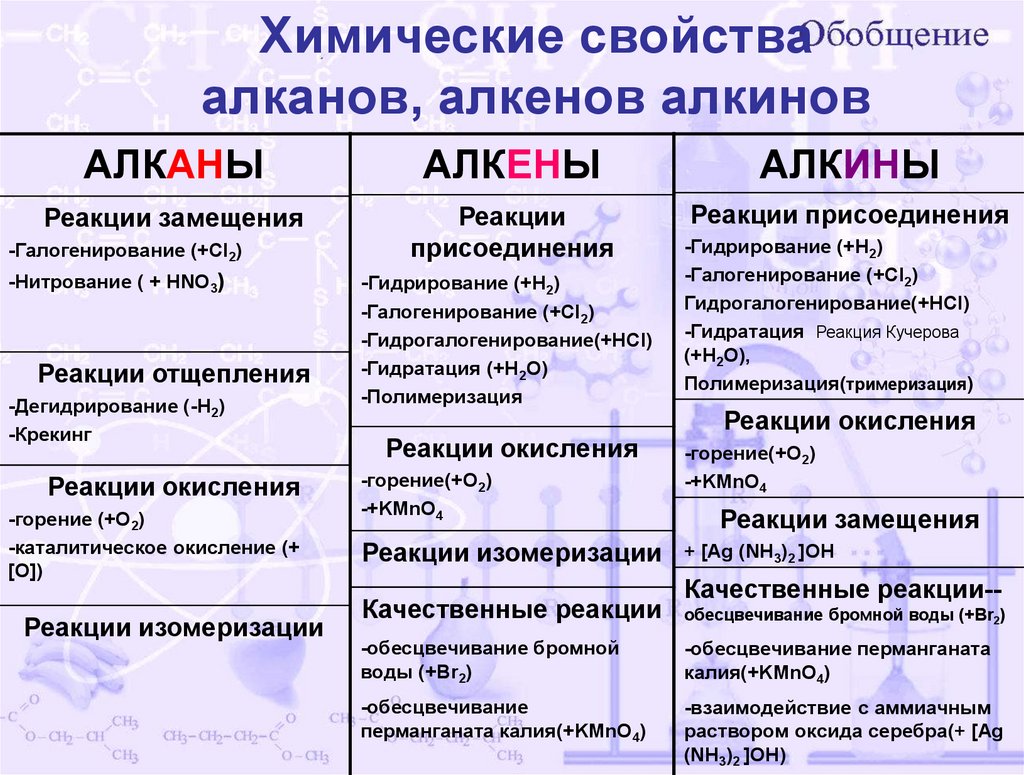
Химические свойстваалканов, алкенов алкинов
АЛКАНЫ
АЛКЕНЫ
АЛКИНЫ
Реакции замещения
Реакции
присоединения
Реакции присоединения
-Галогенирование (+Cl2)
-Нитрование ( + НNO3)
Реакции отщепления
-Дегидрирование (-Н2)
-Крекинг
Реакции окисления
-горение (+O2)
-каталитическое окисление (+
[O])
Реакции изомеризации
-Гидрирование (+H2)
-Галогенирование (+Cl2)
-Гидрогалогенирование(+HCl)
-Гидратация (+H2O)
-Полимеризация
Реакции окисления
-горение(+O2)
-+KMnO4
Реакции изомеризации
Качественные реакции
-Гидрирование (+H2)
-Галогенирование (+Cl2)
Гидрогалогенирование(+HCl)
-Гидратация Реакция Кучерова
(+H2O),
Полимеризация(тримеризация)
Реакции окисления
-горение(+O2)
-+KMnO4
Реакции замещения
+ [Ag (NH3)2 ]OH
Качественные реакции-обесцвечивание бромной воды (+Br2)
-обесцвечивание бромной
воды (+Br2)
-обесцвечивание перманганата
калия(+KMnO4)
-обесцвечивание
перманганата калия(+KMnO4)
-взаимодействие с аммиачным
раствором оксида серебра(+ [Ag
(NH3)2 ]OH)
17. Задание 7
Видео 1Видео 2
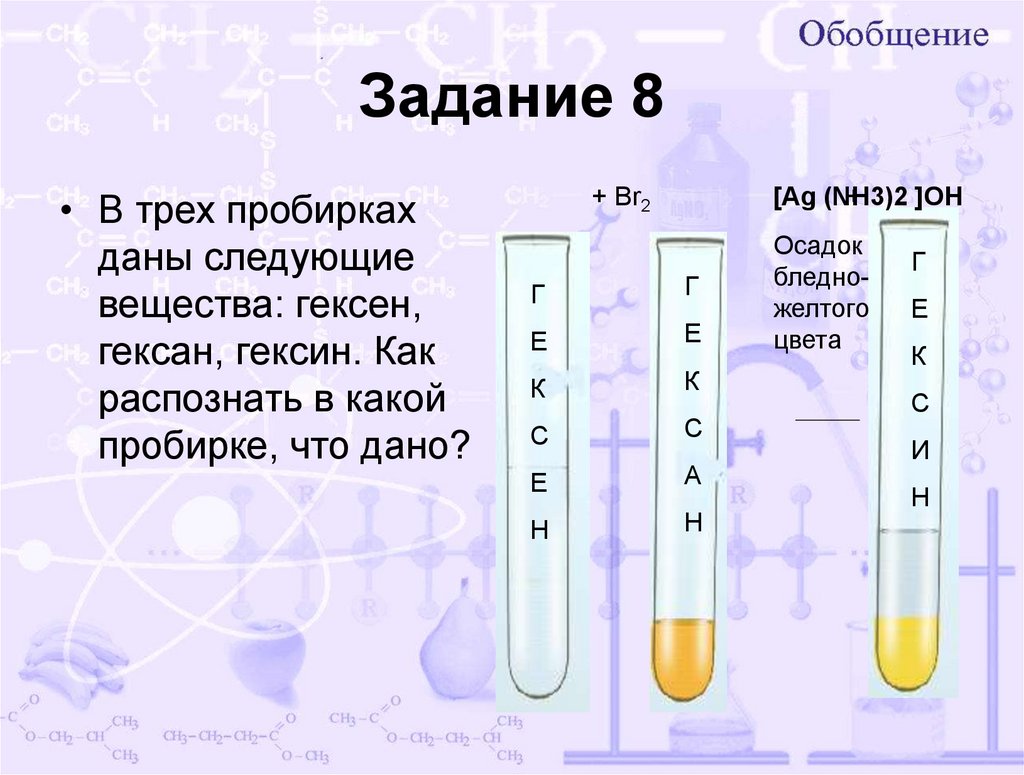
18. Задание 8
• В трех пробиркахданы следующие
вещества: гексен,
гексан, гексин. Как
распознать в какой
пробирке, что дано?
+ Br2
[Ag (NH3)2
+
]OH
Г
Г
Е
Е
К
К
С
С
Е
А
Н
Н
Осадок
бледножелтого
цвета
Г
Е
К
С
И
Н
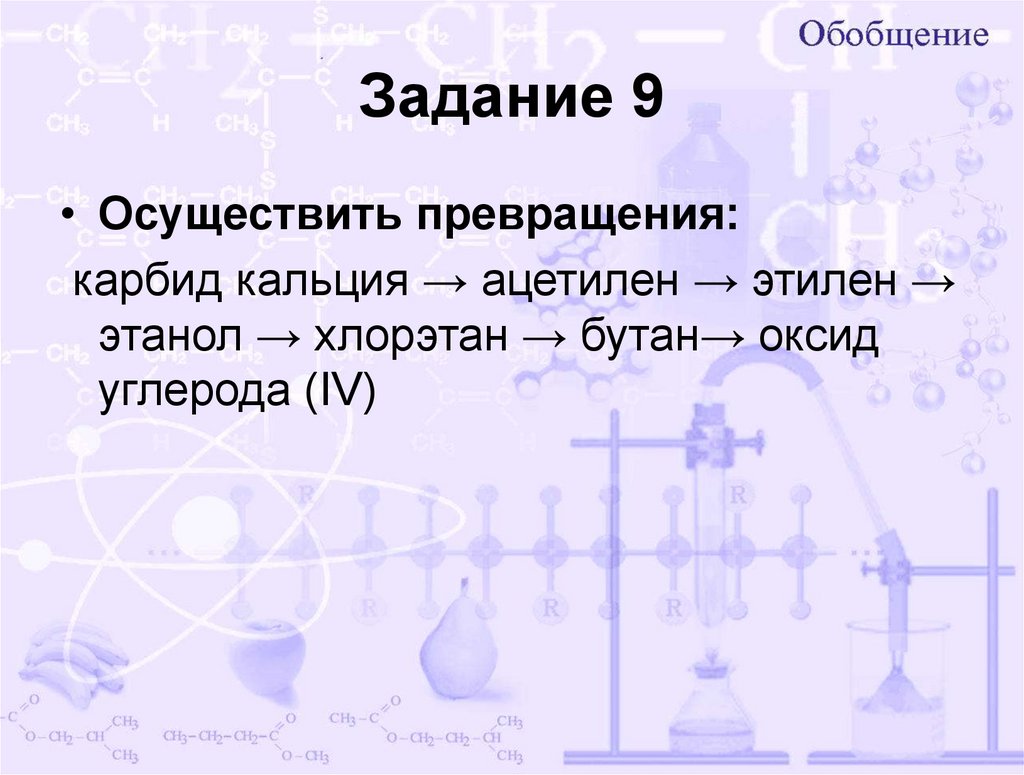
19. Задание 9
• Осуществить превращения:карбид кальция → ацетилен → этилен →
этанол → хлорэтан → бутан→ оксид
углерода (IV)
20.
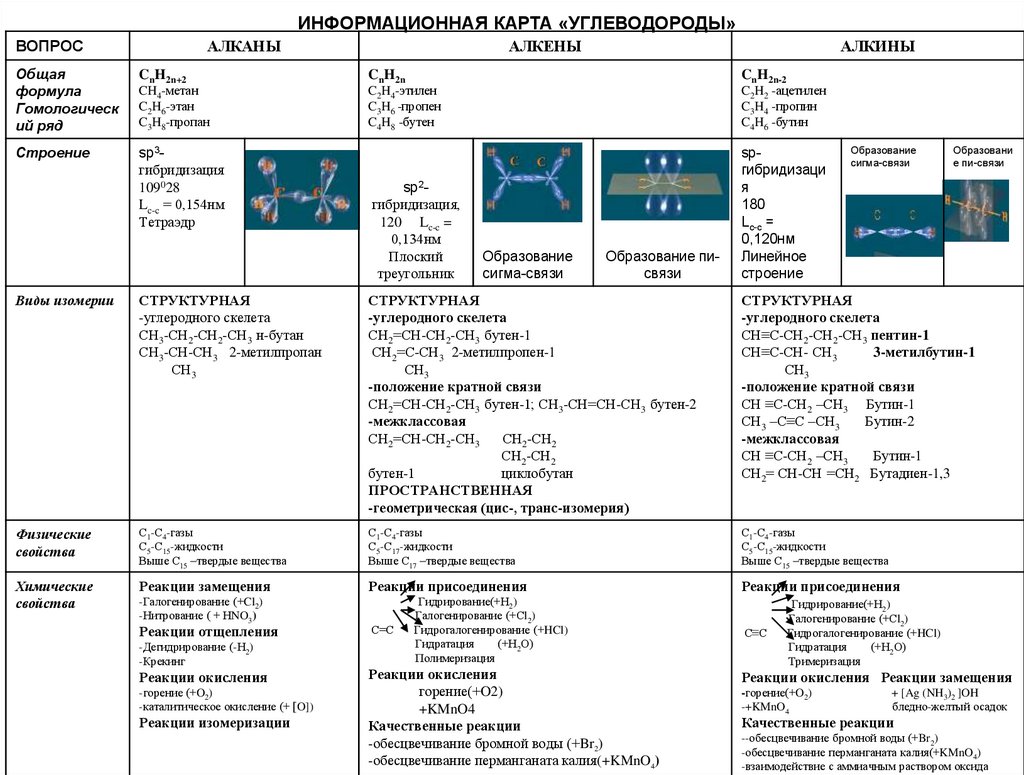
ИНФОРМАЦИОННАЯ КАРТА «УГЛЕВОДОРОДЫ»ВОПРОС
АЛКАНЫ
АЛКЕНЫ
АЛКИНЫ
Общая
формула
Гомологическ
ий ряд
CnH2n+2
CnH2n
CnH2n-2
CH4-метан
C2H6-этан
C3H8-пропан
C2H4-этилен
C3H6 -пропен
C4H8 -бутен
C2H2 -ацетилен
C3H4 -пропин
C4H6 -бутин
Строение
sp3гибридизация
109028
Lc-c = 0,154нм
Тетраэдр
sp2гибридизация,
120 Lc-c =
0,134нм
Плоский
треугольник
spгибридизаци
я
180
Lc-c =
0,120нм
Линейное
строение
Образование
сигма-связи
Образование писвязи
Образование
сигма-связи
Образовани
е пи-связи
Виды изомерии
СТРУКТУРНАЯ
-углеродного скелета
СН3-СН2-СН2-СН3 н-бутан
СН3-СН-СН3 2-метилпропан
СН3
СТРУКТУРНАЯ
-углеродного скелета
СН2=СН-СН2-СН3 бутен-1
СН2=С-СН3 2-метилпропен-1
СН3
-положение кратной связи
СН2=СН-СН2-СН3 бутен-1; СН3-СН=СН-СН3 бутен-2
-межклассовая
СН2=СН-СН2-СН3
СН2-СН2
СН2-СН2
бутен-1
циклобутан
ПРОСТРАНСТВЕННАЯ
-геометрическая (цис-, транс-изомерия)
СТРУКТУРНАЯ
-углеродного скелета
СН≡С-СН2-СН2-СН3 пентин-1
СН≡С-СН- СН3
3-метилбутин-1
СН3
-положение кратной связи
СН ≡С-СН2 –СН3 Бутин-1
СН3 –С≡С –СН3
Бутин-2
-межклассовая
СН ≡С-СН2 –СН3
Бутин-1
СН2= СН-СН =СН2 Бутадиен-1,3
Физические
свойства
С1-С4-газы
С5-С15-жидкости
Выше С15 –твердые вещества
С1-С4-газы
С5-С17-жидкости
Выше С17 –твердые вещества
С1-С4-газы
С5-С15-жидкости
Выше С15 –твердые вещества
Химические
свойства
Реакции замещения
Реакции присоединения
Реакции присоединения
-Галогенирование (+Cl2)
-Нитрование ( + НNO3)
Реакции отщепления
-Дегидрирование (-Н2)
-Крекинг
Реакции окисления
-горение (+O2)
-каталитическое окисление (+ [O])
Реакции изомеризации
С=С
Гидрирование(+Н2)
Галогенирование (+Сl2)
Гидрогалогенирование (+HCl)
Гидратация
(+Н2О)
Полимеризация
Реакции окисления
горение(+O2)
+KMnO4
Качественные реакции
-обесцвечивание бромной воды (+Br2)
-обесцвечивание перманганата калия(+KMnO4)
С≡С
Гидрирование(+Н2)
Галогенирование (+Сl2)
Гидрогалогенирование (+HCl)
Гидратация
(+Н2О)
Тримеризация
Реакции окисления Реакции замещения
-горение(+O2)
-+KMnO4
+ [Ag (NH3)2 ]OH
бледно-желтый осадок
Качественные реакции
--обесцвечивание бромной воды (+Br2)
-обесцвечивание перманганата калия(+KMnO4)
-взаимодействие с аммиачным раствором оксида
21.
Ресурсы1. О.С.Габриелян «Оганическая химия-10 класс»
1. И.И.Новошинский , Н. С.Новошинская
«Органическая химия-11 класс»
2. И.И.Новошинский, Н.С.Новошинская «Типы
химических задача и способы их решения»
3. В.И.Резяпкин «750 задач по химии»
4. А.М.Радецкий, В.П.Горшкова «Дидактические
материалы по химии, 10-11 класс»
5. СD-диск «Виртуальная лаборатория, 9 класс»






 Химия
Химия








