Похожие презентации:
Периодическая система химических элементов Д.И. Менделеева
1.
Периодическая система химическихэлементов Д.И. Менделеева
2.
Железо-никелевые метеориты3.
4,65%распространённость
железа в земной коре
Железо составляет
большую часть земного
ядра.
4.
5.
Fe6.
7.
Железо — это простое вещество, металл,серебристо-белого цвета; его плотность
7,87 г/см3, температура плавления 1539 °C.
Обладает хорошей пластичностью, легко
куётся и прокатывается в тонкие листы или
проволоку.
Alchemist-hp
8.
9.
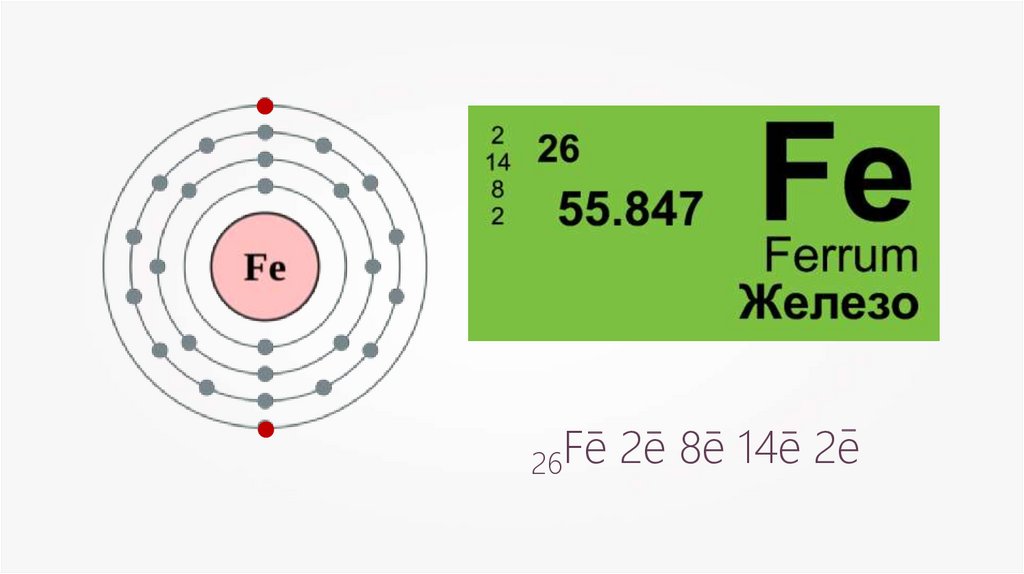
–26Fe
–
–
–
–
2e 8e 14e 2e
10.
Опты №13Fe + 2O2 = Fe3O4 + Q
11.
2Fe + 3Cl2 = 2FeCl3При взаимодействии железа с галогенами
(кроме йода) оно образует галогениды.
12.
Fe + S = FeSПри нагревании смеси железных опилок и
порошка серы образуется сульфид железа (II).
13.
Li, K, Ba, Ca, Na, Mg, Al, Mn, Zn, Cr, Fe, Co, Sn, Pb, H, Cu, Hg, Ag, AuЖелезо растворяется в разбавленной серной и соляной кислотах,
вытесняя из них водород и образуя соответствующую соль.
Fe + 2HCl = FeCl2 + H2↑
14.
+20
+2
0
Fe + CuSO4(р-р) = FeSO4(р-р) + Cu
2e–
Железо восстанавливает из водных растворов солей
металлы, расположенные правее в электрохимическом
ряду напряжений. Если в реакцию с железом вступает соль
свинца или меди, то образуются соединения железа (II).
15.
+10
+1
0
3AgNO3 + Fe = Fe(NO3)3 + 3Ag
При восстановлении железом еще менее
активных металлов, например, серебра из соли
серебра, железо переходит в соединение, в
котором оно проявляет степень окисления +3.
16.
Свойства оксидов2Fe(OH)3 + 3H2SO4 → Fe2(SO4)3 + 6H2O
Оксид железа(II) FeO обладает основными свойствами, ему отвечает
основание Fe(OH)2. Оксид железа(III) Fe2O3 слабо амфотерен, ему
отвечает ещё более слабое, чем Fe(OH)2, основание Fe(OH)3,
которое реагирует с кислотами.
17.
Свойства оксидовFe(OH)3 + 3КОН → K3[Fe(OH)6]
Гидроксид железа(III) Fe(OH)3 проявляет слабо амфотерные
свойства, он способен реагировать только с концентрированными
растворами щелочей.
18.
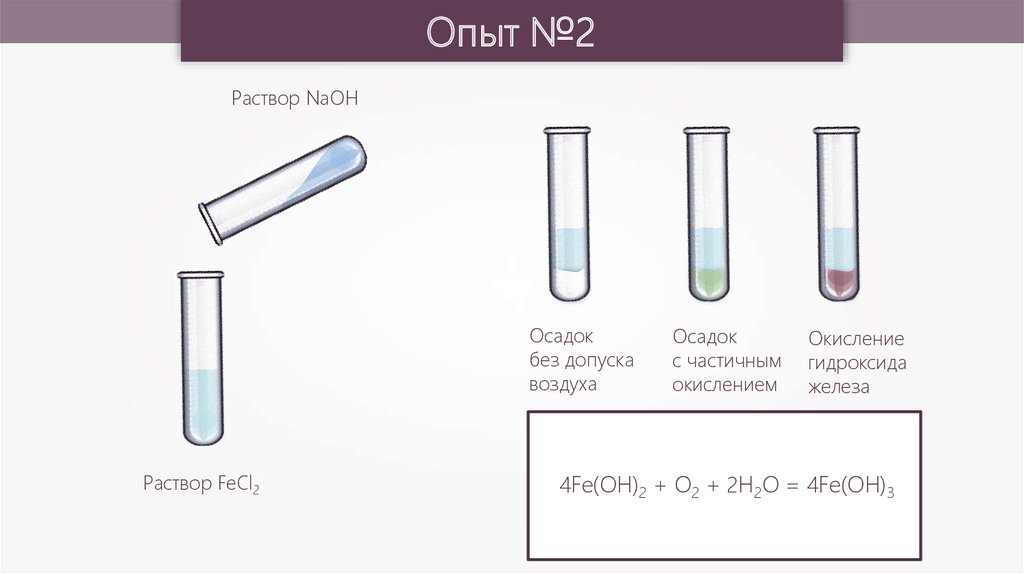
Опыт №2Раствор NaOH
Осадок
без допуска
воздуха
Раствор FeCl2
Осадок
с частичным
окислением
Окисление
гидроксида
железа
4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3
19.
ЖелезоAlchemist-hp
20.
Железо в промышленностиNorbert Kaiser
Красный железняк
Красный железняк
21.
По запасу железных руд Россиязанимает первое место в мире.
Они залегают на Урале,
в Курской области.
22.
23.
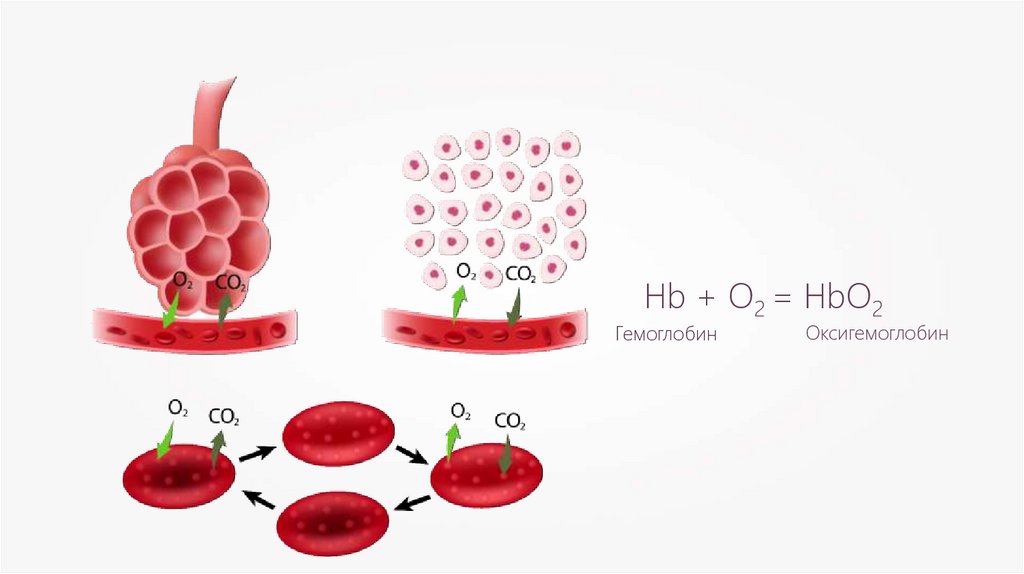
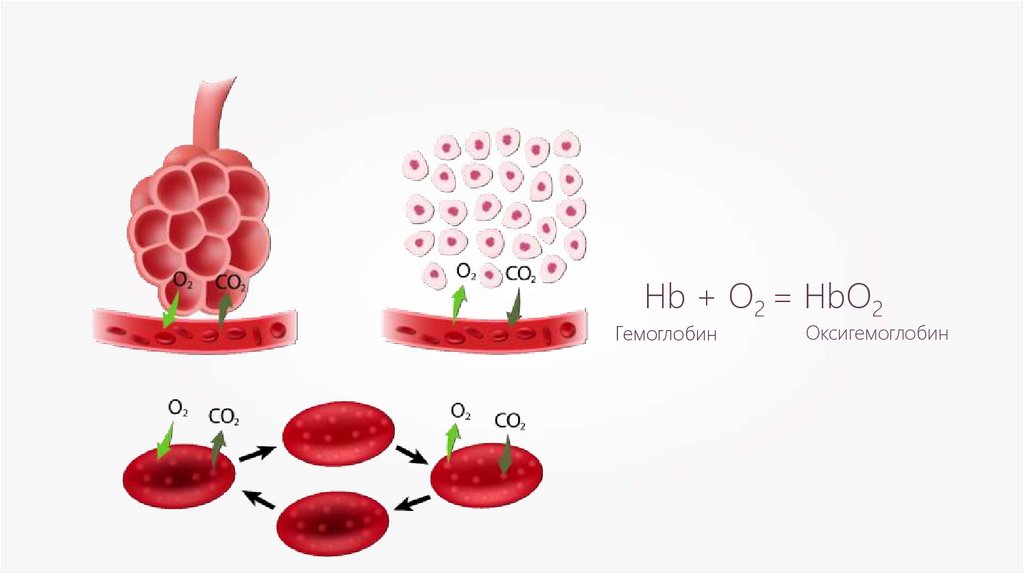
Hb + O2 = HbO2Гемоглобин
Оксигемоглобин
24.
25.
ЖелезоЧугуны
Стали
26.
Железные сплавыЧугун
Сталь
27.
В чугуне содержится углеродабольше, чем железо может удержать
его при затвердевании в виде
твердого раствора. Избыточный
углерод может при затвердевании
расплавленного чугуна выделяться
в виде пластинчатых кристаллов
графита.
28.
Особенность чугуна: призатвердевании он не
сжимается, как большинство
металлов, а расширяется.
Поэтому чугун можно
использовать для
изготовления деталей сложной
конфигурации литьем.
29.
Решётка Летнего Сада30.
Сталь31.
Свойства стали в закаленномсостоянии зависят от массовой
доли в ней углерода: чем
больше в стали углерода, тем
она твёрже.
32.
33.
Легированная сталь34.
35.
Быстрорежущая сталь36.
Нержавеющая сталь37.
Нержавеющие стали широкоприменяют в химической,
машиностроительной, пищевой
отраслях промышленности.
В быт нержавеющая сталь вошла в
виде вилок, ножей и других предметов
домашнего обихода.
38.
Арки станции метро «Маяковская»московского метрополитена
Eugeny1988
39.
Содержание железау взрослого человека: 2–5 г.
Содержание железа
у взрослого человека: 300–400 мг.
40.
41.
Hb + O2 = HbO2Гемоглобин
Оксигемоглобин
42.
Железо выполняет множествоважнейших функций, основная
из которых — поддержание
постоянного уровня гемоглобина
в крови.







































 Химия
Химия








