Похожие презентации:
Химическая связь
1.
2.
Известно, что вещества состоят измолекул , а молекулы из атомов.
Чтобы атомы оставались вместе,
образуя молекулу, их должна
удерживать сила. Эту силу назвали
химической связью.
которая
Химическая
связь
- это сила,
А способность
элемента
образовывать
удерживает
атомы
в молекуле.
ллллллллллллллллллллллллллллллллл
определенное
количество
связей назвали
ллллллллллллллллллллллллллллллллл
валентностью.
3.
Валентность химического элемента свойство его атомов присоединять определенное число атомов других элементовHCl
H2 O
H3 N
H4 C
4.
Определитевалентность
натрия, бора,
Как
же можно
узнать валентность
элемента?
углерода, кислорода, хлора, кальция,
алюминия,
серы,
фосфора,Менделеева!
магния и азота
Очень
просто!
Из таблицы
Валентность элемента совпадает с номером группы
5.
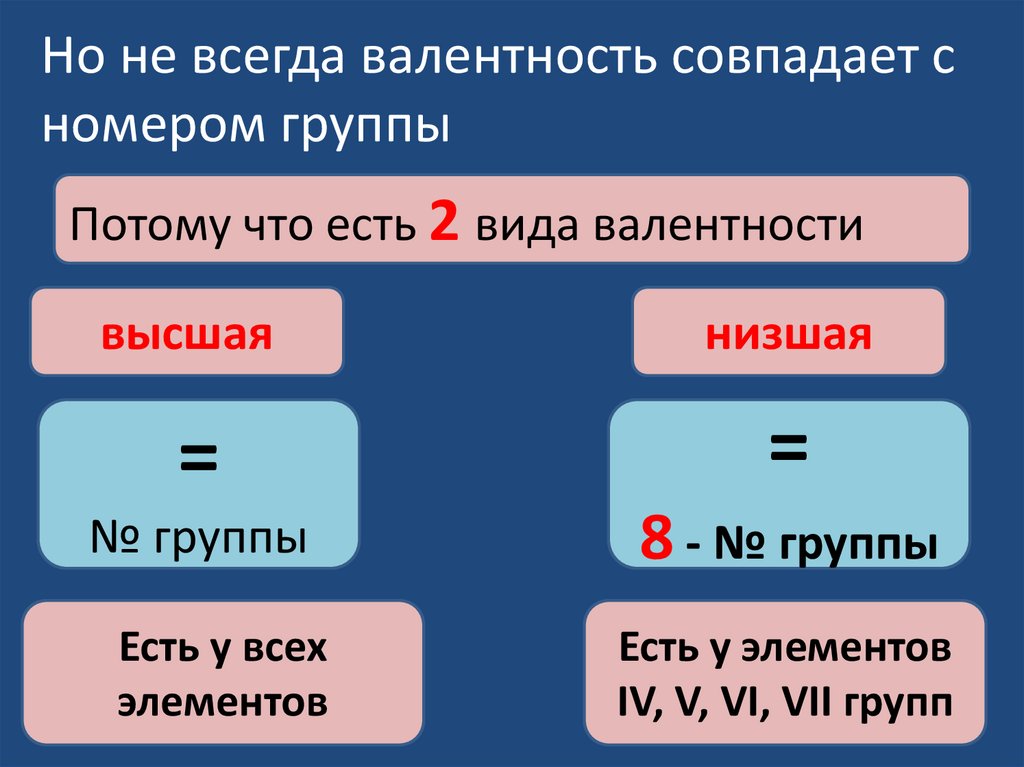
Но не всегда валентность совпадает сномером группы
Потому что есть 2 вида валентности
высшая
низшая
=
=
№ группы
8 - № группы
Есть у всех
элементов
Есть у элементов
IV, V, VI, VII групп
6.
валентностьвысшая
=
№ группы
Есть у всех
элементов
низшая
=
8 - № группы
Есть у элементов
IV, V, VI, VII групп
7.
Как узнать, когда элемент обладаетвысшей валентностью, а когда
низшей?
Для этого вводят еще одно свойство
атомов – электроотрицательность.
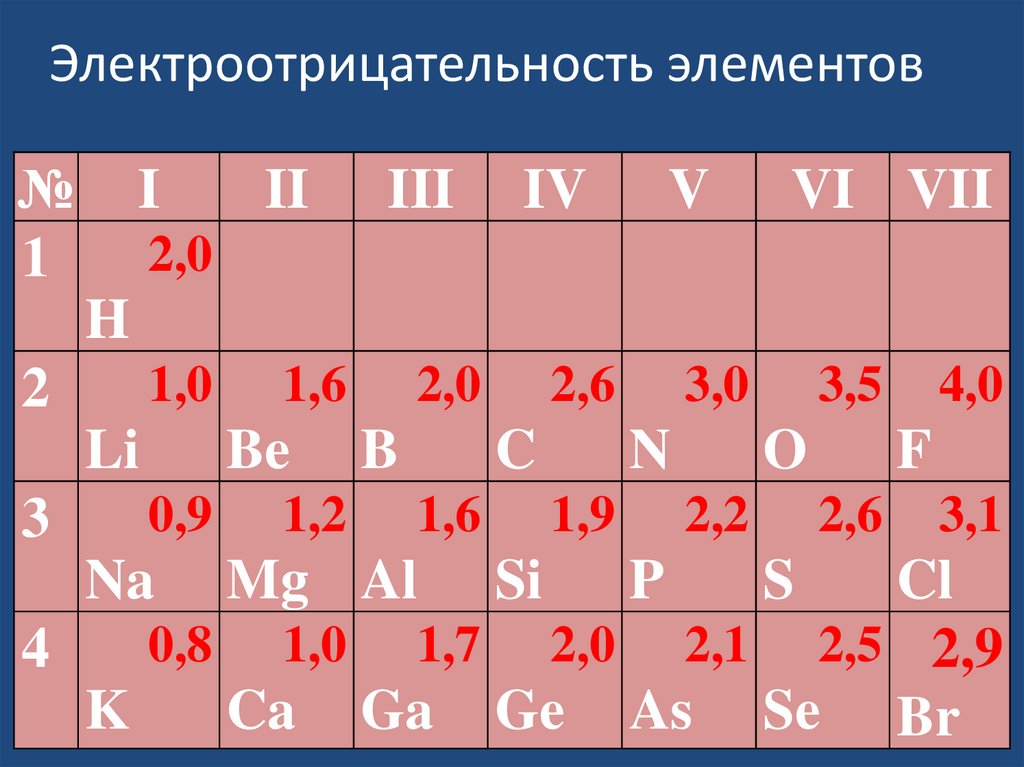
Значения электроотрицательности
атомов элементов мы будем брать из
таблицы
8.
Электроотрицательность элементов№
1
I
II
III
IV
V
VI VII
2,0
H
1,0
2
Li
3
1,6
Be
0,9
Na
1,2
2,0
B
2,6
C
1,6
Mg Al
3,0
N
1,9
Si
3,5
O
2,2
P
F
2,6
S
4,0
3,1
Cl
0,8 1,0 1,7 2,0 2,1 2,5 2,9
4
K
Ca Ga Ge As Se Br
9.
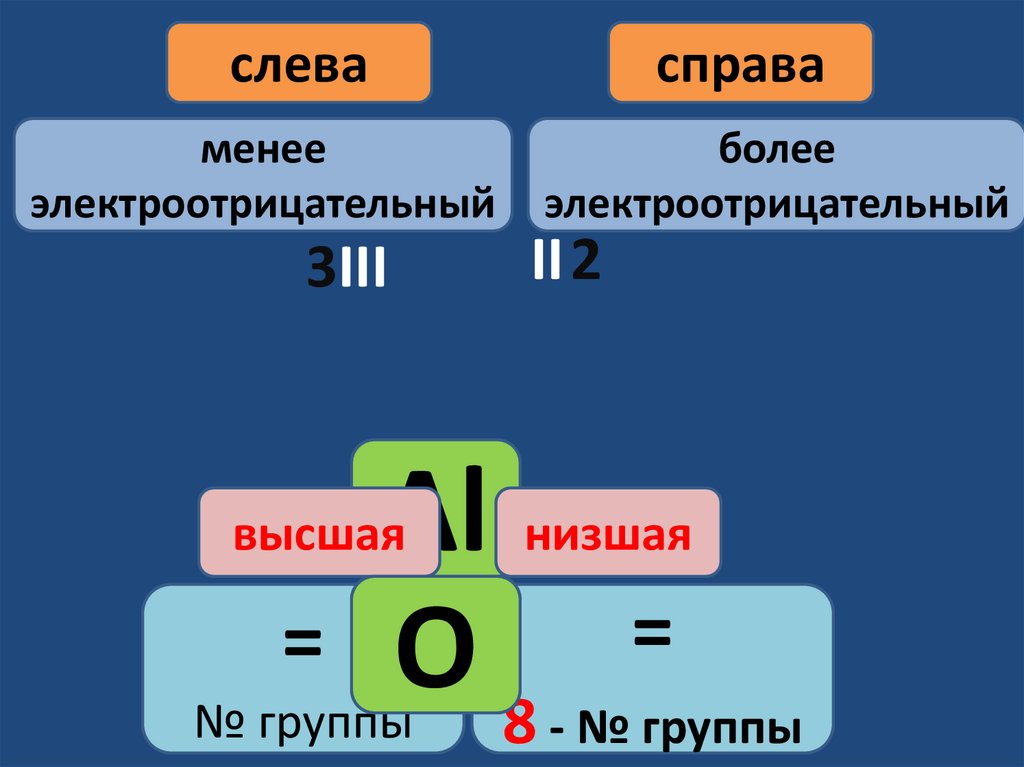
При составлении формул элемент сбольшей электро-отрицательностью
надо записывать справа, а с
меньшей - слева
Т.е справа записывают элемент,
который имеет низшую валентность, а
слева - высшую
10.
1.Рядом записываем знакихимических элементов.
2.Определяем валентность элементов:
У элемента,
который
записан
слева – она
высшая и
=№ группы
4. Считаем индексы:
У элемента,
который
записан справа
– она низшая и
=8 - № группы
11.
слеваменее
электроотрицательный
3III
справа
более
электроотрицательный
II 2
Аl низшая
=
= O
№ группы
8 - № группы
высшая
12.
IVII
2
13.
IIIII
2
3
14.
Составить формулысоединений с
кислородом
Na2O
1. Натрия
следующих элементов
MgO
2. Магния
3. Алюминия
Al2O3
SiO2
4. Кремния
P2O5
5. Фосфора
SO3
6. Серы
Cl2O7
7. Хлора
15.
Составить формулысоединений с хлором
следующих элементов
1. Натрия
2. Магния
3. Алюминия
4. Кремния
5. Фосфора
6. Серы
NaCl
MgCl2
AlCl3
SiCl4
PCl5
SCl6
16.
Составить формулысоединений с
азотом следующих
Na3N
Натрия элементов
1.
2. Магния
3. Алюминия
4. Кремния
5. Фосфора
6. Серы
7. Хлора
Mg3N2
Al N
Si3N4
P3N5
SN2
NCl5
17.
Составить формулысоединений с
углеродом
Na
С
1. Натрия
4
следующих элементов
Mg2С
2. Магния
3. Алюминия
Al4С3
Si С
4. Кремния
P4С5
5. Фосфора
S2С3
6. Серы
С Cl4
7. Хлора
18.
Составить формулысоединений с
кислородом
Оксид кальция
СaO
Кальция
следующих элементов
Оксид бора
В2 O 3
Бора
1.
2.
К2O
3. Калия
ZnO
4. Цинка
CO2
5. Углерода
6. Железа (II) FeO
7. Железа (III) Fe2O3
Оксид калия
Оксид цинка
Оксид углерода
Оксид железа (II)
Оксид железа (III)
19.
Составить формулысоединений, образованных:
Н 2O
кислородом и водородом
1.
2. водородом и магнием
3. Алюминием и фосфором
4. Фосфором и водородом
5. Цинком и азотом
6. Азотом и калием
7. Кислородом и бором
MgН2
Al Р
Н3Р
Zn3N2
К3N
B2O3
20.
Составить формулысоединений, образованных:
Н 2S
Серой и водородом
1.
2. Серой и кислородом
3. Серой и кальцием
4. Серой и натрием
5. Железом (II) и серой
6. Железом (III) и серой
7. Водородом и азотом
SO3
CaS
Na2S
FeS
Fe2S3
H 3N

















 Химия
Химия








