Похожие презентации:
Классификация неорганических веществ кислоты
1.
КЛАССИФИКАЦИЯНЕОРГАНИЧЕСКИХ ВЕЩЕСТВ
КИСЛОТЫ
Учитель химии МАОУ Лицей №1
Солоха Н.В.
2.
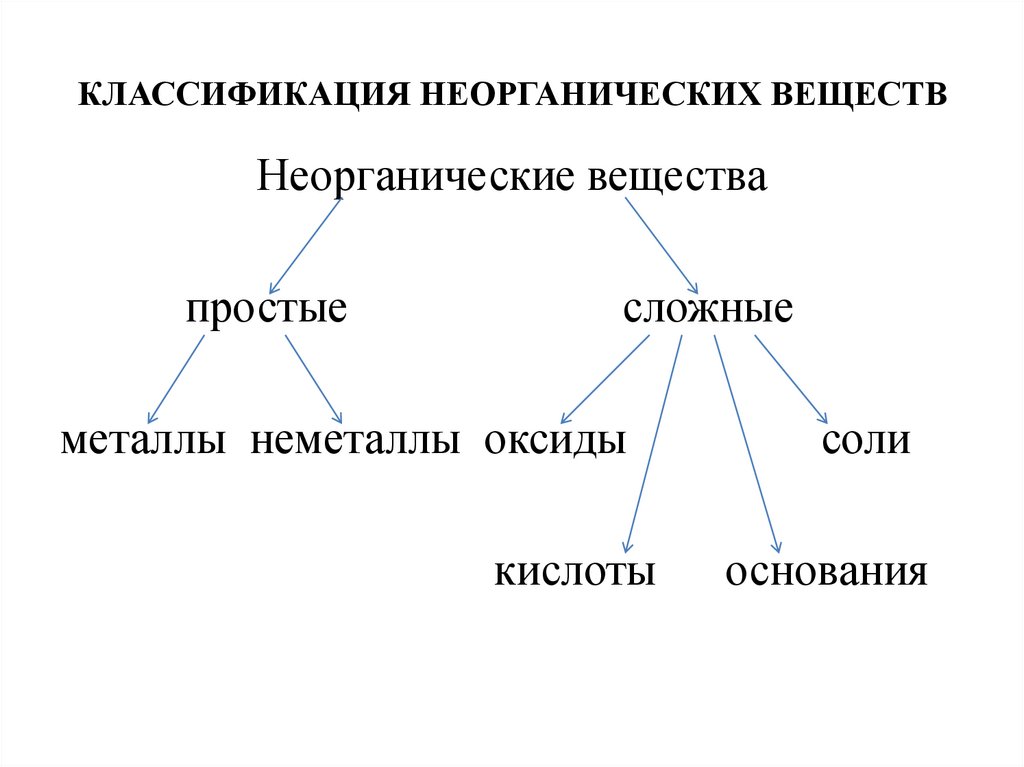
КЛАССИФИКАЦИЯ НЕОРГАНИЧЕСКИХ ВЕЩЕСТВНеорганические вещества
простые
сложные
металлы неметаллы оксиды
соли
кислоты
основания
3.
КИСЛОТЫКислоты – сложные вещества, состоящие из
атомов водорода и кислотного остатка.
HF, HCl, HBr, HI, H2S, H2SO4, H2SO3,
HClO4 , H2SiO3 , HNO2 , HNO3, H3PO4 , HClO,
H2Cr2O7, H2CO3.
Кислотный остаток – это всё в молекуле
кислоты, кроме атомов водорода.
HF, HCl,
HBr,
HI, H2S,
H2SO4, H2SO3,
H2SiO3 , HNO2 , HNO3, H3PO4 , H2Cr2O7, H2CO3.
Валентность кислотного остатка равна количеству
атомов водорода в молекуле кислоты.
4.
Классификация кислотКислоты – сложные вещества, состоящие из
атомов водорода и кислотного остатка.
Кислоты (по содержанию кислорода)
бескислородные
HCl, HBr , H2S
кислородосодержащие
H2SO4, HNO3 , H3PO4
5.
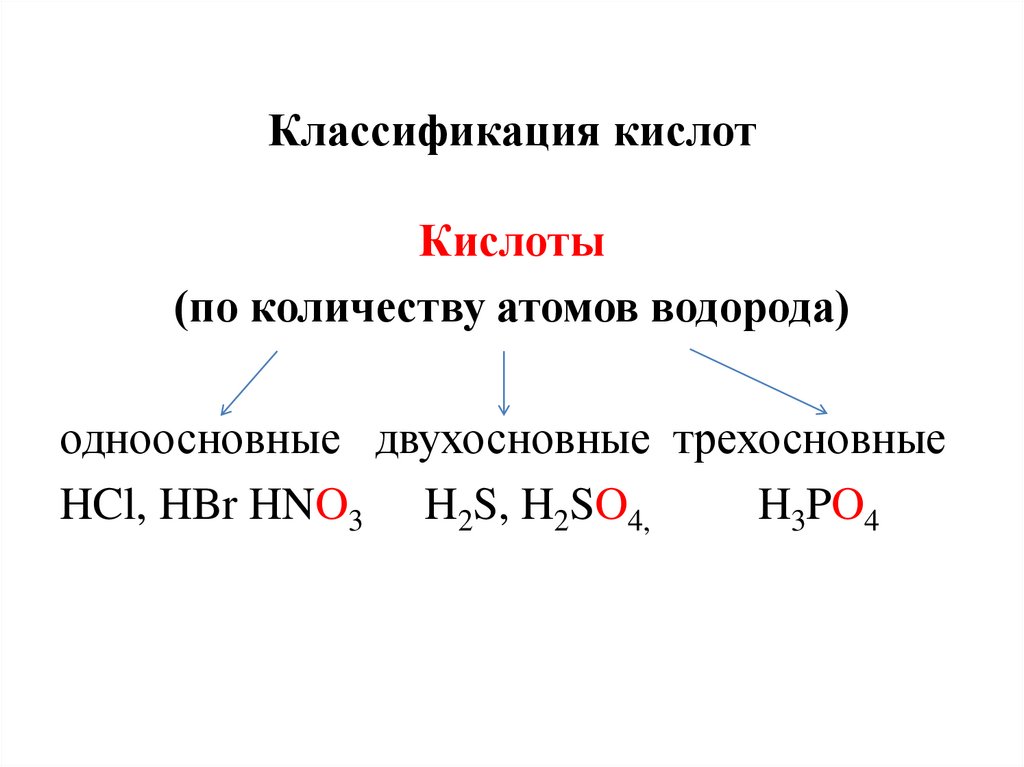
Классификация кислотКислоты
(по количеству атомов водорода)
одноосновные двухосновные трехосновные
HCl, HBr HNO3 H2S, H2SO4,
H3PO4
6.
Неустойчивые кислоты:• угольная кислота - H2CO3
• кремниевая кислота - H2SiO3
• сернистая кислота - H2SO3
7.
Формулы и названия кислот№
Название кислоты
Формула
Кислотный
остаток
Валентность кислотн.
остатка
Название солей
1
Хлороводородная (соляная)
кислота
HCl
Cl
I
хлорид
2
Бромоводородная кислота
HBr
Br
I
бромид
3
Фтороводородная кислота
HF
F
I
фторид
4
Иодоводородная кислота
HI
I
I
иодид
5
Сероводородная кислота
H2S
S
II
cульфид
6
Серная кислота
Н2SO4
SO4
II
cульфат
7
Сернистая кислота
H2SO3
SO3
II
cульфит
8
Угольная кислота
H2CO3
CO3
II
карбонат
9
Кремниевая кислота
H2SiO3
SiO3
II
силикат
10
Азотная кислота
HNO3
NO3
I
нитрат
11
Азотистая кислота
HNO2
NO2
I
нитрит
12
Ортофосфорная кислота
H3PO4
PO4
III
ортофосфат
8.
Физические свойства кислот:• кислоты могут быть жидкими ( H2SO4 , HNO3 ),
твердыми (H3PO4, H3BO3 ) ;
• большинство кислот образуют бесцветные
растворы;
• некоторые кислоты обладают характерными
запахами;
• большинство кислот хорошо растворимы в воде;
• имеют кислый вкус;
• вызывают ожоги;
• разрушают бумагу, ткани.
9.
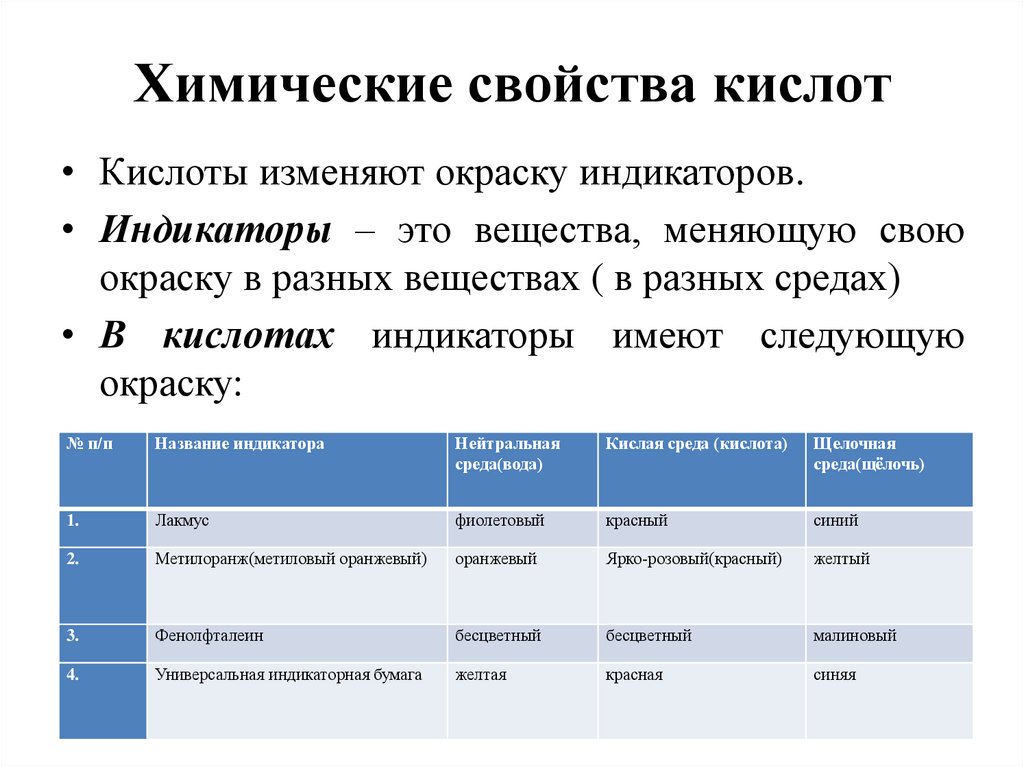
Химические свойства кислот• Кислоты изменяют окраску индикаторов.
• Индикаторы – это вещества, меняющую свою
окраску в разных веществах ( в разных средах)
• В кислотах индикаторы имеют следующую
окраску:
№ п/п
Название индикатора
Нейтральная
среда(вода)
Кислая среда (кислота)
Щелочная
среда(щёлочь)
1.
Лакмус
фиолетовый
красный
синий
2.
Метилоранж(метиловый оранжевый)
оранжевый
Ярко-розовый(красный)
желтый
3.
Фенолфталеин
бесцветный
бесцветный
малиновый
4.
Универсальная индикаторная бумага
желтая
красная
синяя
10.
11.
12.
Выберите строку, в которой расположенытолько кислоты
Mg(NO2)2
PbO2
HCl
H3PO4
H2SO4
Na2S
HNO3
BaCO3
Al4C3
13.
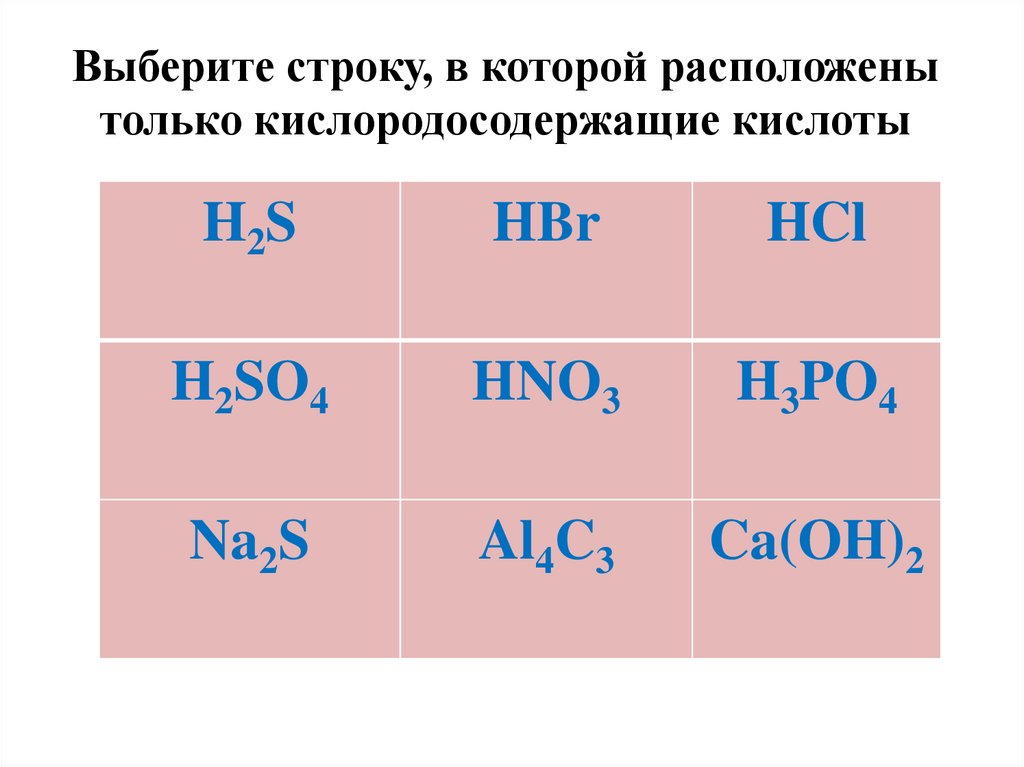
Выберите строку, в которой расположенытолько кислородосодержащие кислоты
H2S
HBr
HCl
H2SO4
HNO3
H3PO4
Na2S
Al4C3
Ca(OH)2
14.
Выберите строку, в которой расположенытолько двухосновные кислоты
H3PO4
H2SO4
HCl
Mg(NO2)2
H2S
Ba3P2
BaCO3
H2CO3
Al2S3
15.
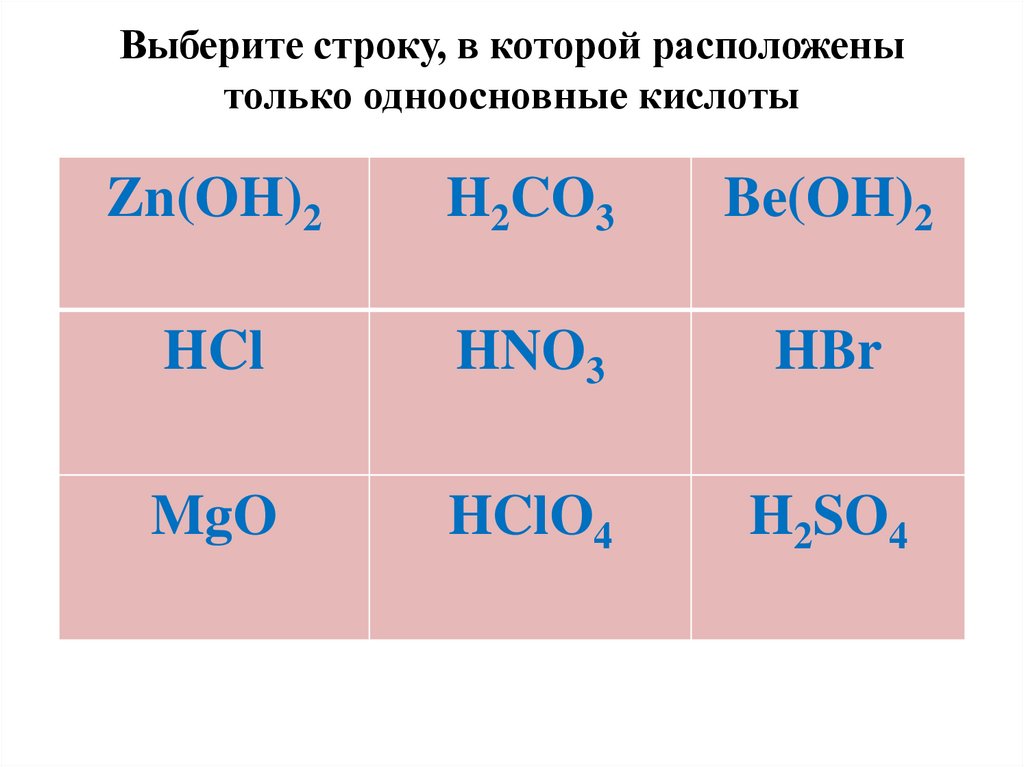
Выберите строку, в которой расположенытолько одноосновные кислоты
Zn(OH)2
H2CO3
Be(OH)2
HCl
HNO3
HBr
MgO
HClO4
H2SO4
16.
Домашнее задание:• Выписать в столбик формулы кислот, подчеркнуть кислотные
остатки, указать их валентность, назвать кислоты
PH3, Cl2O5, LiOН, HClO4, Li3N, H2CrO4, NaBr, HMnO4,
BaSO4, Ca3P2, HgO, KOH, HBr, H2SiO3, BaS, H2SO4,
HNO3, Cu(OH)2, PbO, Mg3P2, НСl, H2СO3, НF.
• Распределить эти кислоты по группам: одноосновные,
двухосновные, трехосновные, кислородосодержащие,
бескислородные.
• ПО ЖЕЛАНИЮ МОЖНО ПОДГОТОВИТЬ ПРЕЗЕНТАЦИЮ
ПО ТЕМЕ «КИСЛОТЫ В ПРИРОДЕ»










 Химия
Химия








