Похожие презентации:
Классификация неорганический веществ
1.
Классификациянеорганический
веществ
2.
ВеществаПростые-
Сложные-
состоят из
атомов одного
химического
элемента.
состоят из
атомов разных
элементов
3.
Простые веществаБлагородные
газы
Неметаллы He,
Металлы
Na,
Fe,
Al,
Zn…
O2,
H2,
Cl2,
S,
P,
C…
Ne,
Ar,
Kr,
Xe,
Rn
4.
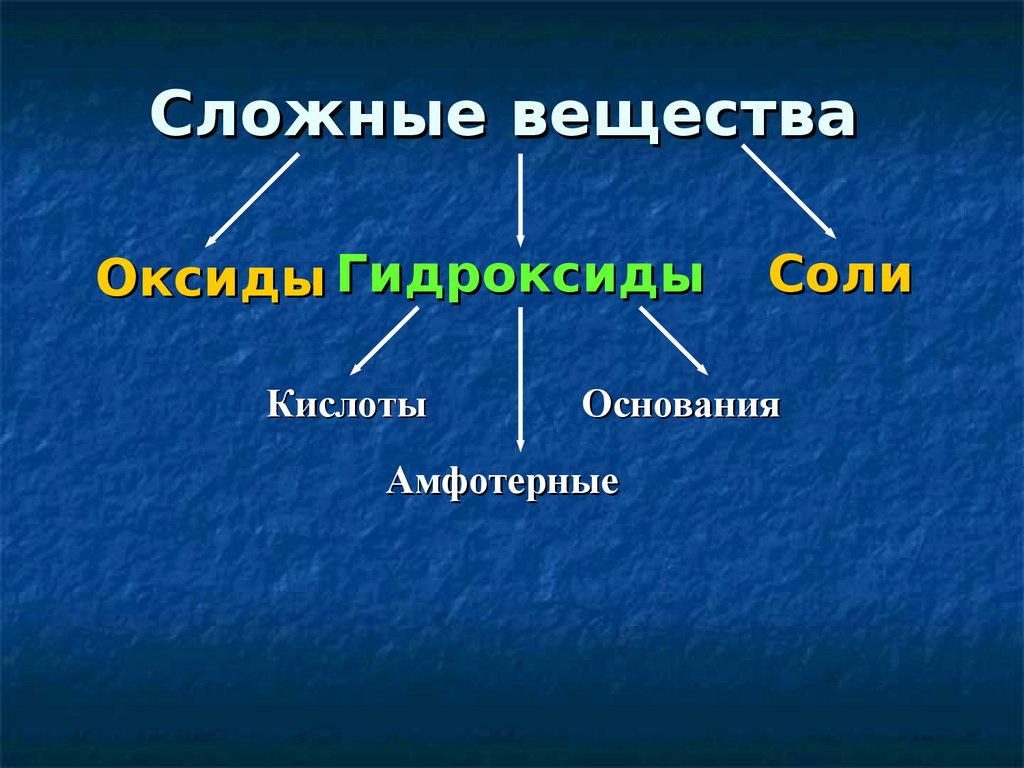
Сложные веществаОксиды Гидроксиды
Кислоты
Соли
Основания
Амфотерные
5.
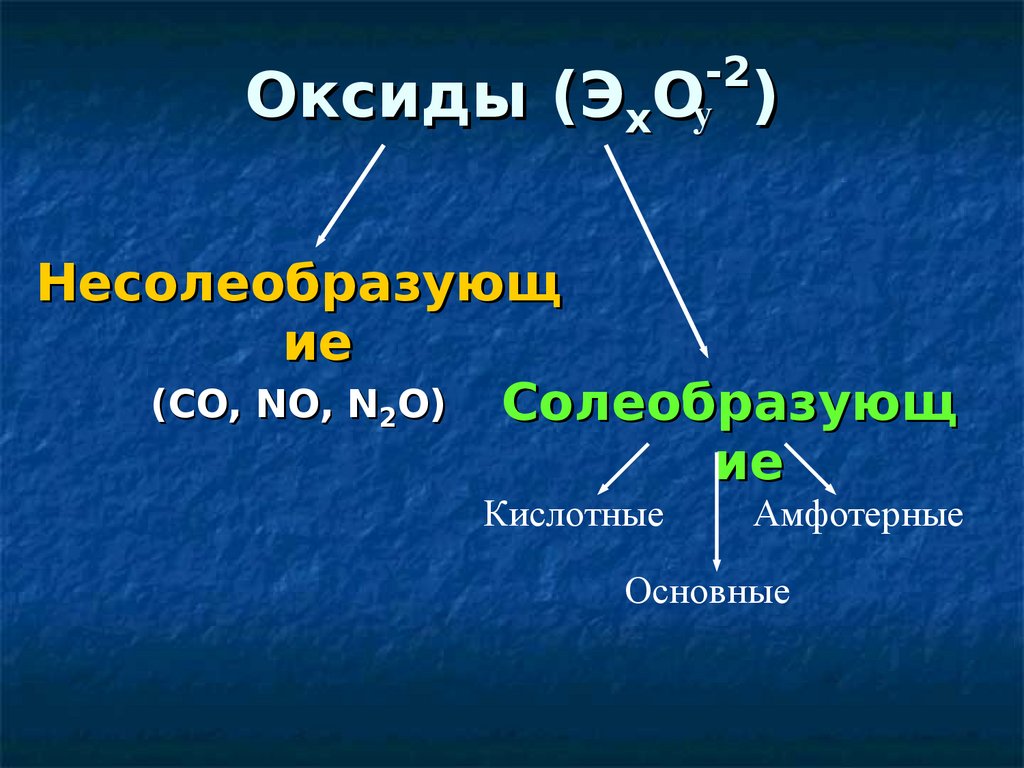
-2Оксиды (ЭхОy )
Несолеобразующ
ие
(СO, NO, N2O) Солеобразующ
ие
Кислотные
Амфотерные
Основные
6.
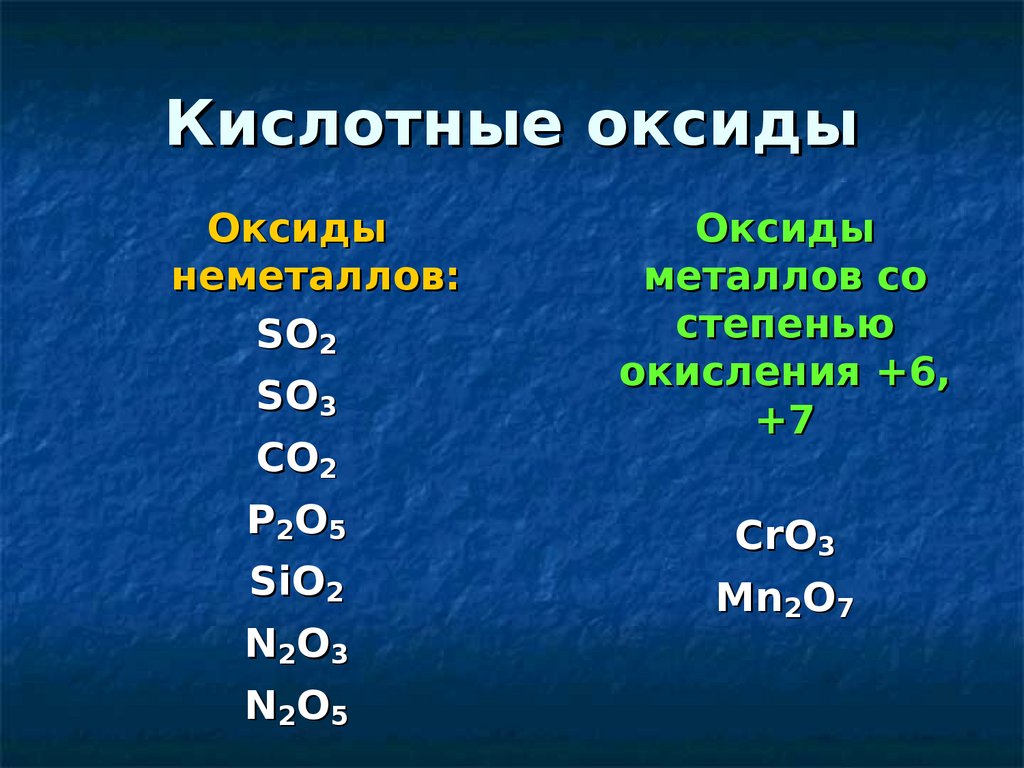
Кислотные оксидыОксиды
неметаллов:
SO2
SO3
CO2
P2O5
SiO2
N2O3
N2O5
Оксиды
металлов со
степенью
окисления +6,
+7
СrO3
Mn2O7
7.
Основные оксиды-оксиды металлов
со степенью окисления +1, +2
Na2O
Li2O
K2 O
MgO
CaO
BaO
CrO
FeO
NiO
8.
Амфотерные оксидыZnO
Al2O3
Fe2O3
Cr2O3
BeO
9.
Кислоты (НхR)HCl – соляная
HNO3 – азотная
HNO2 – азотистая
H2SO4 – серная
H2S – сероводородная
HF - фтороводородная
HI – иодоводородная
HBr – бромоводородная
HMnO4 - марганцовая
H2SO3 – сернистая H2CrO4 – хромовая
H2SiO3 – кремниевая
H3PO4 - фосфорная
10.
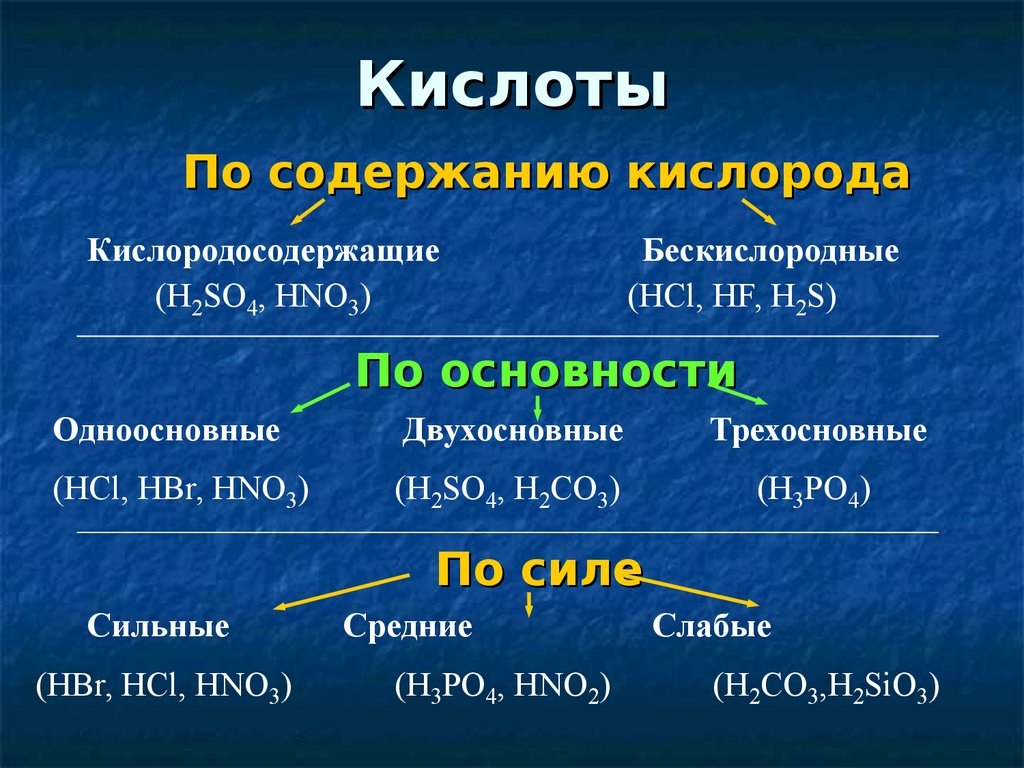
КислотыПо содержанию кислорода
Кислородосодержащие
(H2SO4, HNO3)
Бескислородные
(HCl, HF, H2S)
По основности
Одноосновные
Двухосновные
Трехосновные
(HCl, HBr, HNO3)
(H2SO4, H2CO3)
(H3PO4)
По силе
Сильные
(HBr, HCl, HNO3)
Средние
(H3PO4, HNO2)
Слабые
(H2CO3,H2SiO3)
11.
Соответствие кислот иоксидов
SO2 –
SO3 –
CO2 –
P2O5 –
SiO2 –
N2O3 –
N2O5 –
СrO3 –
Mn2O7 –
H2SO3
H2SO4
H2CO3
H3PO4
H2SiO3
HNO2
HNO3
H2CrO4
HMnO4
12.
Основания (Ме(ОН)x)По растворимости в воде
Растворимые – щелочи
(NaOH, KOH, Ba(OH)2 )
Нерастворимые
(Fe(OH)2, Ni(OH)2, Mg(OH)2)
По силе
Сильные щелочи
Слабые
13.
Соответствие основанийи оксидов
Na2O – NaOH
Li2O – LiOH
K2O – KOH
MgO –
Mg(OH)2
CaO –
Ca(OH)2
BaO –
Ba(OH)2
14.
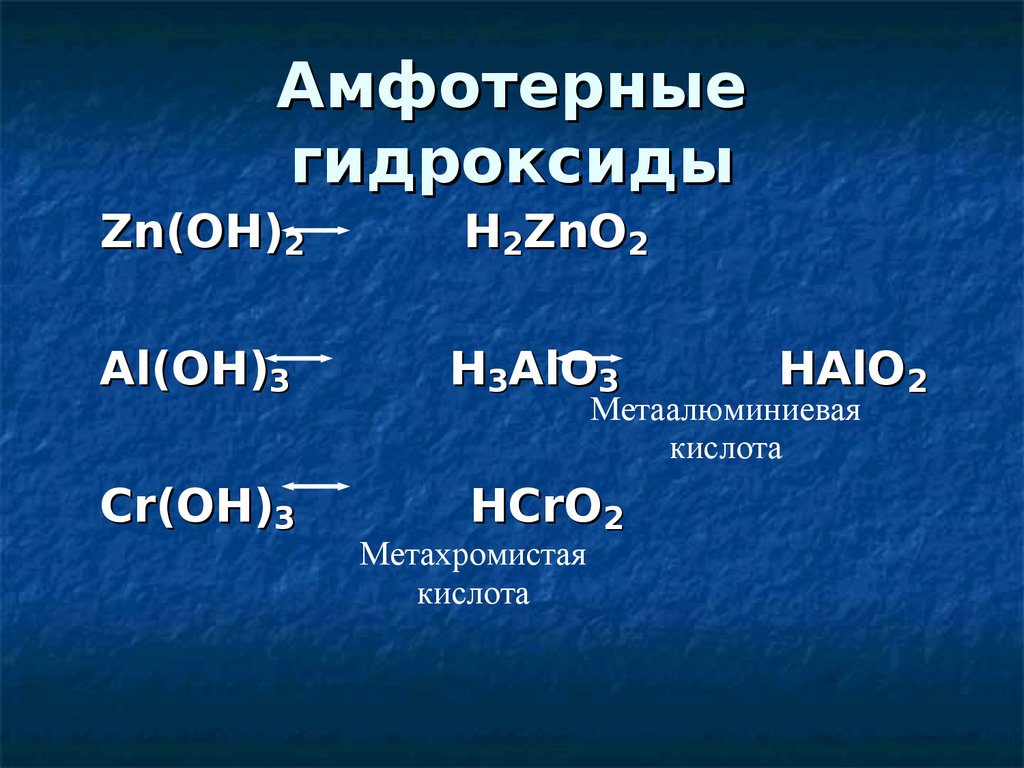
Амфотерныегидроксиды
Zn(OH)2
H2ZnO2
Al(OH)3
H3AlO3
Cr(OH)3
HCrO2
HAlO2
Метаалюминиевая
кислота
Метахромистая
кислота
15.
СолиНормальные (средние)
NaCl, Na2SO4, Na3PO4
Кислые
NaHSO4, Na2HPO4, NaH2PO4
Основные
Двойные
MgOHCl, Al(OH)2NO3
KAl(SO4)2,
Смешанные
Fe(NH4)2(SO4)2
Комплексные
Na2[Zn(OH)4], K3[Fe(CN)6]










 Химия
Химия








