Похожие презентации:
Карбоновые кислоты
1. Карбоновые кислоты
2.
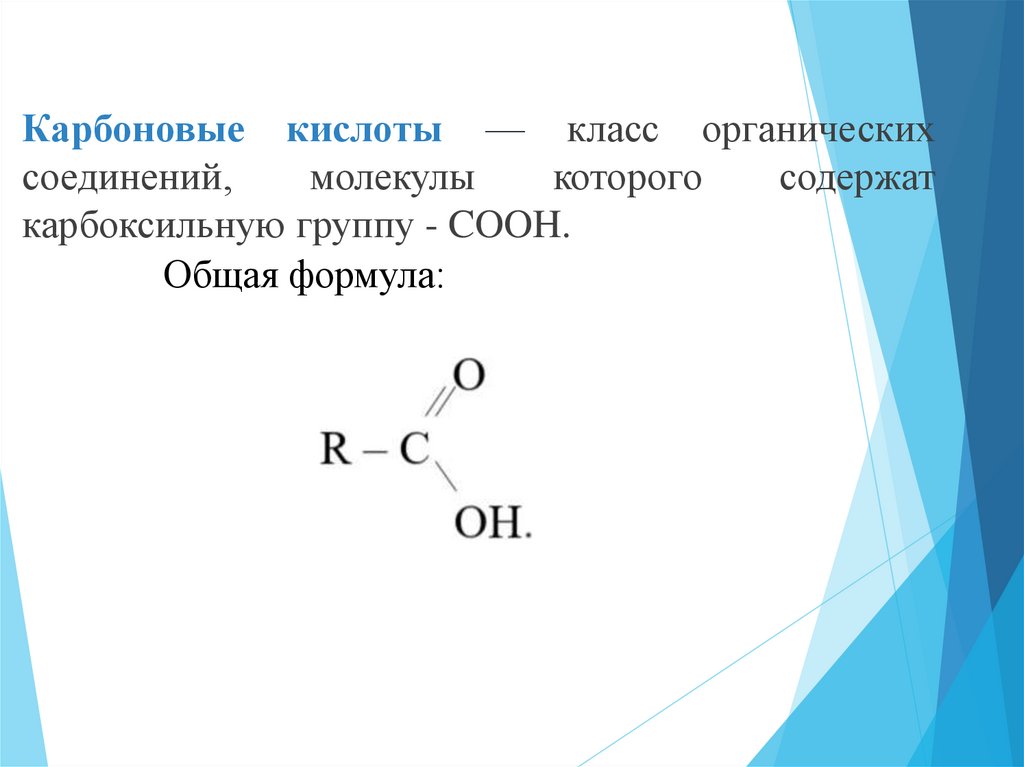
Карбоновые кислоты — класс органическихсоединений,
молекулы
которого
содержат
карбоксильную группу - COOH.
Общая формула:
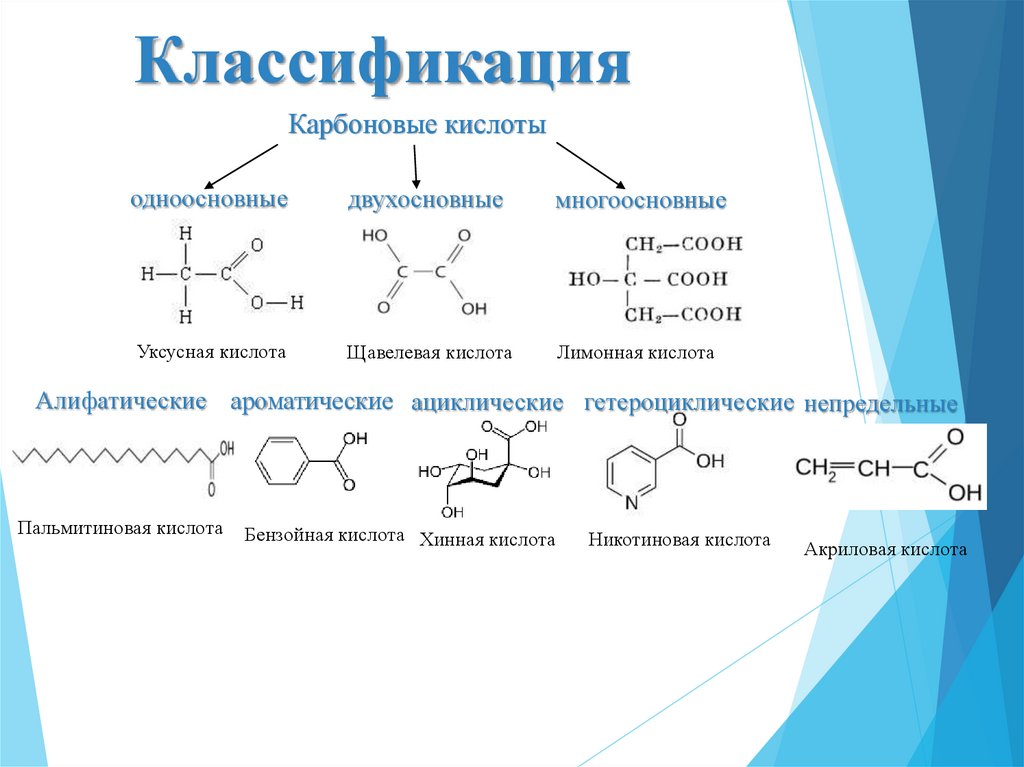
3. Классификация
Карбоновые кислотыодноосновные
двухосновные
многоосновные
Уксусная кислота
Щавелевая кислота
Лимонная кислота
Алифатические ароматические ациклические гетероциклические непредельные
Пальмитиновая кислота
Бензойная кислота Хинная кислота
Никотиновая кислота
Акриловая кислота
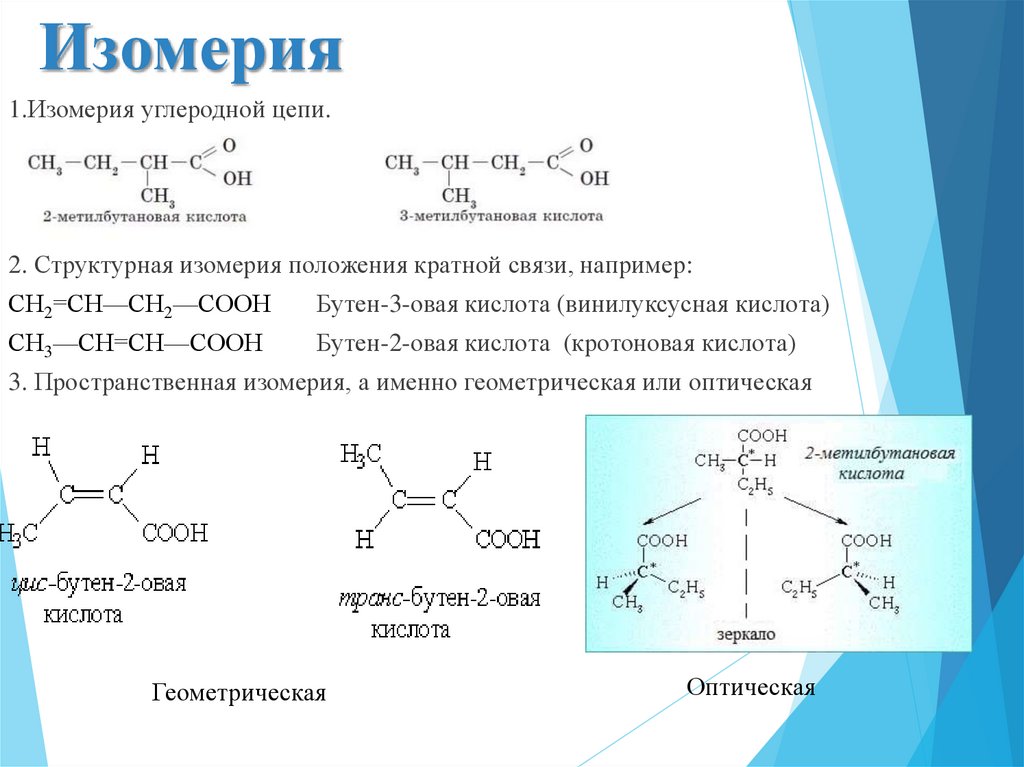
4. Изомерия
1.Изомерия углеродной цепи.2. Структурная изомерия положения кратной связи, например:
СН2=СН—СН2—СООН
Бутен-3-овая кислота (винилуксусная кислота)
СН3—СН=СН—СООН
Бутен-2-овая кислота (кротоновая кислота)
3. Пространственная изомерия, а именно геометрическая или оптическая
Геометрическая
Оптическая
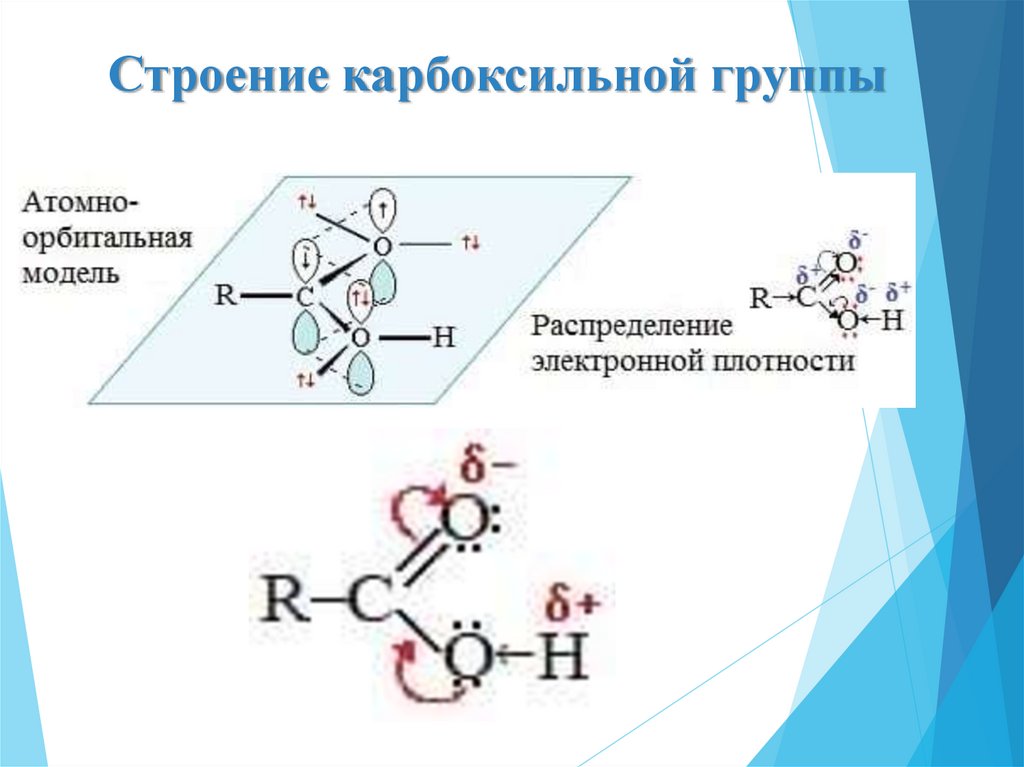
5. Строение карбоксильной группы
6. Электронные эффекты в молекулах карбоновых кислот
Мезомерный эффект: р- - сопряжение. Электронная плотность от одногоатома кислорода оттягивается ко второму. Это приводит к тому, что
двойная связь становится более прочной: Еπ ≈ Еσ. Реакции по ней не
происходят. При этом усиливается индуктивный эффект (а значит, и
полярность) О-Н и С-ОН связи, а также С-Н связи у α-атома углерода.
Цифрами показаны эти наиболее активные полярные связи в молекуле
уксусной кислоты.
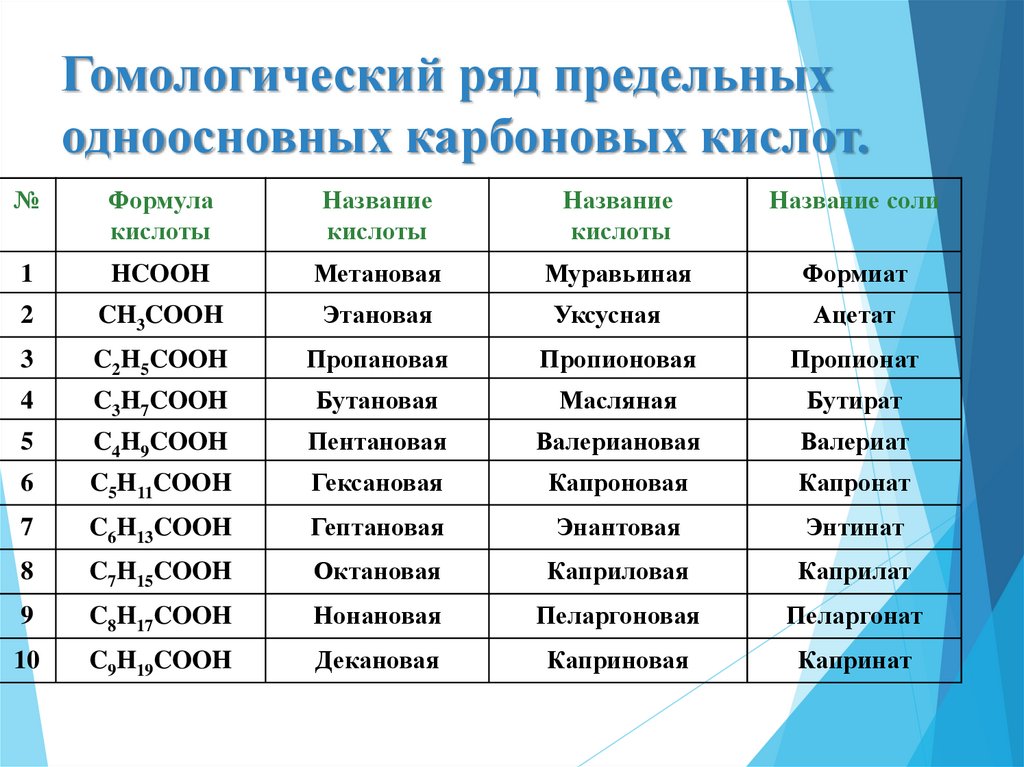
7. Гомологический ряд предельных одноосновных карбоновых кислот.
№Формула
кислоты
Название
кислоты
Название
кислоты
Название соли
1
HCOOH
Метановая
Муравьиная
Формиат
2
CH3COOH
Этановая
3
C2H5COOH
Пропановая
Пропионовая
Пропионат
4
C3H7COOH
Бутановая
Масляная
Бутират
5
C4H9COOH
Пентановая
Валериановая
Валериат
6
C5H11COOH
Гексановая
Капроновая
Капронат
7
C6H13COOH
Гептановая
Энантовая
Энтинат
8
C7H15COOH
Октановая
Каприловая
Каприлат
9
C8H17COOH
Нонановая
Пеларгоновая
Пеларгонат
10
C9H19COOH
Декановая
Каприновая
Капринат
Уксусная
Ацетат
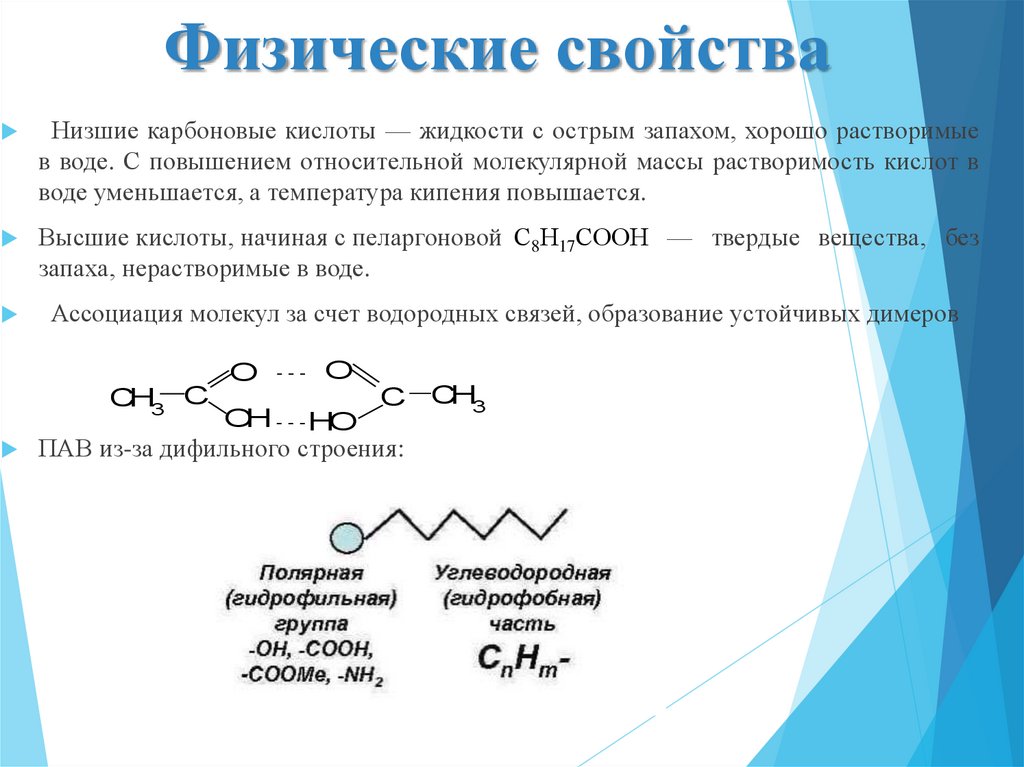
8. Физические свойства
Низшие карбоновые кислоты — жидкости с острым запахом, хорошо растворимыев воде. С повышением относительной молекулярной массы растворимость кислот в
воде уменьшается, а температура кипения повышается.
Высшие кислоты, начиная с пеларгоновой С8Н17СООН — твердые вещества, без
запаха, нерастворимые в воде.
Ассоциация молекул за счет водородных связей, образование устойчивых димеров
CH3 C
O
O
C CH3
OH HO
ПАВ из-за дифильного строения:
9. Химические свойства
I Реакции по первой активной О-Н связи в карбоксильной группе:1) Способность к диссоциации (кислотные свойства). При растворении в воде
все карбоновые кислоты проявляют себя как слабые электролиты, т.е.
диссоциируют (распадаются на ионы) под действие полярных молекул
растворителя. Кислотные свойства карбоновых кислот обусловлены
подвижностью атома водорода карбоксильной группы и их способностью
отщеплять его в виде протона. Однако, равновесие процесса диссоциации
сильно смещено влево, об этом свидетельствует тот факт, что даже
сильноразбавленные водные растворы кислот имеют резкий запах.
O
O
+
C
C
H
C
H
C
H
+
3
3
O
O
H
pK= -lg Kd (константа диссоциации)
pK(CH3COOH)=4,75
pK(HCOOH)=3,7
10.
В гомологическом ряду предельных одноосновных кислот самойсильной кислотой является муравьиная кислота.
Заместители, присутствующие в молекуле карбоновой кислоты, сильно
влияют на ее кислотность вследствие оказываемого ими индуктивного
эффекта. Алкильные радикалы, связанные с карбоксильной группой,
обладают положительным индуктивным эффектом (+І). Они отталкивают от
себя электронную плотность, тем самым уменьшая частичный
положительный заряд (δ+) на атоме углерода карбоксильной группы.
Положительный индуктивный эффект возрастает, но быстро затухает по мере
увеличения длины углеводородного радикала, что в свою очередь ослабляет
полярность связи О-Н. Алкильные группы понижают кислотность.
11.
Такие заместители, как хлор, фенильный радикал и другие,оттягивают на себя электронную плотность и, следовательно,
вызывают отрицательный индуктивный эффект (— I), что приводит к
повышению кислотности карбоновой кислоты.
δ-
O
R
CH2
H2C
δ+
О
H
Электроноакцепторные заместители
Hal, NO2-, OH-, C6H5-, CH2=CH-.
12.
2)Реакции солеобразования:a)
взаимодействие с активными металлами (в ряду напряжений до
водорода)
b)
взаимодействие с основаниями (р. нейтрализации)
c)
взаимодействие с основными и амфотерными оксидами
13.
d)взаимодействие с солями более слабых кислот
d)
взаимодействие
аммония
с
аммиаком
или
гидроксидом
14.
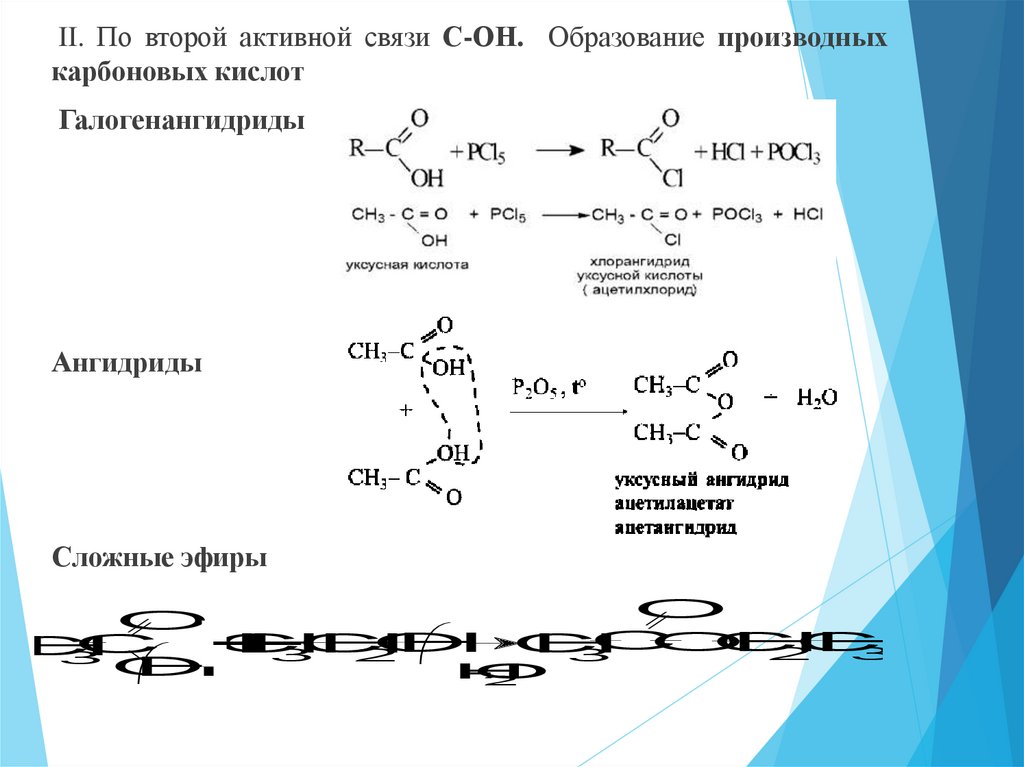
II. По второй активной связи С-ОН. Образование производныхкарбоновых кислот
Галогенангидриды
Ангидриды
Сложные эфиры
O
O
C
O
C
H
C
H
O
H C
C
H
C
H
H
C
C
H
+
2
3
3
2
3
3
O
H
H
O
2
15.
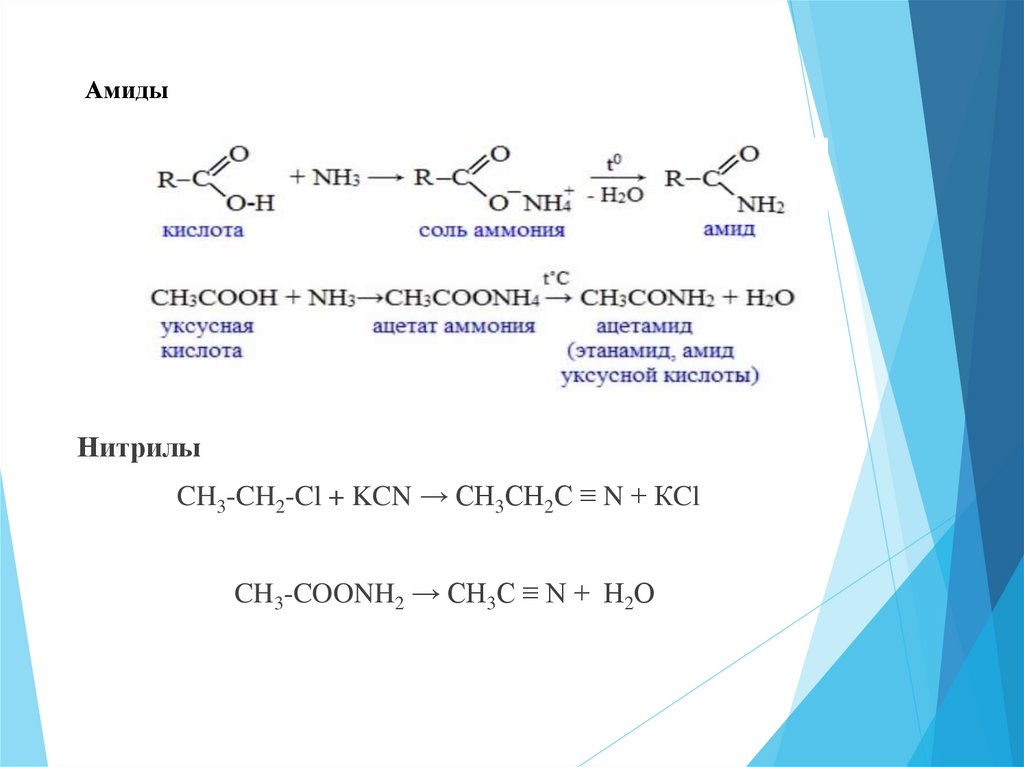
АмидыНитрилы
CH3-CH2-Cl + KCN → СН3СН2С ≡ N + КCl
CH3-COONH2 → СН3С ≡ N + Н2О
16.
III Реакции по третьей активной связи реакции декарбоксилированиякарбоновых кислот
(разрушение С-С связи с изменением углеродного скелета).
1.
При сплавлении солей карбоновых кислот со щелочами образуются
алканы:
СН3-СН2-СООNa + NaOH → CH3-СН3 + Na2CO3
2.
При сильном нагревании (пиролизе) ацетата кальция, магния или
бария образуется ацетон, который очень летуч и легко
воспламеняется:
СООН + 2[Ag(NH3)2]OH → 2Ag + (N)2CO3 + 2NH3 + H2H4O
O
C
C
H
3
O
C
H
C
C
a
C
a
C
O
H
+
3
3C
3
O
O
C
C
H
3
O
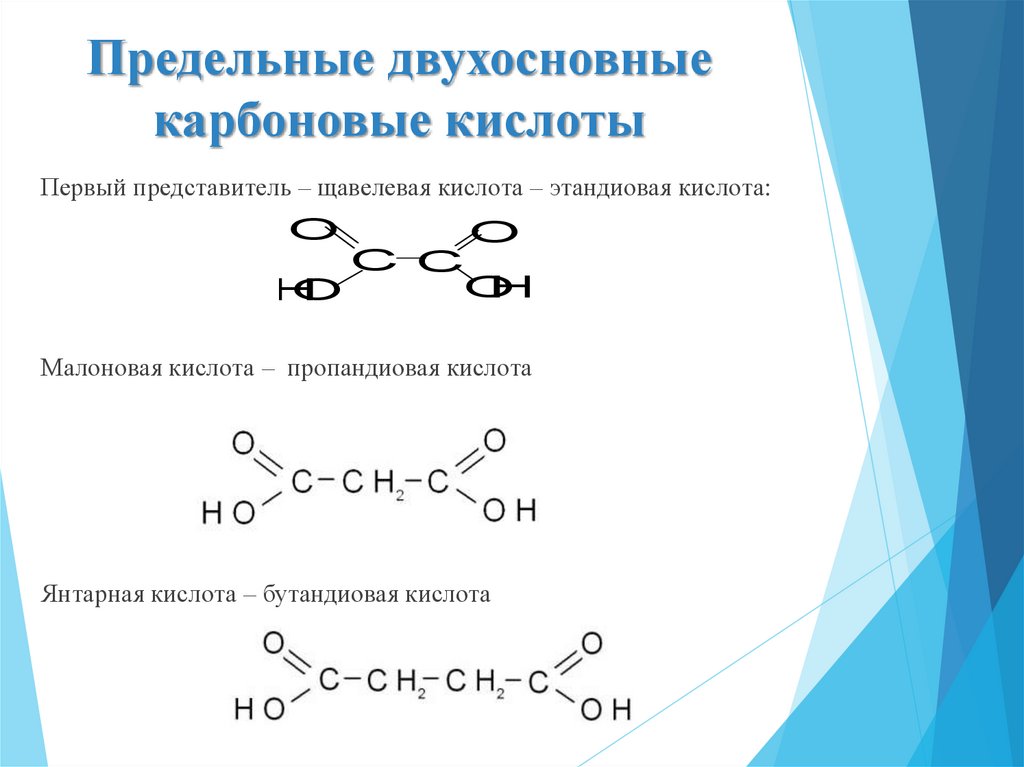
17. Предельные двухосновные карбоновые кислоты
Первый представитель – щавелевая кислота – этандиовая кислота:O
O
C C
O
H
H
O
Малоновая кислота – пропандиовая кислота
Янтарная кислота – бутандиовая кислота
18. Химические свойства дикарбоновых кислот.
У двухосновных кислот сохраняются все общие для карбоновыхкислот свойства. Дикарбоновые кислоты превращаются в соли и
образуют те же производные, что и монокарбоновые
(галогенангидриды, ангидриды, амиды, нитрилы, сложные эфиры),
но реакции могут идти как по одной, так и по обеим
карбоксильным группам. Механизм реакций образования
производных тот же, что и у монокарбоновых кислот.
Двухосновные кислоты обнаруживают также ряд особенностей,
обусловленных влиянием двух СООН-групп.
19. Особые химические свойства :
Дикарбоновые кислоты сильнее, чем соответствующие одноосновныеиз-за взаимного влияния карбоксильных групп друг на друга. При этом
диссоциируют они в 2 ступени, каждая из которых характеризуется
своей константой диссоциации.
OO
OO
+
C
H
H
C
H
C
C
C
C
+
2
2
H
H
OO
H
OO
OO
+
OO
H
C
H
C
C
+
C
H
C
C
2
2
OO
H
OO
Для малоновой кислоты рК1=2,86 рК2=5,7
Для щавелевой кислоты рК1=1,27 рК2=4,3
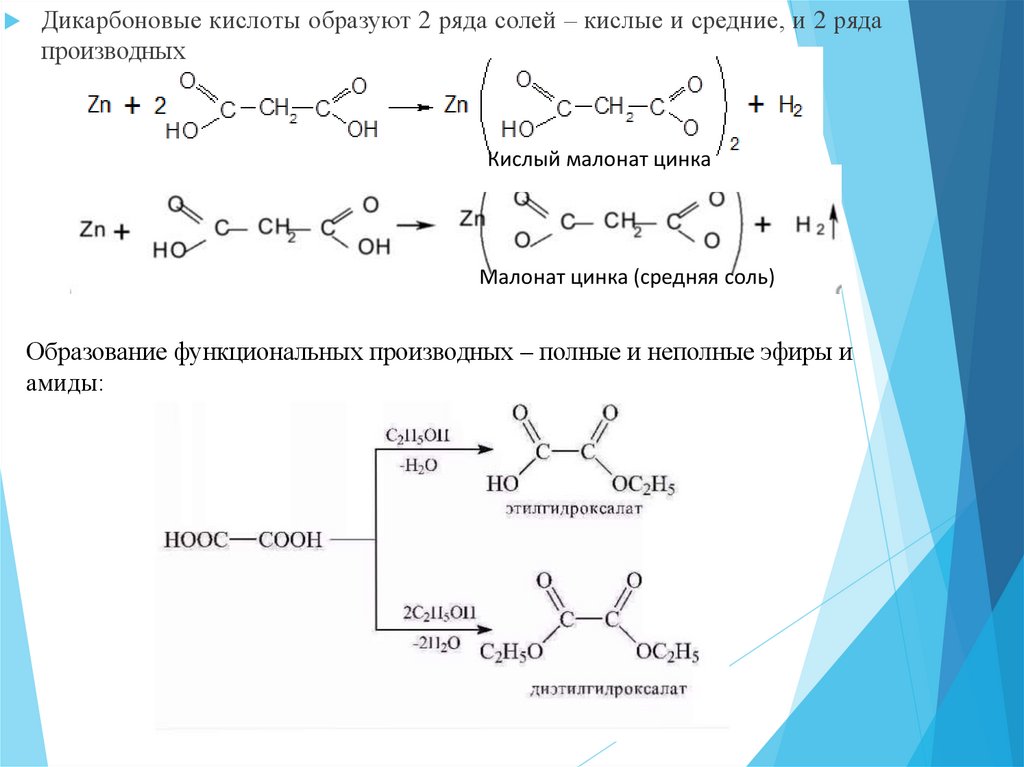
20.
Дикарбоновые кислоты образуют 2 ряда солей – кислые и средние, и 2 рядапроизводных
Кислый малонат цинка
Малонат цинка (средняя соль)
Образование функциональных производных – полные и неполные эфиры и
амиды:
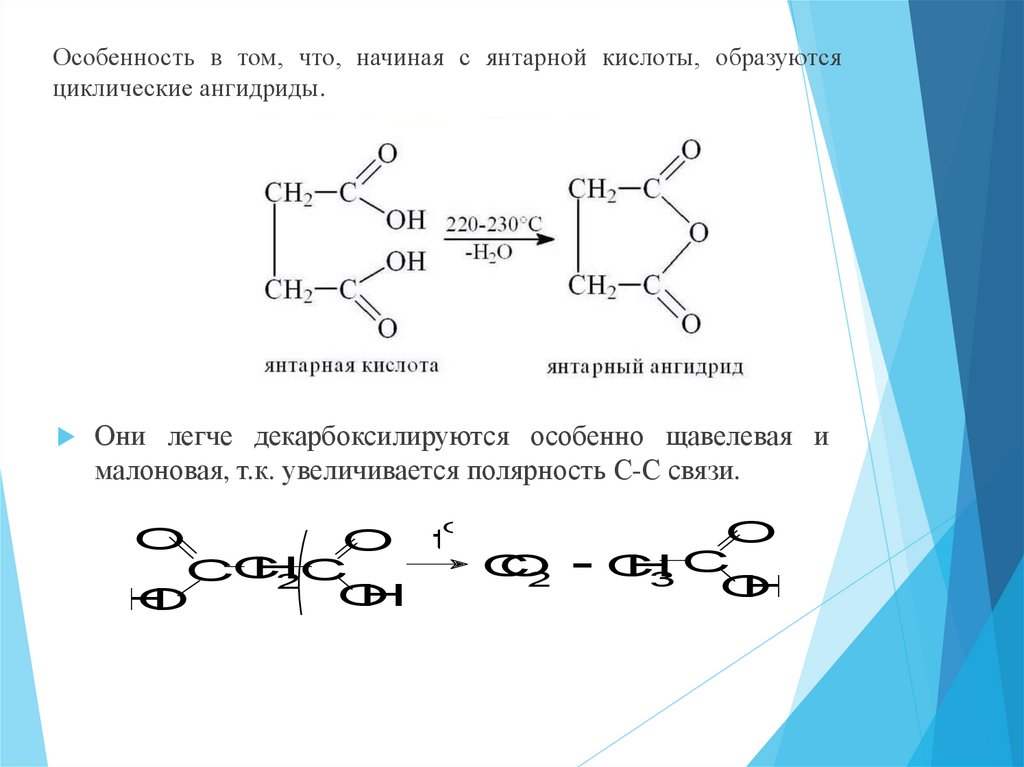
21.
Особенность в том, что, начиная с янтарной кислоты, образуютсяциклические ангидриды.
Они легче декарбоксилируются особенно щавелевая и
малоновая, т.к. увеличивается полярность С-С связи.
O
O
O t
C
O
H
CC
2
2C
O
H
H
O
O
C
H
+C
3
O
H
22.
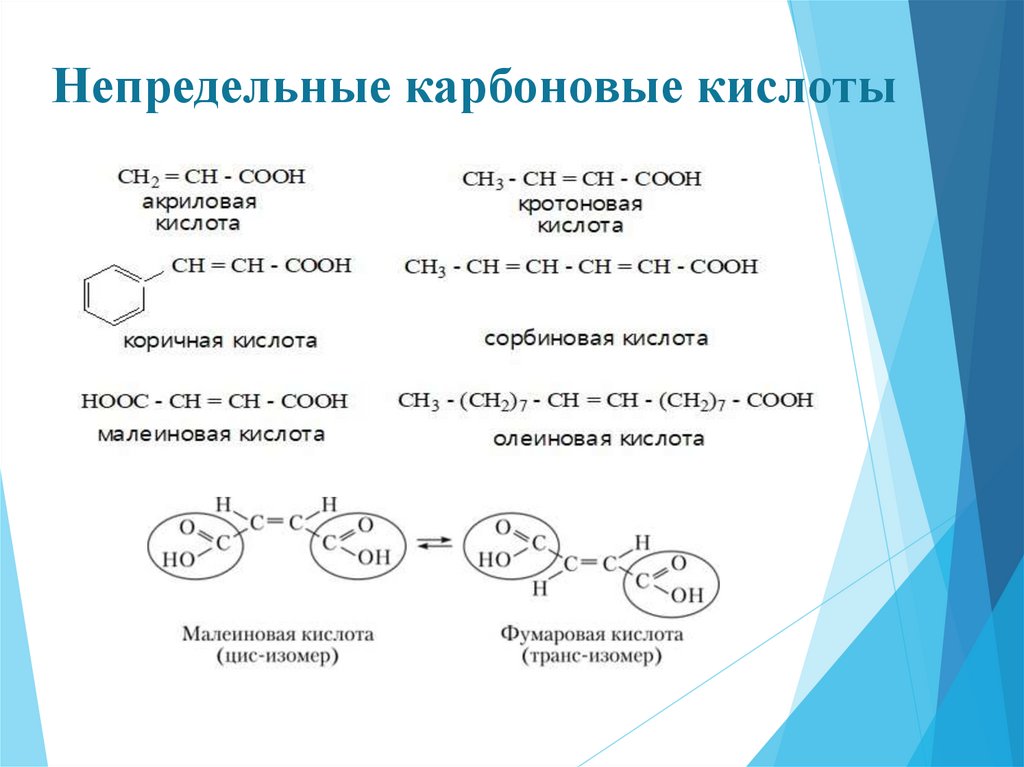
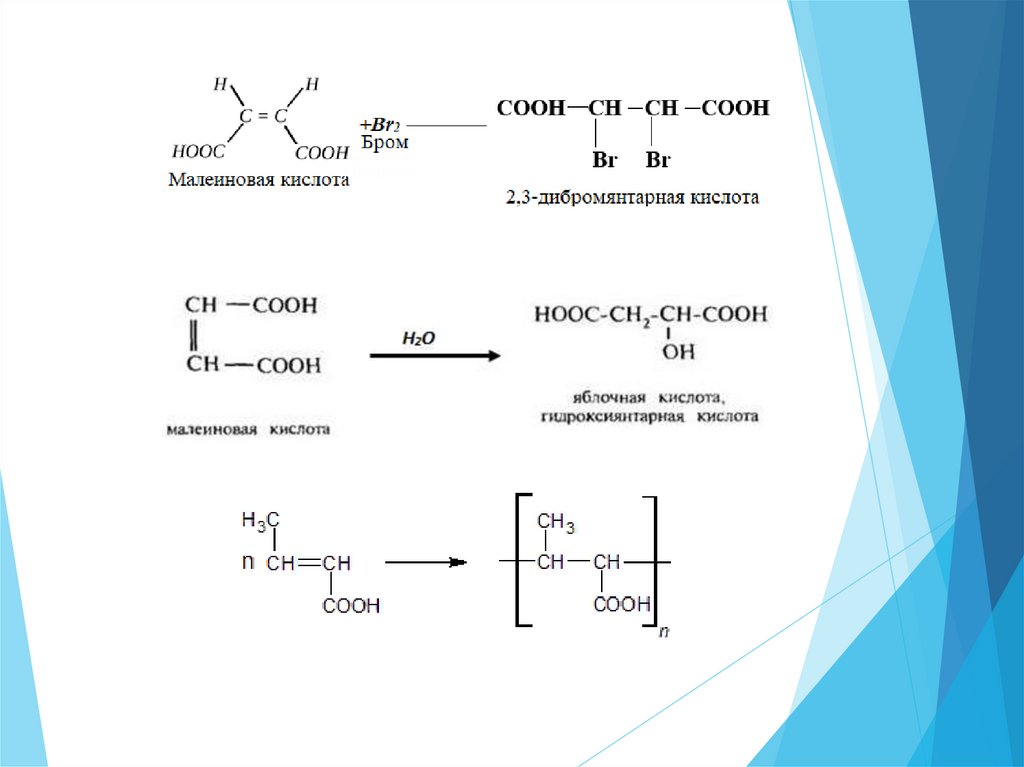
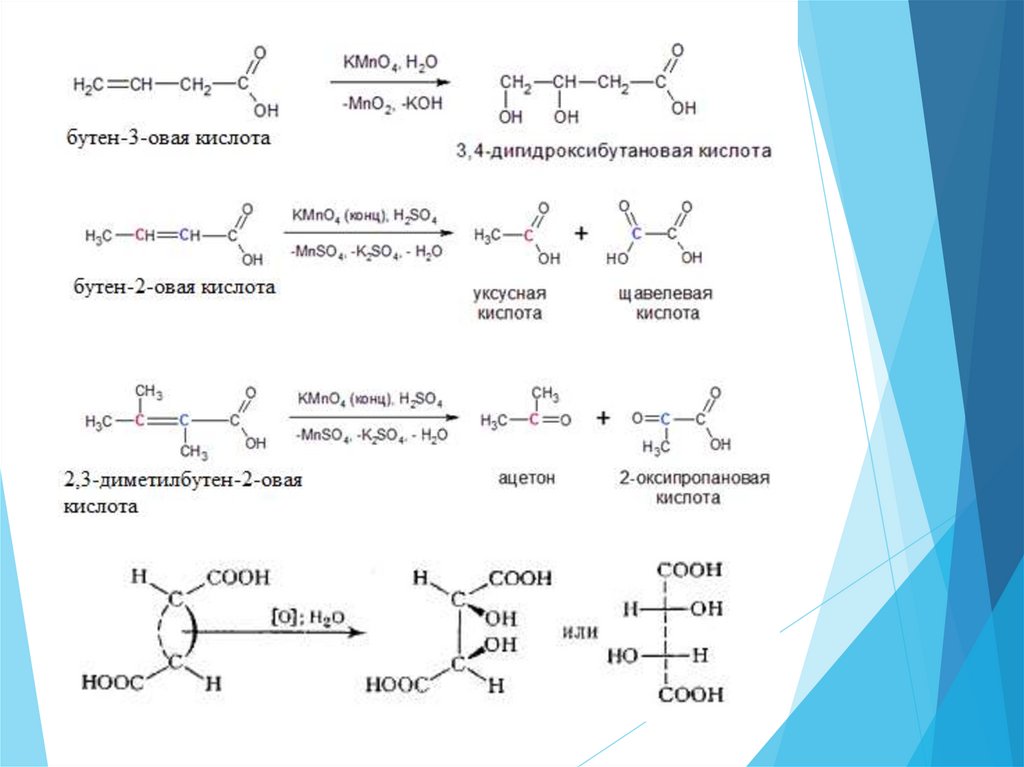
Непредельные карбоновые кислоты23.
Химические свойства.Для
непредельных
карбоновых
кислот
характерны
все свойства предельных кислот. При этом они проявляют более
сильные кислотные свойства, чем соответствующие предельные.
Т.к. непредельный радикал обладает электроно-акцепторными
свойствами.
Однако, в отличие от предельных кислот, непредельные карбоновые
кислоты благодаря наличию кратных связей в их молекулах способны
вступать в реакции присоединения, полимеризации и окисления, подобно
непредельным углеводородам.
24.
25.
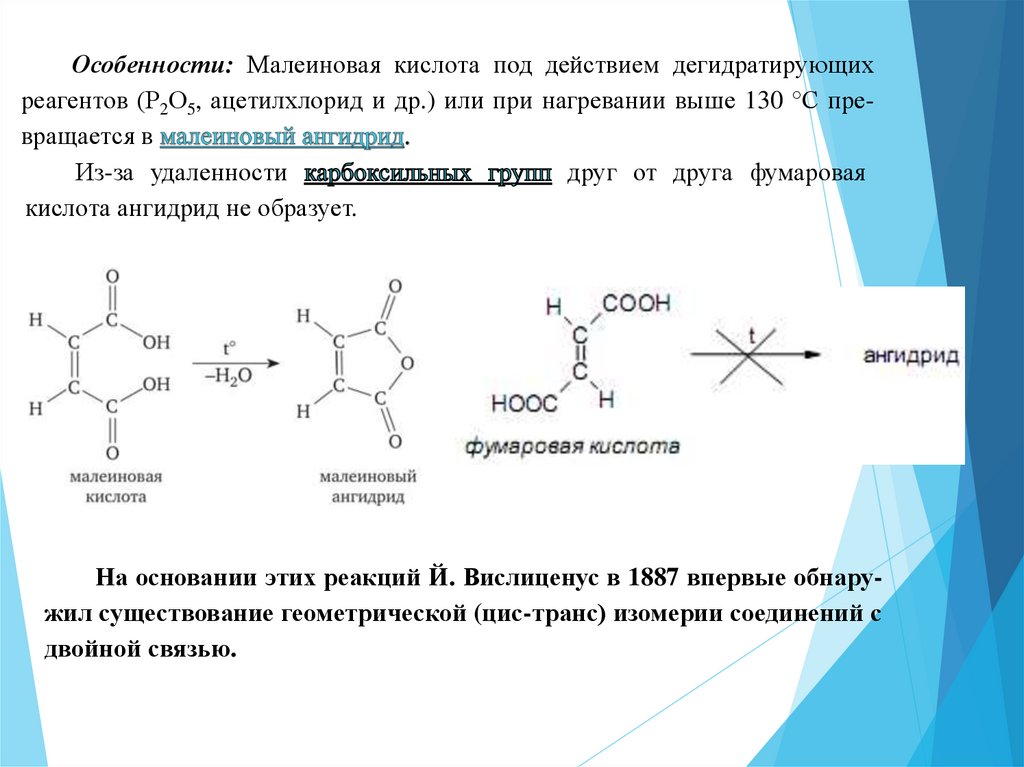
26.
Особенности: Малеиновая кислота под действием дегидратирующихреагентов (Р2О5, ацетилхлорид и др.) или при нагревании выше 130 °С превращается в
Из-за удаленности
друг от друга фумаровая
кислота ангидрид не образует.
На основании этих реакций Й. Вислиценус в 1887 впервые обнаружил существование геометрической (цис-транс) изомерии соединений с
двойной связью.
27.
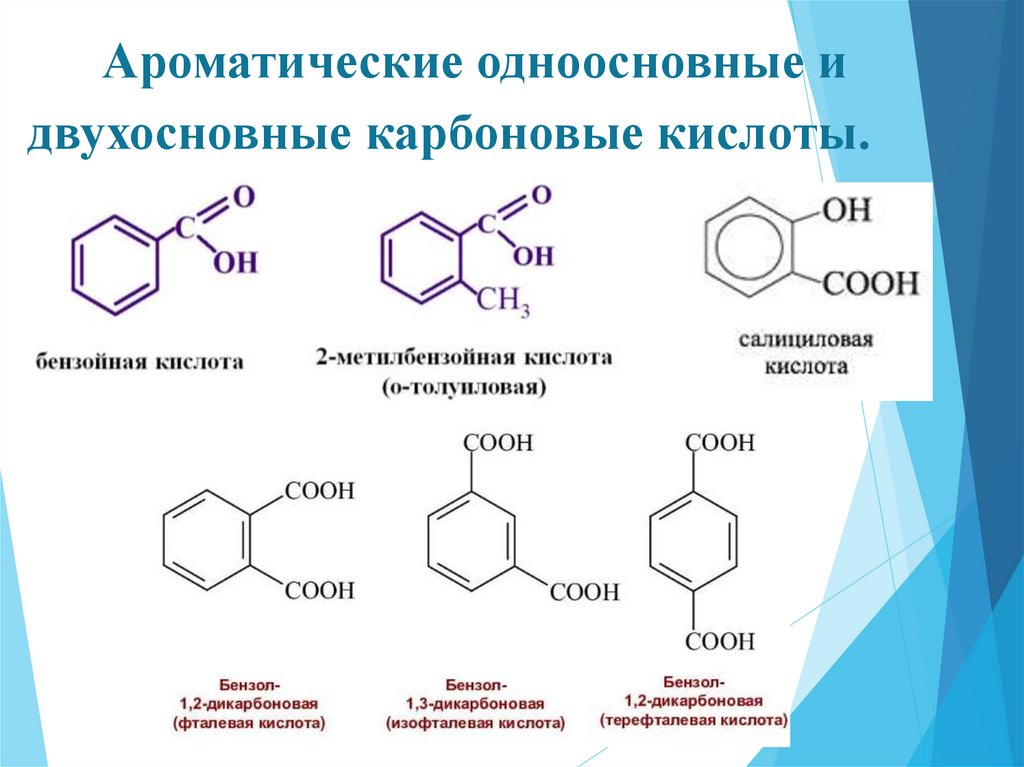
Ароматические одноосновные идвухосновные карбоновые кислоты.
28.
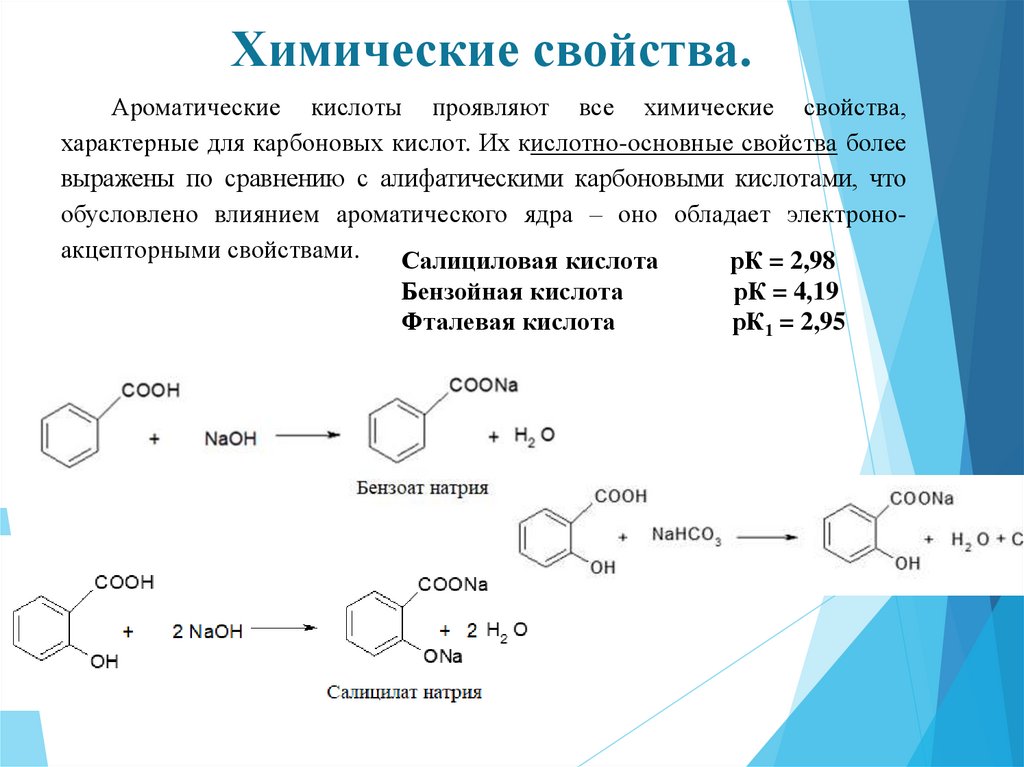
Химические свойства.Ароматические кислоты проявляют все химические свойства,
характерные для карбоновых кислот. Их кислотно-основные свойства более
выражены по сравнению с алифатическими карбоновыми кислотами, что
обусловлено влиянием ароматического ядра – оно обладает электроноакцепторными свойствами.
Салициловая кислота
рК = 2,98
Бензойная кислота
Фталевая кислота
рК = 4,19
рК1 = 2,95
29.
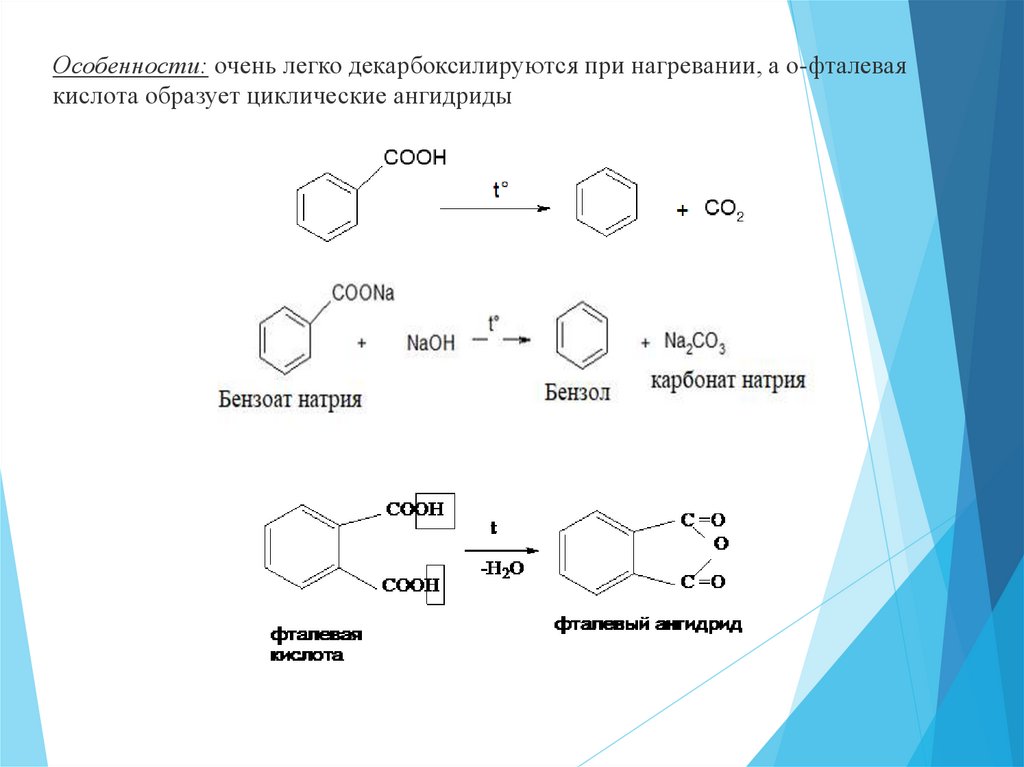
Особенности: очень легко декарбоксилируются при нагревании, а о-фталеваякислота образует циклические ангидриды
30.
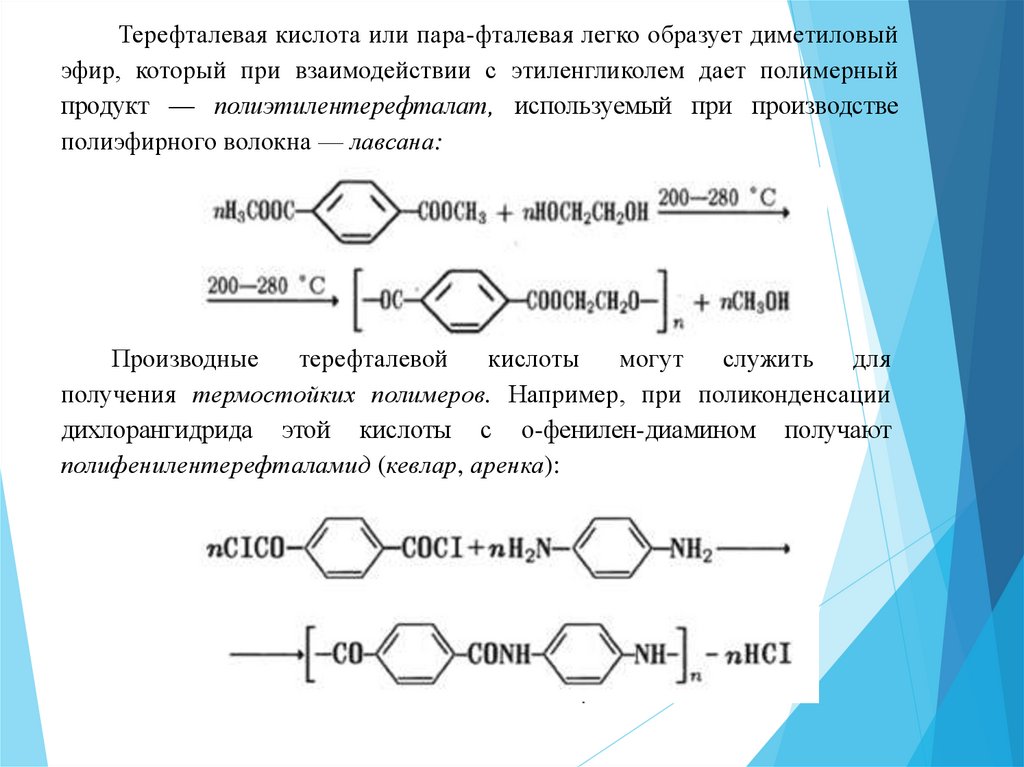
Терефталевая кислота или пара-фталевая легко образует диметиловыйэфир, который при взаимодействии с этиленгликолем дает полимерный
продукт — полиэтилентерефталат, используемый при производстве
полиэфирного волокна — лавсана:
Производные
терефталевой
кислоты
могут
служить
для
получения термостойких полимеров. Например, при поликонденсации
дихлорангидрида этой кислоты с о-фенилен-диамином получают
полифенилентерефталамид (кевлар, аренка):
31. Получение карбоновых к-т
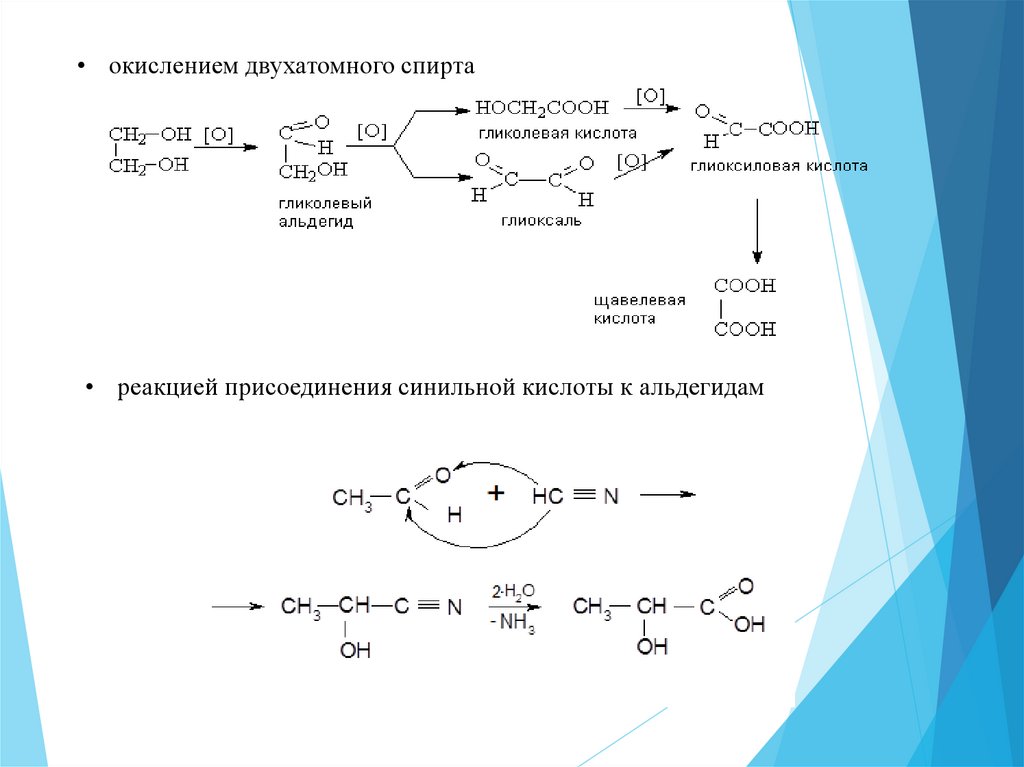
Окислениесоединений
соответствующих
кислородсодержащих
Например, из двухатомного спирта пропандиола 1,3 можно
получить малоновую кислоту через стадию образования
соответствующих альдегидов.
Нитрильный
синтез
с
последующим
производных: нитрилов и амидов
гидролизом
Например: малоновая кислота из дигалогенпроизводных
2
K
C
C
l C
H
l+
2 C
N
H
CC
2
N
-2
K
C
l
OO
4
H
2
C N
O
H
CC
2C
O
H
H
O
N
H
-2
3
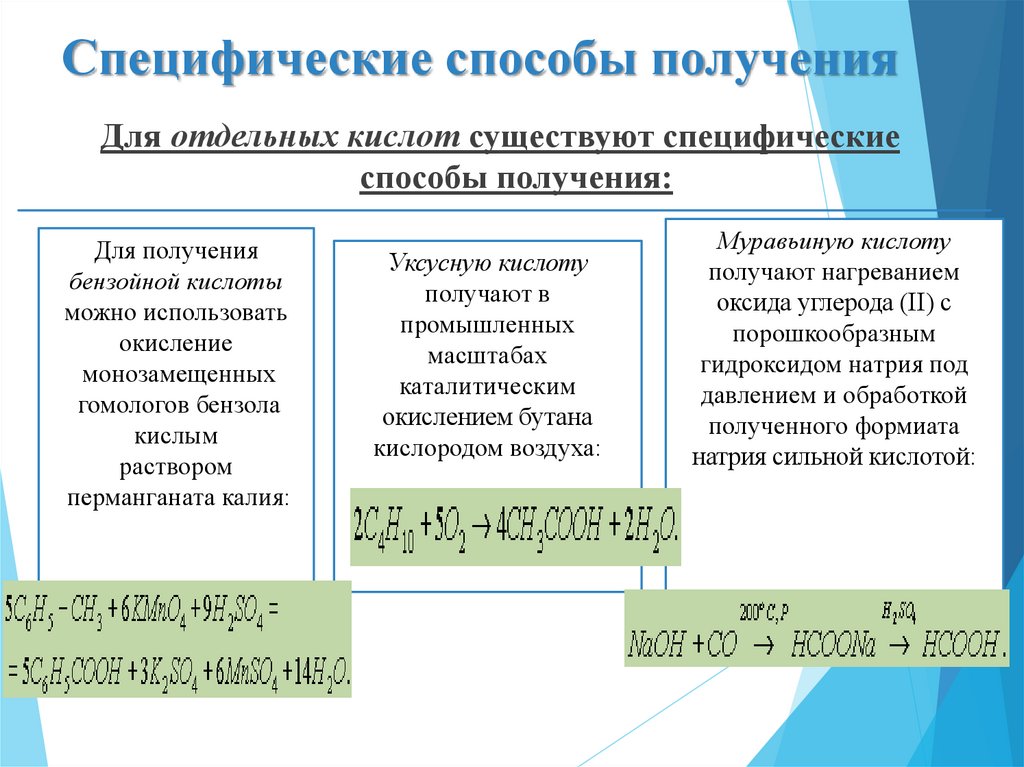
32. Специфические способы получения
Для отдельных кислот существуют специфическиеспособы получения:
Для получения
бензойной кислоты
можно использовать
окисление
монозамещенных
гомологов бензола
кислым
раствором
перманганата калия:
Уксусную кислоту
получают в
промышленных
масштабах
каталитическим
окислением бутана
кислородом воздуха:
Муравьиную кислоту
получают нагреванием
оксида углерода (II) с
порошкообразным
гидроксидом натрия под
давлением и обработкой
полученного формиата
натрия сильной кислотой:
33.
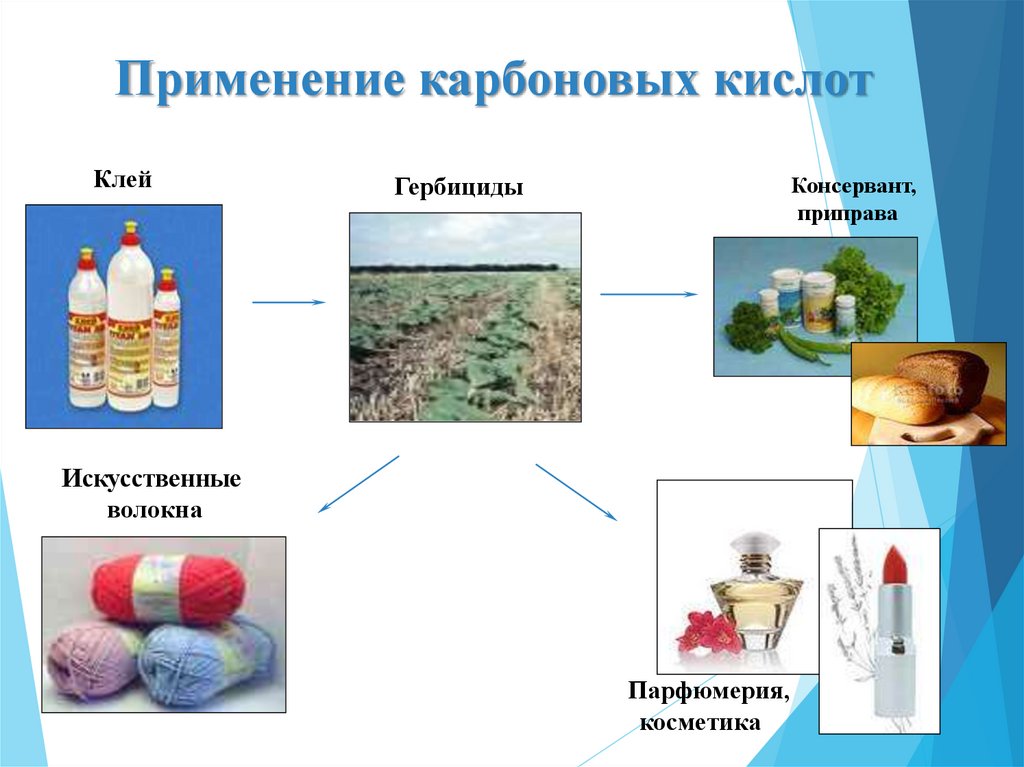
Применение карбоновых кислотКлей
Консервант,
приправа
Гербициды
Искусственные
волокна
Парфюмерия,
косметика
34. Интересные исторические факты, связанные с органическими кислотами
В 1714 г. по указу Петра I в Петербурге был заложен аптекарский сад.Там выращивали лекарственные растения, снабжая ими аптеки или
перерабатывая их на лекарства. Так вот, листья одного из таких
растений, помещенные в молоко, предохраняют его от скисания.
Свежее мясо и рыба, переложенные этим растением, дольше
сохраняются. Из его корней можно получить желтый краситель. Из
волокон можно изготовить сети, не гниющие в воде. Листья –
неистощимая основа для фантазии хозяйки по приготовлению
здоровой и полезной пищи. Мы знаем это растение по сказке
Андерсена. Личный опыт общения с этим растением способен
довести до слез. Наконец, это растение узнают даже слепые. Это –
крапива, содержащая муравьиную кислоту.
35. Крабоновые кислоты в природе:
Муравьиная кислота впервые была выделена в XVIIвеке из красных лесных муравьев. Содержится также
в соке жгучей крапивы. Безводная муравьиная
кислота – бесцветная жидкость с острым запахом и
жгучим вкусом, вызывающая ожоги на коже.
Применяется в текстильной промышленности в
качестве протравы при крашении тканей, для
дубления кож, а также для различных синтезов.
36. Крабоновые кислоты в природе:
Уксусная кислота широко распространена в природе –содержится в выделениях животных (моче, желчи,
испражнениях), в растениях (в зеленых листьях).
Образуется при брожении, гниении, скисании вина, пива,
содержится в кислом молоке и сыре. Температура
плавления безводной уксусной кислоты + 16,5°C,
кристаллы ее прозрачны как лед, поэтому ее называют
ледяной уксусной кислотой. Впервые получена в конце
XVIII века русским ученым
Т. Е. Ловицем.
Натуральный уксус содержит около 5% уксусной кислоты.
37. Оксикислоты.
Оксикислоты – это соединения в которых есть карбоксильная и гидроксильная группВ зависимости от количества карбоксильных групп оксикислоты делятся на
одноосновные, двухосновные и т.д.; в зависимости от общего количества
гидроксильных групп оксикислоты делятся на одно- или многоатомные.
По характеру радикала оксикислоты бывают предельные и непредельные,
ациклические, циклические или ароматические.
По взаимному расположению функциональных групп они делятся на , , и
т.д. оксикислоты. Названия оксикислотам дают по названию кислоты, а название
гидроксильной группы окси- или гидрокси- выносят в приставку и указывают
цифрой ее положение в цепи. Широко используется и тривиальная номенклатура.
Молочная кислота
2-оксипропановая кислота
-оксипропионовая
кислота
(соли – лактаты)
38.
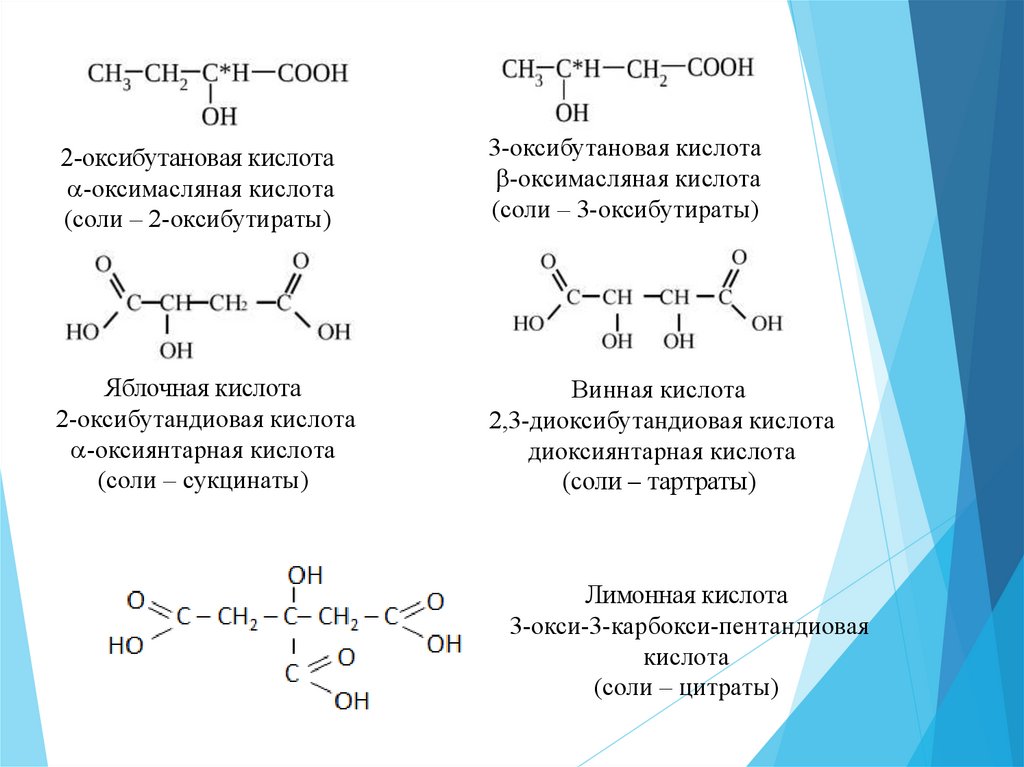
2-оксибутановая кислота-оксимасляная кислота
(соли – 2-оксибутираты)
3-оксибутановая кислота
-оксимасляная кислота
(соли – 3-оксибутираты)
Яблочная кислота
2-оксибутандиовая кислота
-оксиянтарная кислота
(соли – сукцинаты)
Винная кислота
2,3-диоксибутандиовая кислота
диоксиянтарная кислота
(соли – тартраты)
Лимонная кислота
3-окси-3-карбокси-пентандиовая
кислота
(соли – цитраты)
39. Химические свойства.
1. Эти кислоты проявляют функциональные свойства карбоновых кислот испиртов. Кислотные свойства выше, чем у соответствующих кислот из-за того, что
гидроксильная группа в углеводородном радикале создает отрицательный
индуктивный эффект. Причем -оксикислоты сильнее, чем -оксикислоты, т.к.
индуктивный эффект быстро затухает в цепи атомов углерода.
Более полярная
ОН связь
40.
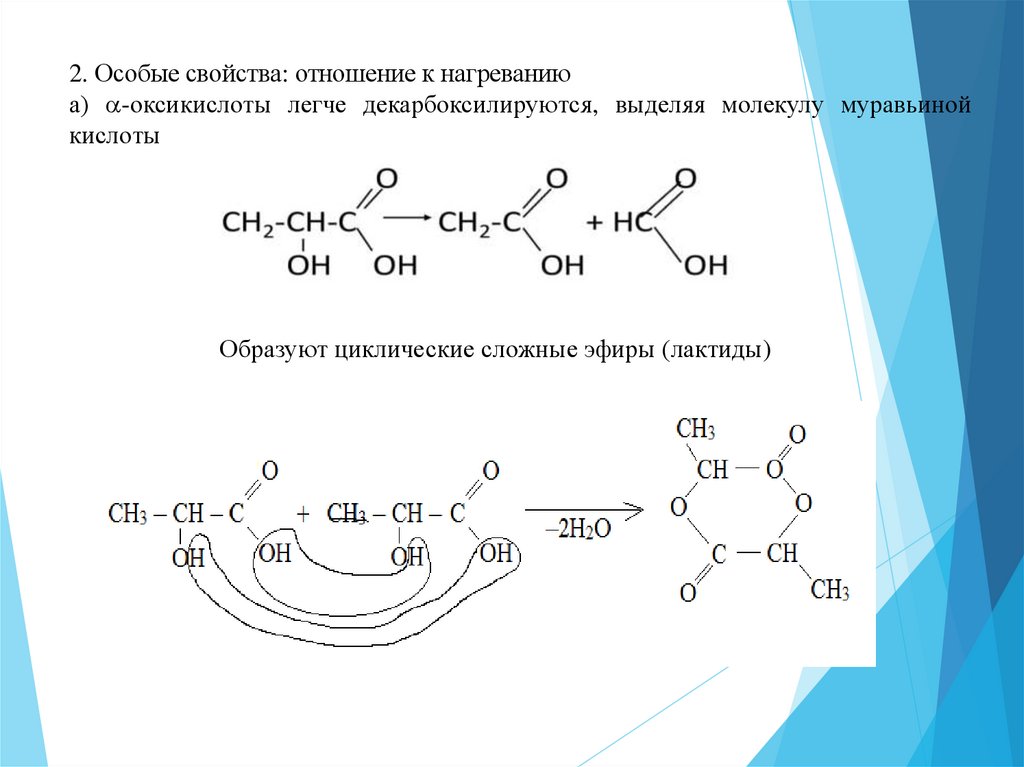
2. Особые свойства: отношение к нагреваниюа) -оксикислоты легче декарбоксилируются, выделяя молекулу муравьиной
кислоты
Образуют циклические сложные эфиры (лактиды)
41.
б) β-оксикислоты чрезвычайно легко вступают в реакцию отщепления воды.(реакция внутримолекулярной дегидратации спиртов) с образованием
непредельных соединений. При этом двойные связи образуются в положении по отношению к карбоксильной группе, т.к. С-Н связь у 2 атома
углерода наиболее полярна из-за влияния обеих функциональных групп.
2-оксибутановая кислота
бутен-2-овая кислота
(кротоновая)
в) γ-оксикислоты дают циклические сложные эфиры (лактоны)
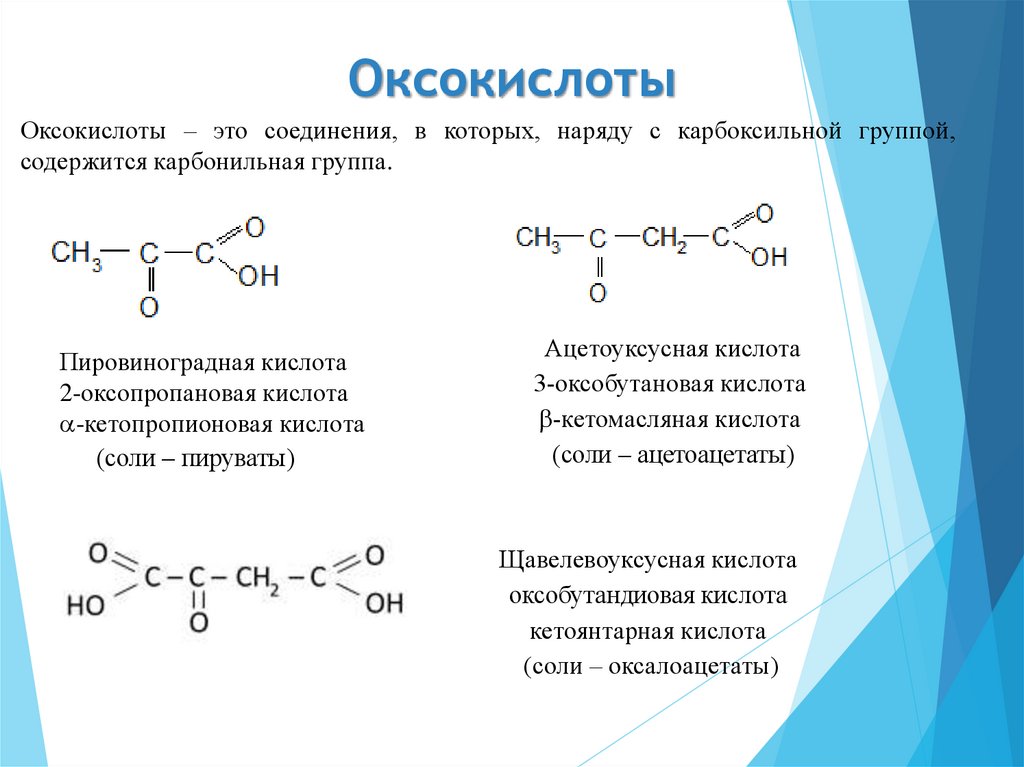
42. Оксокислоты
Оксокислоты – это соединения, в которых, наряду с карбоксильной группой,содержится карбонильная группа.
Пировиноградная кислота
2-оксопропановая кислота
-кетопропионовая кислота
(соли – пируваты)
Ацетоуксусная кислота
3-оксобутановая кислота
-кетомасляная кислота
(соли – ацетоацетаты)
Щавелевоуксусная кислота
оксобутандиовая кислота
кетоянтарная кислота
(соли – оксалоацетаты)
43.
Они сильнее, чем соответствующие оксикислоты, т.к. карбонильнаягруппа создает более сильный отрицательный индуктивный эффект, чем
гидроксильная, при этом -кетокислота сильнее, чем -кетокислота.
Общим свойством и и -кетокислот является то, что они очень легко
декарбоксилируются. Причем для -кетокислот этот процесс происходит
при комнатной температуре за счет перераспределения электронной
плотности в молекуле: образуется сначала непредельный спирт – енол,
который перегруппируется в более устойчивую форму – кетон (кетоенольная таутомерия).
44. Получение
Оксокислоты получают окислением оксикислотОксикислоты можно получить:
• гидролизом галогенпроизводных карбоновых кислот
• гидратацией ненасыщенных карбоновых кислот – присоединением
воды (эта реакция идет против правила Марковникова)
CH2
CH
O
C
+ H OH
OH
O
CH2 CH2 C
OH
OH
45.
• окислением двухатомного спирта• реакцией присоединения синильной кислоты к альдегидам
46. Заключение:
•Придают продуктам определенный вкус.• Могут накапливаться в продуктах, при хранении
вызывая их порчу, (прокисание молочных продуктов).
• Некоторые обладают антисептических действием:
бензойная, сорбиновая - удлиняют сроки хранения
брусники и клюквы, применяются в качестве
консервантов в пищевой промышленности;
салициловая – оказывает лечебные свойства малины
при простудных заболеваниях.
• Высшие карбоновые кислоты входят в состав жиров.
47.
НоменклатураДля определения названия кислоты в соответствии с номенклатурой
IUPAC нужно придерживаться следующего порядка:
1. Главную цепь выбирают таким образом, чтобы атом углерода карбоксильной
группы оказался в ней.
2. Нумерация атомов углерода главной цепи начинается с атома углерода
карбоксильной группы.
3. Полное название данной кислоты образуется от названия углеводорода с тем
же числом атомов углерода в молекуле с добавлением «-овая кислота».
4. Если углеводородный радикал разветвлен, то сначала называют номер атома
углерода, при котором находится радикал, затем через дефис называют сам
радикал.
Обратите внимание, что отсутствие дефиса в данном случае считается за
ошибку. Если с основной цепью соединены два различных радикала, то
первым из них указывается наиболее простой.
5. Если с основной цепью соединены два или более одинаковых радикалов, то их
количество указывается с использованием соответствующих префиксов: -ди, три, -тетра и т. д.
4
3
2
H3C CH CH2
CH3
C
O
OH
изовалериановая кислота
3-метилбутановая
ß-метилмасляная






















 Химия
Химия








