Похожие презентации:
Карбоновые кислоты
1.
Карбоновые кислоты• Карбоновые кислоты – это вещества, в молекулах
которых содержится одна или несколько
карбоксильных групп СООН.
• Общая формула предельных одноосновных карбоновых
кислот: СnH2nO2
2.
Классификация карбоновых кислот• По числу карбоксильных групп:
• одноосновные карбоновые кислоты — содержат одну
карбоксильную группу -СООН. Общая
формула CnH2n+1COOH или CnH2nO2.
• многоосновные карбоновые кислоты — содержат две и
более карбоксильные группы СООН. Например, общая
формула двухосновных карбоновых
кислот CnH2n(СОOH)2 или CnH2n-2O4.
3.
• Классификация по строению углеводородного радикала• Предельные карбоновые кислоты – карбоксильная группа
СООН соединена с предельным радикалом. Например,
этановая кислота СН3–СООН.
• Непредельные карбоновые кислоты – карбоксильная группа
СООН соединена с непредельным радикалом. Например,
акриловая кислота: СН2=СН–СООН.
• Ароматические кислоты — карбоксильная группа СООН
соединена с непредельным радикалом. Например, бензойная
кислота: С6Н5СООН.
• Циклические кислоты — карбоксильная группа СООН
соединена с углеводородным циклом. Например,
циклопропанкарбоновая кислота: С3Н5СООН.
4.
Строение карбоновых кислот• Карбоксильная группа сочетает в себе две функциональные
группы – карбонил и гидроксил, взаимно влияющие друг на
друга.
• Электронная плотность смещена к более
электроотрицательному атому кислорода.
• Атом углерода карбоксильной группы находится в состоянии
sp2-гибридизации, образует три σ-связи и одну π-связь.
5.
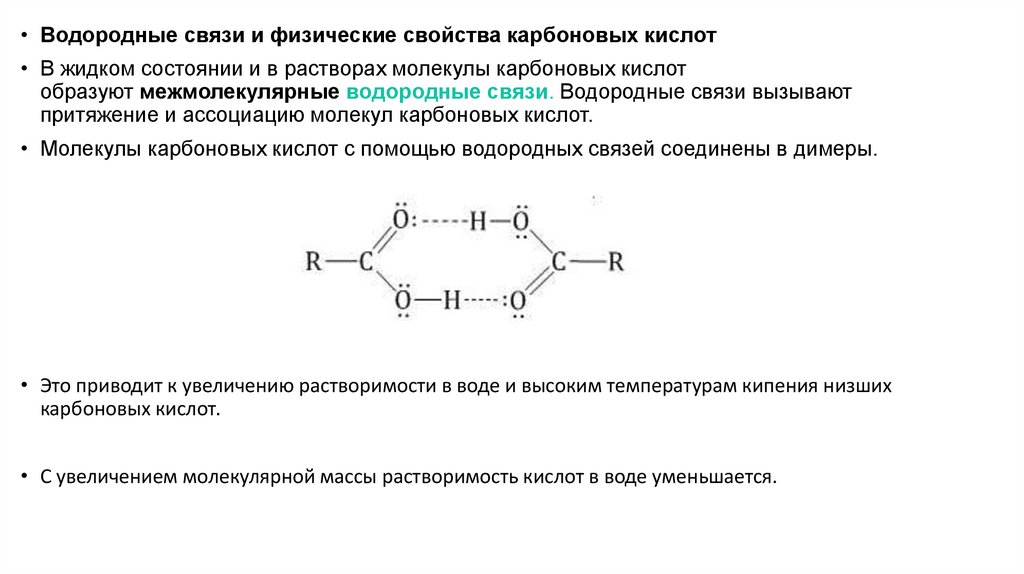
• Водородные связи и физические свойства карбоновых кислот• В жидком состоянии и в растворах молекулы карбоновых кислот
образуют межмолекулярные водородные связи. Водородные связи вызывают
притяжение и ассоциацию молекул карбоновых кислот.
• Молекулы карбоновых кислот с помощью водородных связей соединены в димеры.
• Это приводит к увеличению растворимости в воде и высоким температурам кипения низших
карбоновых кислот.
• С увеличением молекулярной массы растворимость кислот в воде уменьшается.
6.
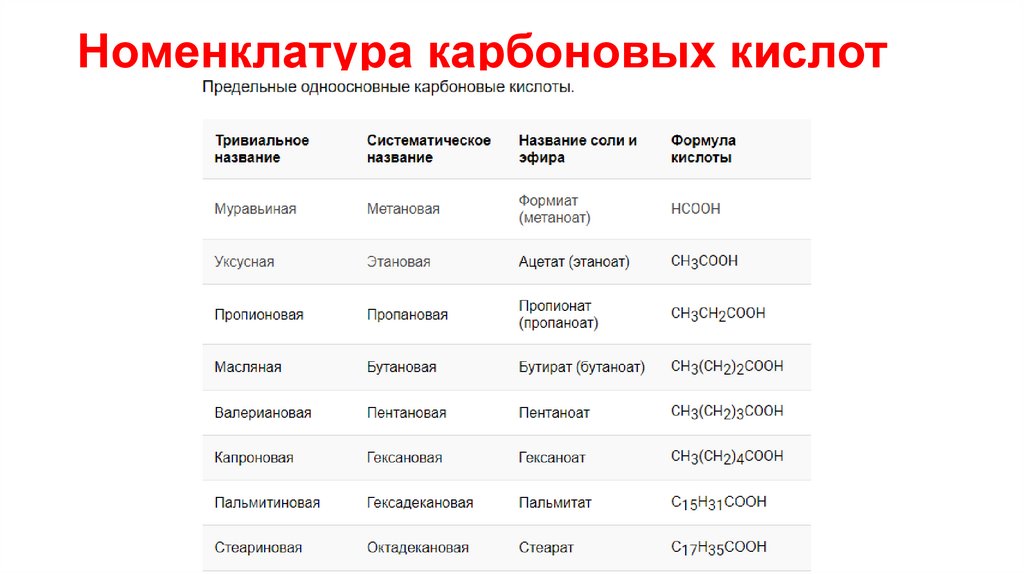
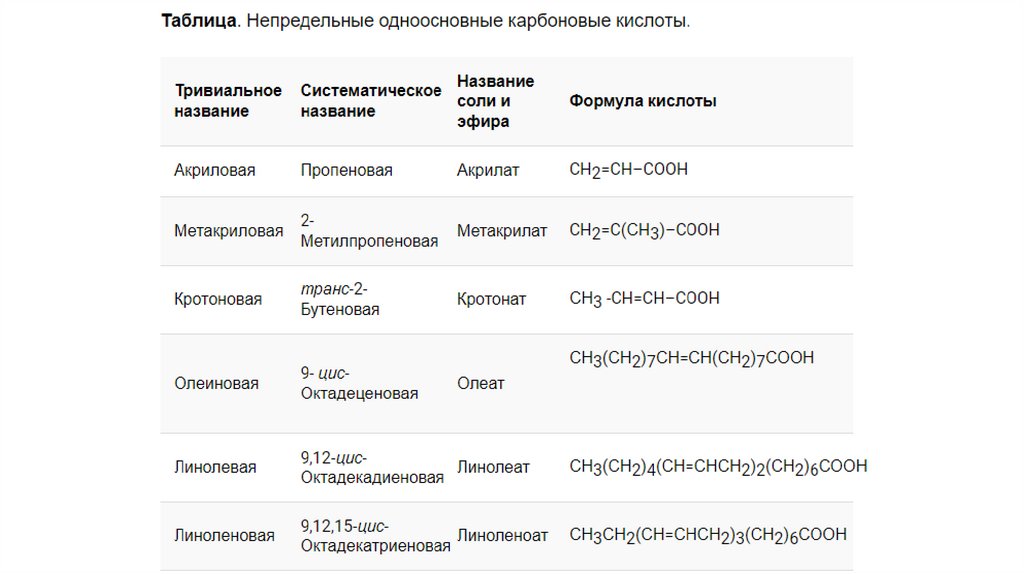
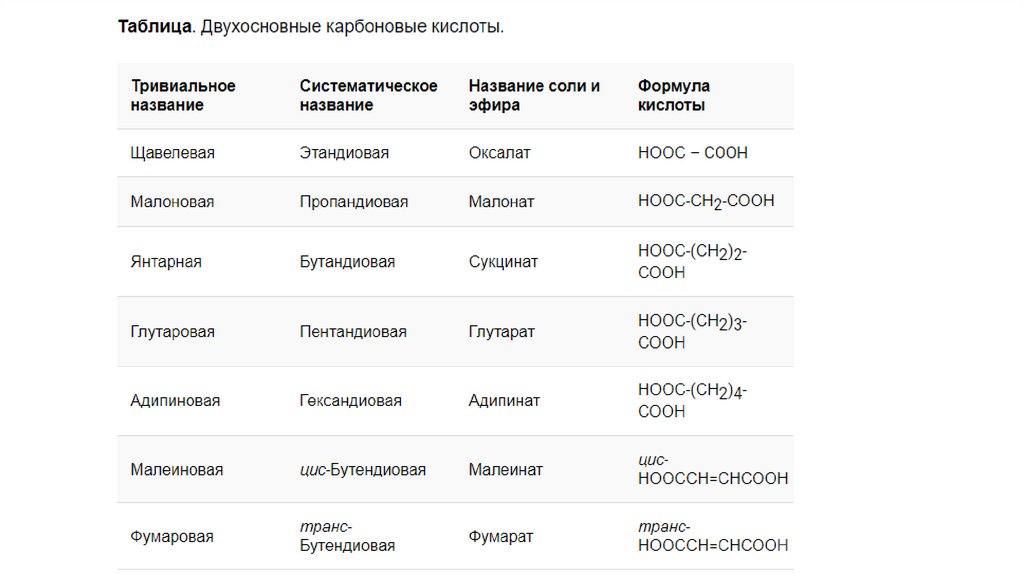
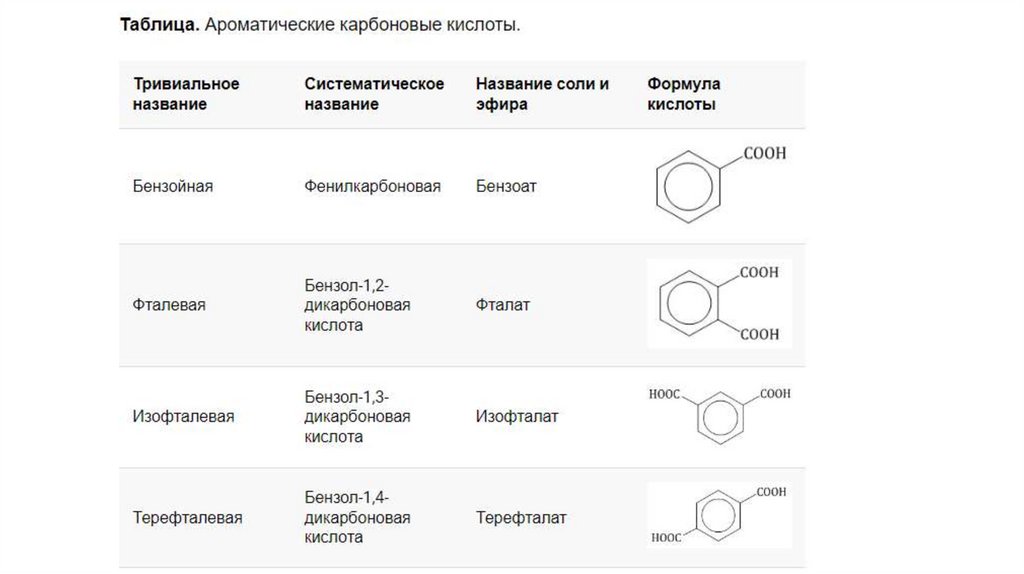
Номенклатура карбоновых кислот7.
8.
9.
10.
Изомерия предельных карбоновыхкислот
• Структурная изомерия
• Для предельных карбоновых кислот
характерна структурная изомерия – изомерия
углеродного скелета и межклассовая изомерия.
• Структурные изомеры – это соединения с одинаковым
составом, которые отличаются порядком связывания
атомов в молекуле, т.е. строением молекул.
• Изомеры углеродного скелета характерна для
карбоновых кислот, которые содержат не менее четырех
атомов углерода.
11.
• Межклассовые изомеры — это вещества разных классовс различным строением, но одинаковым составом.
Карбоновые кислоты изомерны сложным эфирам. Общая
формула и предельных одноосновных карбоновых кислот, и
сложных эфиров — CnH2nО2.
• Общую формулу СnH2nO2 могут также иметь многие другие
полифункциональные соединения,
например: альдегидоспирты, непредельные диолы,
циклические простые диэфиры и т.п.
12.
Химические свойства карбоновыхкислот
• Для карбоновых кислот характерны следующие свойства:
• кислотные свойства, замещение водорода на металл;
• замещение группы ОН
• замещение атома водорода в алкильном радикале
• образование сложных эфиров — этерификация
• 1. Кислотные свойства
• Кислотные свойства карбоновых кислот возникают из-за смещения электронной плотности
к карбонильному атому кислорода и вызванной этим дополнительной (по сравнению со
спиртами и фенолами) поляризацией связи О–Н.
• Карбоновые кислоты – кислоты средней силы.
• В водном растворе карбоновые кислоты частично диссоциируют на ионы:
• R–COOH ⇆ R-COO– + H+
13.
• Карбоновые кислоты реагируют с большинством оснований. При взаимодействиикарбоновых кислот с основаниями образуются соли карбоновых кислот и вода.
• Карбоновые кислоты реагируют с щелочами, амфотерными гидроксидами, водным
раствором аммиака и нерастворимыми основаниями.
• 1.2. Взаимодействие с металлами
• Карбоновые кислоты реагируют с активными металлами. При взаимодействии
карбоновых кислот с металлами образуются соли карбоновых кислот и
водород.
• 1.3. Взаимодействие с основными оксидами
• Карбоновые кислоты реагируют с основными оксидами с образованием солей
карбоновых кислот и воды.
• 1.4. Взаимодействие с с солями более слабых и летучих (или нерастворимых)
кислот
• Карбоновые кислоты реагируют с солями более слабых, нерастворимых и
летучих кислот.
14.
2. Реакции замещения группы ОНДля карбоновых кислот характерны реакции нуклеофильного замещения группы
ОН с образованием функциональных производных карбоновых кислот: сложных
эфиров, амидов, ангидридов и галогенангидридов.
2.1. Образование галогенангидридов
Под действием галогенагидридов минеральных кислот-гидроксидов (пента- или
трихлорид фосфора) происходит замещение группы ОН на галоген.
15.
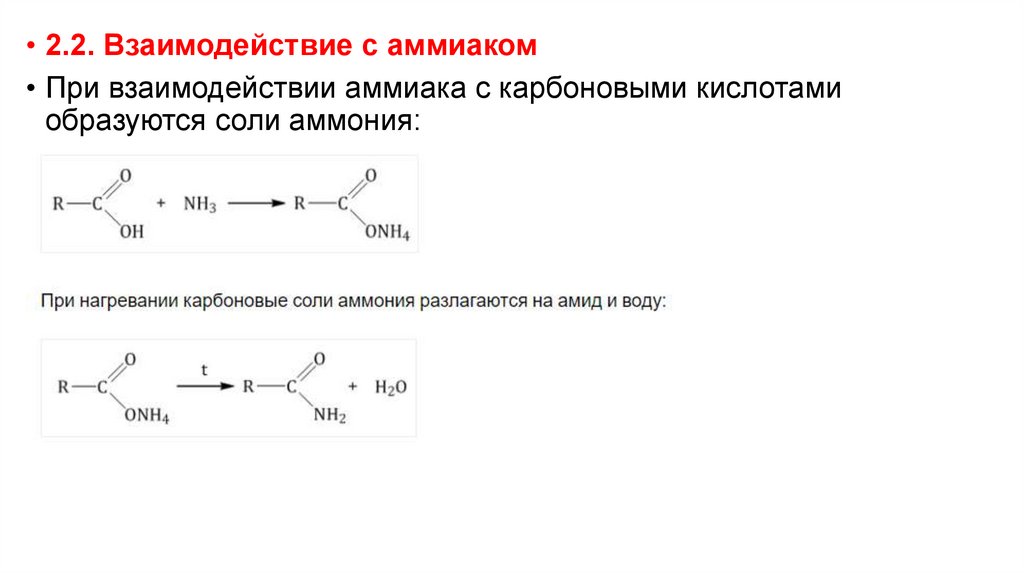
• 2.2. Взаимодействие с аммиаком• При взаимодействии аммиака с карбоновыми кислотами
образуются соли аммония:
16.
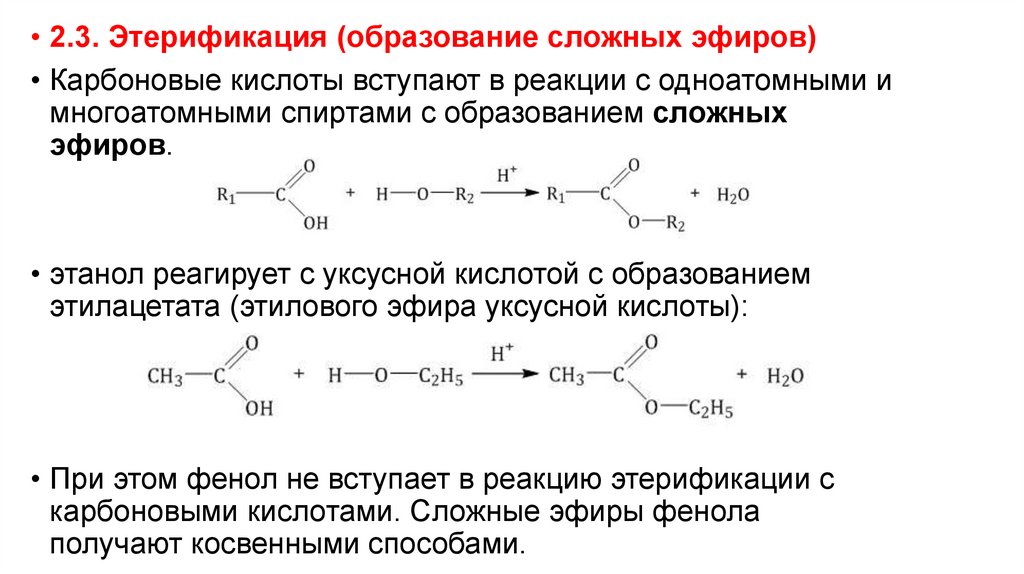
• 2.3. Этерификация (образование сложных эфиров)• Карбоновые кислоты вступают в реакции с одноатомными и
многоатомными спиртами с образованием сложных
эфиров.
• этанол реагирует с уксусной кислотой с образованием
этилацетата (этилового эфира уксусной кислоты):
• При этом фенол не вступает в реакцию этерификации с
карбоновыми кислотами. Сложные эфиры фенола
получают косвенными способами.
17.
• 2.4. Получение ангидридов• С помощью оксида фосфора (V) можно дегидратировать (то
есть отщепить воду) карбоновую кислоту – в результате
образуется ангидрид карбоновой кислоты.
18.
3. Замещение атома водорода приатоме углерода, ближайшем к
карбоксильной группе
• Карбоксильная группа вызывает дополнительную
поляризацию связи С–Н у соседнего с карбоксильной
группой атома углерода (α-положение). Поэтому атом
водорода в α-положении легче вступает в реакции
замещения по углеводородному радикалу.
• В присутствии красного фосфора карбоновые кислоты
реагируют с галогенами.
19.
Получение карбоновых кислот• 1. Окисление спиртов, алкенов и алкинов
• При окислении спиртов, алкенов, алкинов и некоторых других соединений
подкисленным раствором перманганата калия образуются карбоновые кислоты.
• 2. Окисление альдегидов
• Альдегиды реагируют с раствором перманганата или дихромата калия в кислой
среде при нагревании, а также с гидроксидом меди при нагревании.
20.
• 3. Щелочной гидролиз тригалогенидов• Тригалогеналканы, в которых три атома галогена расположены у одного атома
углерода, с избытком щелочи образуется соль кислоты. При этом сначала
происходит замещение галогенов на группы ОН.
Так как щелочь в избытке, то образуется не сама кислота, а её соль.
21.
• 4. Получение карбоновых кислот из солей• Карбоновые кислоты можно получить из солей действием
минеральной кислоты на раствор соли:
• 5. Гидролиз сложных эфиров
• Сложные эфиры подвергаются гидролизу в кислой среде при нагревании:
22.
• 6. Кислотный гидролиз жиров• Под действием кислот жиры гидролизуются до глицерина и
карбоновых кислот, которых входили в молекулу жира.
• 7. Получение муравьиной кислоты из угарного газа
• Соль муравьиной кислоты получают нагреванием оксида
углерода (II) с твёрдым гидроксидом натрия под давлением:
23.
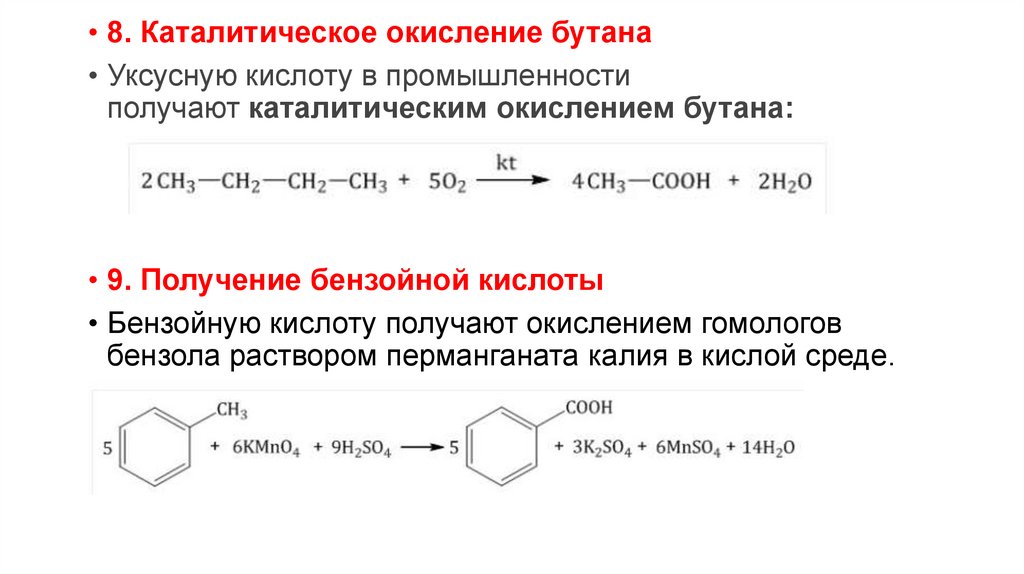
• 8. Каталитическое окисление бутана• Уксусную кислоту в промышленности
получают каталитическим окислением бутана:
• 9. Получение бензойной кислоты
• Бензойную кислоту получают окислением гомологов
бензола раствором перманганата калия в кислой среде.
24.
• 10. Взаимодействие реактива Гриньяра с углекислымгазом
• При взаимодействии реактивов Гриньяра
(алкилгалогенидов магния) с углекислым газом и
последующем гидролизе образовавшегося промежуточного
продукта образуется карбоновая кислота.





















 Химия
Химия








