Похожие презентации:
Комплексные соединения. Мир химии - 2021
1.
IV Международный конкурсучебных презентаций
«МИР ХИМИИ – 2021»
Номинация – 4
«Учебная презентация по теме (11 класс)»
«КОМПЛЕКСНЫЕ
СОЕДИНЕНИЯ»
Автор: Кулишова Ирина Николаевна, учитель
химии МБОУ «Школа №14»
г. Прокопьевска, Кемеровской области
E-mail: ira-kulishova@yandex.ru
2.
Комплексные соединения (лат. Complexus – сочетание, обхват) или, другимисловами, координационные соединения- это частицы (нейтральные молекулы
или ионы), которые образуются в результате присоединения к данному иону
(или атому), называемому комплексообразователем, нейтральных молекул
или других ионов, называемых лигандами.
3.
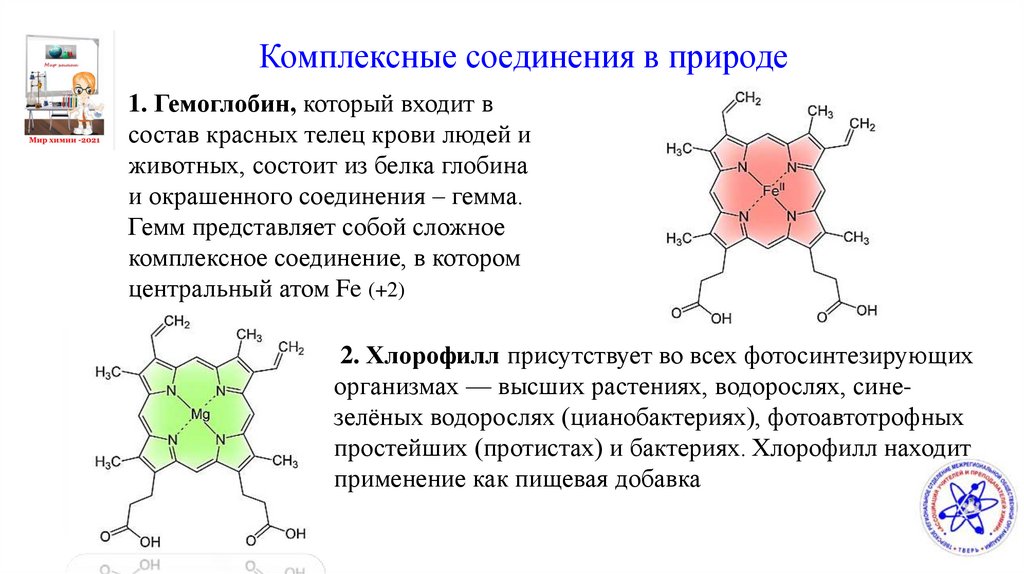
Комплексные соединения в природе1. Гемоглобин, который входит в
состав красных телец крови людей и
животных, состоит из белка глобина
и окрашенного соединения – гемма.
Гемм представляет собой сложное
комплексное соединение, в котором
центральный атом Fe (+2)
2. Хлорофилл присутствует во всех фотосинтезирующих
организмах — высших растениях, водорослях, синезелёных водорослях (цианобактериях), фотоавтотрофных
простейших (протистах) и бактериях. Хлорофилл находит
применение как пищевая добавка
4.
Комплексные соединения в природе3. Многие минералы
3. Витамин В12 – это тоже комплексное соединение,
центральным
Кобальта.
атомом
Витамин
которого
В12
является
влияет
на
атом
жировой,
углеводный и белковый обмены. Стимулирует
образование эритроцитов в костном мозге и рост
аксонов нервных клеток.
4.
Огромное
препаратов
соединения.
количество
представляют
лекарственных
собой
комплексные
5.
Комплексные соединения в природе5. Многие минералы
Гранат (Fe,Mn)3Al2[SiO4]3
Изумруд
Be3Al2[Si6O18]
Бирюза CuAl6(OH)8[PO4]4
6.
Строение комплексных соединенийВ составе комплексного соединения различают две сферы - внутреннюю и
внешнюю.
Цнтральный
ион
или
атом
металла,
называемый
комплексообразователем, удерживает вокруг себя некоторое число ионов,
атомов или групп химически связанных атомов, называемых лигандами (от
лат. ligo -- «связываю»). Комплексообразователь и связанные с ним
лиганды образуют внутреннюю сферу комплекса, которая может быть
нейтральной или иметь заряд (положительный или отрицательный), т. е.
являться
комплексным
ионом.
Внутренняя
сфера
квадратным скобками. Например: [Al(H2O)6]3+ или [Fe(CN)6]3-
обозначается
7.
Строение комплексных соединений8.
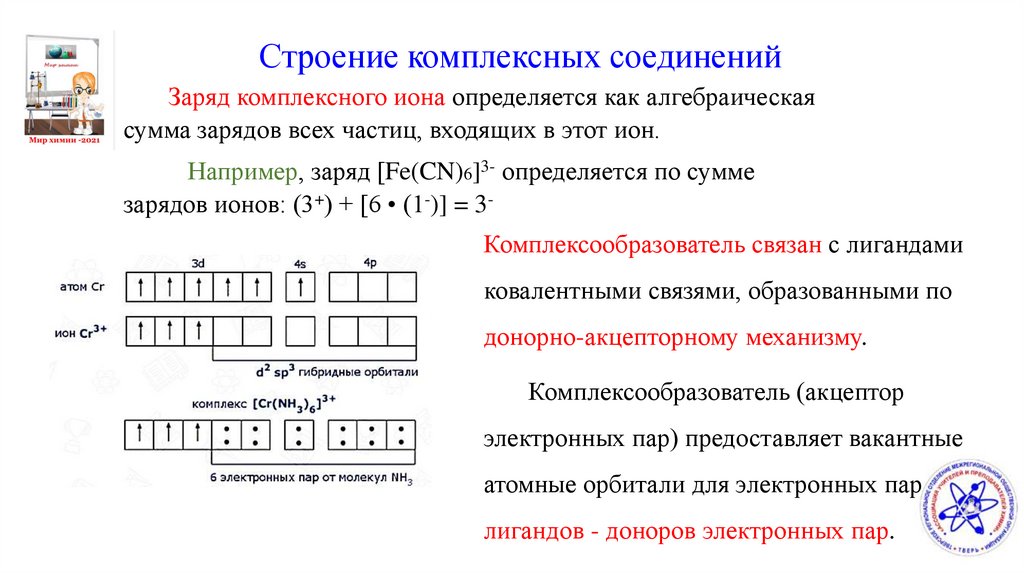
Строение комплексных соединенийЗаряд комплексного иона определяется как алгебраическая
сумма зарядов всех частиц, входящих в этот ион.
Например, заряд [Fe(CN)6]3- определяется по сумме
зарядов ионов: (3+) + [6 • (1-)] = 3Комплексообразователь связан с лигандами
ковалентными связями, образованными по
донорно-акцепторному механизму.
Комплексообразователь (акцептор
электронных пар) предоставляет вакантные
атомные орбитали для электронных пар
лигандов - доноров электронных пар.
9.
Строение комплексных соединенийЗначение координационного числа комплексообразователя зависит от его
природы, степени окисления, природы лигандов и условий (температура,
концентрация), при которых протекает реакция комплексообразования.
Координационное число может иметь значения от 2 до 12. Наиболее
[AlBr4]–
распространенными являются координационные числа 4 и 6. Для
координационного числа 4 структура комплексных частиц может быть
тетраэдрической [AlBr4]–
Комплексные
соединения
и в виде плоского квадрата [Pt(NH3)2Cl2].
с
координационным
числом
октаэдрическое строение [AlF6]3–.
[Pt(NH3)2Cl2]
[AlF6]3–
6
имеют
10.
Строение комплексных соединенийВстречаются комплексы и с другими координационными числами. Лиганды
- анионы и молекулы с неподеленными парами электронов:
анионы (CI-, OH-, F-, CN-, NO2-, SCN- и др.);
полярные молекулы (H2O, NH3, CO, NO и др.);
неполярные, но хорошо поляризующиеся молекулы органических
соединений (H2N-CH, -CH, -NH, - этилендиамин, CO(NH9)2 - мочевина и
др.).
11.
Классификация комплексных соединений1. По составу:
соли (например, K3[Fe(CN)6]
основания (например, [Ag(NH3)2]OH)
кислоты (например, H[AuCl4])
2. По заряду внутренней сферы:
катионный (например, [Cu(NH3)4]2+SO42-)
анионнай (например, K3+ [Fe(CN)6]3-)
нейтральный (например, [Cu(NH3)4]2+[PtCl4]2-)
катионно-анионный (например, [PtCl4(NH3)2]0)
12.
3. По типу координируемых лигандов:Аквакомплексы – это комплексные катионы, в которых лигандами являются молекулы
H2O. Их образуют катионы металлов со степенью окисления +2 и больше, причем
способность к образованию аквакомплексов у металлов одной группы периодической
системы
уменьшается
сверху
вниз.
Примеры
аквакомплексов:
[Al(H2O)6]Cl3,
[Cr(H2O)6](NO3)3.
Гидроксокомплексы – это комплексные анионы, в которых лигандами являются
гидроксид-ионы OH–. Комплексообразователями являются металлы, склонные к
проявлению амфотерных свойств – Be, Zn, Al, Cr. Например: Na[Al(OH)4], Ba[Zn(OH)4].
Аммиакаты – это комплексные катионы, в которых лигандами являются молекулы NH3.
Комплексообразователями являются d-элементы. Например: [Cu(NH3)4]SO4, [Ag(NH3)2]Cl.
Ацидокомплексы – это комплексные анионы, в которых лигандами являются анионы
неорганических и органических кислот. Например: K3[Al(C2O4)3],
Na2[Zn(CN)4], K4[Fe(CN)6].
13.
Номенклатура комплексных соединенийНоменклатура, рекомендованная IUPAC.
а) для анионного комплекса
1. Название комплексного аниона начинается с обозначения состава
внутренней сферы: число лигандов обозначается греческими
числительными: 2–ди, 3–три, 4–тетра, 5–пента, 6–гекса и т.д.
2. Далее следуют названия лигандов, к которым прибавляют соединительную
гласную «о»: Cl– – хлоро-, CN– – циано-, OH– – гидроксо- и т.п.
2. Если у комплексообразователя переменная степень окисления, то в скобках
римскими цифрами указывают его степень окисления, а его название с
суффиксом -ат: Zn – цинкат, Fe – феррат(III), Au – аурат(III).
3. Последним называют катион внешней сферы в родительном падеже.
Примеры:
K3[Fe(CN)6] – гексацианоферрат(III) калия
K4[Fe(CN)6] – гексацианоферрат(II) калия
K2[Zn(OH)4] – тетрагидроксоцинкат калия
14.
Номенклатура комплексных соединенийб) для катионного комплекса
1. Название анионов внешней среды
2. Затем указывается число лигандов
3. Дается латинское название лиганда (молекула аммиака NH3 – аммин,
молекула воды H2O – аква от латинского названия воды) и русское название
элемента-комплексообразователя
4. Римской цифрой в скобках указывается степень окисления элементакомплексообразователя, если она переменная
Например:
[Cu(NH3)4]SO4 – сульфат тетраамминмеди(II)
[Al(H2O)6]Cl3 – хлорид гексаакваалюминия
15.
Номенклатура комплексных соединенийв) Соединений без внешней сферы.
1. Вначале называют лиганды
2. Затем называют комплексообразователь в именительном падеже с
указанием его степени окисления.
3. Все название пишется слитно.
Например
[Ni(CО)4] – тетракарбонилникель (0);
[Pt(NH3)2Cl4] – тетрахлородиамминплатина (IV)
16.
Реакции образования комплексных соединенийКомплексные соединения обычно получают действием избытка лигандов на
содержащее комплексообразователь соединение. Координационное число,
как правило, в 2 раза больше степени окисления комплексообразователя. Из
этого правила бывают, однако, исключения.
Образование гидроксокомплексов.
AlCl3 + 6NaOH(изб) = Na3[Al(OH)6] + 3NaCl
AlCl3 + 4NaOH(изб) = Na[Al(OH)4] + 3NaCl
ZnSO4 + 4NaOH(изб) = Na2[Zn(OH)4] + Na2SO4
17.
Если комплексообразователем является Fe2+ или Fe3+, токоординационные числа в обоих случаях равны шести:
FeCl2 + 6KCN(изб) = K4[Fe(CN)6] + 2KCl
Fe2(SO4)3 + 12KCN(изб) = 2 K3[Fe(CN)6] + 3K2SO4
Координационные числа ртути и меди, как правило, равны
четырем:
Hg(NO3)2 + 4KI(изб) = K2[HgI4] + 2KNO3
CuCl2 + 4NH3(изб) = [Cu(NH3)4]Cl2
Для большинства аква- и амминных комплексов ионов d-элементов
координационное число равно шести:
NiCl2 + 6NH3 (изб) = [Ni(NH3)6]Cl2
18.
Реакции разрушения комплексных соединенийРазрушение комплексных соединений происходит в результате:
• образования малорастворимого соединения с
комплексообразователем:
[Cu(NH3)4]SO4 + Na2S = CuS↓ + 4NH3↑ + Na2SO4
• образования более прочного комплексного соединения с
комплексообразователем или с лигандом:
[Cu(NH3)4]SO4 + 4KCN(изб) = K2[Cu(CN)4] + 4NH3↑ + K2SO4
[Cu(NH3)4]SO4 + 4HCl = 4NH4Cl + CuSO4
• образования малодиссоциированного электролита:
Na2[Zn(OH)4] + 4HCl(изб) = 2NaCl + ZnCl2 + 4H2O
19.
Реакции разрушения комплексных соединений• действия любой сильной кислоты на гидрокомплексы; в этом
случае образуется соль и вода:
К3[Al(OH)6] + 6HCl(изб) = 3KCl + AlCl3 + 6H2O
• нагревания некоторых комплексных соединений:
[Cu(NH3)4]SO4 → CuSO4 + 4NH3↑
Na3[Al(OH)3] → Na3AlO3 + 3H2O
• окислительно-восстановительных реакций:
2Na[Ag(CN)2] + Zn = Na2[Zn(CN)4] + 2Ag
6K4[Fe(CN)6] +K2Cr2O7 +7H2SO4=6K3[Fe(CN)6]
+Cr2(SO4)3 +4K2SO4 +7H2O
20.
Реакции разрушения комплексных соединений• действия любой сильной кислоты на гидрокомплексы; в этом случае
образуется соль и вода:
К3[Al(OH)6] + 6HCl(изб) = 3KCl + AlCl3 + 6H2O
• нагревания некоторых комплексных соединений:
[Cu(NH3)4]SO4 → CuSO4 + 4NH3↑
Na3[Al(OH)3] → Na3AlO3 + 3H2O
• окислительно-восстановительных реакций:
2Na[Ag(CN)2] + Zn = Na2[Zn(CN)4] + 2Ag
6K4[Fe(CN)6] +K2Cr2O7 +7H2SO4=6K3[Fe(CN)6]+Cr2(SO4)3 +4K2SO4 +7H2O
21.
Диссоциация комплексных соединенийКомплексные
соединения
в
водных
растворах
практически полностью диссоциируют на внешнюю и внутреннюю
сферы. В то же время комплексный ион диссоциирует в незначительной
степени
как
ассоциированный
электролит.
Количественной
характеристикой диссоциации внутренней сферы в растворе является
константа нестойкости, представляющая собой константу равновесия
процесса диссоциации комплексного иона.
Например,
в
растворе
комплексное
соединение
[Ni(NH3)6]SO4 диссоциирует следующим образом:
[Ni(NH3)6]SO4 = [Ni(NH3)6]2+ + SO42-
22.
Диссоциация комплексных соединенийДля комплексного иона [Ni(NH3)6]2+, диссоциирующего по уравнению
[Ni(NH3)6]2+ → Ni2+ + 6NH3
константа равновесия процесса диссоциации носит название константы
нестойкости Кн. Для рассматриваемого процесса Кн равна
Кн = [Ni2+]·[NH3]6 / [[Ni(NH3)6]2+]
(1)
Величина, обратная Кн, называется константой устойчивости:
Ку = 1/Кн
(2)
Она представляет собой константу равновесия процесса образования
комплексного иона: Ni2+ + 6NH3 ↔ [Ni(NH3)6]2+
Константа нестойкости Кн связана с изменением энергии Гиббса процесса
диссоциации комплекса уравнением:
ΔGTо = — RTln Кн
23.
Применение комплексных соединенийГальванические покрытия – защита одного металла другим. Например,
медное покрытие крепко соединяется с железом, если использовать в
процессе комплексные соединения.
Электролитическое получение металлов. Например, алюминий в
расплаве криолита образует комплекс Nа3[AlF6]. Из расплавов
соединений комплексных солей получают такие металлы, как Nb, Tl,
Th, Mg.
Защита металлов от коррозии. Ингибиторы – комплексные соли, где
лигандами выступают и органические вещества.
24.
Применение комплексных соединений• Аналитическая химия. Многие индикаторы, реактивы, которые помогают
распознать вещества, ионы и даже заряды ионов, – комплексные
соединения. Катион Fe2+ можно распознать в реакции с
гексацианоферратом(III) калия:
FeCl2 + K3[Fe(CN)6] = KFe[Fe(CN)6] + 2 KCl
образуется синий осадок (турнбулева синь).
Катион Fe3+ можно распознать гексацианоферратом(II) калия:
4FeCl3 + 3K4[Fe(CN)6] = Fe4[Fe(CN6)]3 + 12KCl
Образуется темно-синий осадок (берлинская лазурь)
25.
Применение комплексных соединенийПолучение металлов. Например золота: золотой песок растворяется в
растворе цианида натрия (NaCN) в присутствии кислорода и воды, потому
что образуется очень устойчивое комплексное соединение золота:
4Au + O2 + 2H2O + 8NaCN = 4Na[Au(CN)2] + 4NaOH.
Из полученного комплекса золото вытесняют цинком:
Zn + 2Na[Au(CN)2] = Na2[Zn(CN)4] + 2Au
Фотографический процесс также немыслим без комплексных соединений.
Комплексные соединения платины, Co(III), Fe(III) используются в
химиотерапии при лечении раковых заболеваний и влияют на развитие
раковых клеток
26.
Список литературы и интернетресурсов1.
2.
3.
4.
5.
6.
7.
https://yandex.ru/images/search?pos
https://yandex.ru/images/search?pos=10&img_url
https://vk.com/feed?z=photo553063225_457240170%2Fwall553063225_664
https://chemege.ru/complex/
https://him.1sept.ru/view_article.php?ID=200900805
https://www.chemport.ru/forum/viewtopic.php?t=3660
https://infourok.ru/go.html?href=http%3A%2F%2Fstudopedia.ru%2F3_100699_kompleksniesoedineniya-v-prirode-i-tehnologii.html
8. https://ru.wikipedia.org/wiki/
9. http://www.studfiles.ru/preview/5363016/page:4/
10.https://yandex.ru/images/search?pos=1&img
11.Глинка Н.Л. «Общая химия», Издательство «Химия», 1974; Издательство «Химия», 1977
12.Тополева Н.Н. «Комплексные соединения» «Первое сентября» №8 2008
























 Химия
Химия








