Похожие презентации:
Химия: экологическая физическая химия
1.
Химия: экологическая физическая химияКафедра прикладной экологии ИнЭиП
доцент Валеева Гузель Равильевна
Часть I.
ОСНОВНЫЕ ЗАКОНЫ
термодинамики и
молекулярной
физики
Лекция 3 (2 сем).
Термодинамические процессы и
цикл Карно
Обратимые и необратимые термодинамические процессы.
Круговой процесс, его КПД.
2-е начало термодинамики. Невозможность вечного двигателя.
Цикл Карно, 2 теоремы Карно.
Понятие об энтропии. Второй закон термодинамики.
2021
1
+4
2.
1. Обратимые и необратимые термодинамическиепроцессы. Квазистатические процессы
□
Как показывает опыт, многие тепловые процессы могут протекать только в одном
направлении. Такие процессы называются необратимыми.
■
Например, при тепловом контакте двух тел с разными температурами
тепловой поток всегда направлен от более теплого тела к более холодному.
■
Никогда не наблюдается самопроизвольный процесс передачи тепла от
тела с низкой температурой к телу с более высокой температурой.
■
Следовательно, процесс теплообмена при конечной разности температур
является необратимым.
□
Другие примеры необратимых процессов:
■
■
□
□
□
□
расширение газа в пустоту,
теплопередача.
Обратимый термодинамический процесс – это такой термодинамический
процесс , который он может быть проведен как в прямом, так и в обратном
направлении через одни и те же состояния.
■
При этом сама система и окружающие тела возвращаются к исходному
состоянию.
Процессы, в ходе которых система все время остается в состоянии равновесия,
называются квазистатическими.
Все квазистатические процессы обратимы.
Все обратимые процессы являются квазистатическими.
2
+7
3.
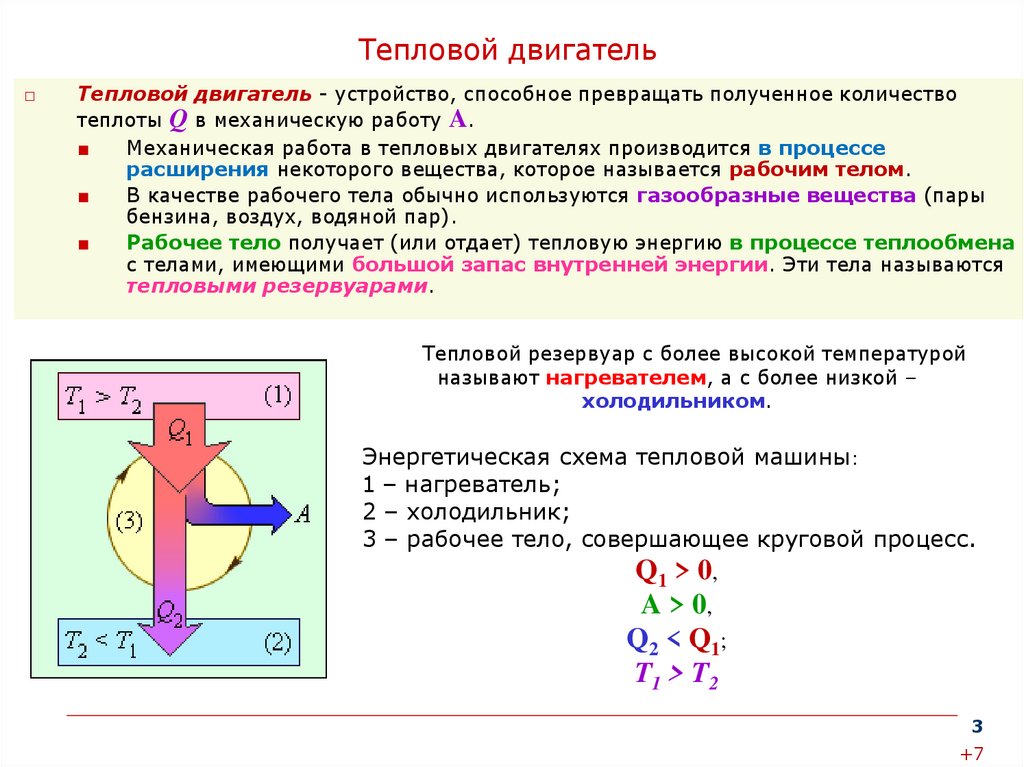
Тепловой двигатель□
Тепловой двигатель - устройство, способное превращать полученное количество
теплоты Q в механическую работу A.
■
Механическая работа в тепловых двигателях производится в процессе
расширения некоторого вещества, которое называется рабочим телом.
■
В качестве рабочего тела обычно используются газообразные вещества (пары
бензина, воздух, водяной пар).
■
Рабочее тело получает (или отдает) тепловую энергию в процессе теплообмена
с телами, имеющими большой запас внутренней энергии. Эти тела называются
тепловыми резервуарами.
Тепловой резервуар с более высокой температурой
называют нагревателем, а с более низкой –
холодильником.
Энергетическая схема тепловой машины:
1 – нагреватель;
2 – холодильник;
3 – рабочее тело, совершающее круговой процесс.
Q1 > 0 ,
A > 0,
Q 2 < Q1 ;
T1 > T2
3
+7
4.
2. Круговой процесс. Равновесные циклы□
□
□
□
□
Реально существующие тепловые двигатели (паровые машины, двигатели
внутреннего сгорания и т. д.) работают циклически.
Процесс теплопередачи и преобразования полученного количества теплоты в работу
периодически повторяется.
Для этого рабочее тело должно совершать круговой процесс или
термодинамический цикл, при котором периодически восстанавливается
исходное состояние.
Цикл или круговой процесс - это процесс, при котором система, пройдя через ряд
состояний, возвращается в исходное.
На диаграмме pV равновесный цикл изображается замкнутой кривой.
Работа за цикл
□
Если за цикл совершается положительная работа А > 0 , а сам цикл
осуществляется по ходу часовой стрелки , то он называется прямым циклом.
□
Если за цикл выполняется отрицательная работа А < 0 , а сам цикл протекает
против хода часовой стрелки, то он называется обратным циклом.
4
+7
5.
3. Второе начало термодинамики.Понятие прямого и обратного цикла
□
□
□
□
□
Второе начало термодинамики указывает на направленность
самопроизвольного термодинамического процесса в замкнутой системе.
Две формулировки:
1. Невозможен процесс, единственным результатом которого является передача
энергии в форме теплоты от менее нагретого тела к более нагретому
(формулировка Клаузиуса).
2. Невозможен процесс, единственным результатом которого является
превращение всей теплоты, полученной от нагревателя, в эквивалентную работу
(формулировка Кельвина).
Прямой цикл реализуется в тепловом двигателе — периодически действующем
устройстве, которое совершает работу за счет полученной от нагревателя теплоты
Q.
Обратный цикл используется в холодильных установках - периодически
действующих устройствах, в которых за счет работы А внешних сил теплота
переносится от более холодного тела к телу с более высокой температурой.
Общее свойство всех круговых процессов состоит в том, что их
невозможно провести, приводя рабочее тело в тепловой контакт только с
одним тепловым резервуаром.
Их нужно, по крайней мере, два: нагреватель и холодильник.
5
+6
6.
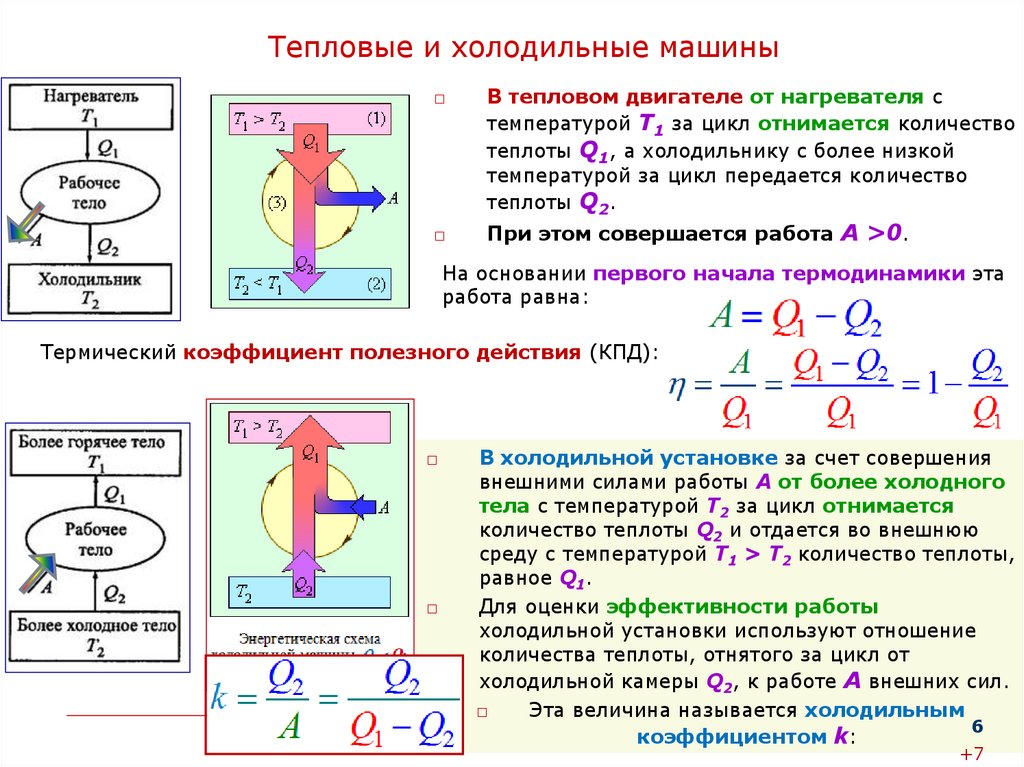
Тепловые и холодильные машины□
В тепловом двигателе от нагревателя с
температурой Т1 за цикл отнимается количество
теплоты Q1, а холодильнику с более низкой
температурой за цикл передается количество
теплоты Q2.
□
При этом совершается работа А >0.
На основании первого начала термодинамики эта
работа равна:
Термический коэффициент полезного действия (КПД):
□
□
В холодильной установке за счет совершения
внешними силами работы А от более холодного
тела с температурой T2 за цикл отнимается
количество теплоты Q2 и отдается во внешнюю
среду с температурой Т1 > Т2 количество теплоты,
равное Q1.
Для оценки эффективности работы
холодильной установки используют отношение
количества теплоты, отнятого за цикл от
холодильной камеры Q2, к работе А внешних сил.
□
Эта величина называется холодильным
6
коэффициентом k:
+7
7.
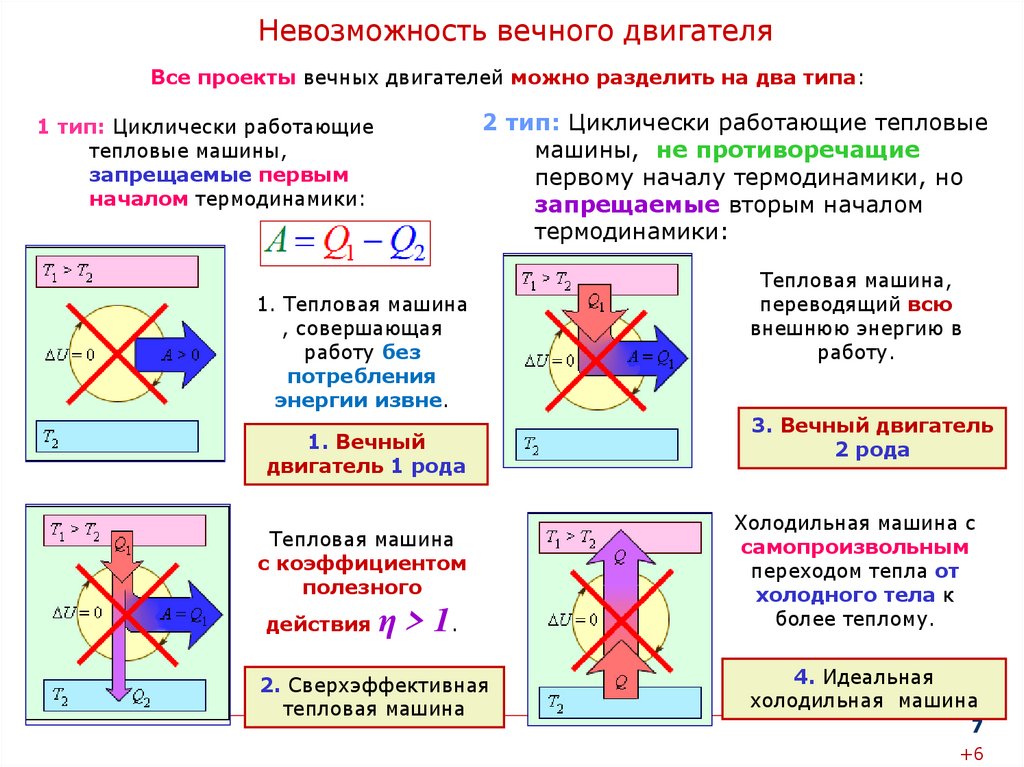
Невозможность вечного двигателяВсе проекты вечных двигателей можно разделить на два типа:
2 тип: Циклически работающие тепловые
машины, не противоречащие
первому началу термодинамики, но
запрещаемые вторым началом
термодинамики:
1 тип: Циклически работающие
тепловые машины,
запрещаемые первым
началом термодинамики:
1. Тепловая машина
, совершающая
работу без
потребления
энергии извне.
1. Вечный
двигатель 1 рода
Тепловая машина
с коэффициентом
полезного
действия
η > 1.
2. Сверхэффективная
тепловая машина
Тепловая машина,
переводящий всю
внешнюю энергию в
работу.
3. Вечный двигатель
2 рода
Холодильная машина с
самопроизвольным
переходом тепла от
холодного тела к
более теплому.
4. Идеальная
холодильная машина
7
+6
8.
4. Примеры циклов. Цикл Карно и теоремы Карно□
□
□
В двигателях, применяемых в технике, используются различные круговые
процессы.
На рисунках изображены циклы, используемые в бензиновом карбюраторном и в
дизельном двигателях.
В обоих случаях рабочим телом является смесь паров бензина или дизельного
топлива с воздухом.
Цикл дизельного
Цикл карбюраторного
двигателя внутреннего
двигателя внутреннего
сгорания состоит из:
сгорания состоит из:
двух адиабат (1–2, 3–4),
двух изохор (1–2, 3–4) и
одной изобары (2–3) и
двух адиабат (2–3, 4–1).
одной изохоры (4–1).
Реальный коэффициент
Реальный коэффициент
полезного действия у
полезного действия у
карбюраторного
дизельного двигателя –
двигателя порядка 30 %.
порядка 40 %.
□
□
□
Цикл Карно – это цикл , состоящий из двух
адиабат и двух изотерм.
В обратимом цикле Карно тепло, отнятое от тела,
превращается в максимально возможную
механическую работу.
В данном цикле должны отсутствовать
необратимые процессы теплопроводности.
8
+7
9.
Цикл Карно и теоремы КарноИдеализированный
вид
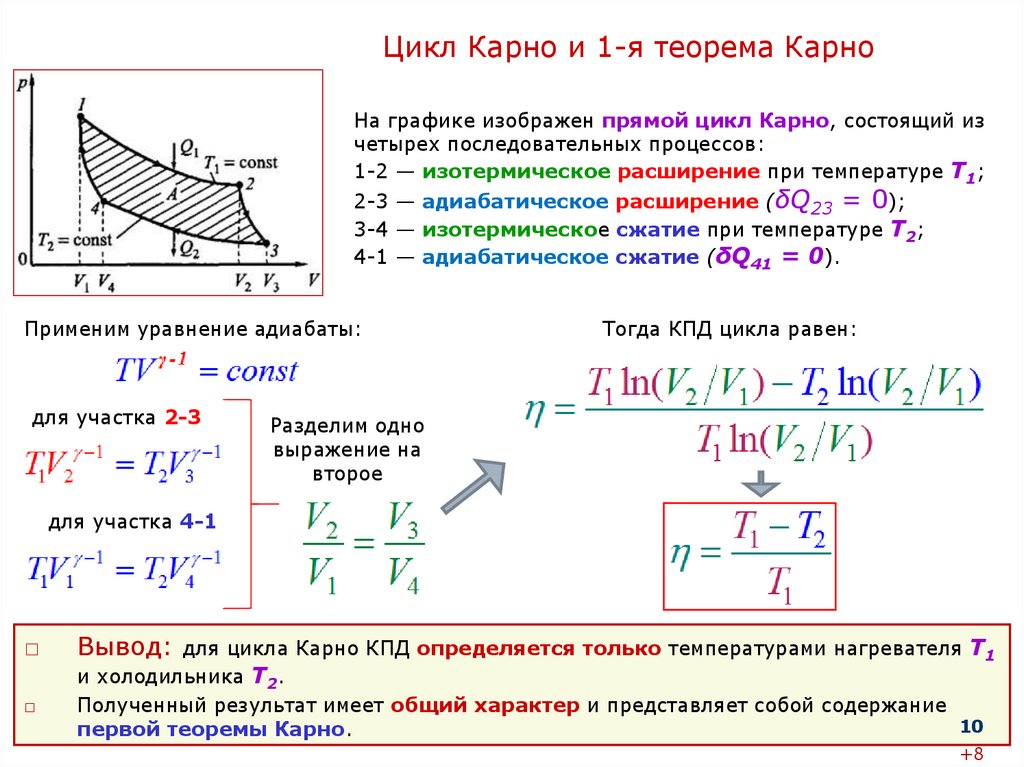
На графике изображен прямой цикл Карно, состоящий из
четырех последовательных процессов:
1-2 — изотермическое расширение при температуре Т1;
2-3 — адиабатическое расширение (δQ23 = 0);
3-4 — изотермическое сжатие при температуре T2;
4-1 — адиабатическое сжатие (δQ41 = 0).
□
Более реальный
вид
□
□
На всех стадиях рассмотренного кругового процесса нигде не
допускается соприкосновение двух тел с различными
температурами, и, таким образом, исключается
необратимый процесс теплопроводности.
Весь цикл проводится, следовательно, обратимым путем.
Данный цикл протекает независимо от вида рабочего тела.
Найдем КПД цикла, в котором рабочим телом является
идеальный газ.
□
При изотермическом расширении на участке 1-2 количество теплоты Q1 полученное газом от
нагревателя, равно работе расширения, совершаемой газом при переходе из состояния 1 в состояние
2:
Термический КПД цикла Карно по определению:
Теплота, отданная газом
холодильнику (участок 3-4):
9
+6
10.
Цикл Карно и 1-я теорема КарноНа графике изображен прямой цикл Карно, состоящий из
четырех последовательных процессов:
1-2 — изотермическое расширение при температуре Т1;
2-3 — адиабатическое расширение (δQ23 = 0);
3-4 — изотермическое сжатие при температуре T2;
4-1 — адиабатическое сжатие (δQ41 = 0).
Применим уравнение адиабаты:
для участка 2-3
Тогда КПД цикла равен:
Разделим одно
выражение на
второе
для участка 4-1
□
□
Вывод: для цикла Карно КПД определяется только температурами нагревателя Т1
и холодильника Т2.
Полученный результат имеет общий характер и представляет собой содержание
10
первой теоремы Карно.
+8
11.
2-я теорема КарноКПД обратимого цикла Карно не зависит от природы рабочего тела и от технических
способов осуществления цикла.
Сравнение КПД различных обратимых и необратимых циклов с КПД обратимого цикла
Карно (идеальной тепловой машины) позволило сделать следующий вывод (вторая
теорема Карно):
■
КПД любого реального обратимого или необратимого прямого кругового
□
□
η
процесса (тепловой машины) любого не может превышать КПД обратимого
цикла Карно ηКарно при одинаковых температурах Т1 нагревателя и Т2
холодильника:
Тогда:
□
□
Обратный цикл Карно служит основой
работы идеальной холодильной установки.
Для холодильного коэффициента k :
Вывод: чем меньше разность между температурами окружающей среды Т1 и
холодильной камеры Т2, тем больше холодильный коэффициент k и тем
эффективнее работа холодильной установки.
11
+7
12.
2.6. Второй законтермодинамики
2.6.2. Самопроизвольные и
несамопроизвольные процессы
Существуют явления, которые происходят сами
по себе, и явления, которые сами по себе
происходить не могут (приведите примеры).
Самопроизвольные процессы – это
процессы, которые совершаются без внешнего
воздействия (затрат энергии извне).
Несамопроизвольные процессы – это
процессы, которые происходят под
воздействием каких-либо усилий (затрат
энергии извне).
12
13.
2. Химическая термодинамика2.6. Второй закон
термодинамики
Самопроизвольные
Несамопроизвольные
процессы
процессы
1. Сжатие газа
1. Камень скатывается с
горы
2. Ржавление железа
р
а
б
о
2. Работа холодильника
т
3. Электролиз воды
3. Круговорот
воды
4. Диффузия в газах и
жидкостях
5. Распад электролитов на ионы в
водных растворах:
13
4. Накачивание
велосипедной шины
насосом
14.
2. Химическая термодинамика2.6. Второй закон
термодинамики
14
15.
2.6. Второй законтермодинамики
Самопроизвольный процесс –переход
тепла от горячего тела к холодному
Самопроизвольный процесс –расширение
газа в вакуум
15
Необратимые
процессы
самопроизвольно идут только в
одном определённом направлении
- в направлении выравнивания
интенсивного
параметра
(температуры, давления, заряда,
уровня
горизонтального
положения,
химического
потенциала и т.д.) до тех пор, пока
это выравнивание не произойдет и
процесс станет равновесным.
Т₁ =Т₂ термическое
равновесие
p₁ = p₂ механическое равновесие
µ˛¹ = µ˛² химическое равновесие
16.
2.6. Второй законтермодинамики
Как определить, будет ли процесс протекать
самопроизвольно или нет?
Принцип Бертло-Томсена (середина 19 века): из числа возможных
реакций происходит та, которая сопровождается наибольшим
выделением тепла.
Согласно этому принципу самопроизвольно могут протекать только
экзотермические реакции:
А + В → АВ
при ΔΗ < 0
А + В → С + D при ΔΗ < 0
Установлено, что для
соблюдается, однако
зависимость:
95%
для
NH4NO3 → NH4+ aq+ NO3_aq
N2O4 → 2NO2
всех необратимых реакций принцип
5% реакций существует обратная
ΔΗ > 0
ΔΗ > 0
Следовательно,
самопроизвольно
могут
происходить
и
эндотермические процессы, если в результате их система переходит в
более разупорядоченное состояние.
16 Итак,
выделение
или
поглощение
системой
теплоты
(энтальпийный фактор) не позволяет судить о возможности
17.
2. Химическая термодинамика2.6. Второй закон термодинамики
Первый закон термодинамики не может
отличить обратимые процессы от необратимых.
Он просто требует от термодинамического
процесса (в том числе и химических реакций)
определенного энергетического баланса и
ничего не говорит о том, возможен такой
процесс или нет.
Направление самопроизвольно протекающих
процессов устанавливает второй закон
термодинамики.
17
18.
2.6. Второй законтермодинамики
2.6.3. Формулировки второго закона
термодинамики
«Чудес не бывает»
Второй закон термодинамики устанавливает, возможен
или невозможен при данных условиях тот или иной
процесс и каким будет его результат при заданных
условиях
Второй закон термодинамики дает ответы на вопросы:
В каком направлении будет в действительности
протекать процесс
2.
При каком соотношении концентраций установится
состояние равновесия химической реакции
3.
Как температура и давление влияют на состояние
равновесия реакции
18
1.
19.
2. Химическая термодинамика2.6. Второй закон термодинамики
Формулировки второго закона термодинамики:
Формулировка Клаузиуса: (1850): теплота сама по себе не
может перейти от более холодного тела к более теплому,
тогда как передача теплоты от теплого тела к холодному
может быть единственным результатом процессов
Формулировка Томсона: (1851): никакая совокупность
процессов не может сводиться только к превращению
теплоты в работу, тогда как превращение работы в
теплоту
может
быть
единственным
результатом
процесса.
Формулировка Оствальда: невозможно создание вечного
двигателя второго рода, т.е. такой машины, которая
производила бы работу только за счет поглощения
теплоты из окружающей среды без передачи части
теплоты холодильнику (невозможно всю внутреннюю
энергию системы превратить в работу).
Формулировка
Больцмана:
изолированная
система
эволюционирует
преимущественно
в
направлении
большей термодинамической вероятности.
19
20.
2. Химическая термодинамика2.6. Второй закон термодинамики
Термодинамическая формулировка второго
закона:
Существует
экстенсивная
функция
состояния
термодинамической системы, называемая энтропией S,
изменение
которой
в
изолированной
системе*
следующим образом связано с поглощаемой теплотой и
температурой:
;
ΔS>0
самопроизвольный процесс
;
ΔS=0
равновесный
(обратимый) процесс
;
несамопроизвольный процесс
20
ΔS<0
21.
2.6. Второй законтермодинамики
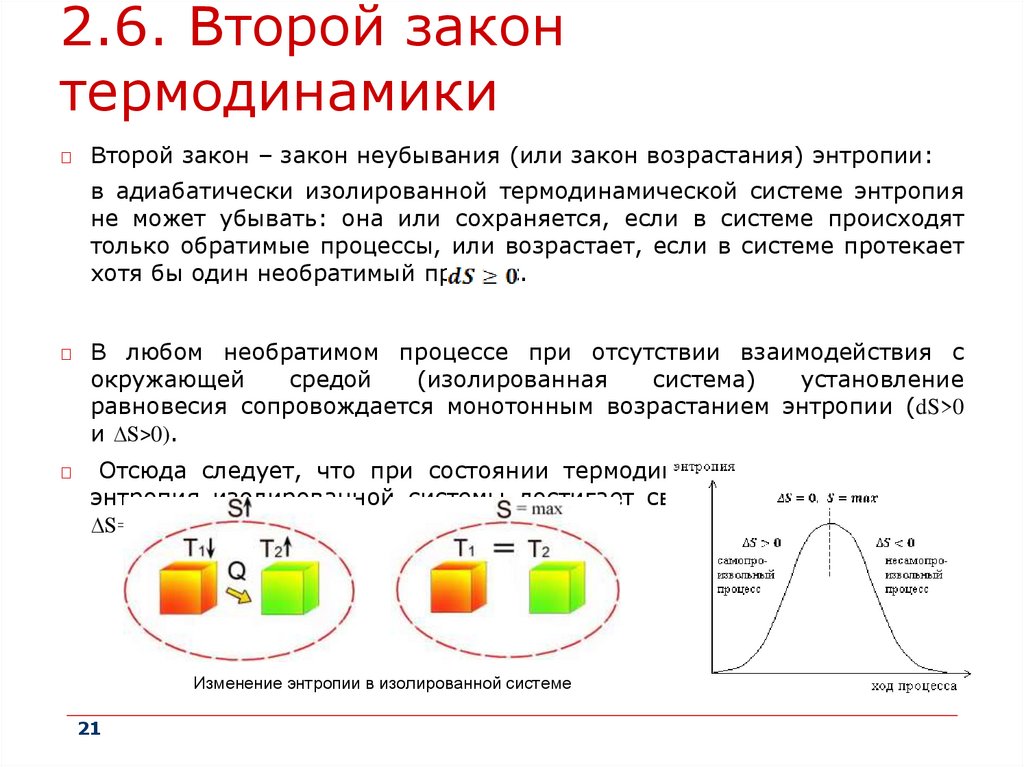
Второй закон – закон неубывания (или закон возрастания) энтропии:
в адиабатически изолированной термодинамической системе энтропия
не может убывать: она или сохраняется, если в системе происходят
только обратимые процессы, или возрастает, если в системе протекает
хотя бы один необратимый процесс.
В любом необратимом процессе при отсутствии взаимодействия с
окружающей
средой
(изолированная
система)
установление
равновесия сопровождается монотонным возрастанием энтропии (dS>0
и ∆S>0).
Отсюда следует, что при состоянии термодинамического равновесия
энтропия изолированной системы достигает своего максимума (dS=0 и
∆S=0).
Изменение энтропии в изолированной системе
21
22.
2. Химическая термодинамика2.7. Энтропия
Понятие энтропии было
впервые введено в 1865 году
Рудольфом Клаузиусом.
Изменение энтропии
термодинамической системы
при обратимом процессе
есть отношение изменения
общего количества тепла,
которым система обменивается
с окружающей средой, ΔQ к
величине абсолютной
температуры T:
22
Clausius, Rudolf Julius
Emanuel
1822-1888
23.
2. Химическая термодинамика2.7. Энтропия
Физический смысл энтропии
- количество связанной
энергии, отнесенное к одному градусу:
Энтропия
- это термодинамическая функция состояния,
то есть любому состоянию соответствует вполне
определенное значение энтропии.
Энтропия определяет возможность, направленность и
предел всех процессов.
Энтропия
выражает
способность
энергии
к
превращениям: чем больше энтропия системы, тем
меньше заключенная в ней энергия способна к
превращениям.
23
http://www.youtube.com/watch?v=xyDJCqd86Wc
24.
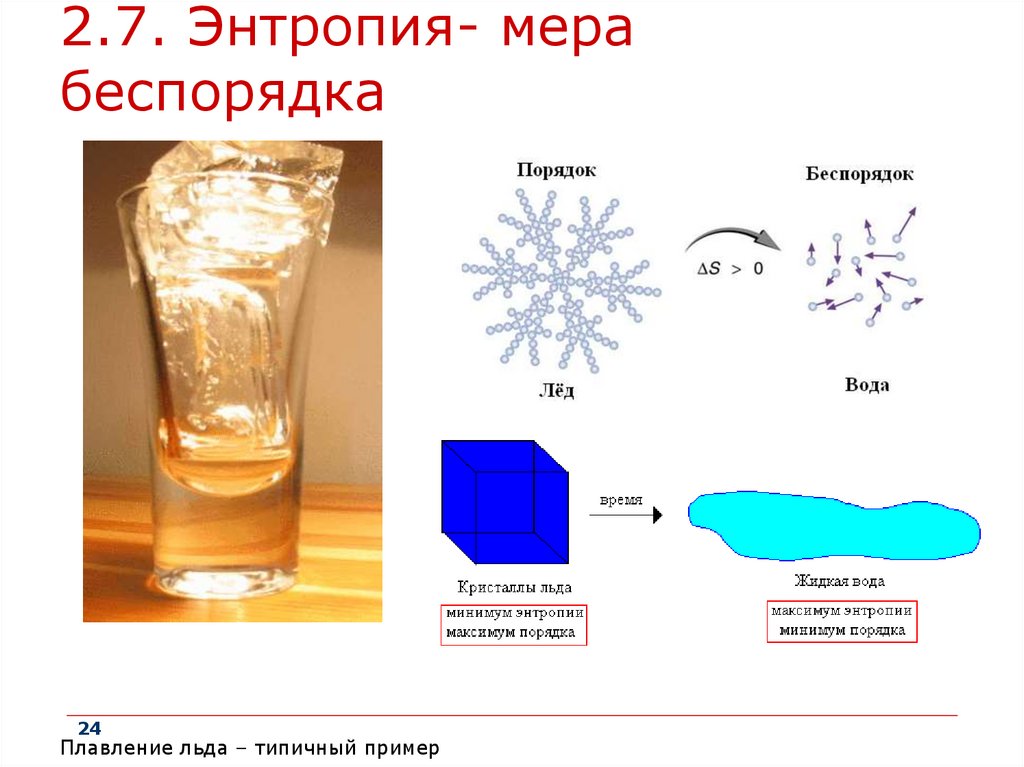
2.7. Энтропия- мерабеспорядка
24
Плавление льда – типичный пример
25.
2. Химическая термодинамика2.7. Энтропия
Энтропия характеризует
направление протекания
самопроизвольных процессов в
термодинамической закрытой
системе.
Неравенство Клаузиуса
Для обратимых процессов энтропия
остается постоянной
25
26.
2. Химическая термодинамика2.7. Энтропия
Энтропия – экстенсивное свойство
системы, зависит от количества
вещества (массы) и его природы, а
также от температуры
Мольная энтропия
26
27.
2. Химическая термодинамика2.7. Энтропия
Энтропия зависит от:
агрегатного состояния вещества;
энтропия увеличивается при
переходе от твердого к жидкому и
особенно к газообразному
состоянию (вода, лед, пар);
изотопного состава (H2O и D2O);
молярной массы однотипных
соединений (CH4, C2H6, н-C4H10);
строения молекулы (н-C4H10, изоC H );
27
28.
2. Химическая термодинамика2.7. Энтропия
Энтропия – функция состояния, поэтому ее изменение не
зависит от пути процесса, а определяется только
начальным и конечным состоянием системы:
В химической термодинамике широко используют
следующие понятия:
стандартная энтропия S0, т.е. энтропия при давлении
р=1,013·105 Па (1 атм) и температуре 298К (25°С);
стандартная энтропия химической реакции, т.е. разница
стандартных энтропий продуктов и реагентов
28
29.
2. Химическая термодинамика2.7. Энтропия
29
30.
2. Химическая термодинамика2.7. Энтропия
Энтропия подчиняется закону
аддитивности, т.е энтропия
равновесной системы равна сумме
энтропий отдельных ее частей, а
изменение энтропии всей системы
равно сумме изменений энтропии
ее частей.
Изменение энтропии в сложном
процессе равно сумме изменений
30
31.
2. Химическая термодинамика2.7. Энтропия
Для обратимых процессов второй
закон термодинамики выступает
как закон о существовании и
сохранении энтропии:
при обратимых процессах в
изолированной системе энтропия
остается постоянной.
Если обратимый процесс протекает
в неизолированной системе, то её
энтропия может меняться, но тогда
изменяется и энтропия
31
32.
2. Химическая термодинамика2.7. Энтропия
Для необратимых процессов второй закон
термодинамики – это закон существования и
возрастания энтропии:
при протекании необратимого
самопроизвольного процесса в изолированной
системе энтропия возрастает.
В неизолированной системе могут протекать
процессы, в которых энтропия системы
уменьшается, но это сопровождается
возрастанием энтропии тел, находящихся во
внешней среде и взаимодействующих с
системой, на величину, равную или
превосходящую уменьшение энтропии системы.
32
33.
2. Химическая термодинамика2.7. Энтропия
Статистическая формулировка энтропии
В 1878 году Л. Больцман дал вероятностную трактовку понятия
энтропии. Он предложил рассматривать энтропию как меру
статистического беспорядка в замкнутой термодинамической
системе. Все самопроизвольно протекающие процессы в замкнутой
системе, приближающие систему к состоянию равновесия и
сопровождающиеся
ростом
энтропии,
направлены
в
сторону
увеличения вероятности состояния.
Всякое состояние макроскопической системы, содержащей большое
число частиц, может быть реализовано многими способами.
Термодинамическая вероятность W состояния системы – это число
способов, которыми может быть реализовано данное состояние
макроскопической
системы,
или
число
микросостояний,
осуществляющих
данное
макросостояние.
По
определению
термодинамическая вероятность W >> 1.
Энтропия - число различных микросостояний, которые соответствуют
тому же самому макросостоянию.
33
34.
2. Химическая термодинамика2.7. Энтропия
Например, если в сосуде находится 1 моль газа, то возможно
огромное число N способов размещения молекул по двум
половинкам сосуда: где N – число Авогадро. Каждый из них
является микросостоянием. Только одно из микросостояний
соответствует случаю, когда все молекулы соберутся в одной
половинке (например, правой) сосуда. Вероятность такого
события
практически
равна
нулю.
Наибольшее
число
микросостояний соответствует равновесному состоянию, при
котором молекулы равномерно распределены по всему объему.
Поэтому равновесное состояние является наиболее
вероятным. Равновесное состояние с другой стороны является
состоянием наибольшего беспорядка в термодинамической
системе и состоянием с максимальной энтропией.
34
35.
2. Химическая термодинамика2.7. Энтропия
Согласно Больцману, энтропия S системы и термодинамическая
вероятность W связаны между собой следующим образом:
S = к · ln W
где к –постоянная Больцмана
Таким образом, энтропия определяется логарифмом числа
микросостояний, с помощью которых может быть
реализовано данное макросостояние. Следовательно, энтропия
может рассматриваться как мера вероятности состояния
термодинамической системы.
35
36.
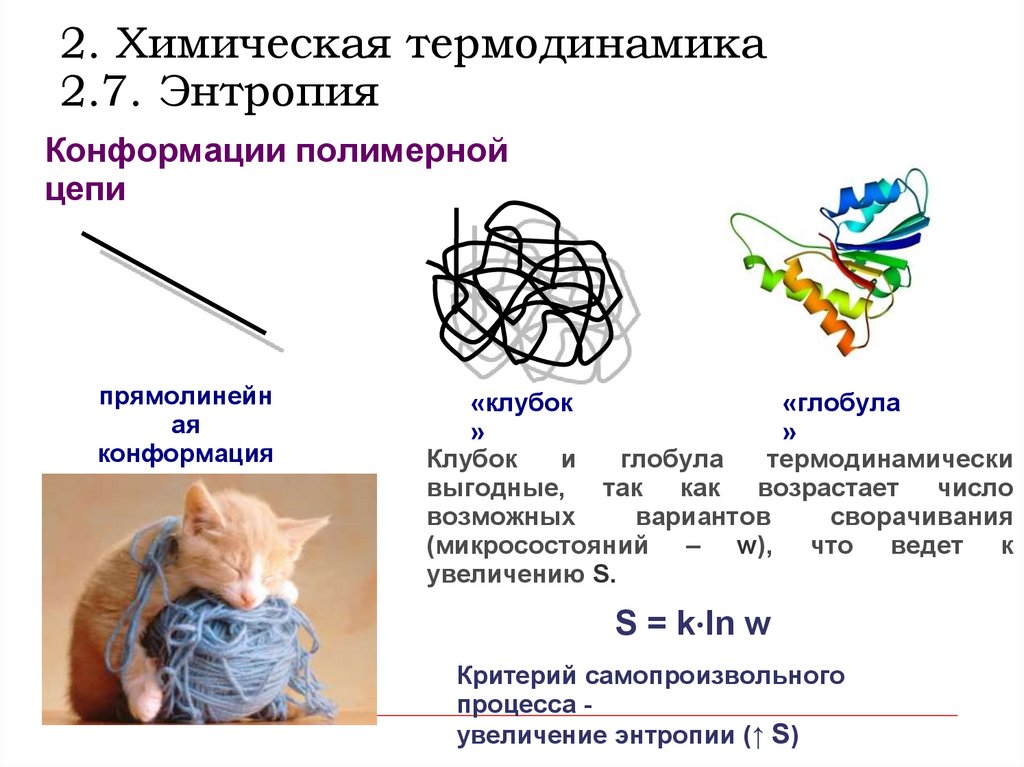
2. Химическая термодинамика2.7. Энтропия
Конформации полимерной
цепи
прямолинейн
ая
конформация
«клубок
«глобула
»
»
Клубок
и
глобула
термодинамически
выгодные, так как возрастает число
возможных
вариантов
сворачивания
(микросостояний – w), что ведет к
увеличению S.
S = k⋅ln w
Критерий самопроизвольного
процесса увеличение энтропии (↑ S)
37.
2. Химическая термодинамика2.7. Энтропия
Чем более упорядочено состояние системы, тем
меньше его энтропия, и наоборот, чем менее
упорядочено вещество, тем больше его
энтропия.
Энтропия 1 моль воды в стандартных условиях
(
)
Н₂О (тв) = 39,3; Н₂О (ж) = 70,0;
Н₂О (г) = 188,7
Энтропия данного количества вещества
увеличивается по мере усложнения молекул (
)
37
СО (г) = 197,4; СО₂ (г) =213
38.
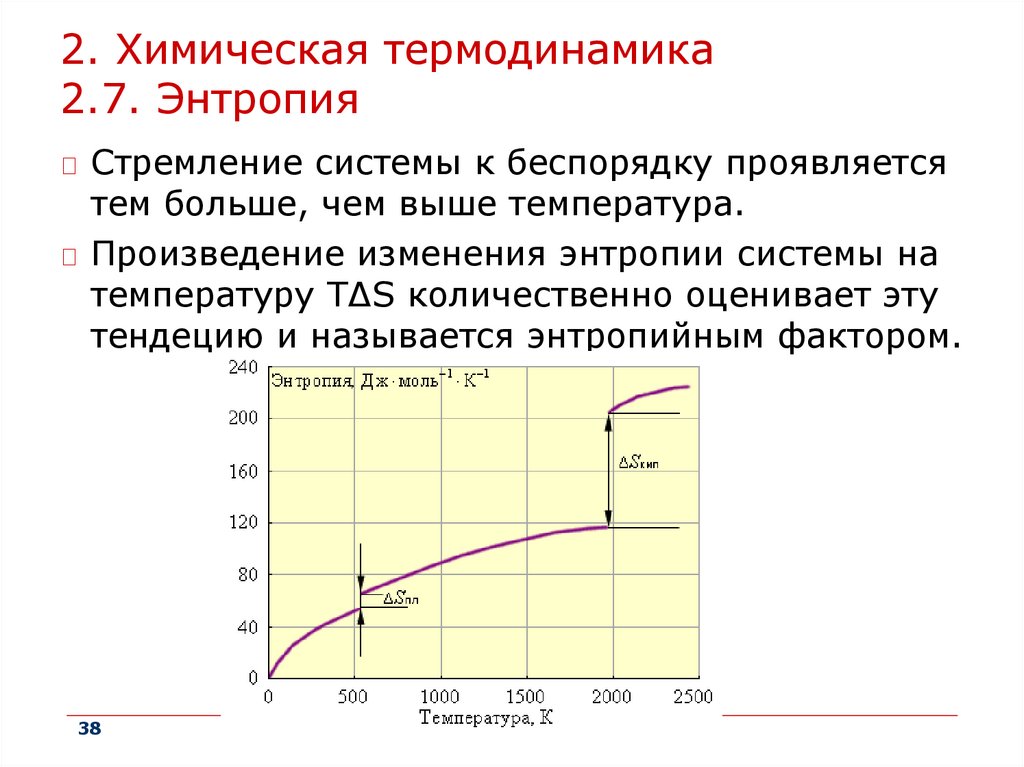
2. Химическая термодинамика2.7. Энтропия
Стремление системы к беспорядку проявляется
тем больше, чем выше температура.
Произведение изменения энтропии системы на
температуру TΔS количественно оценивает эту
тендецию и называется энтропийным фактором.
38
39.
2. Химическая термодинамика2.7. Энтропия
Таким образом, энтропия это
тепловая координата, фактор ёмкости, подобно
объёму (W=pΔV, Q=TΔS);
мера вероятности состояния системы;
функция состояния системы, т.е. она имеет
конкретное численное значение, когда система
находится в определённом состоянии;
аддитивная (экстенсивная) величина;
функция состояния системы, позволяющая
определить направление протекания процессов в
системе;
произведение ТS является мерой связанной энергии
системы, которая ни при каких условиях не
превращается в работу.
39
40.
2. Химическая термодинамика2.7. Энтропия
Как определить, будет ли процесс протекать
самопроизвольно или нет?
40
ΔH<0 и ΔS>0
Процесс протекает самопроизвольно
ΔH>0 и ΔS<0
Процесс не может протекать
самопроизвольно ни при каких
условиях
ΔH>0 и ΔS>0
Процесс может протекать
самопроизвольно при ΔH<TΔS
ΔH<0 и ΔS<0
Процесс может протекать
самопроизвольно при ΔH>TΔS
41.
2. Химическая термодинамика2.8. Абсолютная энтропия. Теорема
Нернста
Проинтегрируем уравнение
Получим абсолютную энтропию
где S₀ – постоянная интегрирования, энтропия при каких-либо
известных условиях.
Таким образом, чтобы найти абсолютное значение
энтропии, надо знать S₀ - исходную точку для
последующих расчётов. Эту точку даёт третий закон
термодинамики.
Третий закон термодинамики устанавливает единый для
всех веществ уровень отсчёта энтропии и определяет
значение свойств веществ вблизи абсолютного нуля
41
температуры.
42.
2. Химическая термодинамика2.8. Абсолютная энтропия. Теорема
Нернста
Третий закон термодинамики:
При нулевой абсолютной температуре энтропия
любых веществ, находящихся в равновесном
состоянии, имеет одно и то же постоянное
значение, не зависящее от фазового состояния
вещества. Эта величина может быть принята за
ноль.
42
43.
2. Химическая термодинамика2.8. Абсолютная энтропия. Теорема
Нернста
Постулат Планка:
При абсолютном нуле все идеальные кристаллы
имеют одинаковую энтропию, равную нулю.
Идеальным твёрдым телом называется твёрдое вещество с
идеальной кристаллической решёткой, в которой все узлы
заняты атомами, молекулами или ионами (Т=0, S₀=0).
Для дефектных кристаллов, твёрдых растворов и
стеклообразных веществ энтропия при абсолютном нуле не
равна нулю (Т=0, S₀≠0)
Постулат Планка позволяет ввести понятие абсолютной
энтропии вещества, т.е. энтропии, отсчитанной от нулевого
значения при Т=0.
Изменение энтропии вещества ΔS при переходе от нуля к
некоторой температуре Т равно
Так как
43
Таким образом, определение абсолютной энтропии ST сводится к
расчёту изменения энтропии в ходе процесса.
44.
2. Химическая термодинамика2.8. Абсолютная энтропия. Теорема
Нернста
Тепловая теорема Нернста:
Вблизи абсолютного нуля все
термодинамические процессы
протекают без изменения энтропии.
Вблизи абсолютного нуля устанавливается некоторое
стандартное состояние, обладающее определённым
значением энтропии.
В этом стандартном макросостоянии у веществ
наблюдаются нестандартные свойства: явления
сверхтекучести, сверхпроводимости и др.
44
45.
2. Химическая термодинамика2.8. Абсолютная энтропия. Теорема
Нернста
Следствия из третьего закона
термодинамики:
Абсолютного нуля температуры
нельзя достигнуть ни в каком
процессе, связанном с изменением
энтропии, к нему можно лишь
приблизиться (принцип
недостижимости абсолютного нуля
температуры).
При стремлении температуры к
нулю должны стремиться к нулю
45
46.
2. Химическая термодинамика2.9.Расчёт изменения энтропии в различных
процессах
Пример нагревание вещества при р=const
46
47.
2. Химическая термодинамика2.9.Расчёт изменения энтропии в различных
процессах
47
48.
2. Химическая термодинамика2.9.Расчёт изменения энтропии в различных
процессах
48
49.
2. Химическая термодинамика2.9.Расчёт изменения энтропии в различных
процессах
49
50.
2. Химическая термодинамика2.9.Расчёт изменения энтропии в различных
процессах
50
51.
2. Химическая термодинамика2.9.Расчёт изменения энтропии в различных
процессах
51
52.
2. Химическая термодинамика2.9.Расчёт изменения энтропии в различных
процессах
52
53.
2. Химическая термодинамика2.9.Расчёт изменения энтропии в различных
процессах
53
54.
2. Химическая термодинамика2.9.Расчёт изменения энтропии в различных
процессах
Энтропия идеального газа
А) изотермический процесс
Б) изохорное нагревание
В) изобарный процесс
54
55.
Химия: Экологическая физическая химияКафедра прикладной экологии ИнЭиП
доцент Валеева Гузель Равильевна
Часть I.
ОСНОВНЫЕ ЗАКОНЫ
термодинамики и
молекулярной
физики
Спасибо за внимание!
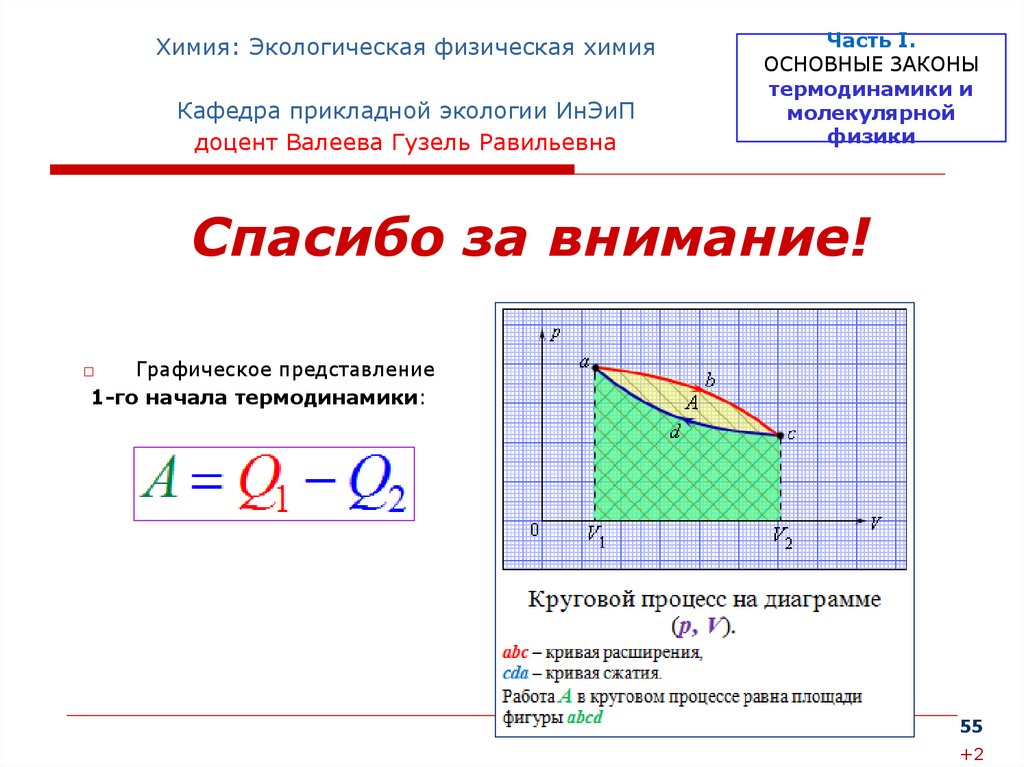
□
Графическое представление
1-го начала термодинамики:
55
+2














































 Физика
Физика Химия
Химия








