Похожие презентации:
ГМО. Віруси рослин
1.
ГМО. Віруси рослин.2.
•1804 р. – 1 млрд•1927 р. – 2 млрд
•1960 р. – 3 млрд
•1974 р. – 4 млрд
•1987 р. – 5 млрд
•1999 р. – 6 млрд
•2011 р. – 7 млрд
•2022 р. – 8 млрд
•2035 р. – 9 млрд
•2058 р. – 10 млрд
1960 р. на одну людину планети 4300 кв. м орних
земель
2005 р. - 2300 кв.м,
2030 р. - лишиться 1800 кв. м.
Щоб прогодувати 1 людину за теперішнього рівня
виробництва необхідно 15 соток орної землі.
Цю межу людство перетне між 2030 р. і 2050 р.
Виробництво необхідно збільшити на 70% порівняно з
теперішнім.
Зелена революція або Третя аграрна революція - комплекс змін у сільському господарстві, що мав місце в 1940-х 1970-х роках. Включав активне виведення більш продуктивних сортів рослин, розширення зрошення, застосування
добрив, пестицидів, впровадження нових методів культивування, включаючи механізацію.
3.
4.
5.
Віруси рослин становлять серйозну загрозу продуктивності сільського господарствапорівняно з іншими патогенами, такими як бактерії та гриби.
Звичайні агротехнічні прийоми (сівозміна, контроль насіннєвого матеріалу, знищення
векторів, карантинні заходи і т.д.) мають дуже обмежену здатність контролю вірусів
рослин.
Єдиний спосіб боротьби з вірусами рослин – превентивний.
6.
Стратегії інженерії стійкості рослин до вірусів1) гени стійкості рослини-господаря (host plant gene resistance, гени R)
2) патоген-асоційована стійкість (pathogen-derived resistance, PDR)
3) направлена стійкість до патогенів (pathogen-targeted resistance, PTR)
7.
1) Гени стійкості рослини-господаря(гени R)рецесивна стійкість
Рецесивний імунітет є несумісністю компонентів господаря та кодованих
вірусом компонентів або факторів, які повинні взаємодіяти один з одним для
поширення вірусу в клітині-хазяїні для індукування інфекції.
Рецесивні гени стійкості, відомі проти вірусів рослин, описані для Potyviruses.
Геном вірусу віспи сливи (Plum pox
virus, PVV)з електронною
мікрофотографією та моделлю віріонів
8.
Такі рецесивні гени стійкості кодують фактори ініціації трансляції родини 4E або 4G(eIF4E/eIF4G). Ці білки взаємодіють із кеп-подібною структурою на вірусних транскриптах,
щоб допомогти в процесі трансляції.
Транскрипти потівірусів містять VPg, який представляє
собою пов'язаний з геномом вірусний білок, а не
кеп-подібну структуру.
Гени рецесивної стійкості хазяїна припиняють процес взаємодії всіх транскриптів із таким
кепом.
9.
cтійкість домінантного гена R• Більшість домінантної стійкості залежить від R-генів
хазяїна, які роблять вірусний ізолят авірулентним.
• Вроджений імунітет у рослин опосередкований так
званою расоспецифічною чи генною стійкістю, коли
результат зараження визначається генотипами як
господаря, так і патогена.
• Гени домінантної стійкості рослин до хвороб (R)
кодують відповідні гени домінантної авірулентності
(Avr).
• Геноми рослин з R-генами кодують білки NB-LRR, які
мають домени, що зв'язують нуклеотиди (NB) і
повтори, багаті на лейцин (LRR). Було ідентифіковано
безліч пар білків NB-LRR і Avr, що асоціюються, а
також клітинних білків, які опосередковують
взаємодії R/Avr.
Рис. 2 Механізм стійкості гена R у рослин до
патогенних інфекцій
10.
Домінантні гени R викликають реакцію гіперчутливості (HR) абоекстремальну реакція (ER). Обидві ці відповіді включають
запрограмовану клітинну смерть (PCD), яка відбувається швидко і
вбиває інфіковані клітини, зупиняючи поширення вірусу.
11.
2) патоген-асоційована стійкістьЦе тип стійкості, коли ген або частина геному вірусу вводиться в
рослину-хазяїна для надання стійкості проти цього вірусу. Цей
механізм створення ГМ-культур в основному поділяється на два
типи:
(1) стійкість, опосередкована білком,
(2) стійкість, опосередкована РНК.
12.
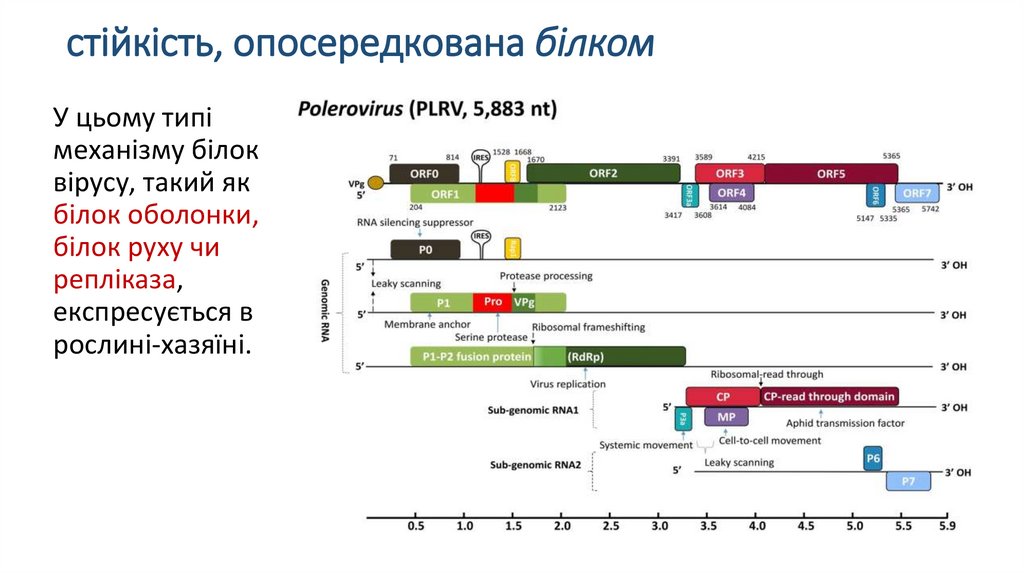
стійкість, опосередкована білкомУ цьому типі
механізму білок
вірусу, такий як
білок оболонки,
білок руху чи
репліказа,
експресується в
рослині-хазяїні.
13.
білок оболонки• Білок оболонки відіграє важливу та різноманітну
роль у виживанні вірусу, таку як інкапсидація,
трансляція вірусної РНК, взаємодія вектор-вірус
для передачі, системний рух від однієї клітини
до іншої, тяжкість захворювання та прояв
симптомів.
• Першу демонстрацію стійкості хазяїна до вірусу
рослин шляхом експресії білка оболонки вірусу
зробили Abel et al. (1986). Під час цього
експерименту було виявлено, що трансгенні
рослини тютюну, які експресують високий рівень
білка оболонки вірусу тютюнової мозаїки (ВТМ),
є високостійкими до ВТМ. Ключовий механізм
включав інгібування розбірки вірусу
експресованими білками оболонки, які
утворюють псевдокапсиди.
Демонстрація захисту, опосередкованого білком оболонки (CPMP) за
допомогою сконструйованого CP TMV, експресованого в трансгенних
рослинах
В той час, коли рослини інокулювали очищеною РНК вірусу, стійкість втрачалася, оскільки для вивільнення
вірусної РНК у клітину-хазяїна не потрібно розбирати віріон. Інфекція, спричинена інокуляцією вірусної РНК,
поширилася від інокульованого листа до інших листків трансгенних рослин, показуючи, що РНК ВТМ не
потребує інкапсидації для свого руху між клітинами.
14.
білок руху• Серед інших стратегій PDR стійкість опосередкована білком руху
(movement protein, MP) також є одним із помітних механізмів.
(movement protein-mediated protection, MPMP).
• Ця стратегія передбачає створення мутантних
(дисфункціональних) форм вірусних генів. Оскільки вірус
використовує білки руху для забезпечення локального або
системного поширення від клітини до клітини, експресія
дефектних або мутантних MP вірусу надає стійкість до відповідної
вірусної інфекції.
• Ці мутантні MP конкурують з MP дикого типу за взаємодію сайтів
зв’язування із плазмодесмами. Оскільки мутантний MP, зв’язаний
з плазмодесмами, не здатний переміщати вірус, рух або
поширення вірусу зупиняється.
• Цей тип стійкості може забезпечувати стійкість до інших вірусів,
окрім тих, MP яких експресується в трансгенних рослинах.
Рис. 4 Взаємодія вірусу із
плазмодесмами
15.
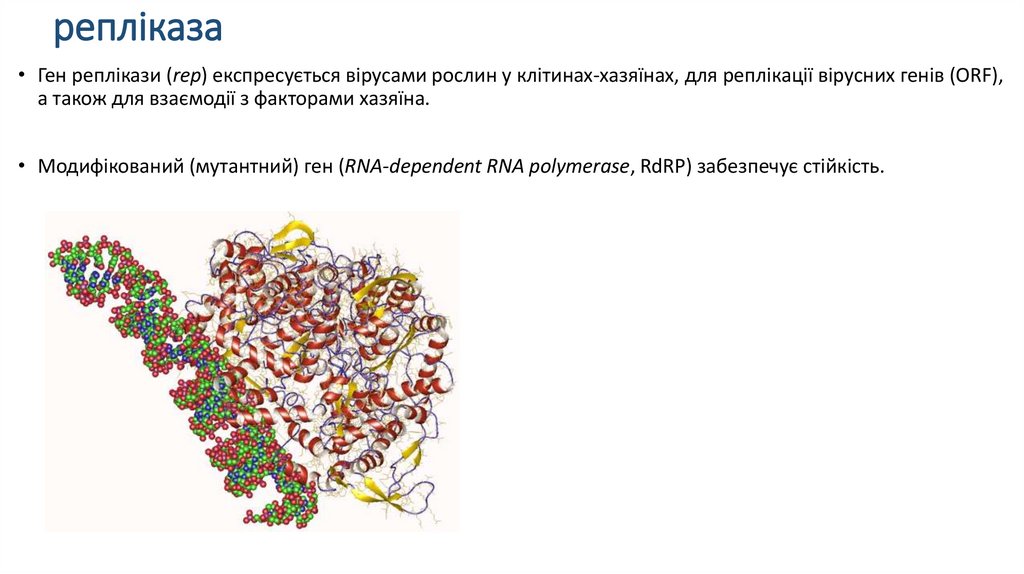
репліказа• Ген реплікази (rep) експресується вірусами рослин у клітинах-хазяїнах, для реплікації вірусних генів (ORF),
а також для взаємодії з факторами хазяїна.
• Модифікований (мутантний) ген (RNA-dependent RNA polymerase, RdRP) забезпечує стійкість.
16.
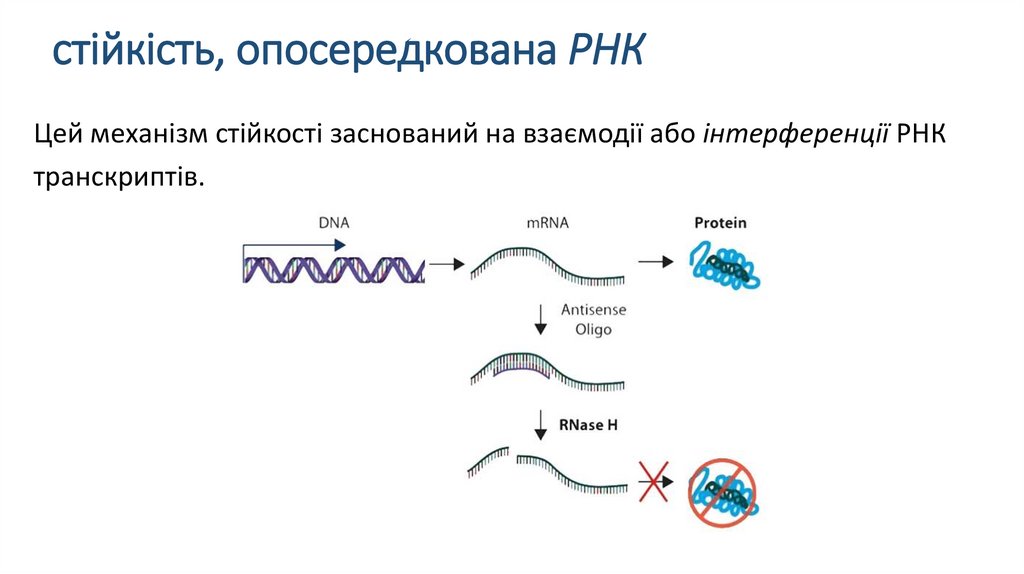
стійкість, опосередкована РНКЦей механізм стійкості заснований на взаємодії або інтерференції РНК
транскриптів.
17.
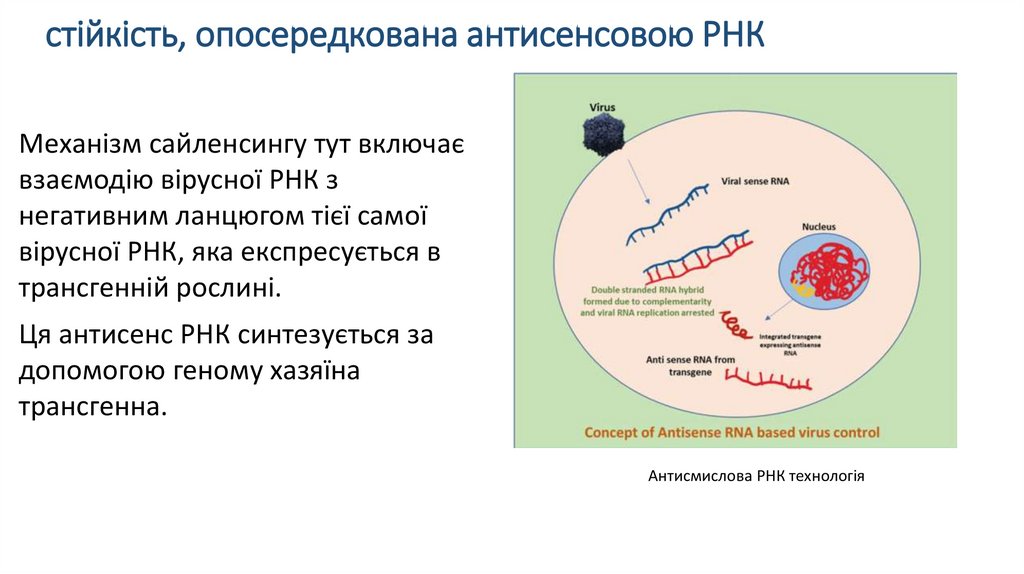
стійкість, опосередкована антисенсовою РНКМеханізм сайленсингу тут включає
взаємодію вірусної РНК з
негативним ланцюгом тієї самої
вірусної РНК, яка експресується в
трансгенній рослині.
Ця антисенс РНК синтезується за
допомогою геному хазяїна
трансгенна.
Антисмислова РНК технологія
18.
трансгенна стійкість до вірусів на основі міРНК (siRNA)• Механізм сайленсингу РНК запускається наявністю
дволанцюгових рибонуклеїнових кислот (длРНК).
З длРНК зв’язується фермент Dicer, який
розщеплює длРНК на 21–24 нуклеотидні
фрагменти РНК, які відомі як малі інтерферуючі
РНК (siRNA). Ці siRNA зв’язуються комплексами
РНК-індукованого сайленсингу (RISC), до якого
входять Argonaute (AGO) та інші білки.
• Потім активований RISC разом із антисмисловим
ланцюгом siRNA може ідентифікувати та
розщеплювати цільову мРНК.
19.
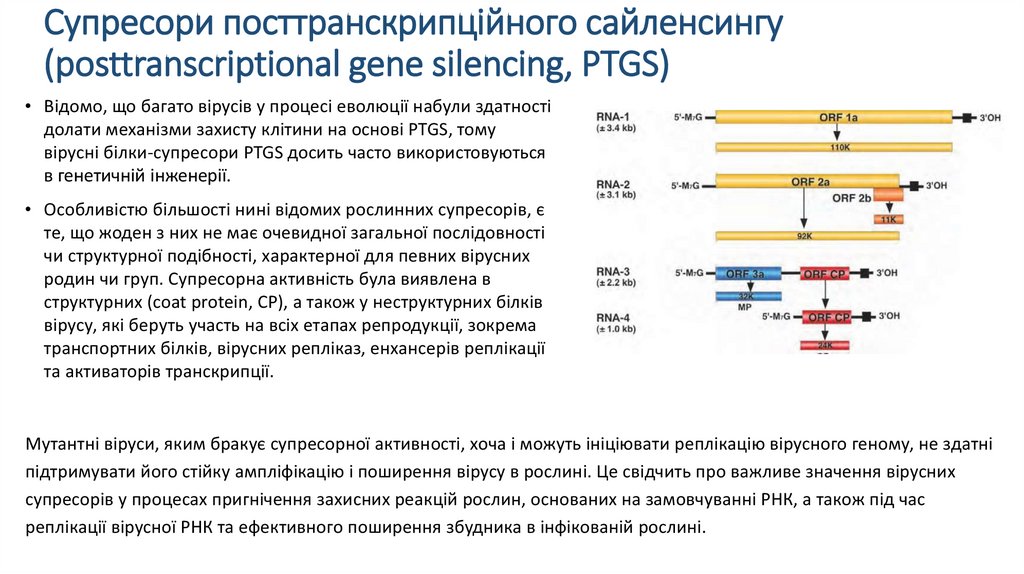
Супресори посттранскрипційного сайленсингу(posttranscriptional gene silencing, PTGS)
• Відомо, що багато вірусів у процесі еволюції набули здатності
долати механізми захисту клітини на основі PTGS, тому
вірусні білки-супресори PTGS досить часто використовуються
в генетичній інженерії.
• Особливістю більшості нині відомих рослинних супресорів, є
те, що жоден з них не має очевидної загальної послідовності
чи структурної подібності, характерної для певних вірусних
родин чи груп. Супресорна активність була виявлена в
структурних (coat protein, CP), а також у неструктурних білків
вірусу, які беруть участь на всіх етапах репродукції, зокрема
транспортних білків, вірусних репліказ, енхансерів реплікації
та активаторів транскрипції.
Мутантні віруси, яким бракує супресорної активності, хоча і можуть ініціювати реплікацію вірусного геному, не здатні
підтримувати його стійку ампліфікацію і поширення вірусу в рослині. Це свідчить про важливе значення вірусних
супресорів у процесах пригнічення захисних реакцій рослин, основаних на замовчуванні РНК, а також під час
реплікації вірусної РНК та ефективного поширення збудника в інфікованій рослині.
20.
3) направлена стійкість до патогенівTALENS
TALENS, відомі як ефекторна нуклеаза, подібна до активатора транскрипції (transcription activator-like effector nuclease,
TALEN). Ці TALE змінюють транскриптом хазяїна шляхом зв’язування в промоторних областях і імітації факторів
транскрипції хазяїна.
TALE мають ДНК-зв’язуючий домен, що складається з 16–20 мономерів, кожен з яких має довжину ~34 амінокислоти.
Подальший прогрес у цій технології призвів до розшифровки коду TALE для розпізнавання ДНК, що дало один із
примітивних методів редагування геному. Потім ДНК-зв’язуючий домен TALE був модифікований шляхом злиття з
каталітичним доменом ендонуклеази Fok1 для створення молекули TALEN, класу молекул, які можна використовувати
для редагування геному. Ці TALEN зробили можливим створення дволанцюгових розривів у певних послідовностях ДНК,
де зв’язуються TALE. У випадку еукаріотів ці DSB відновлюються за допомогою негомологічного механізму відновлення
з’єднання кінців (NHEJ) або гомологічної рекомбінації, яка індукує мутацію, зокрема в місці DSB.
21.
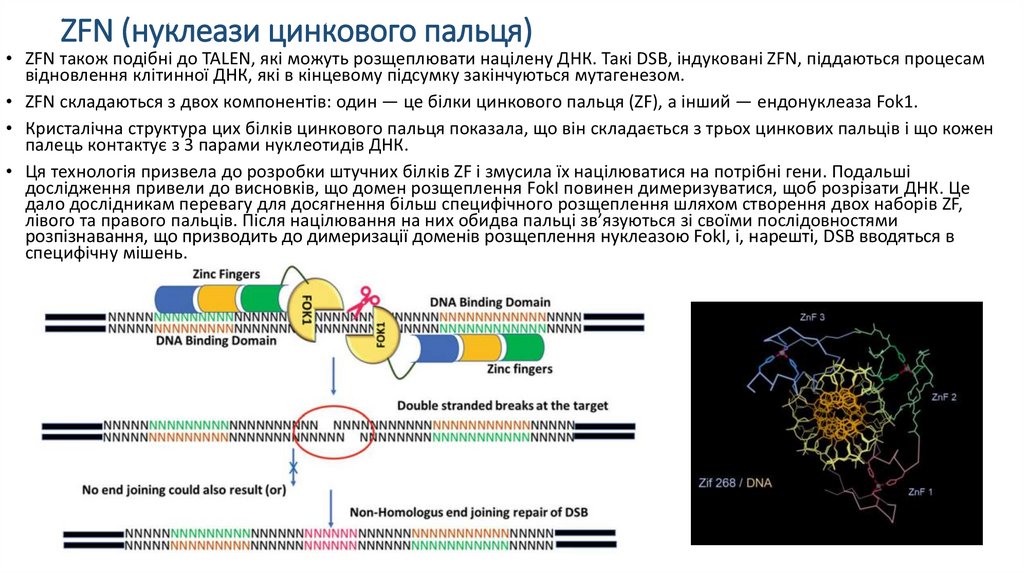
ZFN (нуклеази цинкового пальця)• ZFN також подібні до TALEN, які можуть розщеплювати націлену ДНК. Такі DSB, індуковані ZFN, піддаються процесам
відновлення клітинної ДНК, які в кінцевому підсумку закінчуються мутагенезом.
• ZFN складаються з двох компонентів: один — це білки цинкового пальця (ZF), а інший — ендонуклеаза Fok1.
• Кристалічна структура цих білків цинкового пальця показала, що він складається з трьох цинкових пальців і що кожен
палець контактує з 3 парами нуклеотидів ДНК.
• Ця технологія призвела до розробки штучних білків ZF і змусила їх націлюватися на потрібні гени. Подальші
дослідження привели до висновків, що домен розщеплення FokI повинен димеризуватися, щоб розрізати ДНК. Це
дало дослідникам перевагу для досягнення більш специфічного розщеплення шляхом створення двох наборів ZF,
лівого та правого пальців. Після націлювання на них обидва пальці зв’язуються зі своїми послідовностями
розпізнавання, що призводить до димеризації доменів розщеплення нуклеазою FokI, і, нарешті, DSB вводяться в
специфічну мішень.
22.
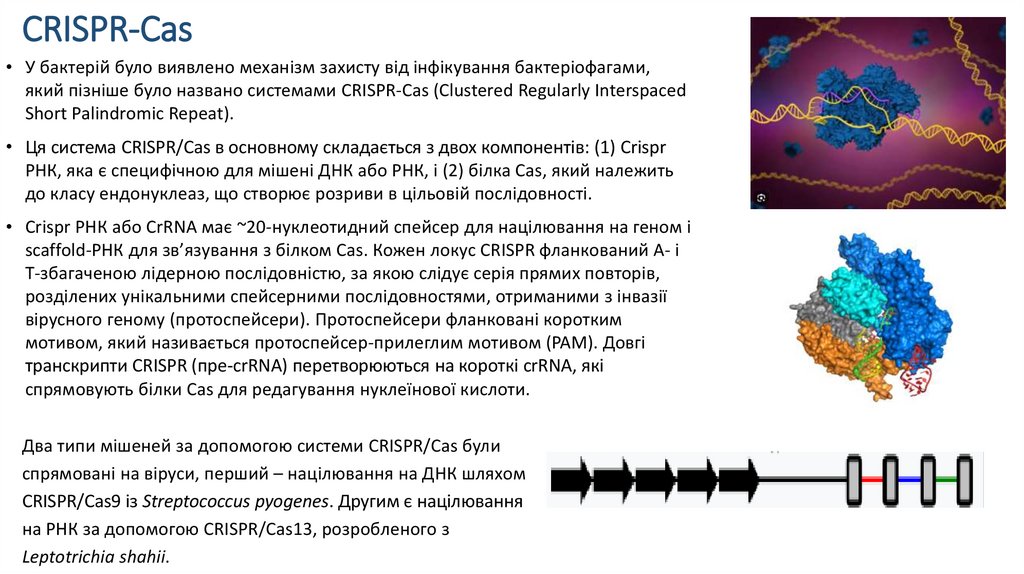
CRISPR-Cas• У бактерій було виявлено механізм захисту від інфікування бактеріофагами,
який пізніше було названо системами CRISPR-Cas (Clustered Regularly Interspaced
Short Palindromic Repeat).
• Ця система CRISPR/Сas в основному складається з двох компонентів: (1) Crispr
РНК, яка є специфічною для мішені ДНК або РНК, і (2) білка Cas, який належить
до класу ендонуклеаз, що створює розриви в цільовій послідовності.
• Crispr РНК або CrRNA має ~20-нуклеотидний спейсер для націлювання на геном і
scaffold-РНК для зв’язування з білком Cas. Кожен локус CRISPR фланкований A- і
T-збагаченою лідерною послідовністю, за якою слідує серія прямих повторів,
розділених унікальними спейсерними послідовностями, отриманими з інвазії
вірусного геному (протоспейсери). Протоспейсери фланковані коротким
мотивом, який називається протоспейсер-прилеглим мотивом (PAM). Довгі
транскрипти CRISPR (пре-сrRNA) перетворюються на короткі сrRNA, які
спрямовують білки Cas для редагування нуклеїнової кислоти.
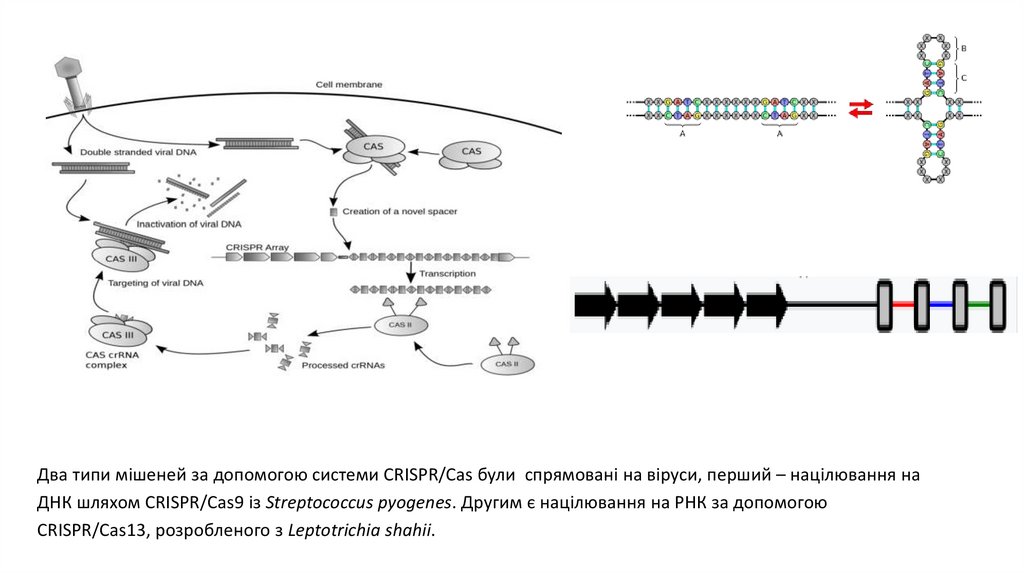
Два типи мішеней за допомогою системи CRISPR/Cas були
спрямовані на віруси, перший – націлювання на ДНК шляхом
CRISPR/Cas9 із Streptococcus pyogenes. Другим є націлювання
на РНК за допомогою CRISPR/Cas13, розробленого з
Leptotrichia shahii.
23.
Два типи мішеней за допомогою системи CRISPR/Cas були спрямовані на віруси, перший – націлювання наДНК шляхом CRISPR/Cas9 із Streptococcus pyogenes. Другим є націлювання на РНК за допомогою
CRISPR/Cas13, розробленого з Leptotrichia shahii.
24.
• Використання систем CRISPR/Cas для націлювання на віруси включає різні етапи:• (1) конструювання керуючої РНК/single guide (sg) RNA CRISPR, яка є специфічною для цільового вірусу (близько
20 нуклеотидів), і додавання послідовності мотиву PAM до sgRNA (мотив NGG-PAM у випадку CRISPR/Cas9),
• (2) дизайн векторів, що експресують відповідний фермент Cas (Cas9 для редагування ДНК та Cas13a для
редагування РНК) та sgRNA,
• (3) доставка векторів до цільового господаря за допомогою опосередкованої Agrobacterium трансформації або
інших методів перенесення генів з подальшим відбором і регенерацією трансформантів
• (4) аналіз мутацій
• (5) зараження трансгенних рослин відповідними рослинними вірусами та візуалізація можливих симптомів
захворювання.
















 Биология
Биология








