Похожие презентации:
Кислородсодержащие органические соединения
1. КИСЛОРОДСОДЕРЖАЩИЕ ОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ
2.
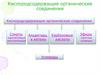
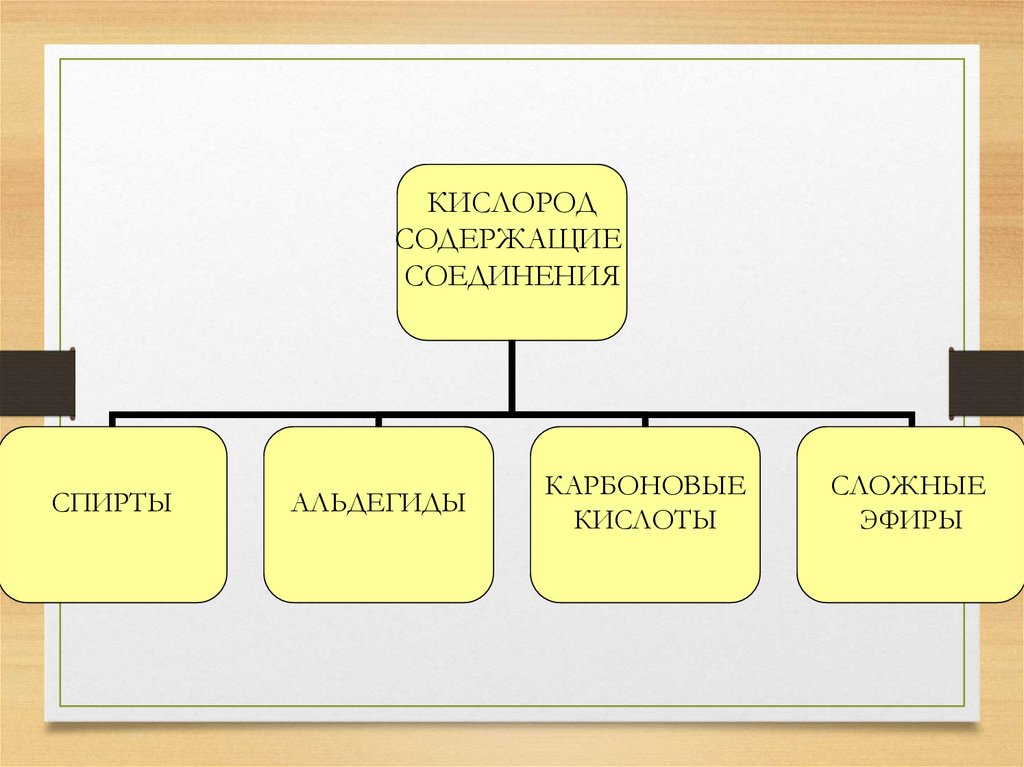
КИСЛОРОДСОДЕРЖАЩИЕ
СОЕДИНЕНИЯ
СПИРТЫ
АЛЬДЕГИДЫ
КАРБОНОВЫЕ
КИСЛОТЫ
СЛОЖНЫЕ
ЭФИРЫ
3.
Спирты - это органические соединения, вмолекулах которых содержаться одна или
несколько
гидроксильных
групп,
связанных с углеводородным радикалом.
СПИРТЫ
ОДНОАТОМНЫЕ
МНОГОАТОМНЫЕ
4. Физические свойства спиртов Спирты не имеют газообразных соединений. С1-С12 - это жидкости. Более С12 - это твёрдые соединения.
Спирты имеют высокие температурыкипения.
Смешиваются с водой в любых
отношениях.
Все спирты легче воды.
5. ОДНОАТОМНЫЕ СПИРТЫ
Сложные вещества с общейформулой СnН2n+1ОН, в
которых
гидроксильная
группа
соединена
с
углеводородным радикалом.
6. Правила названия спиртов
Название предельного углеводорода + суффикс-ол.
СН3ОН – метанол (метиловый спирт)
С2Н5ОН – этанол (этиловый спирт)
С3Н7ОН – пропанол
С4Н9ОН – бутанол
7. Метанол СН3ОН
Бесцветная жидкость, с водой смешиваетсяв любых соотношениях.
Горит бесцветным пламенем.
ОЧЕНЬ ЯДОВИТ!
Небольшое
количество
–
общее
отравление и слепота, большие количества
смертельны.
8. Этанол С2Н5ОН
Бесцветная жидкость созапахом и жгучим вкусом.
слабым
Смешивается с
соотношениях.
любых
водой
в
Горит голубоватым пламенем.
9. Получение этанола
1. Гидратация этилена:СН2 = СН2 + Н2О С2Н5ОН
2. Брожение сахаристых веществ:
С6Н12О6 2С2Н5ОН +2СО2
10. Химические свойства спиртов
1. ГорениеС2Н5ОН + 3О2 2СО2 + 3Н2О
2. Окисление
С2Н5ОН + [ O ] CH3 – C=O
|
H
уксусный альдегид
11. Химические свойства спиртов
3. Взаимодействие со щелочнымиметаллами
2С2Н5ОН + 2Na 2С2Н5ОNa + H2
этилат натрия
12. Действие этанола на организм человека
1. Разрушение клеток печени.2. Общее отравление организма.
3. Нарушение работы желудочно-кишечного
тракта, сердечно-сосудистой системы.
4. Деградация личности.
13. Многоатомные спирты
СН2 – ОНCH2 – OH
|
|
CH2 – OH
CH – OH
|
CH2 – OH
Этиленгликоль
Глицерин
Бесцветные, сиропообразные жидкости,
сладковатые на вкус. Ядовиты!
14.
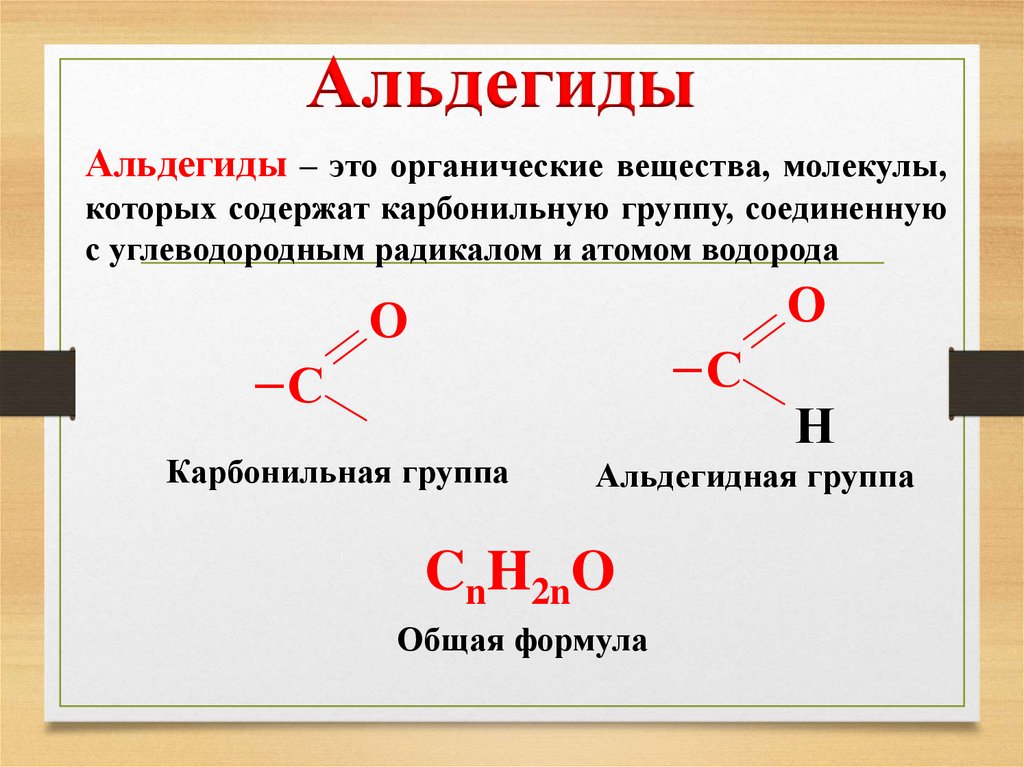
АльдегидыАльдегиды – это органические вещества, молекулы,
которых содержат карбонильную группу, соединенную
с углеводородным радикалом и атомом водорода
О
О
─С
─С
Карбонильная группа
Н
Альдегидная группа
CnH2nO
Общая формула
15.
Правила названия альдегидовНазвание предельного углеводорода
+ суффикс –аль.
Метаналь (формальдегид)
Этаналь (ацетальдегид)
Пропаналь
Бутаналь
Пентаналь
16. Правила названия альдегидов
Физические свойстваС1
– газ с резким запахом;
С2 – С3 – жидкости с резким запахом;
С4 – С6 – жидкости с неприятным запахом;
>С6 – твердые, нерастворимые в воде с
цветочным
запахом (применяются в
парфюмерии).
НСОН, СН3СОН – растворимы в воде
неограниченно,
температуры кипения ниже,
чем у соответствующих спиртов.
17.
Химические свойства альдегидовРеакция окисления аммиачным раствором
оксида серебра - «серебряное зеркало» качественная реакция на альдегиды.
СН3 – С= О + Ag2O CH3 – C = O + 2Ag ↓
|
|
H
OH
Этаналь
Уксусная кислота
Реакция «серебряного зеркала».
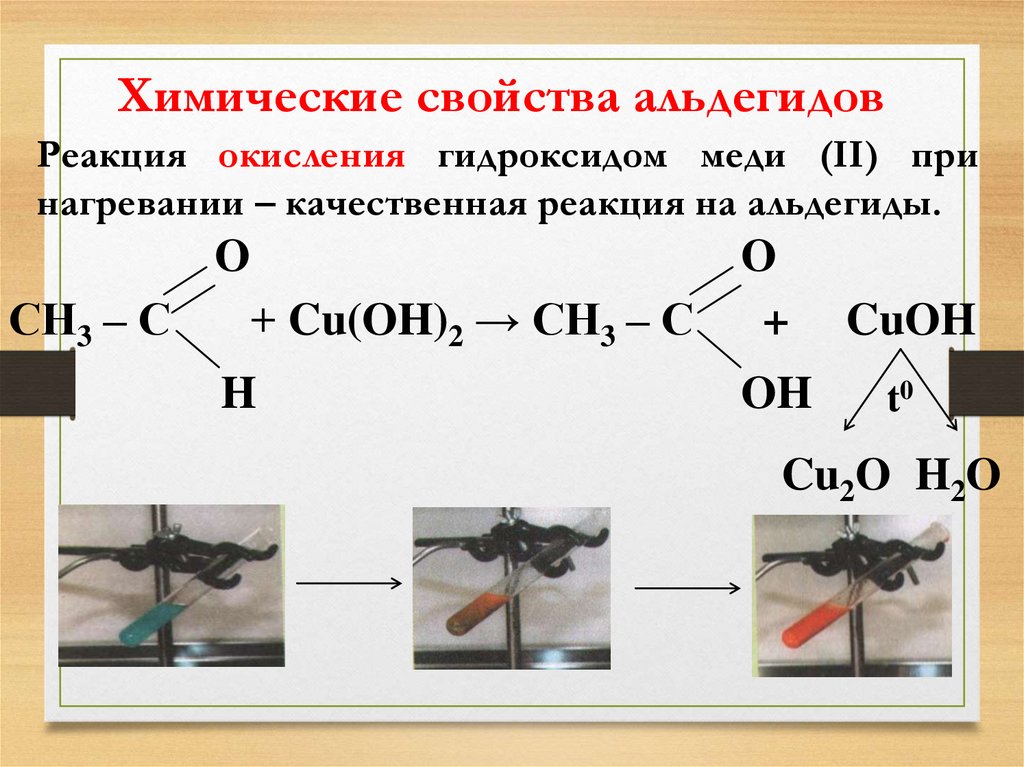
18. Химические свойства альдегидов
Реакция окисления гидроксидом меди (II) принагревании – качественная реакция на альдегиды.
O
СН3 – С
+ Cu(OH)2 → СН3 – С
O
+
CuOH
H
OH
t0
Cu2O H2O
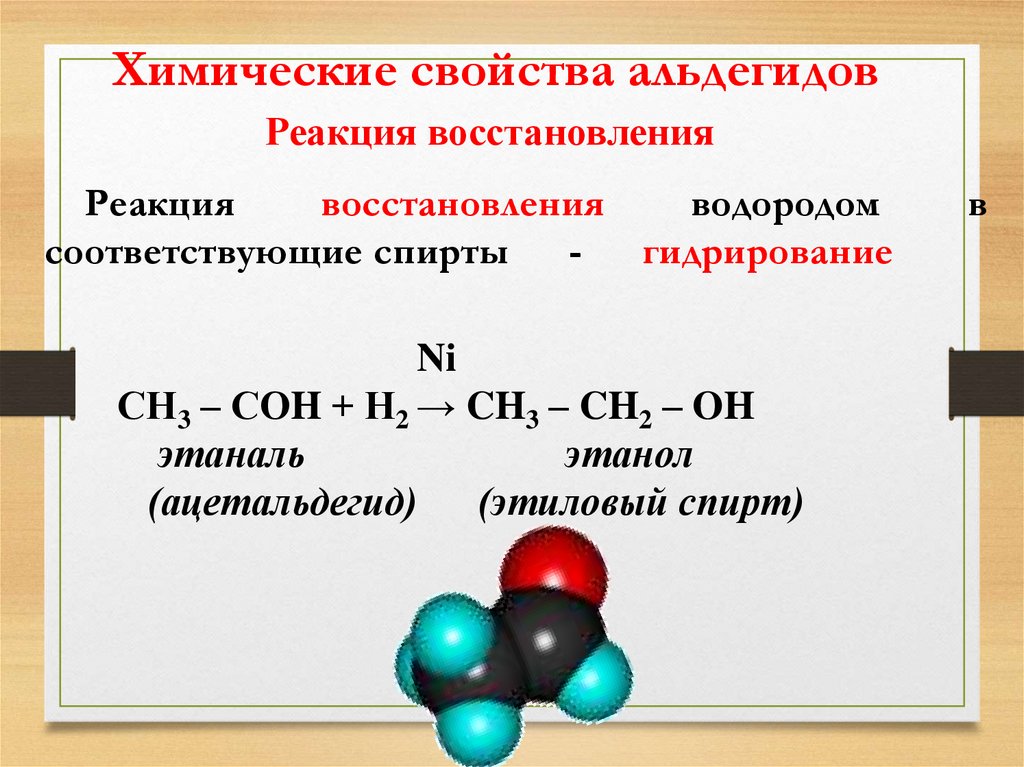
19.
Химические свойства альдегидовРеакция восстановления
Реакция
восстановления
водородом
соответствующие спирты
гидрирование
Ni
СН3 – СОH + Н2 → CH3 – CH2 – OH
этаналь
этанол
(ацетальдегид)
(этиловый спирт)
в
20.
Альдегиды. ПрименениеФенолформальдегидные
смолы
Сельское
хозяйство
Формальдегид
Кожевенная
промышленность
Медицина
21.
Уксуснаякислота
Этиловый
спирт
Уксусный
альдегид
Пластмассы
Ацетатное
волокно
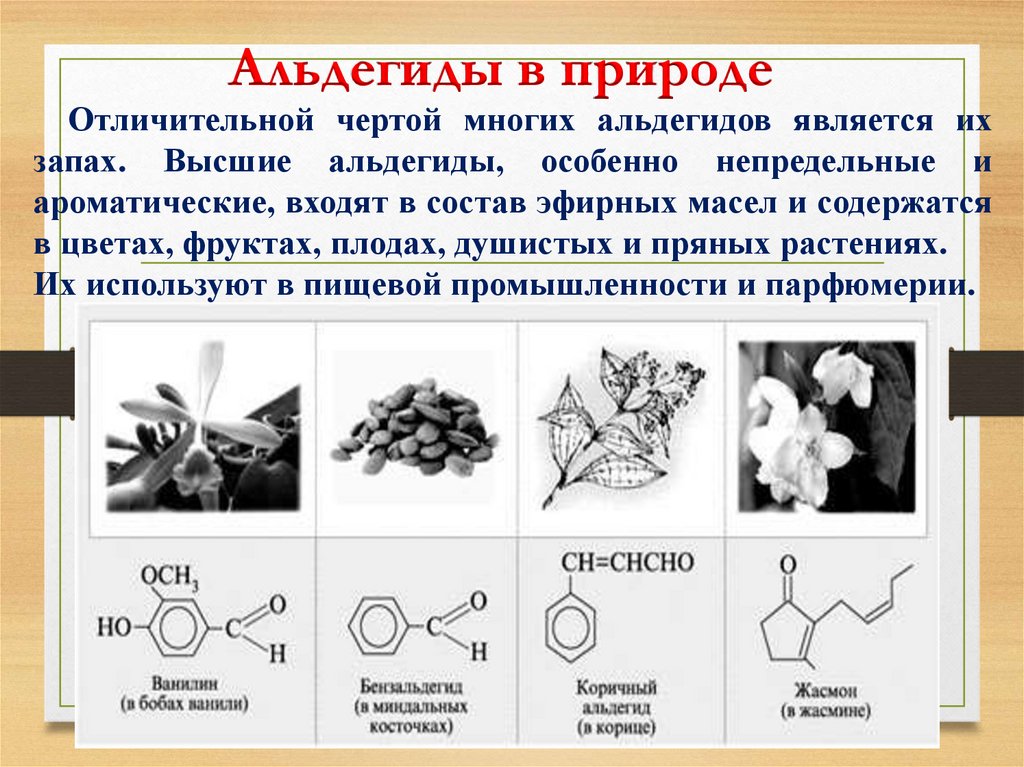
22.
Альдегиды в природеОтличительной чертой многих альдегидов является их
запах. Высшие альдегиды, особенно непредельные и
ароматические, входят в состав эфирных масел и содержатся
в цветах, фруктах, плодах, душистых и пряных растениях.
Их используют в пищевой промышленности и парфюмерии.
23.
Карбоновыекислоты
соединения,
молекулы
карбоксильную группу –
углеводородным радикалом.
-
это органические
которых
содержат
СООН, связанную с
Все карбоновые кислоты имеют
функциональную группу
24.
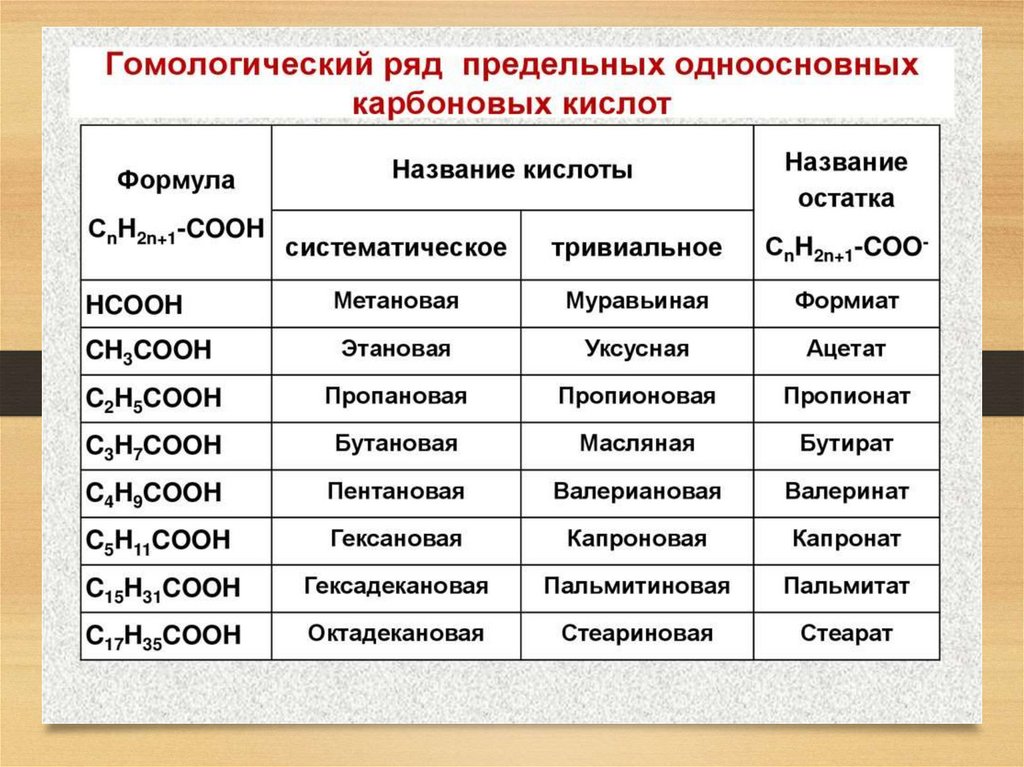
Правила названия карбоновыхкислот
Название предельного углеводорода + -овая кислота.
Н–С= О
метановая кислота (муравьиная)
|
ОН
СН3 – С = О
этановая кислота (уксусная)
|
OH
С17Н35 – С = О
|
OH
стеариновая кислота
25. Правила названия карбоновых кислот
26.
Классификациякарбоновых
кислот:
1. В зависимости от числа карбоксильных групп
Одноосновные
(уксусная)
Двухосновные
(щавелевая)
Многоосновные
(лимонная)
2. В зависимости от природы радикала
Предельные
(пропионовая)
Непредельные
(акриловая)
Ароматические
(бензойная)
3. По содержанию атомов С:
С1-С9 - низшие, С10 и более - высшие
27. Классификация карбоновых кислот:
ФИЗИЧЕСКИЕ СВОЙСТВАС1 – С3
Жидкости с характерным резким
запахом, хорошо растворимые в воде
Вязкие маслянистые жидкости с
С4 – С9 неприятным запахом, плохо
растворимые в воде
C10 и Твердые вещества, не имеющие запаха,
не растворимые в воде
более
28.
Физические свойства уксусной кислотыАгрегатное состояние - жидкое
Цвет - бесцветная прозрачная жидкость
Запах - резкий уксусный
Растворимость в воде - хорошая
Температура кипения - 118 º С
Температура плавления – 16,75º С
Физические свойства стеариновой
кислоты
Бесцветные кристаллы, нерастворимы в воде
29.
Химические свойства уксуснойкислоты
Проявляет характерные свойства кислот.
1. Изменяет окраску индикатора:
СН3СООН СН3СОО- + Н+
2. Взаимодействует с металлами:
2СН3СООН + Мg (CH3COO)2Mg + H2
30. Химические свойства уксусной кислоты
3. Взаимодействует с основными оксидами:2СН3СООН + СаО (CH3COO)2Ca + H2O
4. Взаимодействует с основаниями:
СH3COOH + NaOH CH3COONa + H2O
5. Взаимодействует с солями:
2CH3COOH + Na2CO3 2CH3COONa + CO2
+ H2O
31. Химические свойства уксусной кислоты
6.Реакция этерификации - реакция междукарбоновой кислотой и спиртом с
образованием сложного эфира.
CH3–C=O + H–O–C2H5 CH3–C=O + Н2О
|
|
OH
O–C2H5
уксусная кислота
этанол
этиловый эфир
уксусной кислоты
32.
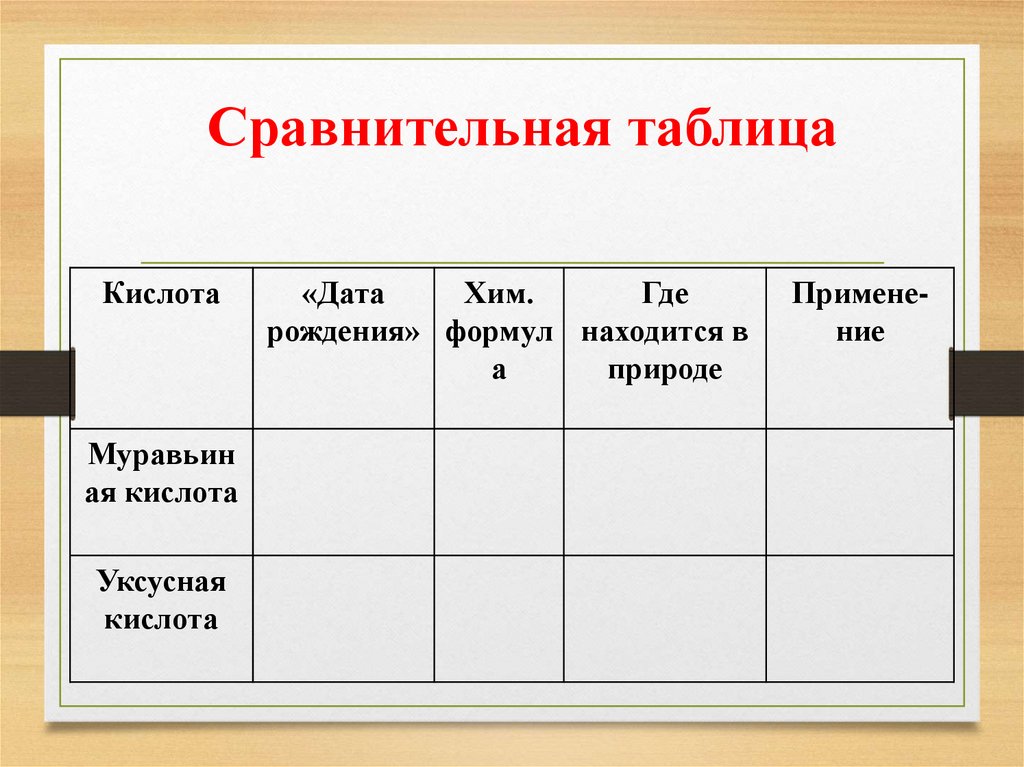
Сравнительная таблицаКислота
Муравьин
ая кислота
Уксусная
кислота
«Дата
Хим.
Где
рождения» формул находится в
а
природе
Применение
























 Химия
Химия