Похожие презентации:
Кислородсодержащие органические соединения
1. Кислородсодержащие органические соединения
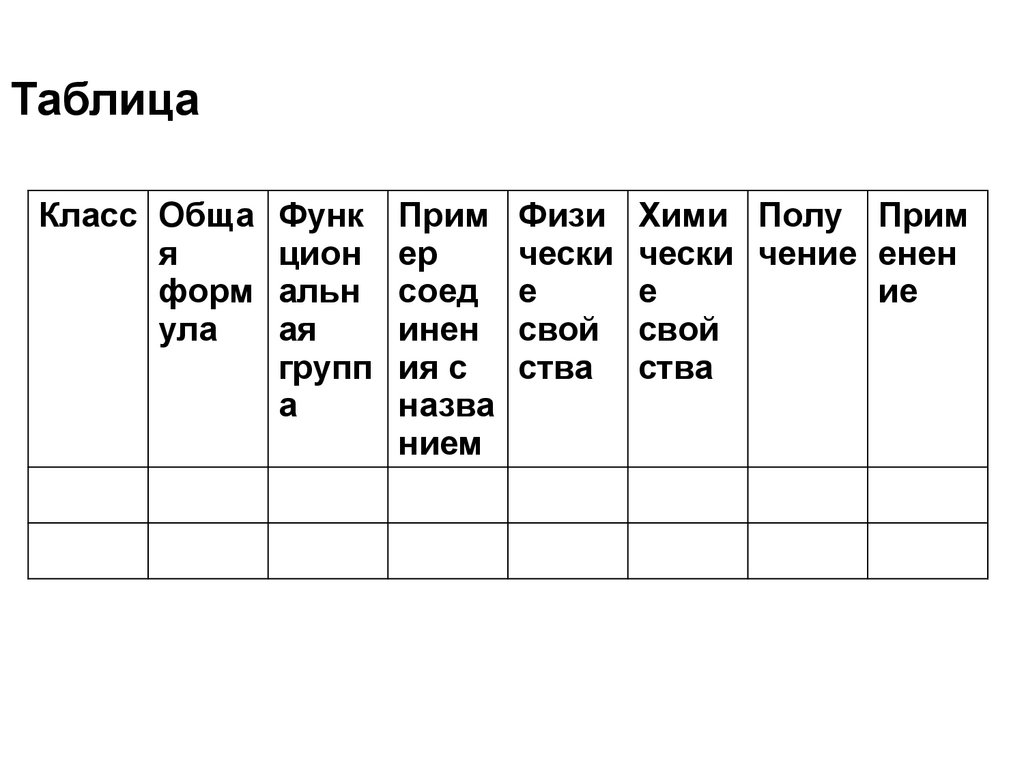
2. Таблица
Класс Общая
форм
ула
Функ
цион
альн
ая
групп
а
Прим
ер
соед
инен
ия с
назва
нием
Физи
чески
е
свой
ства
Хими Полу Прим
чески чение енен
е
ие
свой
ства
3. СПИРТЫ
CnH2n-1 OHСпиртами называются органические
вещества, молекулы которых содержат
одну или несколько гидроксильных групп,
связанных с углеводородным радикалом.
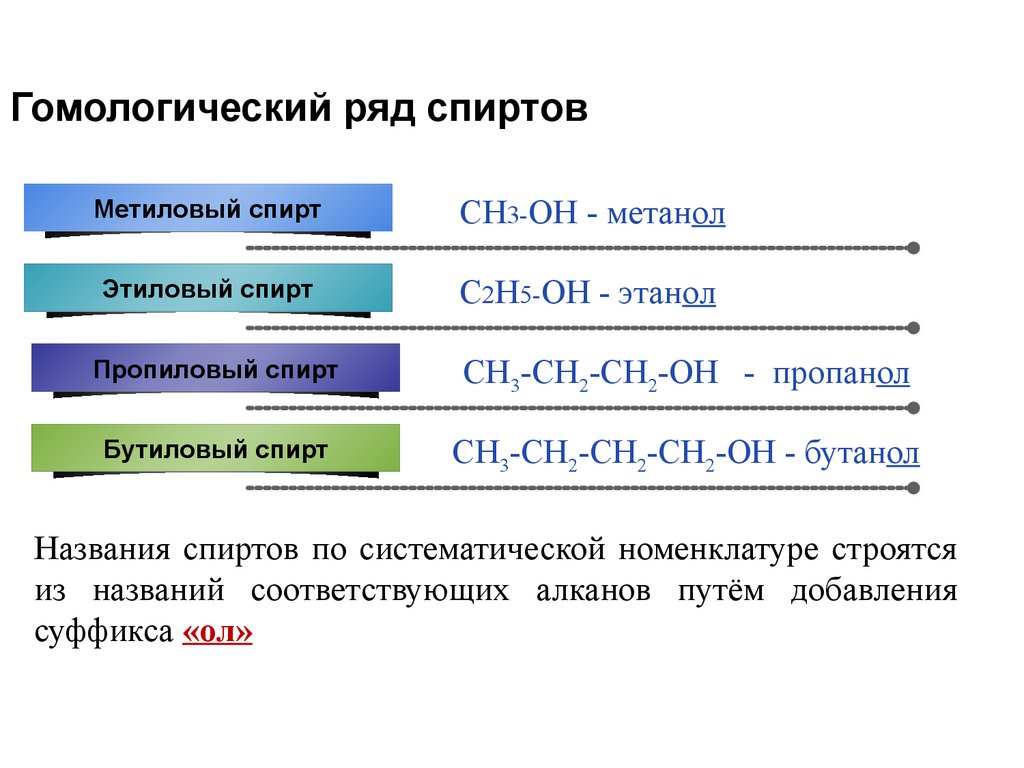
4. Гомологический ряд спиртов
Метиловый спиртCH3-OH - метанол
Этиловый спирт
C2H5-OH - этанол
Пропиловый спирт
СН3-СН2-СН2-ОН - пропанол
Бутиловый спирт
СН3-СН2-СН2-СН2-ОН - бутанол
Названия спиртов по систематической номенклатуре строятся
из названий соответствующих алканов путём добавления
суффикса «ол»
5. Физические свойства спиртов
Спирты являются бесцветными жидкостями или кристаллическимивеществами с характерным запахом. Первые представители
гомологического ряда имеют приятный запах, для бутанолов и
пентанолов запах становится неприятным и раздражающим. Высшие
алканолы имеют приятный ароматный запах.
6.
Химические свойства спиртовwww.themegallery.com
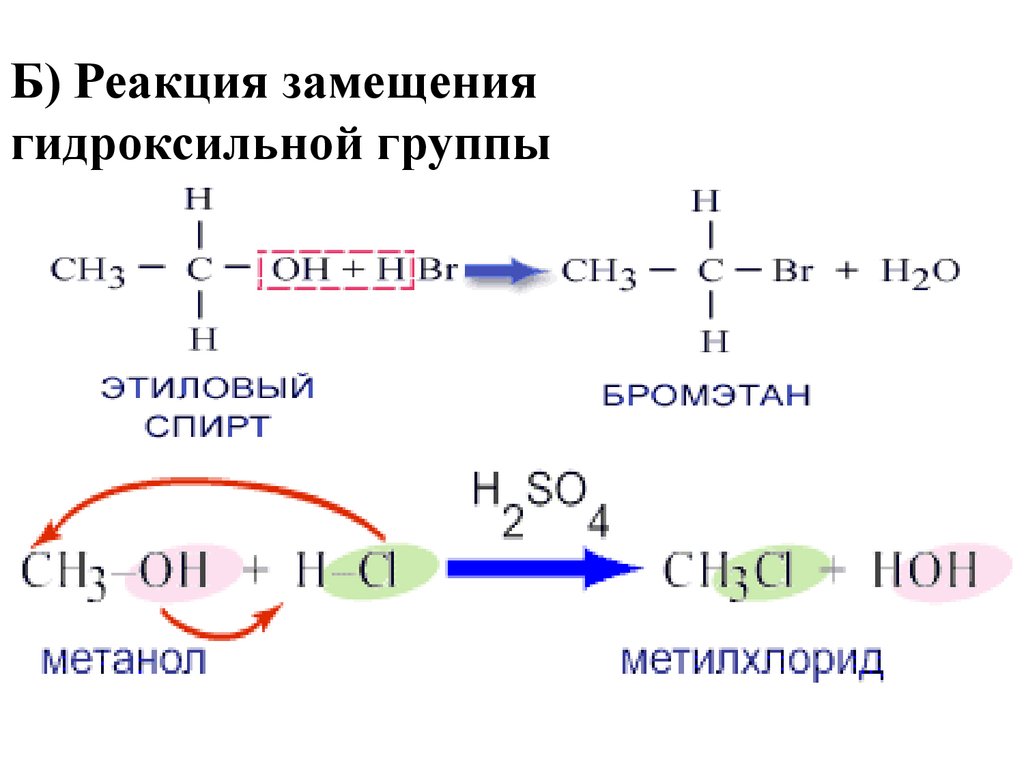
7. А) Реакция замещения атома водорода гидроксильной группы
1. Реакции замещенияА) Реакция замещения атома
водорода гидроксильной группы
С2Н5ОН + Na → C2H5ONa + H2
Спирты могут реагировать с щелочными металлами.
Образующиеся при этом металлические производные
спиртов называются алкоголятами.
8. Б) Реакция замещения гидроксильной группы
9. 2) Реакция дегидратации
При более слабом нагревании этилового спирта с серной кислотойобразуется диэтиловый эфир. Это летучая, легко воспламеняющаяся
жидкость. Диэтиловый эфир относится к классу простых эфиров –
органических веществ, молекулы которых состоят из двух
углеводородных радикалов, соединённых посредством атома кислорода.
Общая формула R – O - R
10.
Горение спиртов11. Получение спиртов
12.
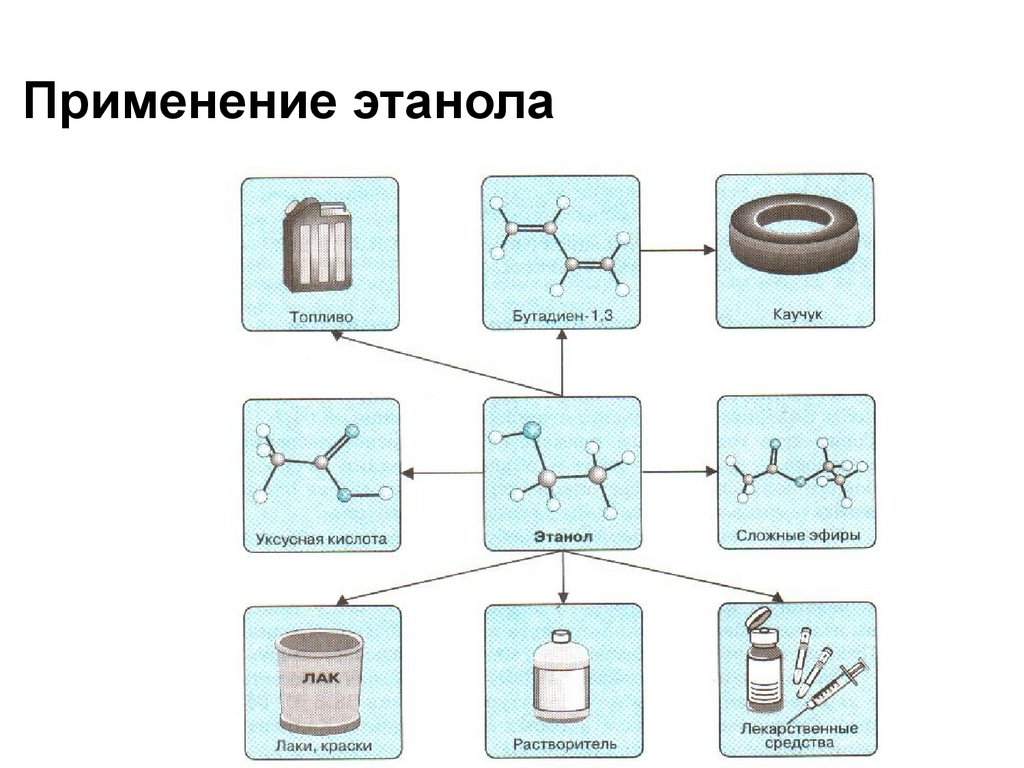
Применение этанола13. Альдегиды
LOGOАльдегиды
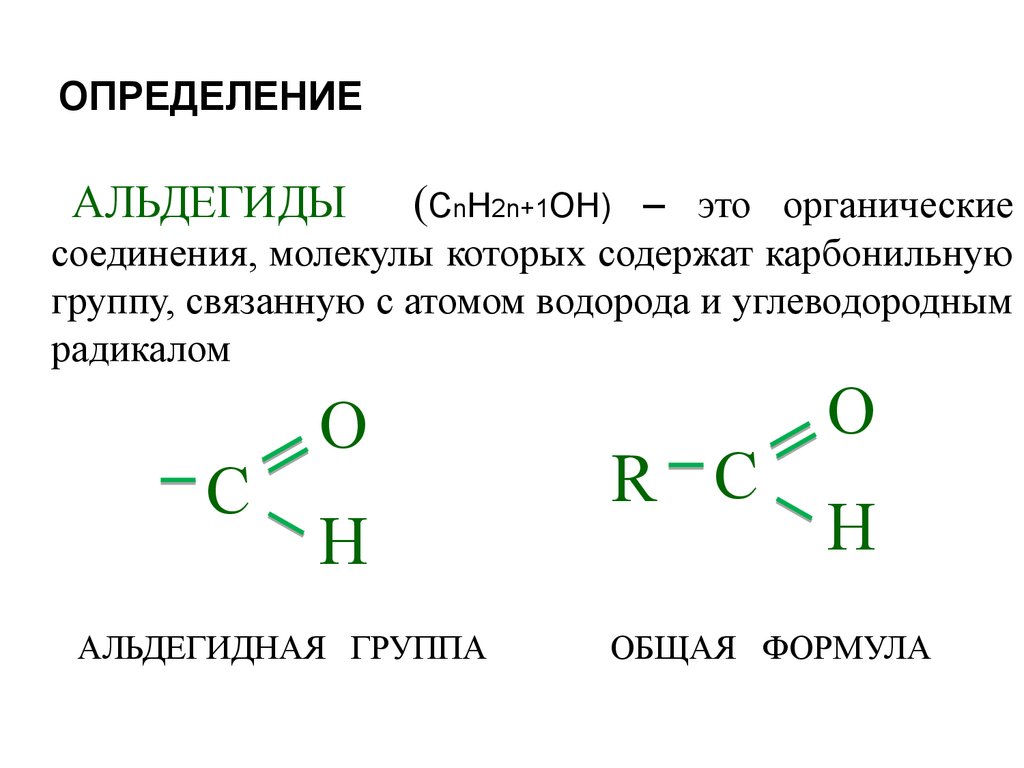
14. ОПРЕДЕЛЕНИЕ
АЛЬДЕГИДЫ(СnH2n+1OН) – это органические
соединения, молекулы которых содержат карбонильную
группу, связанную с атомом водорода и углеводородным
радикалом
С
O
H
АЛЬДЕГИДНАЯ ГРУППА
R С
O
H
ОБЩАЯ ФОРМУЛА
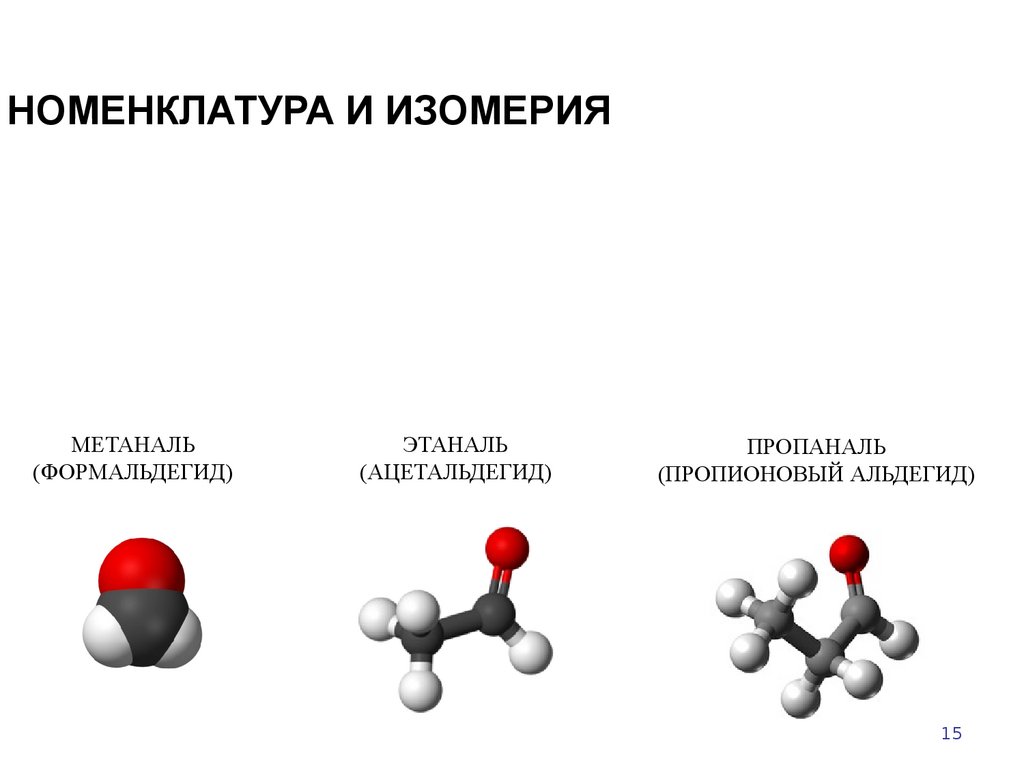
15. НОМЕНКЛАТУРА И ИЗОМЕРИЯ
МЕТАНАЛЬ(ФОРМАЛЬДЕГИД)
ЭТАНАЛЬ
(АЦЕТАЛЬДЕГИД)
ПРОПАНАЛЬ
(ПРОПИОНОВЫЙ АЛЬДЕГИД)
15
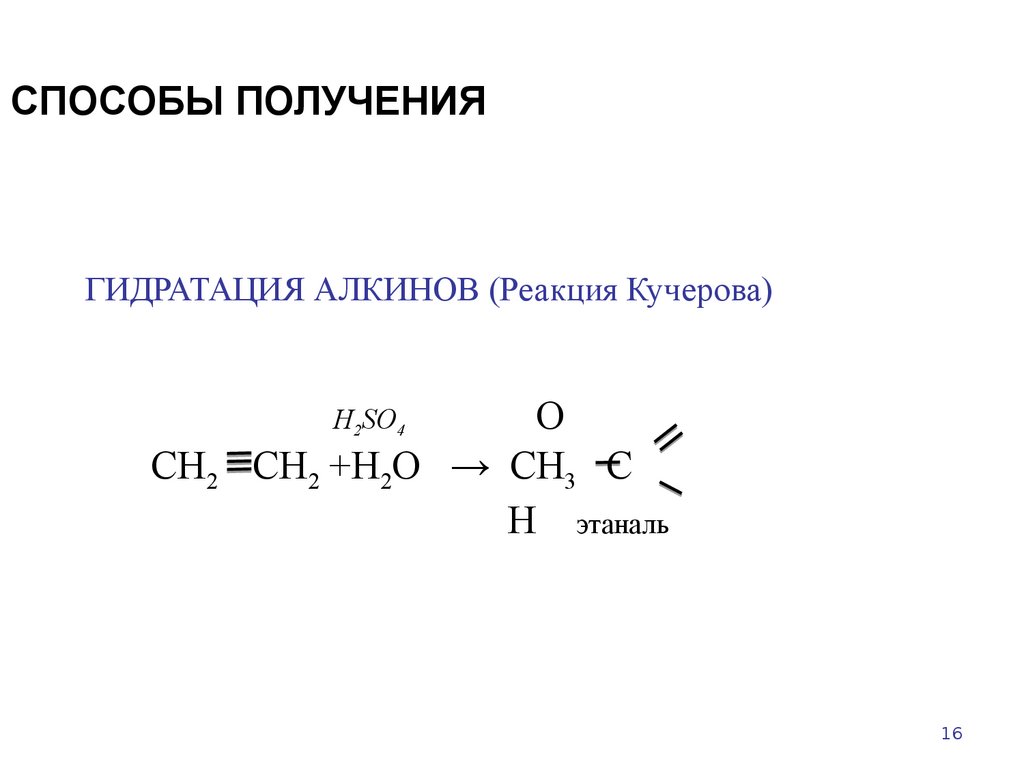
16. СПОСОБЫ ПОЛУЧЕНИЯ
ГИДРАТАЦИЯ АЛКИНОВ (Реакция Кучерова)О
СН2 +Н2О → СН3 С
Н этаналь
H2SO4
СН2
16
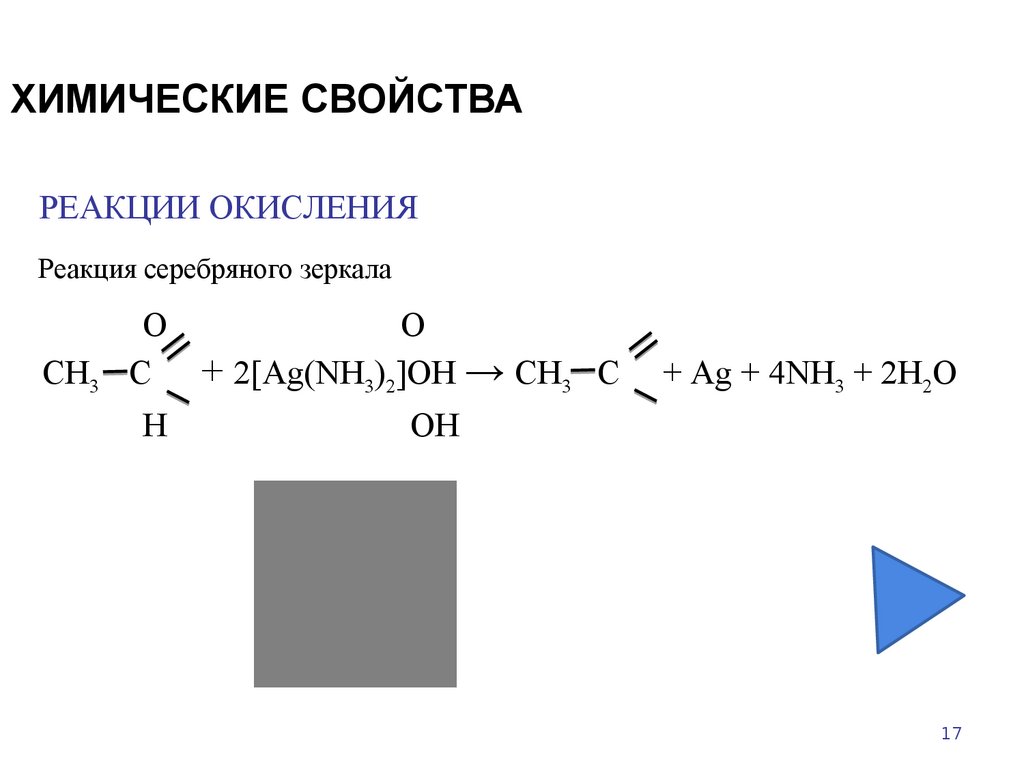
17. ХИМИЧЕСКИЕ СВОЙСТВА
РЕАКЦИИ ОКИСЛЕНИЯРеакция серебряного зеркала
СН3
О
О
С + 2[Ag(NH3)2]OH → СН3 С
Н
+ Ag + 4NH3 + 2H2O
OН
17
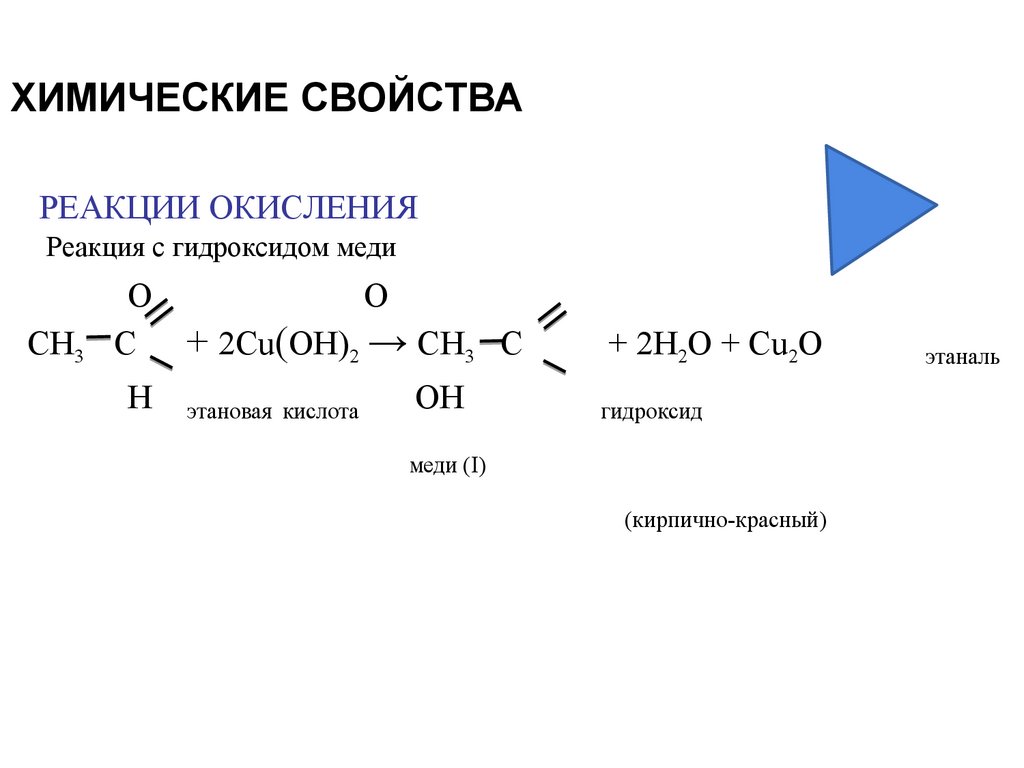
18. ХИМИЧЕСКИЕ СВОЙСТВА
РЕАКЦИИ ОКИСЛЕНИЯРеакция с гидроксидом меди
СН3
О
О
С + 2Cu(OH)2 → СН3 С
Н
этановая кислота
OН
+ 2H2O + Cu2O
гидроксид
меди (I)
(кирпично-красный)
этаналь
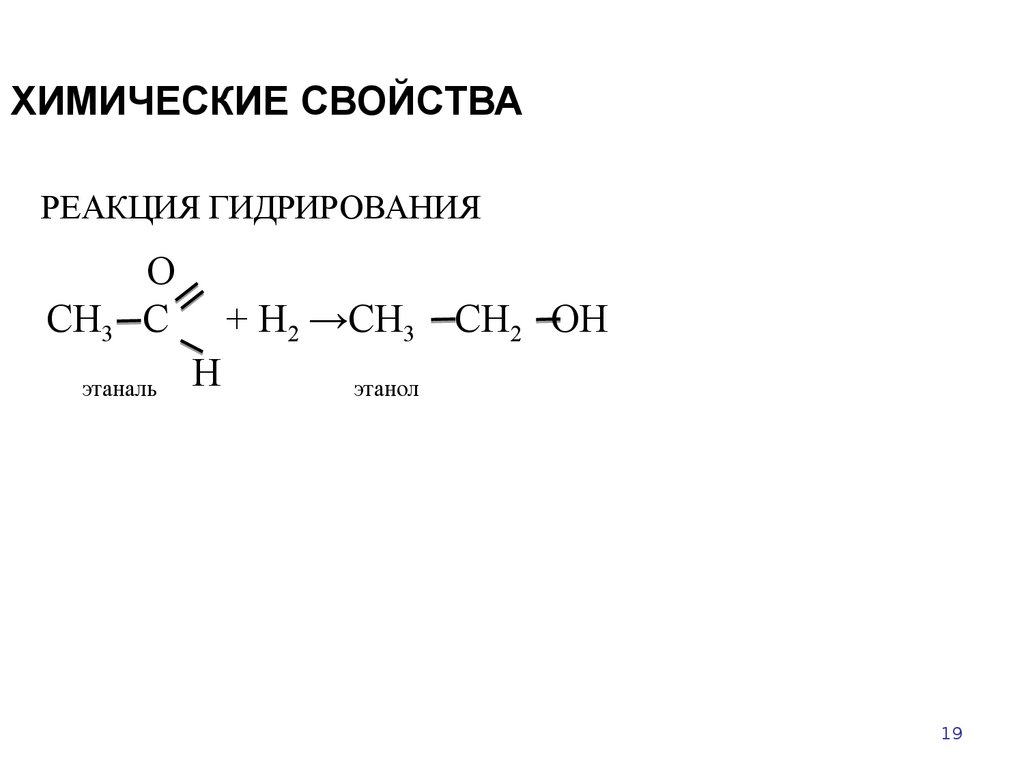
19. ХИМИЧЕСКИЕ СВОЙСТВА
РЕАКЦИЯ ГИДРИРОВАНИЯСН3
О
С
этаналь
+ Н2 →СН3 СН2 ОН
Н
этанол
19
20. ПРИМЕНЕНИЕ АЛЬДЕГИДОВ
ПАРФЮМЕРИЯ• Альдегид анисовый, обепин
– жидкость с приятным
запахом мимозы
• Альдегид дециловый,
деканаль – при разбавлении
появляются нотки запаха
апельсиновой корки
21. ПРИМЕНЕНИЕ АЛЬДЕГИДОВ
ПОЛИМЕРНЫЕ МАТЕРИАЛЫФенолформальдегидные смолы
22. ПРИМЕНЕНИЕ АЛЬДЕГИДОВ
ПРОИЗВОДСТВО ВЕЩЕСТВУксусная кислота
Этилацетат
Формалин
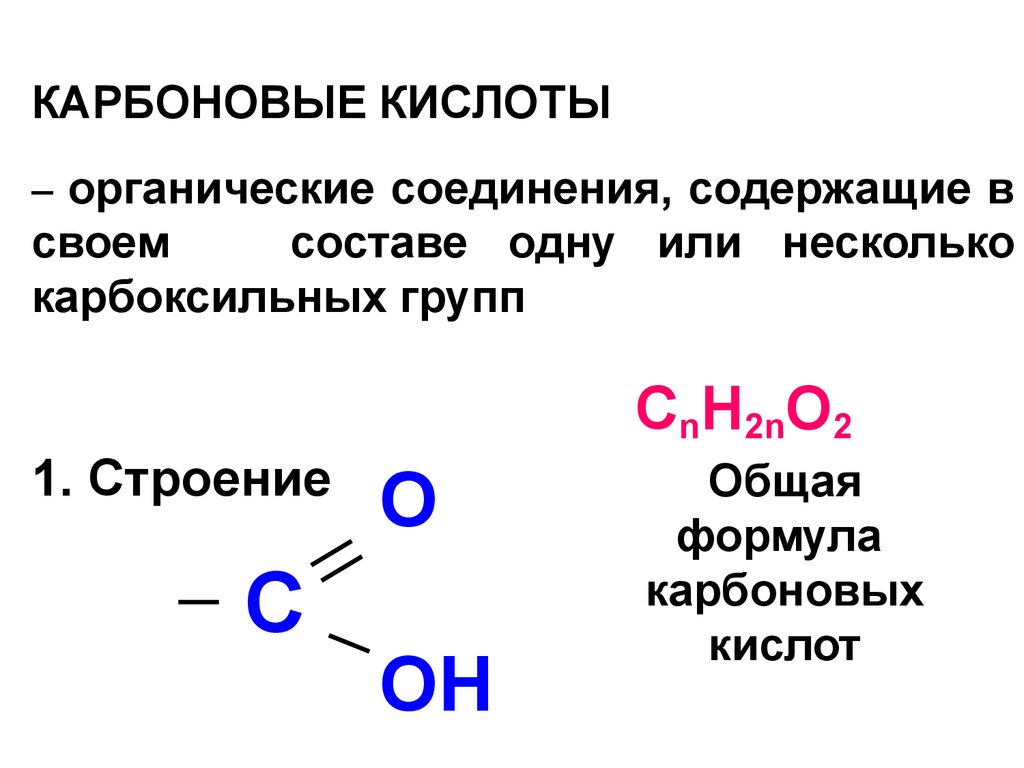
23. КАРБОНОВЫЕ КИСЛОТЫ
LOGOКАРБОНОВЫЕ
КИСЛОТЫ
24.
КАРБОНОВЫЕ КИСЛОТЫ– органические соединения, содержащие в
своем
составе одну или несколько
карбоксильных групп
СnH2nO2
1. Строение
C
O
OH
Общая
формула
карбоновых
кислот
25.
МЕТАНОВАЯ КИСЛОТА(МУРАВЬИНАЯ КИСЛОТА)
26.
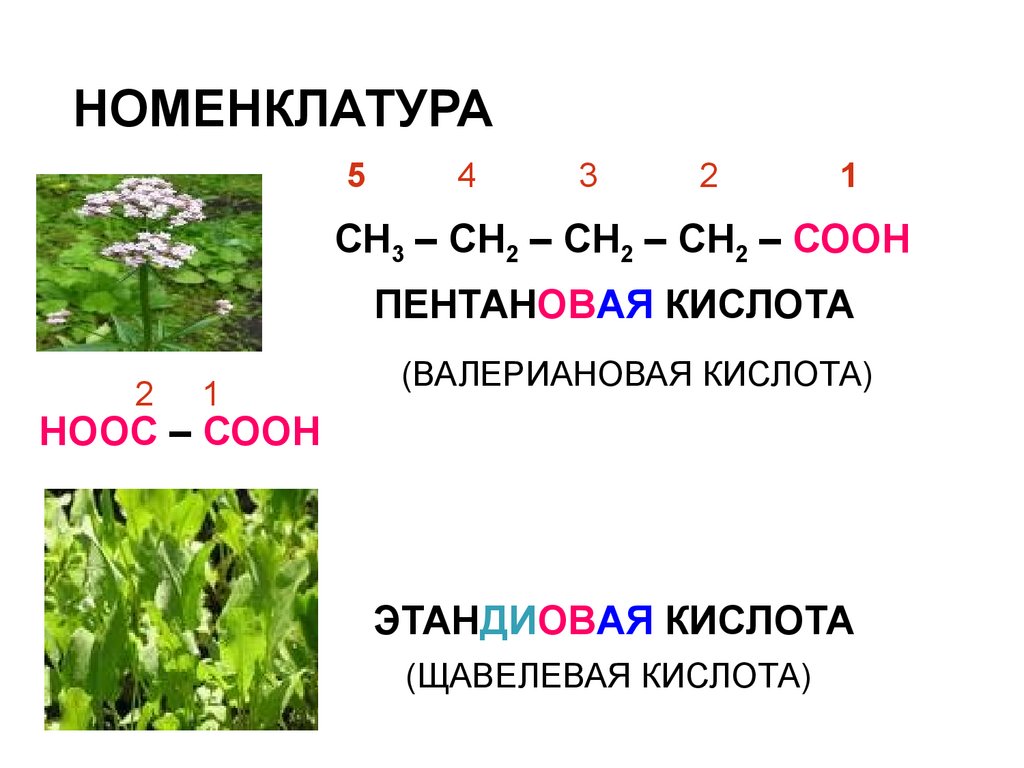
НОМЕНКЛАТУРА5
4
3
2
1
СН3 – СН2 – СН2 – СН2 – СООН
ПЕНТАНОВАЯ КИСЛОТА
2
1
(ВАЛЕРИАНОВАЯ КИСЛОТА)
НООС – СООН
ЭТАНДИОВАЯ КИСЛОТА
(ЩАВЕЛЕВАЯ КИСЛОТА)
27.
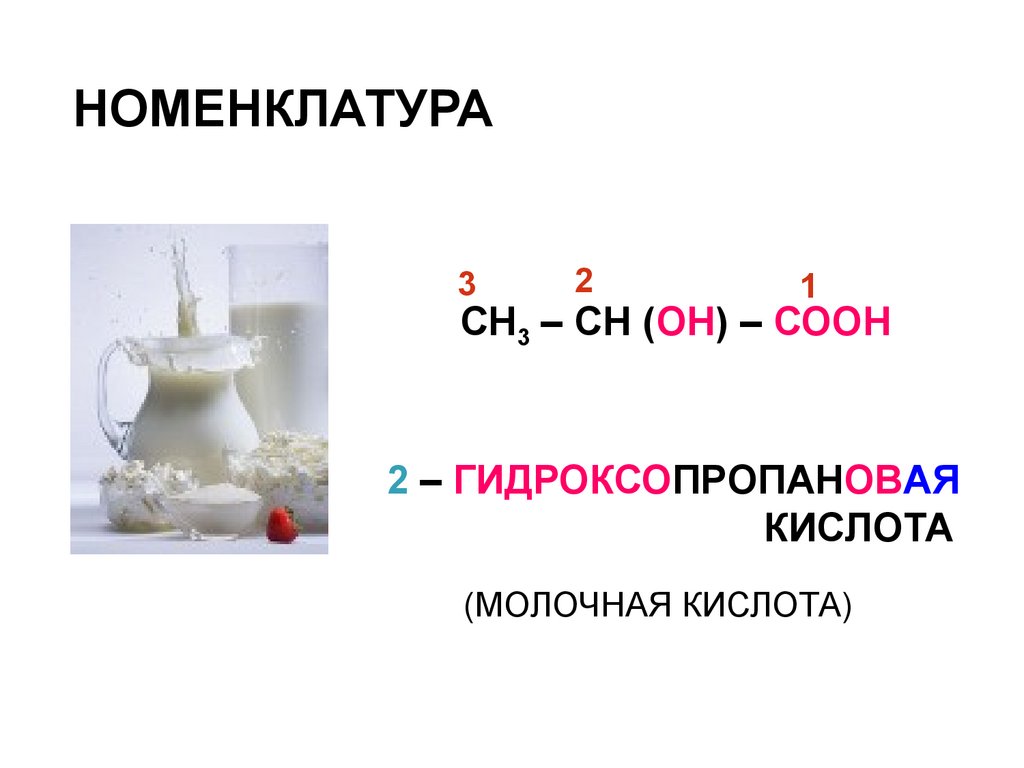
НОМЕНКЛАТУРА3
2
1
СН3 – СН (ОН) – СООН
2 – ГИДРОКСОПРОПАНОВАЯ
КИСЛОТА
(МОЛОЧНАЯ КИСЛОТА)
28.
Физические свойстваС 1 – С3
С4 –
Жидкости с характерным
резким запахом, хорошо
растворимые
в
воде
Вязкие
маслянистые
с неприятным
С9 жидкости
запахом, плохо растворимые
в воде
C10 и >
Твердые
вещества,
не имеющие запаха, не
растворимые в воде
29.
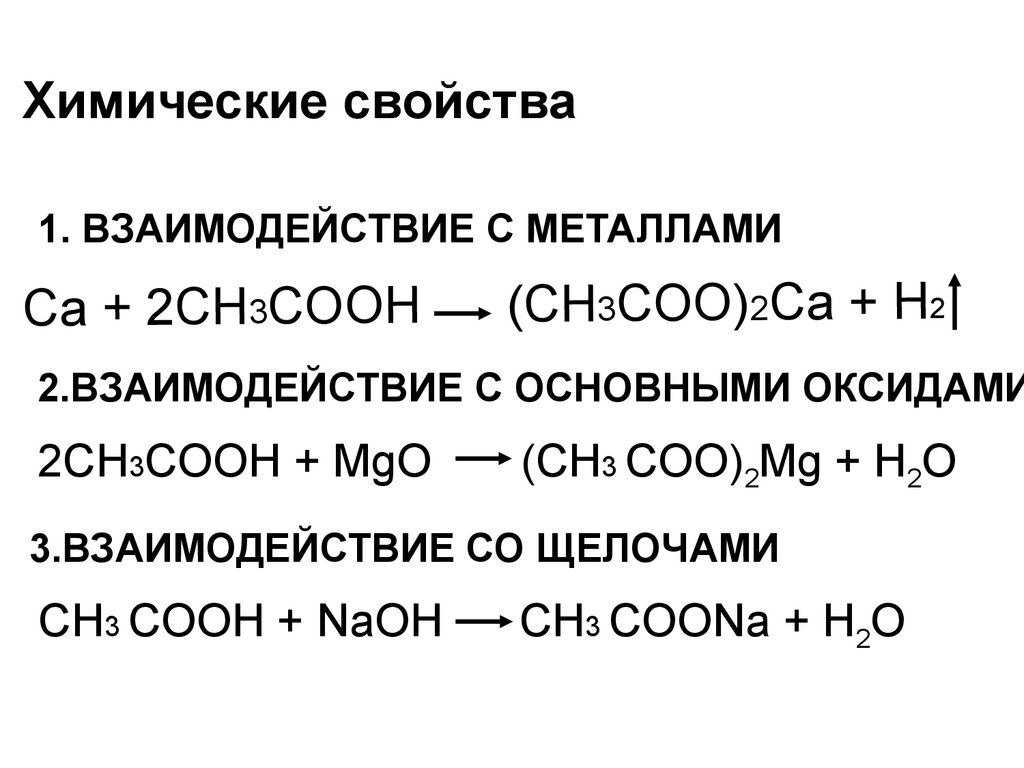
Химические свойства1. ВЗАИМОДЕЙСТВИЕ С МЕТАЛЛАМИ
Ca + 2CH3COOH
(CH3COO)2Ca + H2
2.ВЗАИМОДЕЙСТВИЕ С ОСНОВНЫМИ ОКСИДАМИ
2СН3COOH + MgO
(СН3 COO)2Mg + H2O
3.ВЗАИМОДЕЙСТВИЕ СО ЩЕЛОЧАМИ
СН3 COOH + NaOH
СН3 COONa + H2O
30.
СПОСОБЫ ПОЛУЧЕНИЯКАРБОНОВЫХ КИСЛОТ
1. ОКИСЛЕНИЕ СПИРТОВ, АЛЬДЕГИДОВ,
АЛКАНОВ И АЛКЕНОВ
31. ПРИМЕНЕНИЕ
в кожевенной (при дублении кож);в пищевой (для консервирования
фруктов);
в медицине;
в производстве некоторых полимеров
для отбеливания тканей;
в производстве красителей;
для удаления ржавчины и накипи.
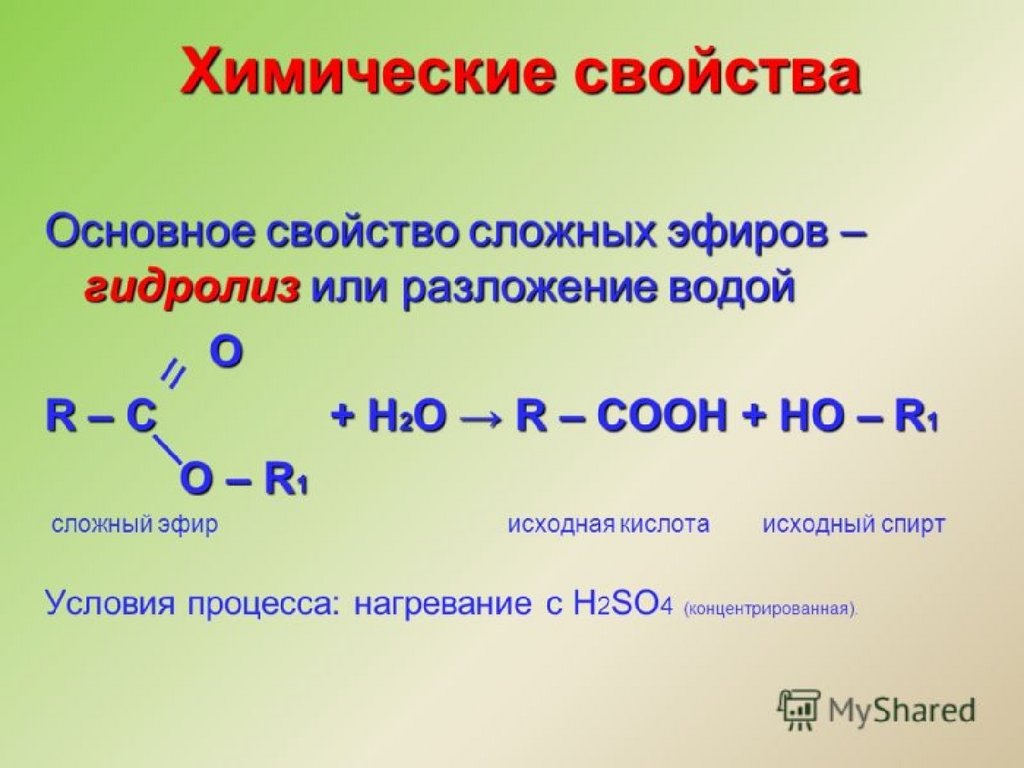
32. Сложные эфиры
LOGOСложные эфиры
33. Сложными эфирами называют производные карбоновых кислот, в которых атом водорода карбоксильной группы замещён на углеводородный
Сложные эфирыСложными эфирами называют производные
карбоновых кислот, в которых атом водорода
карбоксильной группы замещён на
углеводородный радикал.
Их состав соответствует общей формуле
34. ПОЛУЧЕНИЕ
Реакция этерификацииCH3COOH + НОС2Н5
уксусная кислота
этиловый спирт
CH3COOС2Н5 + H2O
этиловый эфир
уксусной кислоты
(этилацетат)
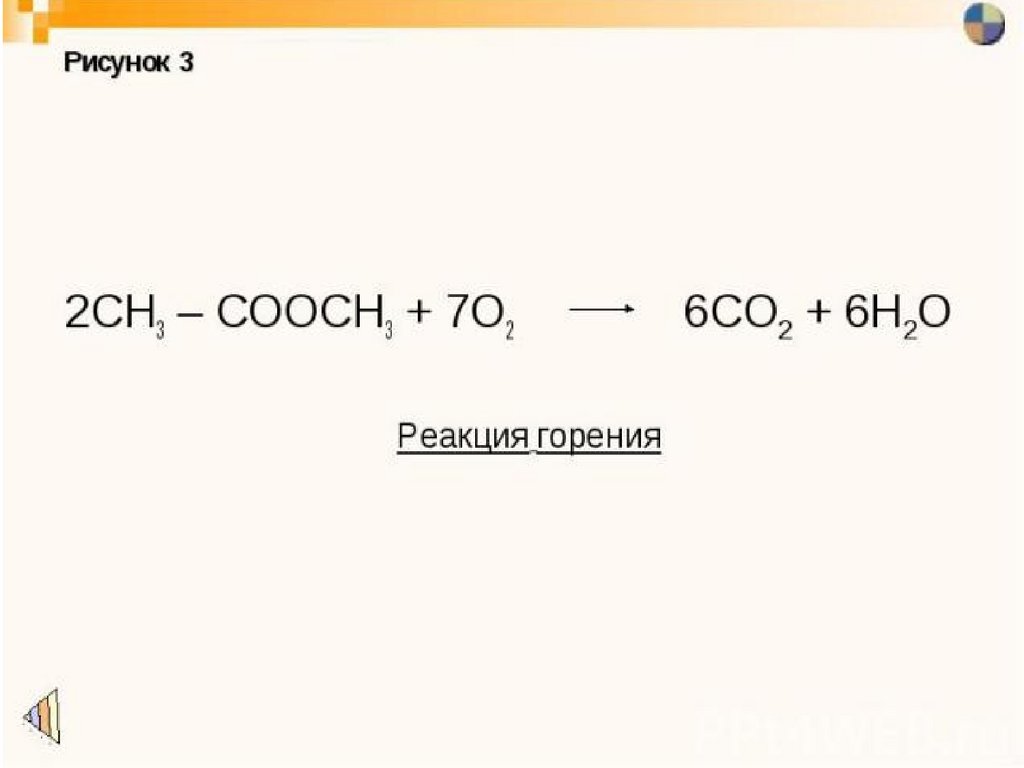
35. Применение
ПРИМЕНЕНИЕ36. Физические свойства
Сложные эфиры – жидкости, обладающиеприятными фруктовыми запахами. В воде они
растворяются очень мало, но хорошо
растворимы в спиртах.
Сложные эфиры очень распространены в
природе. Их наличием обусловлены приятные
запахи цветов и фруктов.
37.
ЖАСМИНОВЫЙ ЗАПАХС2 Н 5СОО СН 2С6 Н 5
Бензил-ацетат
38.
LOGOГРУШЕВЫЙ ЗАПАХ
СН 3 СОО С2 Н 5
этилэтанат
39.
Вишнёвый запахНСОО С5 Н11
бутилметанат
40.
41.
42. Домашнее задание
1)Подготовка презентации на тему:- Формальдегид как основа получения веществ
и материалов для моей профессиональной
деятельности.
- Лавсан как представитель синтетических
волокон.
- Синтетические моющие средства — СМС
(детергенты), их преимущества и недостатки.
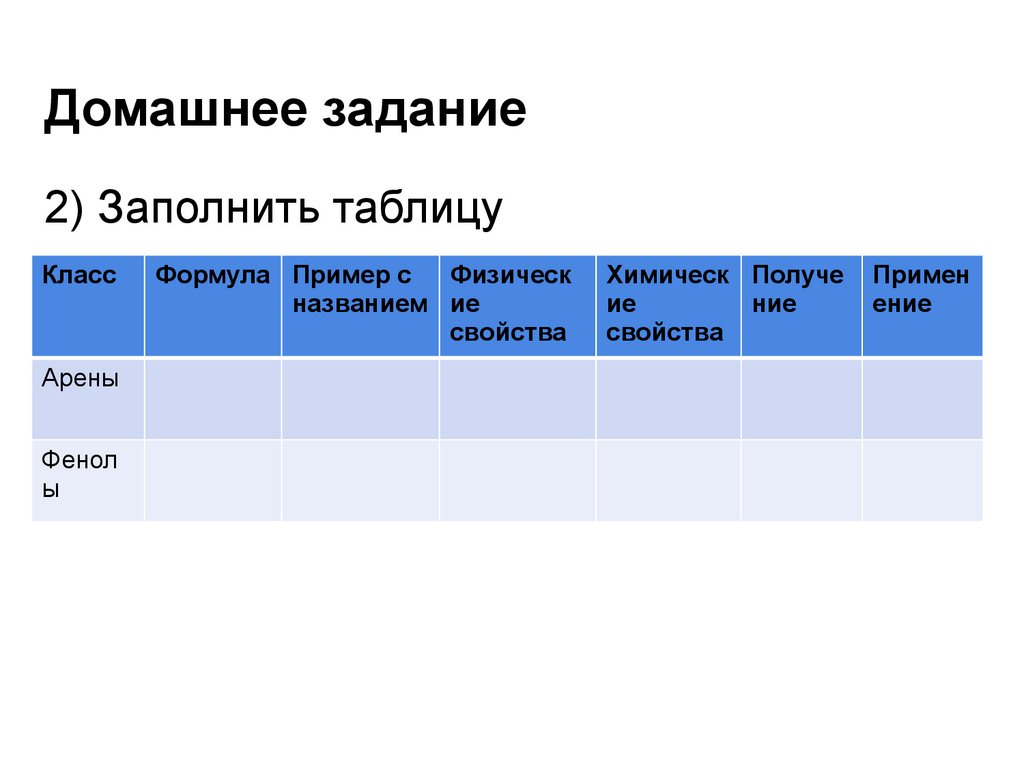
43. Домашнее задание
2) Заполнить таблицуКласс
Арены
Фенол
ы
Формула Пример с Физическ
названием ие
свойства
Химическ Получе
ие
ние
свойства
Примен
ение

























 Химия
Химия