Похожие презентации:
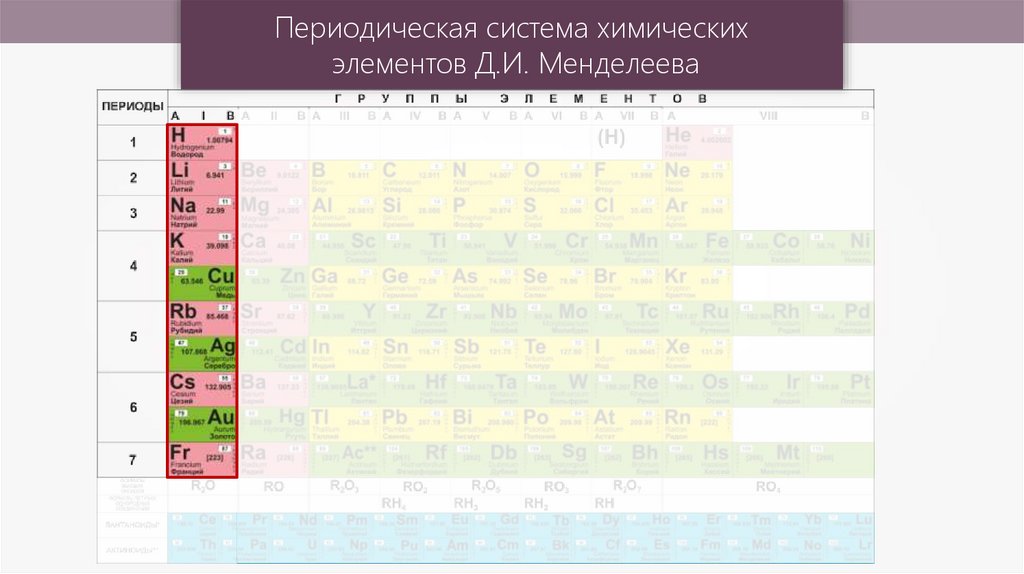
Периодическая система химических элементов Д.И. Менделеева
1.
Периодическая система химическихэлементов Д.И. Менделеева
2.
Литий был открыт в 1817 г.шведским химиком
А. Арфведсоном. Металл назвали
литием, что в переводе с
греческого означает «камень».
А. Арфведсон
1792–1841 гг.
3.
Впервые литий был полученанглийским химиком Г. Дэви в 1818 г.
Г. Деви
1778–1829 гг.
4.
ЛитийDnn87
5.
Использование лития6.
Использование лития7.
В 1807 г. английский химик и физикГ. Дэви впервые получил натрий в
чистом виде при электролизе
едкого натра.
Он первым изучил его свойства.
Г. Деви
1778–1829 гг.
8.
НатрийDnn87
9.
10.
Натрий содержится ворганизме человека: в
эритроцитах крови, сыворотке,
пищеварительных соках, играет
важную роль в водно-солевом
обмене и поддержании
кислотно-щелочного
равновесия.
11.
12.
13.
Металлическим натриемвосстанавливают из
соединений такие
ценные металлы, как
цирконий, тантал.
Цирконий
Alchemist-hp
Тантал
14.
КалийDnn87
15.
В природе калий встречаетсятолько в соединениях с другими
элементами, например, в
морской воде, во многих
минералах.
Очень быстро окисляется на
воздухе и очень легко вступает в
химические реакции, особенно
с водой, образуя щёлочь.
16.
17.
Калий используют обычно в формесолей. Калийные удобрения — это
природные или изменённые в
процессе химической обработки соли
калия.
18.
Калий19.
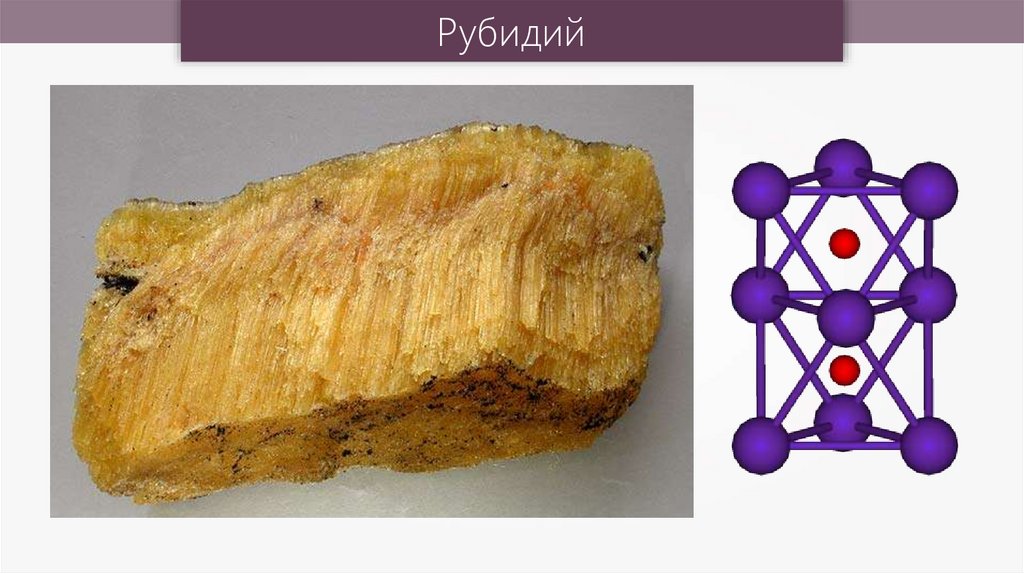
Рубидий20.
Рубидий21.
ЦезийMagnus Manske
22.
ФранцийФранций был открыт в 1939 г.
Маргаритой Пере. Она же дала ему
в 1964 г. название в честь своей
родины — Франции.
Маргарита Пере
1909–1975 гг.
23.
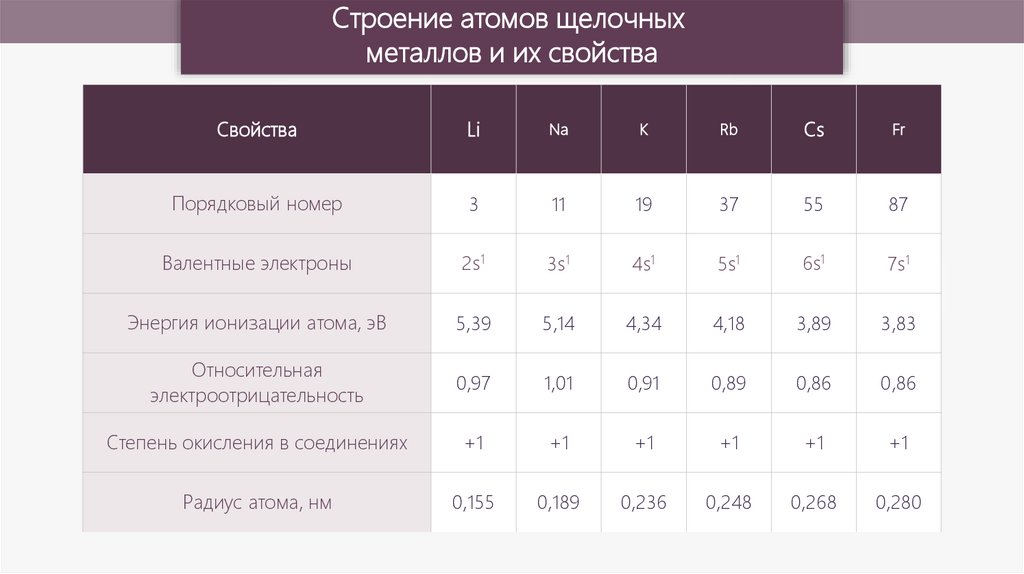
Строение атомов щелочныхметаллов и их свойства
Свойства
Li
Na
K
Rb
Cs
Fr
Порядковый номер
3
11
19
37
55
87
Валентные электроны
2s1
3s1
4s1
5s1
6s1
7s1
Энергия ионизации атома, эВ
5,39
5,14
4,34
4,18
3,89
3,83
Относительная
электроотрицательность
0,97
1,01
0,91
0,89
0,86
0,86
Степень окисления в соединениях
+1
+1
+1
+1
+1
+1
Радиус атома, нм
0,155
0,189
0,236
0,248
0,268
0,280
24.
Металлические свойстваМеталлический блеск
Пластичность
Мягкость
Хорошая электропроводность
Хорошая теплопроводность
25.
Химические свойства металлов0
0
t
+1 –1
2M + H2 = 2MH
гидрид
–
2e
Щелочные металлы активно взаимодействуют
почти со всеми неметаллами.
26.
Химические свойства металлов0
0
t
+1 –1
2M + Cl2 = 2MCl
хлорид
–
2e
При взаимодействии щелочных металлов с
галогенами образуются соли (галогениды металлов).
27.
Химические свойства металлов0 t +1 –2
0
2M + S = M2S
сульфид
–
2e
При взаимодействии щелочных металлов с серой
образуются сульфиды металлов.
28.
Реакция взаимодействиящелочных металлов с кислородом
0
0
t
+1 –2
4Li + O2 = 2Li2O
29.
Взаимодействия натрия с водой,путём вытеснения воздуха
30.
0+1
+1
0
+1
+1
0
2Na + H2O = 2NaOH + H2↑
0
2K + H2O = 2KOH + H2↑
При взаимодействии с водой щелочные
металлы образуют щёлочи, восстанавливая
воду до водорода, и водород.
31.
Соединения щелочных металловГалит
Сильвинит
32.
Оксиды щелочных металловR2O +H2O =2ROH
Оксиды щелочных металлов являются типичными
основными оксидами, они обладают всеми свойствами
основных оксидов.
33.
Гидроксиды щелочных металловNa2O + H2O = 2NaOH
K2O+HNO3 = 2KNO3 + H2O
нитрат калия
Гидроксиды щелочных металлов являются
сильными основаниями. Они участвуют во
всех реакциях, характерных для оснований.
34.
Соли щелочных металловГидроксид натрия
35.
Соли щелочных металловХлорид натрия
36.
Соли щелочных металлов37.
Соли щелочных металлов38.
Самая значительная способность калия —поддерживать работу сердечной мышцы,
поэтому нехватка калия в организме очень
сказывается на здоровье человека.
Взрослый человек должен в сутки
потреблять с пищей 3,5 г ионов калия.

































 Химия
Химия








