Похожие презентации:
Электролитическая диссоциация
1. Электролитическая диссоциация
2. Определение
Электролитическая диссоциация — процессраспада электролита на ионы при растворении его
в полярном растворителе или при плавлении.
3. Электролитическая диссоциация
1.2.
3.
4.
5.
6.
Электролиты и неэлектролиты
Электролитическая диссоциация
Механизм электролитической
диссоциации
Сильные и слабые электролиты
Диссоциация кислот, оснований, солей
Значение электролитов
4. Электролитическая диссоциация химических элементов
Основные положения теории:1. Электролиты при растворении в воде распадаются
(диссоциируют) на ионы – положительные и
отрицательные. Ионы находятся в более устойчивых
электронных состояниях, чем атомы. Они могут состоять
из одного атома – это простые ионы или из нескольких
атомов – сложные ионы
5.
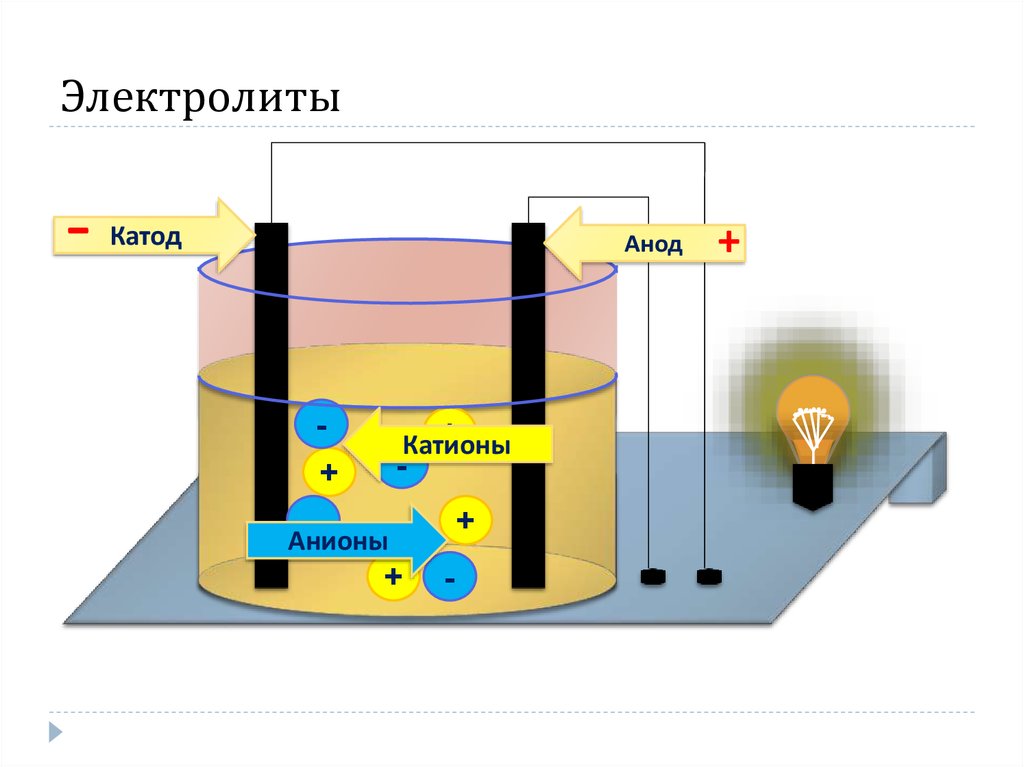
Основные положения теории:2. При действии электрического тока ионы
приобретают направленное движение: положительно
заряженные ионы движутся к катоду, отрицательно
заряженные – к аноду. Поэтому первые называются
катионами, а вторые – анионами. Направленное
движение ионов происходит в результате притяжения
их к противоположено заряженным электродам
6.
Основные положения теории:3. Диссоциация – обратимый процесс: параллельно с
распадом молекул на ионы (диссоциацией) протекает
процесс соединения ионов (ассоциация). Поэтому в
уравнениях электролитической диссоциации вместо
знака равенства ставят знак обратимости.
7. Электролиты
Электролиты- это вещества, растворы ирасплавы которых проводят электический
ток.
Кислоты
HCl; HNO3; H2SO4
Щелочи
NaOH; KOH; Ba(OH)2
Соли
NaCl; CuSO4; Al(NO3)3
8. Электролиты
-Катод
Анод
+
-
+
Катионы
-
Анионы
+
+
-
+
9. Неэлектролиты
Неэлектролиты- это вещества, растворы илирасплавы которых не проводят
электрический ток.
Органический вещества: сахар, ацетон,
керосин, глицерин, этиловый спирт, бензол
и др.
Газы: кислород, водород, азот и др.
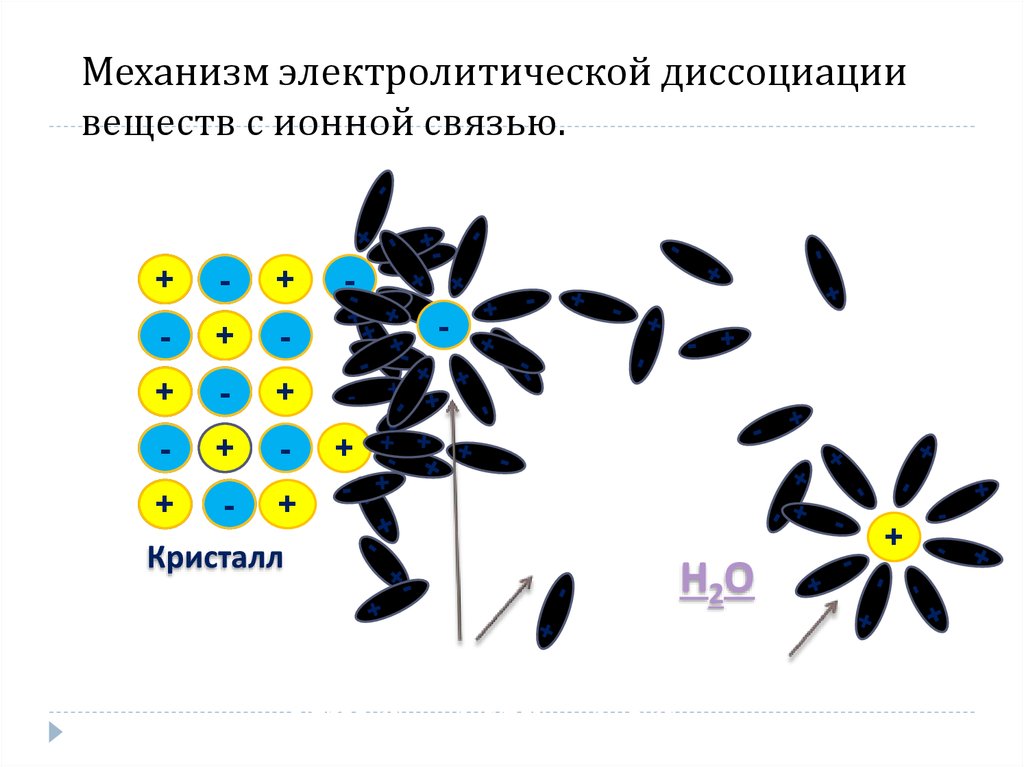
10. Механизм электролитической диссоциации веществ с ионной связью.
+-
+
-
+
-
+
-
+
-
+
-
+
-
+
Кристалл
-
+
+
Н2О
NaCl → Na+ + Cl -
11. Степень электролитической диссоциации (α) -
Степень электролитическойдиссоциации (α)
отношение числа диссоциированных
молекул к общему числу молекул,
находящихся в растворе.
n
α=
N
Сильные электролиты α
> 30%
Слабые электролиты
α< 30%
12. Сильные и слабые электролиты
ЭлектролитыСоли
Сильные (α >30%)
Слабые (α < 30%)
практически все
Hg2Cl2 , некоторые
cоли тяжелых металлов
гидроксиды
щелочных и
щелочноземельных
металлов
водный раствор
аммиака
Основания
растворимые в воде
нерастворимые
-
все
Кислоты
бескислородные
HI, HBr, HCl
кислородосодержащи
е
HClO4 H2SO4,
HNO3
HF, H2S
H2SO3, H2CO3,
H2SiO3, Н3РO4,
CH3COOH и др.
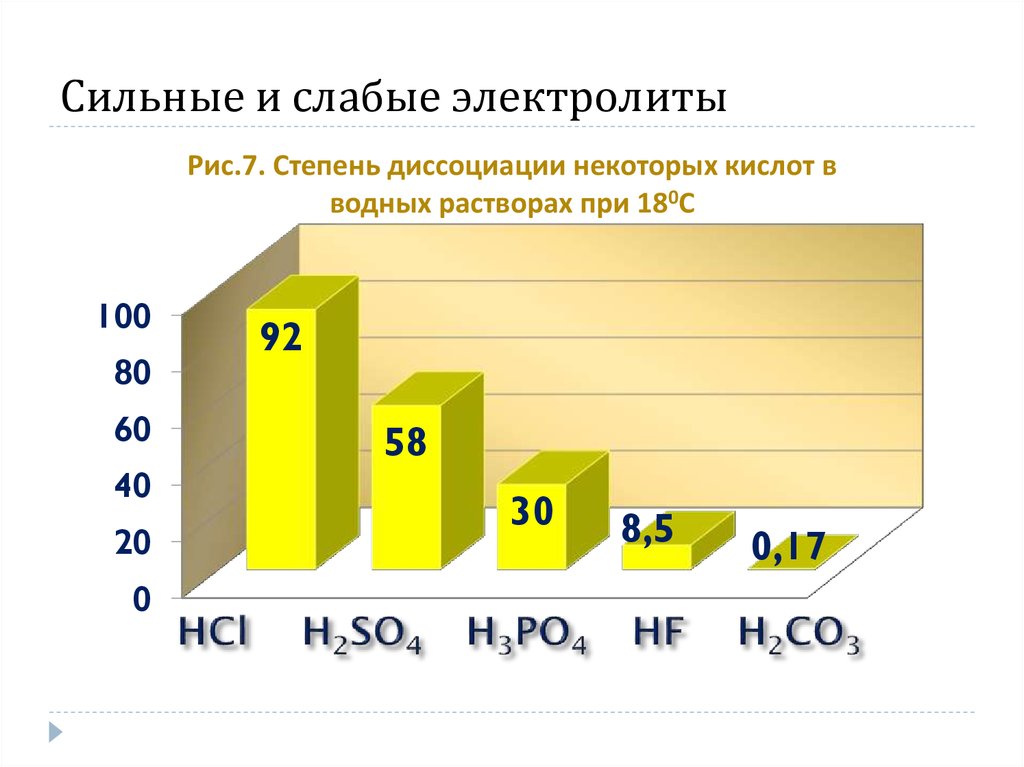
13. Сильные и слабые электролиты
Рис.7. Степень диссоциации некоторых кислот вводных растворах при 180С
100
80
60
40
20
0
92
58
30
8,5
0,17
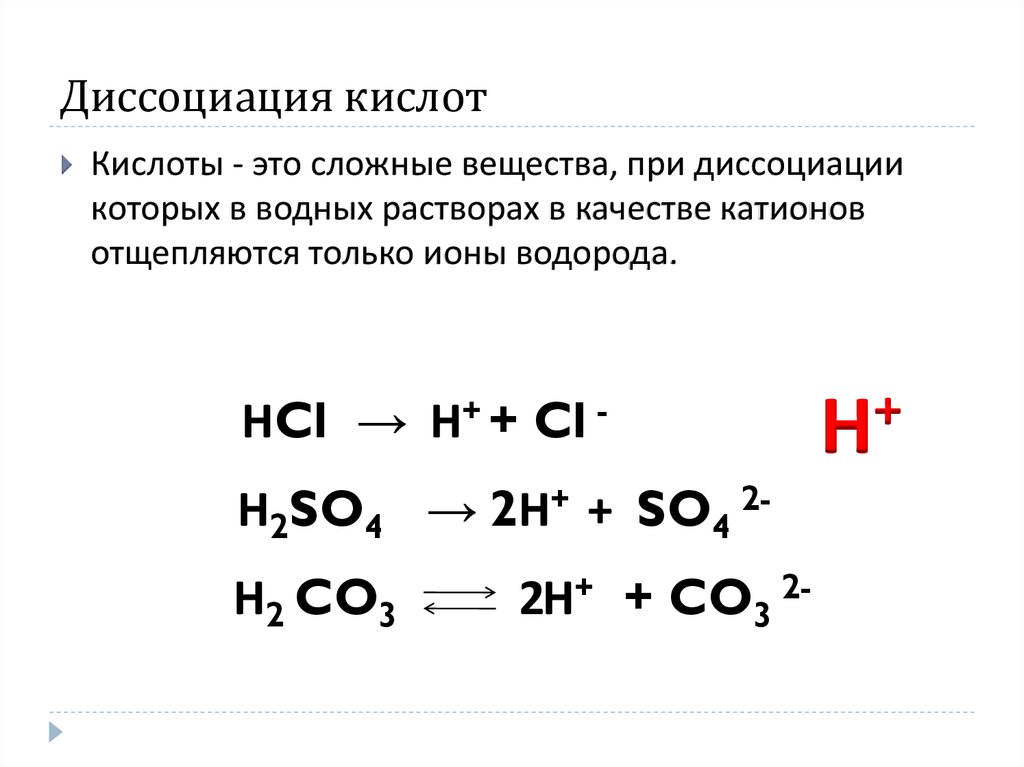
14. Диссоциация кислот
Кислоты - это сложные вещества, при диссоциациикоторых в водных растворах в качестве катионов
отщепляются только ионы водорода.
НCl → Н+ + Cl Н2SO4 → 2Н+ + SO4 2-
Н2 CO3
2Н+ + CO3 2-
+
Н
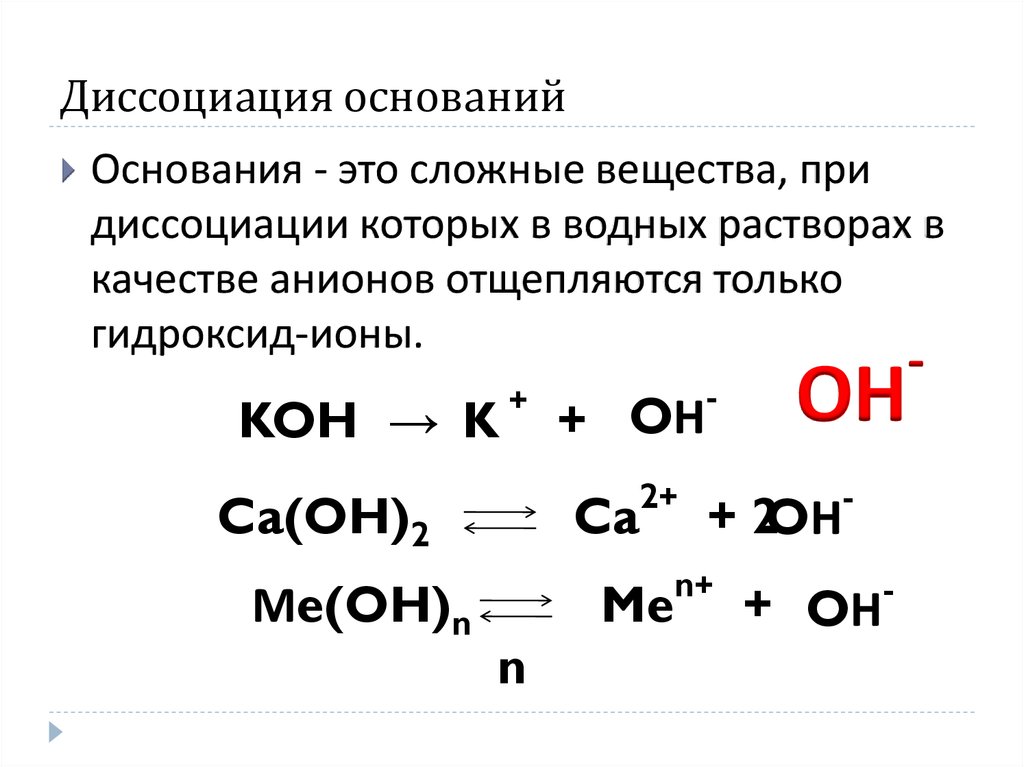
15. Диссоциация оснований
Основания - это сложные вещества, придиссоциации которых в водных растворах в
качестве анионов отщепляются только
гидроксид-ионы.
KOH → K
+
+ OН
2+
Ca(OH)2
Мe(OH)n
-
Ca
Me
n
-
ОН
-
+ 2OН
n+
-
+ OН
16. Диссоциация солей
Соли- это сложные вещества,которые в водных растворах диссоциируют на
катионы металла и анионы кислотного остатка.
NaCl →
Na+ +
K2SO4 → 2K+ +
Me
СlSO4 2-
Al(NO3)3 →Al3+ + 3NO3 -
n+
(кислотный остаток)
в-
17. Электролитическая диссоциация
Электролиты – составнаячасть жидкостей и плотных
тканей живых организмов.
+ +
2+
2+ +
-2
Ионы Na ,K ,Ca ,Mg ,H ; OH ; Cl ; SO4 ;
имеют большое значение для физиологических и
биохимических процессов:
+
ионы H ; OH играют большую роль в работе
ферментов, обмене веществ, переваривании пищи и
др.
при нарушении водно-солевого обмена в медицине
применяется физиологический раствор – 0,85%
раствор NaCl;
ионы I влияют на работу щитовидной железы.
18. Закон разбавления Оствальда
K=a2C1-a
здесь C-молярная концентрация
электролита, моль/л.Если степень
диссоциации значительно меньше
единицы, то при приближенных
вычислениях можно принять, что 1a≈1.Тогда выражение закона
разбавления упрощается
K=a2C, откуда a=√K/C












 Химия
Химия








