Похожие презентации:
Оксиды. Классификация оксидов
1.
Оксиды2.
Что такое оксиды?Оксиды- это
сложные вещества,
состоящие из двух элементов, один из
которых кислород.
Общая формула:
ХO
m
n
3.
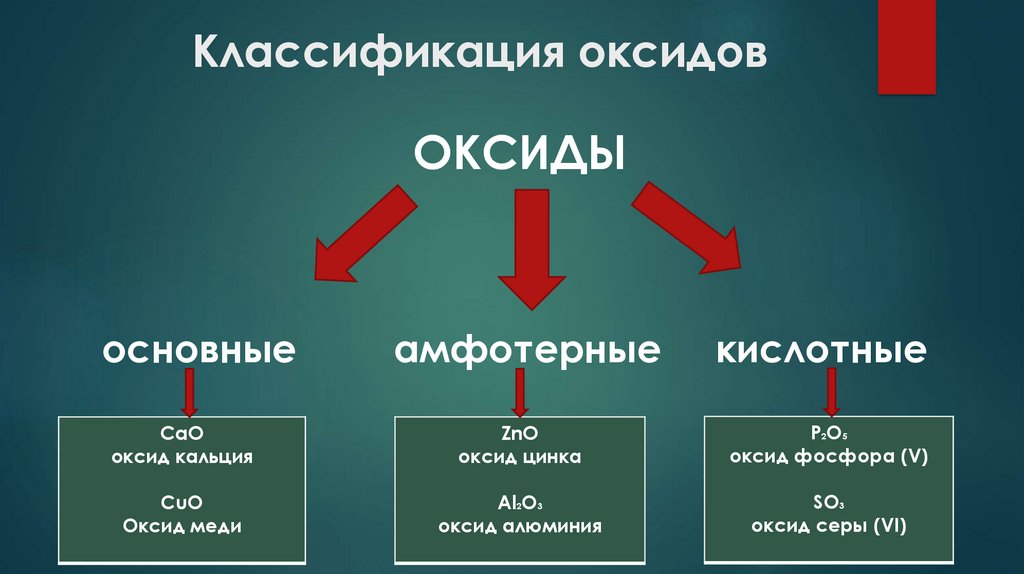
Классификация оксидовОКСИДЫ
основные
амфотерные
кислотные
СaO
оксид кальция
ZnO
оксид цинка
P2O5
оксид фосфора (V)
СuO
Оксид меди
Al2O3
оксид алюминия
SO3
оксид серы (VI)
4.
НАПИШИТЕ ХИМИЧЕСКИЕ ФОРМУЛЫ ОКСИДОВ1)Оксид серы(IV)
2)Оксид азота(V)
3)Оксид калия (I)
4)Оксид железа(II)
5)Оксид фосфора(V)
6) оксид натрия (I)
5.
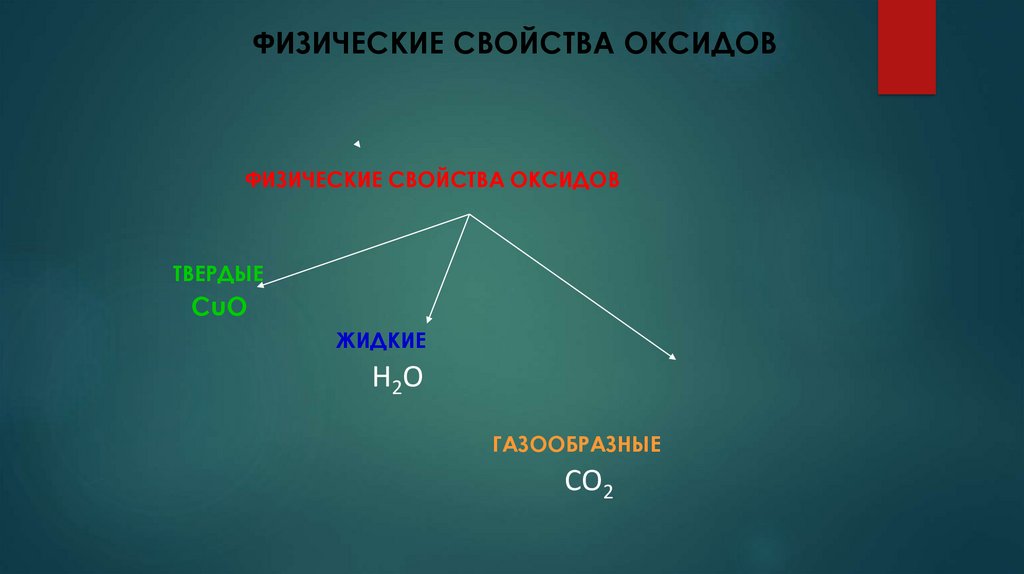
ФИЗИЧЕСКИЕ СВОЙСТВА ОКСИДОВФИЗИЧЕСКИЕ СВОЙСТВА ОКСИДОВ
ТВЕРДЫЕ
СuO
ЖИДКИЕ
Н2 О
ГАЗООБРАЗНЫЕ
СО2
6.
Химические свойства оксидовосновных
кислотных
1. Основные оксиды
взаимодействуют с кислотами. При
этом образуется соль и вода:
t
CuO+H2SO4=CuSO4+H2O
1. Кислотные оксиды
взаимодействуют с растворимым
основаниями(щелочами). При этом
образуются соль и вода:
2. Оксиды активных металлов
взаимодействуют с водой с
образованием растворимого
основания(щелочи):
2. Большинство кислотных оксидов
взаимодействует с водой с
образованием кислоты:
t
P2O5+3H2O=2H3PO4
Li2O+H2O=2LiOH
CO2+Ca(OH)2=CaCO3 +H2O
3. Основные и кислотные оксиды взаимодействуют друг с другом с
образованием солей:
СaO+CO2=CaCO3
4. Менее летучие кислотные оксиды
вытесняют более летучие из их
солей:
t
CaCO3+SiO2=CaSiO3+CO2
7.
АМФОТЕРНЫЕ ОКСИДЫ8.
Амфотерные оксиды1) с кислотами как основные
ZnO + 2HCl = ZnCl2 + H2O
2) с основаниями как кислотные
ZnO + 2NaOH = Na2ZnO + H2O
(цинкат натрия)
9.
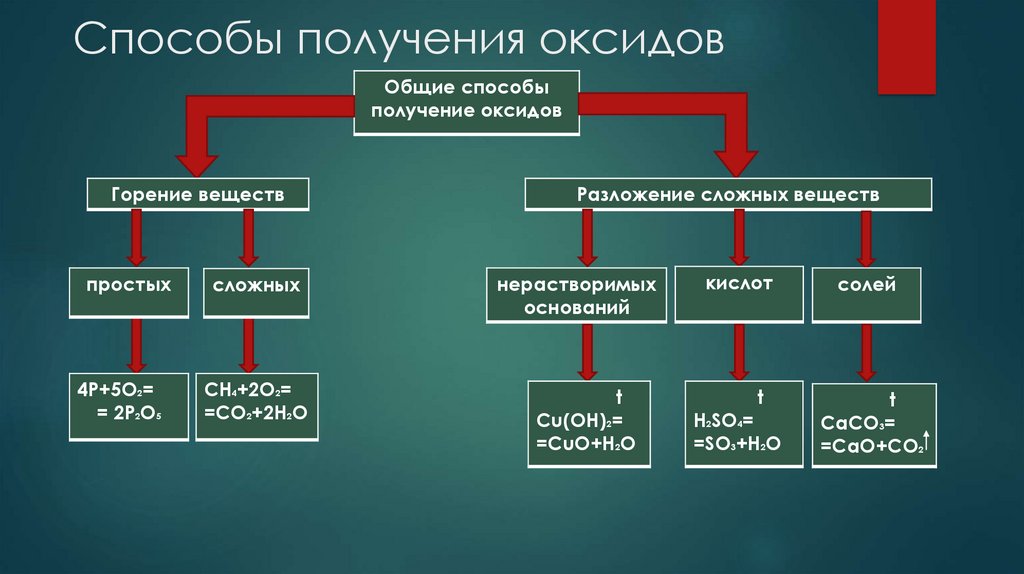
Способы получения оксидовОбщие способы
получение оксидов
Горение веществ
простых
4P+5O2=
= 2P2O5
сложных
CH4+2O2=
=CO2+2H2O
Разложение сложных веществ
нерастворимых
оснований
t
Сu(OH)2=
=CuO+H2O
кислот
t
H2SO4=
=SO3+H2O
солей
t
CaCO3=
=CaO+CO2
10.
Распределите на группы вещества, формулыкоторых представлены в схеме:
11.
Выполните задания1.Даны элементы: кремний, кальций, фосфор(V), углерод(IV), водород,
индий, литий, цинк, барий, сера(IV), медь(II), составьте формулы
основных оксидов.
2. Какие из оксидов будут взаимодействовать с водой, напишите
уравнения реакций, назовите образовавшиеся вещества.
3. С какими из предложенных веществ будут реагировать оксиды:
а) натрия
б) меди
1) HCl, CO2, SO3, H2O
3) KOH, CaCO3, H2O, Fe
2) HNO3, CO, CuO, RbCl
4) NaOH, H2SO4, H2, C
Напишите уравнения химических реакций и назовите образовавшиеся
вещества.
12.
Применение оксидовОксиды крайне распространены по всему земному шару и находят
применение как в быту, так и в промышленности. Самый важный оксид — оксид
водорода, вода — сделал возможной жизнь на Земле. Оксид серы
SO3 используют для получения серной кислоты, а также для обработки пищевых
продуктов — так увеличивают срок хранения, например, фруктов.
Оксиды железа используют для получения красок, производства электродов,
хотя больше всего оксидов железа восстанавливают до металлического железа
в металлургии.
Оксид кальция, также известный как негашеная известь, применяют в
строительстве. Оксиды цинка и титана имеют белый цвет и нерастворимы в воде,
потому стали хорошим материалом для производства красок — белил.
Оксид кремния SiO2 является основным компонентом стекла. Оксид хрома
Cr2O3 применяют для производства цветных зелёных стекол и керамики, а за счёт
высоких прочностных свойств — для полировки изделий (в виде пасты ГОИ).
Оксид углерода CO2, который выделяют при дыхании все живые организмы,
используется для пожаротушения, а также, в виде сухого льда, для охлаждения
чего-либо.









 Химия
Химия