Похожие презентации:
Кислоты. Формулы и названия основных неорганических кислот
1.
“УМ ЗАКЛЮЧАЕТСЯ НЕТОЛЬКО В ЗНАНИИ, НО И
В УМЕНИИ ПРИЛАГАТЬ
ЗНАНИЕ НА ДЕЛЕ”.
(АРИСТОТЕЛЬ).
2.
Тема урока:3.
ЦЕЛИ УРОКА:Дать определение кислотам.
Рассмотреть состав кислот.
Классифицировать кислоты.
Ознакомиться с формулами и
названиями основных неорганических
кислот.
Нахождение в природе и применение в
жизни человека.
4.
Вспомни…Какие соединения называют оксидами?
На какие группы можно разделить оксиды?
Из предложенных формул выберите оксиды.
СаО, HCL, CO2, H2SO4, SО3
K2O, H2CO3, N2O5, Fe2O3
Как получают оксиды?
5.
Прочитайте формулы кислот.H Cl, H2 SO4, H3PO4
Что общего во всех этих формулах?
Остальная часть молекулы называется кислотным остатком.
Заряд кислотного остатка определяется числом атомов водорода в кислоте
6.
Прочитайте формулы кислот.H Cl, H2 SO4, H3PO4
Что общего во всех этих формулах?
Атом водорода
Остальная часть молекулы называется кислотным остатком.
Заряд кислотного остатка определяется числом атомов водорода в кислоте
Кислоты HR
– это сложные вещества, состоящие из
атомов водорода и кислотных остатков.
7.
ФИЗИЧЕСКИЕ СВОЙСТВА КИСЛОТ:Агрегатное
состояние
Запах
Цвет
Серная
Соляная
жидкость
жидкость
нет
резкий
Угольная
Сернистая
нет,
неприятный
бесцветный бесцветный бесцветный
Для
человека
По
стабильности устойчивые устойчивые нестабильные
8.
9.
ДЕЙСТВИЕ КИСЛОТ НА ИНДИКАТОРЫИндикатор
Окраска
индикатора в
воде
Окраска
индикатора в
растворе соляной
кислоты HCl
Окраска
индикатора в
серной кислоте
H2SO4
фиолетовый
красная
красная
Фенолфталеин
бесцветная
бесцветная
бесцветная
Метилоранж
оранжевый
красная
красная
лакмус
Вывод: в
растворах кислот индикаторы изменяют свой цвет
одинаково ( определяют ионы водорода); а это означает, что все
кислоты обладают сходными свойствами.
10.
По какому признаку кислотыразделены на группы?
?
?
HF
HCl
HBr
HI
HNO3
H2S
H2SO4
H2SO3
H2CO3
H2SiO3
?
H3PO4
H3BO3
11.
По какому признаку кислотыразделены на группы?
Одно-
Двух-
Трех-
основные
основные
основные
HF
HCl
HBr
HI
HNO3
H2S
H2SO4
H2SO3
H2CO3
H2SiO3
H3PO4
H3BO3
12.
По какому признакукислоты разделены на группы?
HCl
HNO3
HF
H2SO4
HBr
H2CO3
H2S
H2SiO3
HI
H3PO4
13.
БескислородныеКислородсодержащие
HCl
HNO3
HF
H2SO4
HBr
H2CO3
H2S
H2SiO3
HI
H3PO4
14.
Правило разбавления концентрированнойсерной кислоты водой
15.
Используя таблицурастворимости разделите
кислоты:
HCl
HNO3
H2SO4
H2SiO3
16.
По растворимости .Растворимые
Нерастворимые
HCl
H2SiO3
HNO3
H2SO4
17.
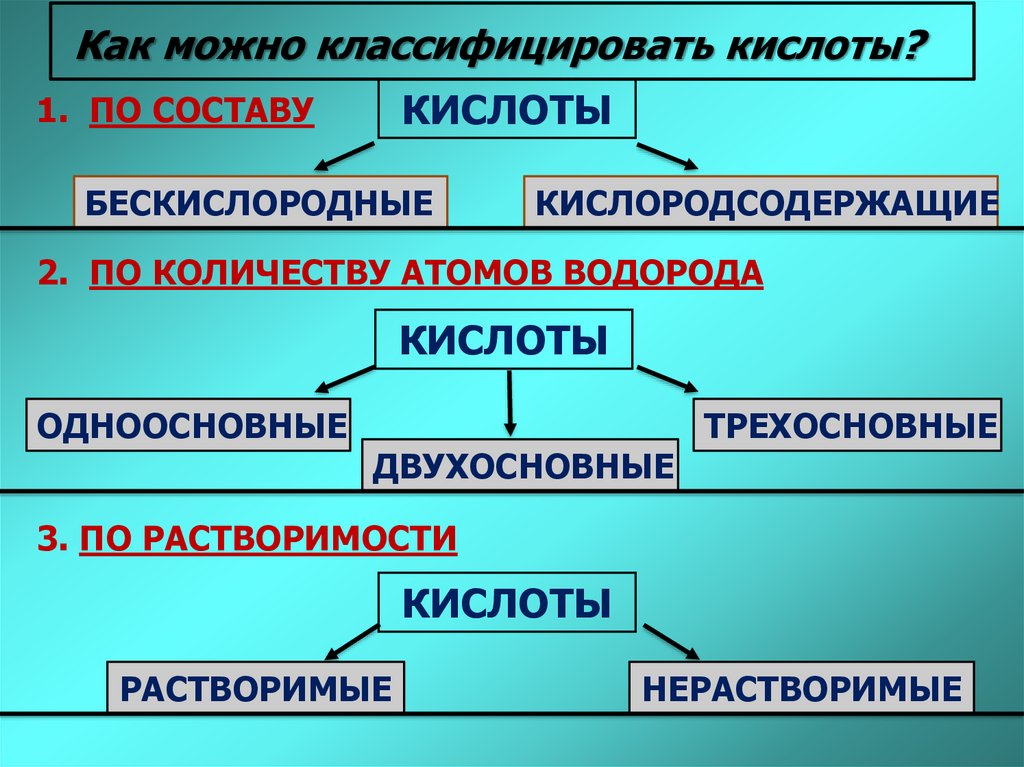
Как можно классифицировать кислоты?КИСЛОТЫ
1. ПО СОСТАВУ
БЕСКИСЛОРОДНЫЕ
КИСЛОРОДСОДЕРЖАЩИЕ
2. ПО КОЛИЧЕСТВУ АТОМОВ ВОДОРОДА
КИСЛОТЫ
ОДНООСНОВНЫЕ
ДВУХОСНОВНЫЕ
ТРЕХОСНОВНЫЕ
3. ПО РАСТВОРИМОСТИ
КИСЛОТЫ
РАСТВОРИМЫЕ
НЕРАСТВОРИМЫЕ
18.
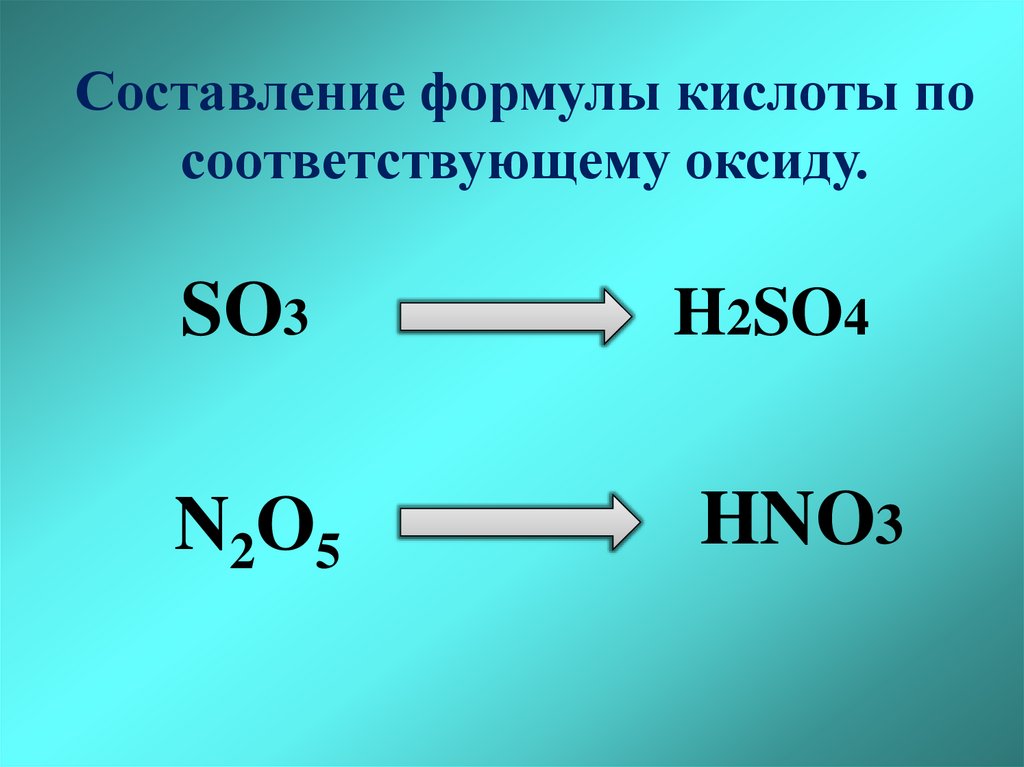
Составление формулы кислоты посоответствующему оксиду.
SO3
N2O5
H2SO4
HNO3
19.
ФизкультминуткаОчень химию мы любим!
Шеей влево, вправо крутим.
Воздух – это атмосфера.
Если правда - хлопай смело!
В атмосфере есть азот,
Делай вправо поворот!
Так же есть и кислород,
Делай влево поворот.
Воздух обладает массой.
Мы потопаем по классу!
Друг на друга мы посмотрим
И урок наш мы продолжим.
20.
ВПРВ таблице приведены названия и химические
формулы некоторых кислот.
№
п/п
Название
кислоты
Формула
1
Соляная кислота
HCL
2
Серная кислота
H2SO4
3
Азотная кислота
HNO3
Молярная масса,
г/моль
Используя предложенные вам справочные материалы,
вычислите молярные массы каждой из кислот и запишите
полученные данные в таблицу.
21.
В ПРИРОДЕ ВСТРЕЧАЕТСЯ МНОГО КИСЛОТ:молочная
яблочная
муравьиная
лимонная
щавелевая
22.
В природе кислоты находятся в:• растениях;
• организмах
животных;
• организме
человека.
23.
Молочная кислотаобразуется в мышцах при
физической нагрузке.
Соляная кислота, находящаяся
в желудке, помогает
переваривать пищу.
24.
Кислоты применяютсяв медицине.
Аскорбиновая,
фолиевая,
липоевая,
Ацетилсалициловая
и другие
25.
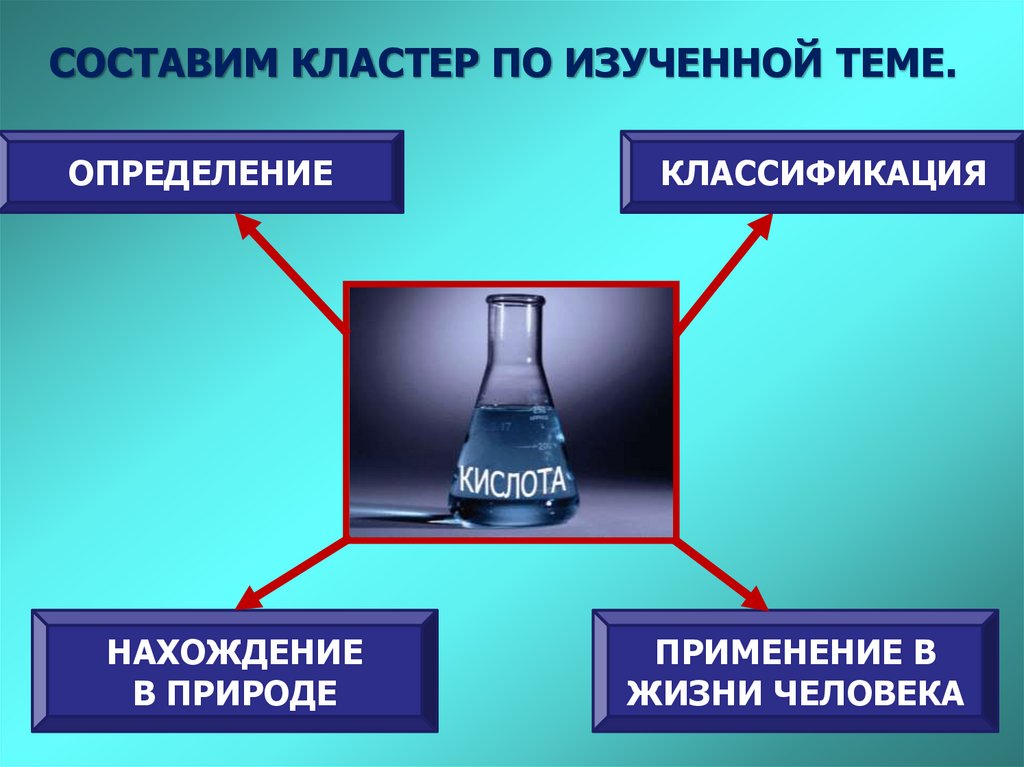
СОСТАВИМ КЛАСТЕР ПО ИЗУЧЕННОЙ ТЕМЕ.ОПРЕДЕЛЕНИЕ
НАХОЖДЕНИЕ
В ПРИРОДЕ
КЛАССИФИКАЦИЯ
ПРИМЕНЕНИЕ В
ЖИЗНИ ЧЕЛОВЕКА






















 Химия
Химия








