Похожие презентации:
Кислоты. Формулы и названия кислот и кислотных остатков
1. КИСЛОТЫ
Составила:учитель химии МБОУ СОШ № 24
Цуканова Е.В.
2.
Кислоты – сложные вещества,состоящие из ионов водорода и
кислотных остатков
+
х-
Нх А
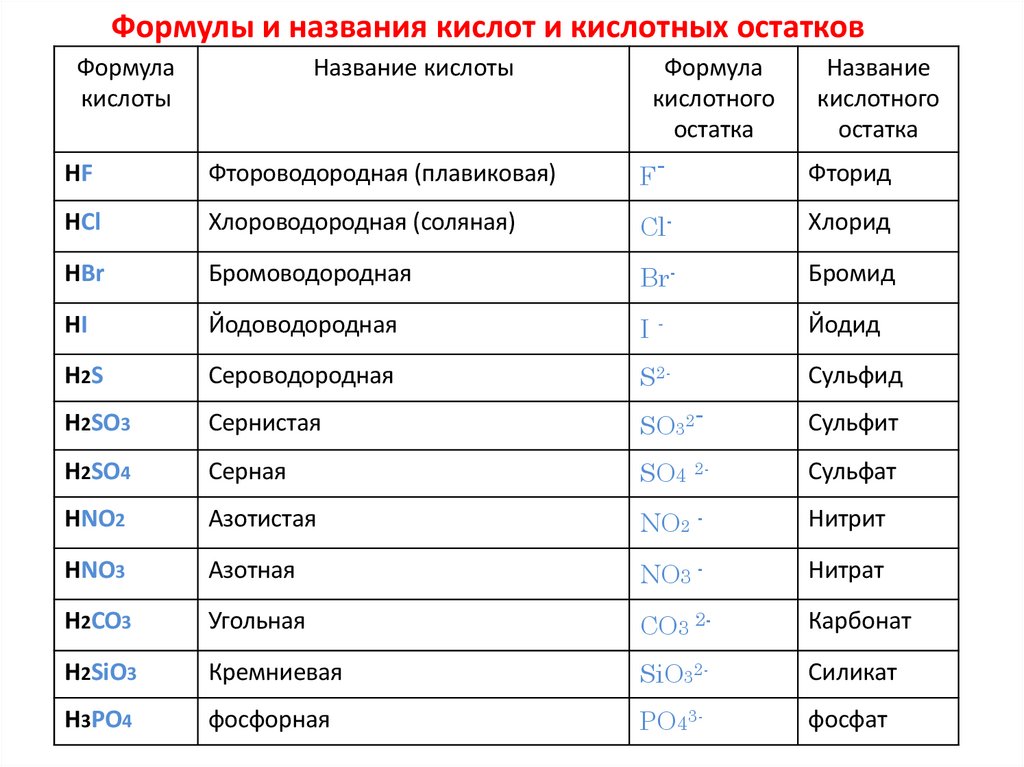
3. Формулы и названия кислот и кислотных остатков
Формулакислоты
Название кислоты
HF
Фтороводородная (плавиковая)
Формула
кислотного
остатка
F-
Название
кислотного
остатка
HCl
Хлороводородная (соляная)
Cl-
Хлорид
HBr
Бромоводородная
Br-
Бромид
HI
Йодоводородная
I-
Йодид
H2S
Сероводородная
S2-
Сульфид
H2SO3
Сернистая
SO32-
Сульфит
H2SO4
Серная
SO4 2-
Сульфат
HNO2
Азотистая
NO2 -
Нитрит
HNO3
Азотная
NO3 -
Нитрат
H2CO3
Угольная
CO3 2-
Карбонат
H2SiO3
Кремниевая
SiO32-
Силикат
H3PO4
фосфорная
PO43-
фосфат
Фторид
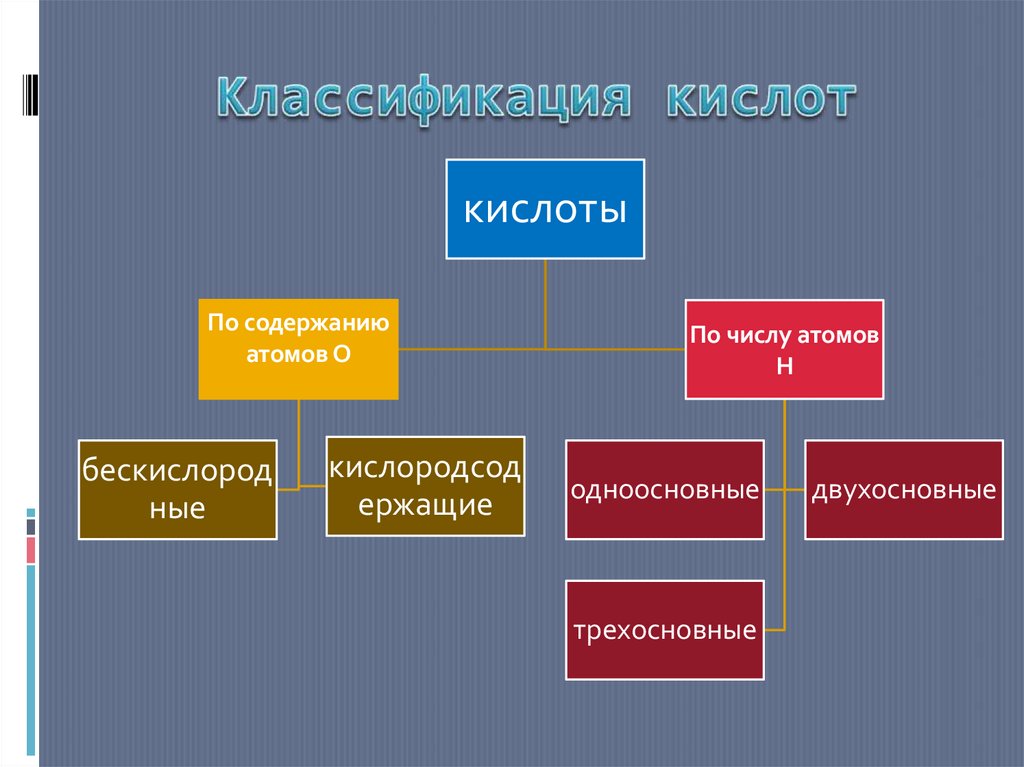
4. Классификация кислот
кислотыПо содержанию
атомов О
бескислород
ные
кислородсод
ержащие
По числу атомов
Н
одноосновные
трехосновные
двухосновные
5. Физические свойства
ФИЗИЧЕСКИЕ СВОЙСТВАСъедобные кислоты (яблочная,
лимонная, аскорбиновая) белые кристаллические
вещества, кислые на вкус
6. Физические свойства
ФИЗИЧЕСКИЕ СВОЙСТВАБольшинство кислот несъедобно, пробовать на
вкус их нельзя!
Многие неорганические кислоты бесцветные
жидкости без запаха, хорошо растворимые в
воде
Правила растворения кислот:
Сначала вода,
Потом – кислота!
Иначе случиться большая беда!!!
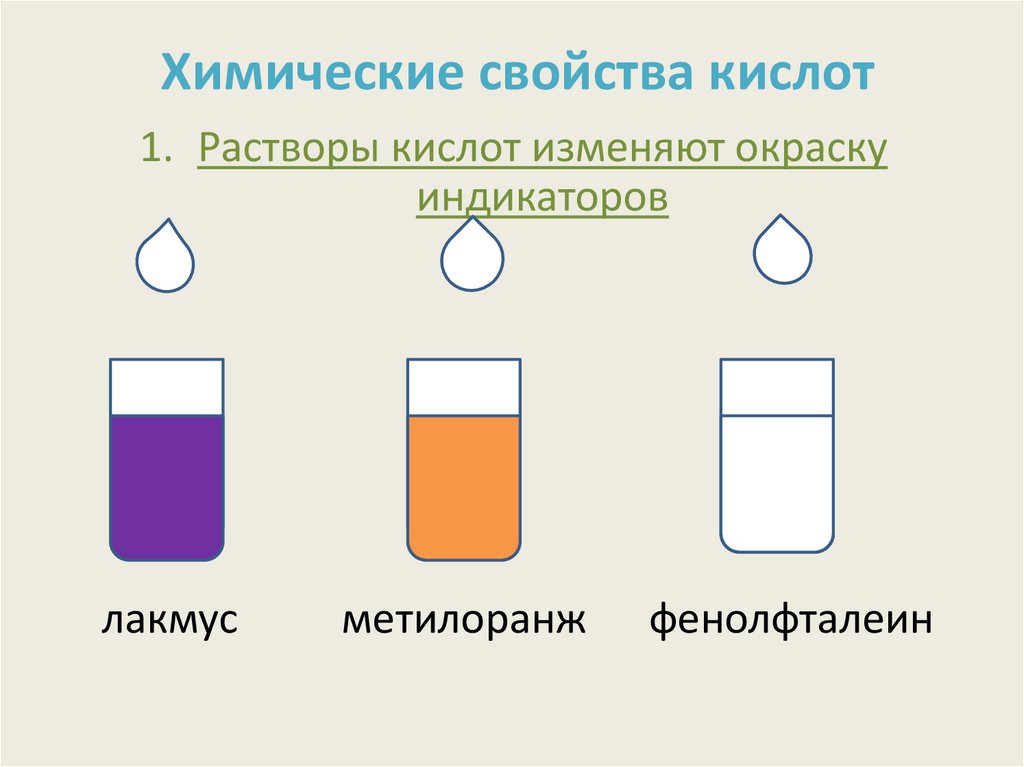
7. Химические свойства кислот
1. Растворы кислот изменяют окраскуиндикаторов
лакмус
метилоранж
фенолфталеин
8.
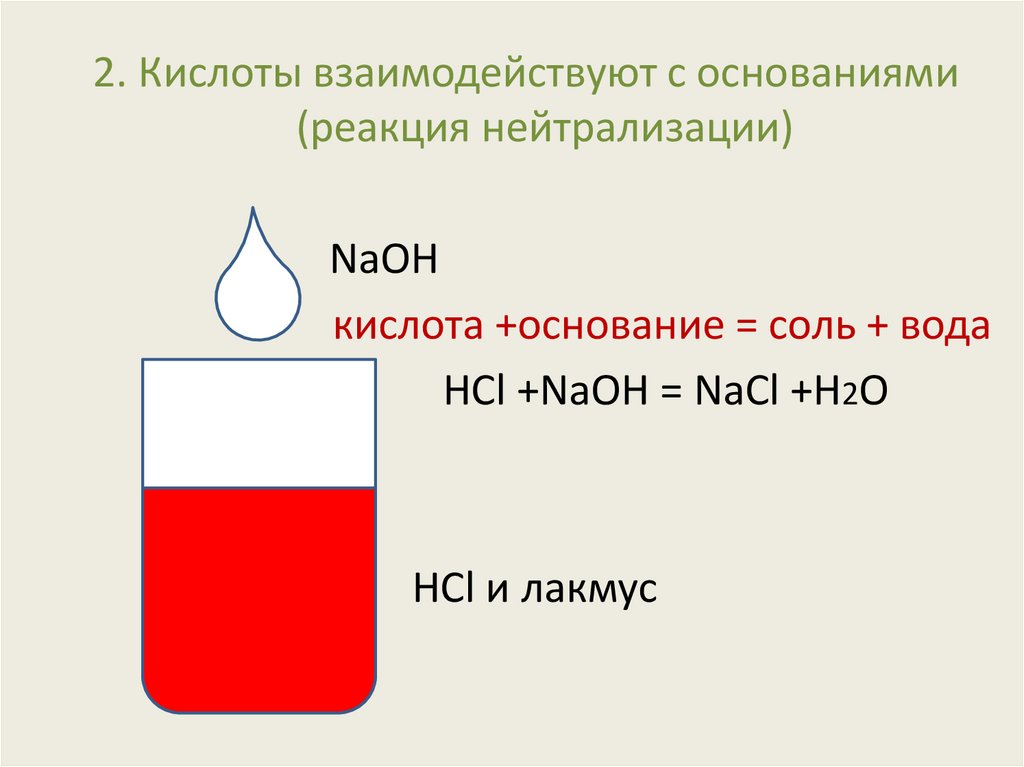
2. Кислоты взаимодействуют с основаниями(реакция нейтрализации)
NaOH
кислота +основание = соль + вода
HCl +NaOH = NaCl +H2O
HCl и лакмус
9.
Сu(OH)2 + 2HCl = CuCl2 + 2H2O10.
3. Кислоты взаимодействуют с основнымиоксидами (если образуется растворимая
соль):
2HCl + CuO = CuCl2 + H2O
11.
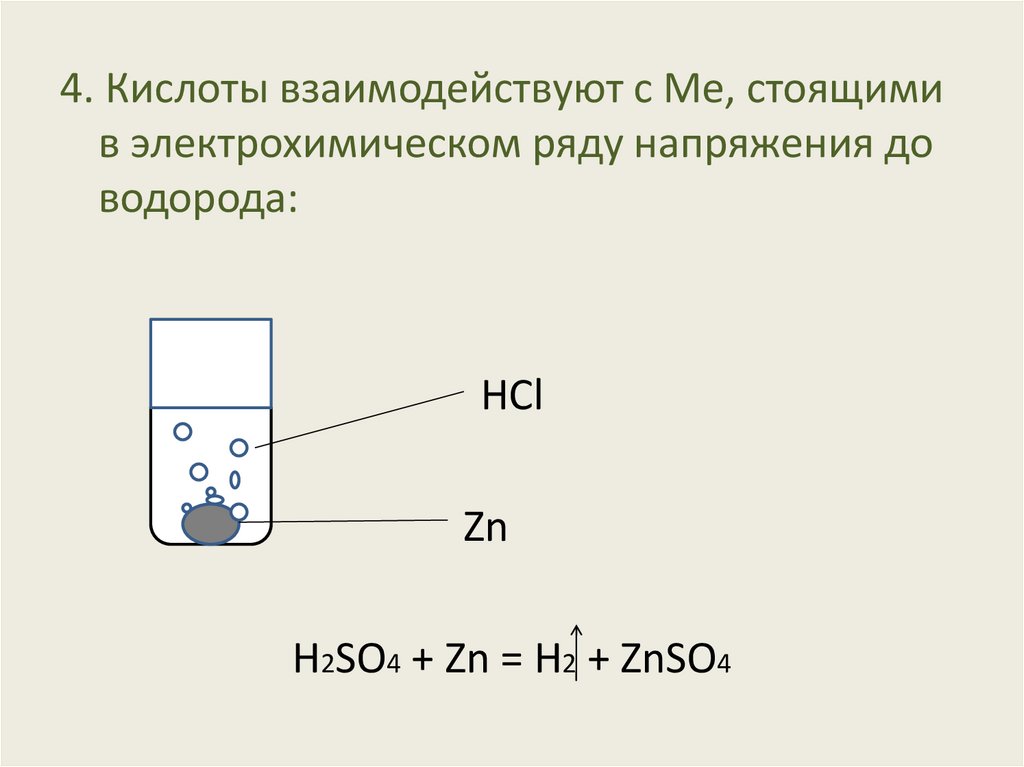
4. Кислоты взаимодействуют с Ме, стоящимив электрохимическом ряду напряжения до
водорода:
HCl
Zn
Н2SO4 + Zn = H2 + ZnSO4
12.
5. Кислоты реагируют с солями других болееслабых кислот
(сила кислот убывает в ряду:
HNO3
H2SO4 – HCl - H2SO3 - H2CO3 - H2S - H2SiO3)
H3PO4
13.
6) При нагревании некоторые кислотыразлагаются на оксид и воду:
t
H2SiO3 = SiO2 + H2O








 Химия
Химия








