Похожие презентации:
Обеспечение инфекционной безопасности в медицинских организациях
1. ГАПОУ «Казанский медицинский колледж» РТ Отдел дополнительного профессионального образования
Обеспечение инфекционнойбезопасности в медицинских
организациях
СОСТАВИТЕЛИ: Ахметшина Н.М., Бурнашева Э.А., преподаватели
эпидемиологии отдела дополнительного профессионального
образования ГАПОУ «Казанский медицинский колледж»
2. Нормативно-директивные документы
• Санитарные правила СП 2.1.3678-20 «Санитарноэпидемиологические требования к эксплуатациипомещений, зданий, сооружений, оборудования и
транспорта, а также условиям деятельности
хозяйствующих субъектов, осуществляющих продажу
товаров, выполнение работ или оказание услуг».
• Санитарные правила и нормы СанПиН 3.3686-21
«Санитарно-эпидемиологические требования по
профилактике инфекционных болезней».
3. ИСМП – инфекции, связанные с оказанием медицинской помощи
Это инфекции:присоединяющиеся к основному заболеванию у
пациентов;
связанные с оказанием любых видов медицинской
помощи.
Это случаи инфицирования медицинских работников в
результате их профессиональной деятельности.
ИСМП могу возникнуть как в период пребывания в
стационаре, так и после выписки из него с учетом
максимального ИП.
4.
Актуальность проблемы ИСМП1. Высокий уровень заболеваемости:
ежегодно в РФ регистрируется 30-35 тыс.случаев
ИСМП;
поражают 5-10% пациентов, находящихся в
стационаре.
2. Высокий уровень летальности от ИСМП:
занимают 10 место в смертности населения.
3. Значительный социально-экономический ущерб,
наносимый ими:
пациенты с ИСМП находятся в стационаре в 2-3 раза
дольше;
в 3-4 раза возрастает стоимость лечения.
5. К причинам, способствующим росту заболеваемости ИСМП, относятся:
1. Неудовлетворительные архитектурно-планировочныерешения:
несоответствие состава и площади помещений;
перекрест технологических потоков;
отсутствие механической приточно-вытяжной вентиляции.
6. К причинам, способствующим росту заболеваемости ИСМП, относятся:
2. Нарушения в организации работы МО:превышение норм коечной емкости палат;
отсутствие разделения по нозологическим формам;
совместное размещение детей и взрослых пациентов;
аварийные ситуации на водопроводной и канализационной
системах,
перебои и отсутствие в подаче горячей и холодной воды,
нарушения в тепло- и энергоснабжении;
нарушения в работе приточно-вытяжной вентиляции.
7. К причинам, способствующим росту заболеваемости ИСМП, относятся:
3. Недостаточное материально-техническое оснащение:недостаток медицинских изделий, в том числе одноразовых
(катетеры, санационные системы, дыхательные трубки и
другие);
нехватка оборудования, перевязочного материала, лекарств;
перебои в поставке белья, моющих и дезинфицирующих
средств.
8. К причинам, способствующим росту заболеваемости ИСМП, относятся:
4. Нарушения противоэпидемического режима:несоблюдение цикличности заполнения палат;
несвоевременный перевод новорожденных и родильниц в
соответствующие стационары;
повторное использование одноразовых медицинских изделий,
неиндивидуальное использование средств ухода за больными,
емкостей для питья, кормления, обработки кожных покровов и
глаз;
нарушение правил текущей и заключительной дезинфекции,
стерилизации и другие.
9. Основными формами ИСМП являются:
Гнойно-септические инфекции новорожденных (ГСИноворожденных).
Гнойно-септические инфекции родильниц (ГСИ родильниц).
Инфекции в области хирургического вмешательства (ИОХВ).
Инфекции кровотока (ИК): инфекции, связанные с инфузией,
трансфузией и лечебной инъекцией, иммунизацией.
Инфекции мочевыводящих путей (ИМВП).
Инфеции нижних дыхательных путей (ИНДП).
Острые кишечные инфекции (ОКИ), в том числе острые гепатиты A и
E. Другие сальмонеллезные инфекции.
Воздушно-капельные инфекции (ВКИ).
Парентеральные инфекции: ВИЧ, гепатиты B и C.
10. Факторы, способствующие возникновению ИСМП
возраст (детский/пожилой);питание;
состояние иммунной системы;
наличие хронических заболеваний;
наличие ран и свежих послеоперационных швов;
часто проводимые инвазивные процедуры.
11. Источники ИСМП
пациенты,медицинские работники,
ухаживающие за больными,
посетители.
Наиболее значимыми источниками инфекции являются
больные манифестными формами,
носители антибиотикорезистентных штаммов
микроорганизмов,
медицинский персонал с патологией верхних и
нижних дыхательных путей, мочевыводящего и
желудочно-кишечного трактов, кожи и подкожной
клетчатки.
12. Механизмы передачи ИСМП:
1. Естественный (фекально-оральный, аэрогенный,контактный, вертикальный).
2. Искусственный (артифициальный):
ассоциированный с инвазивными и неинвазивными
лечебно-диагностическими процедурами и
манипуляциями, в том числе трансплантация
органов, тканей.
13. Факторами передачи являются:
руки медперсонала,белье,
медицинское оборудование (аппараты ИВЛ,
гемодиализа, эндоскопы и другие),
инструменты,
средства ухода за больными,
инъекционные растворы (в первую очередь в
многодозовых флаконах),
повторно используемые одноразовые медицинские
изделия, воздух и другие.
14.
Дезинфекция вмедицинских
организациях
15. Виды дезинфекции
1. Профилактическая.2. Очаговая.
16. Виды дезинфекции
1. Профилактическая –проводится с целью предупреждения
возникновения и распространения ИСМП,
независимо от наличия инфекции.
Формы проведения:
плановая,
по эпидемиологическим показаниям,
по санитарно-гигиеническим показаниям.
17.
1. Плановая –когда источник инфекции не выявлен и возбудитель не
выделен: Это обработка:
всех видов поверхностей;
изделий медицинского назначения;
рук медицинского персонала;
инъекционного поля;
медицинских отходов классов Б и В.
18.
2. По эпидемиологическим показаниям –проводится с целью не допустить распространения
возбудителей инфекций в отделениях из соседних
отделений и т.д.
19.
3. По санитарно-гигиеническим показаниям –проводится как разовое мероприятие в помещениях,
находящихся в неудовлетворительном санитарном
состоянии, по методике проведения генеральных
уборок.
20.
2. Очаговая –проводится при обнаружении источника
инфекции.
Формы проведения:
текущая,
заключительная.
21.
1. Текущая –проводится в присутствии источника инфекции.
2. Заключительная –
проводится после выписки, изоляции или после
смерти.
22. Требования к современным дезсредствам
Для текущей дезинфекции не допускается применение дезсредствI-III класса опасности при ингаляционном пути поступления в
концентрациях, превышающих гигиенические нормативы.
В присутствии пациентов и персонала не допускается:
применять способ орошения поверхностей дезрастворами;
при способе протирания использовать дезсредства,
обладающие раздражающим действием, вызывающие
аллергические реакции.
23. Требования к работе с дезинфицирующими средствами (ДС)
1. Применение ДС должно проводится согласноинструкции.
2. Должен быть расчет потребности в дезсредствах,
учет получения и расхода препаратов.
3. Должен проводится экспресс-контроль за
содержанием действующих веществ в рабочих
растворах.
24. Требования к работе с дезинфицирующими средствами (ДС)
4. Рабочие растворы ДС для обработки объектовхранятся в отдельных емкостях.
5. Емкости с рабочими растворами ДС должны иметь
плотно закрывающуюся крышку, а также четкую
надпись или этикетку с указанием:
названия раствора,
его концентрации,
даты приготовления,
срока годности,
назначения.
25.
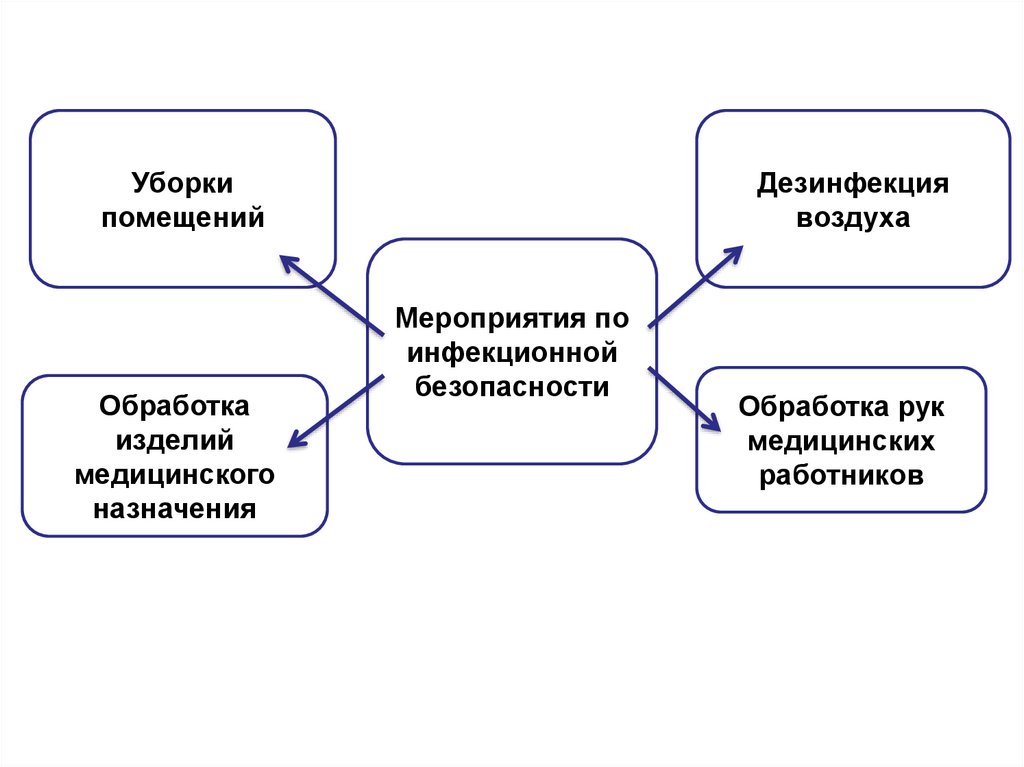
Уборкипомещений
Обработка
изделий
медицинского
назначения
Дезинфекция
воздуха
Мероприятия по
инфекционной
безопасности
Обработка рук
медицинских
работников
26.
Обработка изделиймедицинского
назначения (ИМН)
27. Уровни дезинфекции
I.Дезинфекция низкого уровня (ДНУ)
II. Дезинфекция промежуточного уровня (ДПУ)
III. Дезинфекция высокого уровня (ДВУ)
28. Уровни дезинфекции
ДНУ – уничтожаются большинство вегетативныхмикробов, некоторые вирусы, грибы, но не
уничтожаются микобактерии туберкулеза и споры.
ДПУ – уничтожаются все вегетативные микробы,
вирусы, грибы, микобактерии туберклуеза, споры не
уничтожаются.
ДВУ – уничтожаются все вегетативные микробы,
вирусы, грибы, микобактерии туберкулеза, часть
спор.
29. Медицинские изделия по степени опасности
Критические (высокая степень опасности) проникающие через кожные покровы в ткани,полости организма и сосудистую систему.
Полукритические (средняя) контактирующие со слизистыми оболочками
(бронхоскопы, фиброгастроскопы,
колоноскопы).
Некритические (низкая) – соприкасающиеся с
неповрежденными кожными покровами
(термометры, грелки).
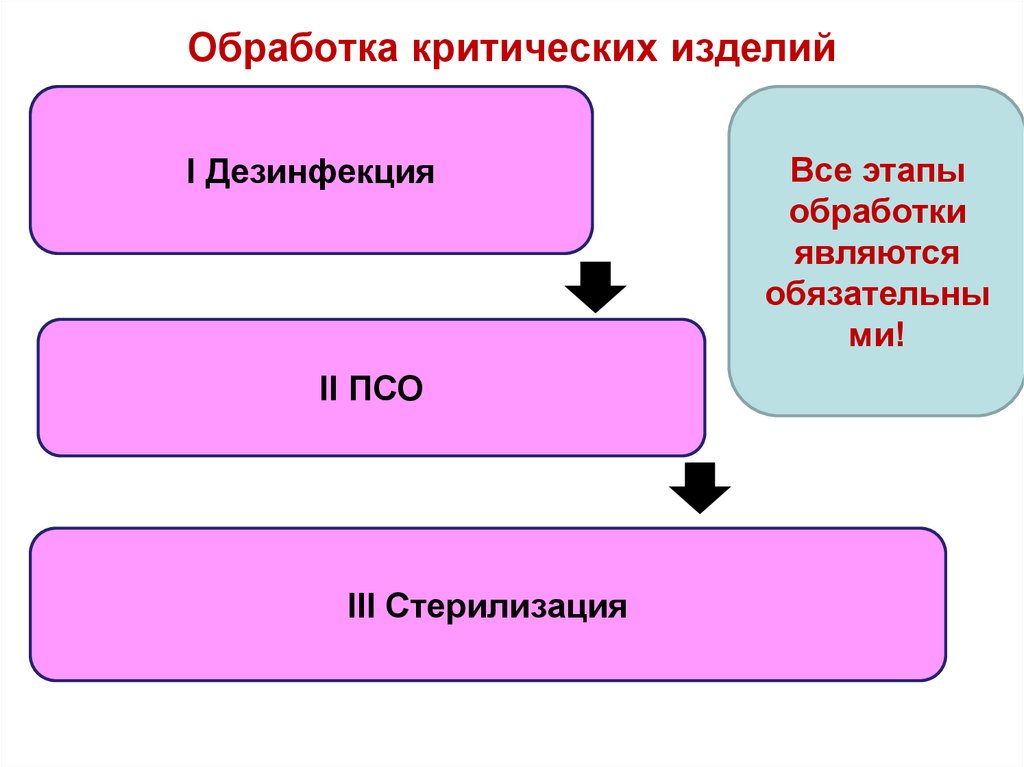
30. Обработка критических изделий
I ДезинфекцияII ПСО
III Стерилизация
Все этапы
обработки
являются
обязательны
ми!
31. Обработка полукритических изделий
Дезинфекция способом погруженияПредстерилизационная очистка
Стерилизация или
Дезинфекция высокого уровня
32. Обработка некритических изделий способом погружения
Дезинфекция способом полного погружения вдезраствор
Промывание под проточной водой, просушивание
Хранение в условиях, исключающих вторичную
контаминацию
33. Обработка некритических изделий способом протирания
Проводится двукратно с интервалом по инструкции.34.
Методы дезинфекции ИМНФизические
Химический
35. Физические методы
Кипячение:Режимы: в
дист. воде –
-30 мин;
-2% содовом
растворе –
-15 мин.
Паровой:
Режим
0.5 атм.
+110°С - 20
минут.
Воздушный:
Режим
+120°С - 45 минут.
36. Химический метод дезинфекции
Проводится с помощьюдезсредств.
в емкости высота
дезраствора над
инструментами –
не менее 1 см.
37. Средства для дезинфекции ИМН
Для дезинфекции применяют дезсредства с широкимспектром антимикробного действия (вирулицидное,
бактерицидное, фунгицидное).
В туберкулезных медорганизациях выбирают
дезсредства и режимы с туберкулоцидной
активностью,
в микологических – с активностью в отношении
дерматофитов.
38. Средства для дезинфекции ИМН (продолжение)
Многократное использование дезрастворовдопускается в течение 1 рабочей смены, если их
внешний вид не изменился вне зависимости от
наличия рекомендаций по срокам использования,
указанных в инструкциях по применению!
39. Контроль качества дезинфекции ИМН
1. Экспресс-контроль концентрации растворовдезсредств с помощью тест-полосок «Дезиконт».
2. Санитарно-бактериологические исследования
(смывы).
40. Предстерилизационная очистка
Это удаление белковых, жировых,механических загрязнений и
лекарственных препаратов с
поверхности мединструментов.
Способы проведения
предстерилизационной очистки:
механический - проводится с
применением моечных машин;
ручной – проводится с помощью
ершей, ватно-марлевых тампонов.
Может быть совмещена с дезинфекцией
в одном этапе.
41. Этапы проведения предстерилизационной очистки:
замачивание;ершевание;
промывание под проточной
водой;
ополаскивание
дистиллированной водой;
сушка.
42. Средства для ПСО
Для ПСО – используются препараты, обладающиевыраженным моющим эффектом.
При ручном способе очистки раствор можно
использовать многократно в течение 1 рабочей
смены.
При механизированном способе очистки в моющедезинфицирующих машинах раствор используется
однократно.
43. Контроль качества проведения предстерилизационной очистки
Контроль качества предстерилизационной очисткипроводят с помощью постановки проб –
ежедневно.
Старшей медсестрой проводится
1 раз в неделю.
Контролю подлежат
1% одновременно обработанных изделий каждого
наименования, но не менее
трех единиц.
Результаты контроля регистрируют в журнале.
44. Пробы на остатки крови на инструментах
1. Азопирамоваярезультат считается положительным, если появилось
фиолетово-сиреневое окрашивание в течение
1 минуты.
2. Амидопириновая
результат считается положительным, если появилось
сине-зеленое окрашивание в течение
1 минуты.
45.
Азопирамовая пробаСмешиваются равные количества азопирама и 3% перекиси водорода.
Рабочий раствор используют в течении 1-2 часов.
Результат положительный при появлении фиолетово-розового
окрашивания в течении 1 минуты.
Раствор азопирама хранится в плотно закрытом флаконе, в темном месте,
в холодильнике – 2 месяца, при комнатной температуре не более
месяца.
Азопирамовая проба в 10 раз чувствительнее амидопириновой.
Амидопириновая проба
Смешиваются равные количества 5% спиртового раствора амидопирина,
30% уксусной кислоты и 3% перекиси водорода.
Результат положительный при появлении сине-зеленое окрашивания в
течении 1 минуты.
Спиртовой раствор амидопирина хранится в плотно закрытом флаконе в
течении 1 месяца.
46.
На остатки моющего средства ставитсяфенолфталеиновая проба.
Результат считается положительным, если появилось
розовое окрашивание в течение
1 минуты.
На остатки жира ставится
судановая проба.
Результат считается положительным, если появилось
желтое окрашивание в течение
10 секунд.
47.
Ложно-положительными пробы считаются, еслиинструмент
горячий;
коррозийный;
имеются остатки хлорсодержащих средств.
48. Стерилизация
Это уничтожение патогенных и условно-патогенныхмикроорганизмов, в том числе их споровых
форм.
------------------------------------------------------------------------------Стерилизации подлежат все изделия:
соприкасающиеся с раневой поверхностью,
контактирующие с кровью в организме пациента или
вводимой в него,
инъекционными препаратами,
контактирующие со слизистой оболочкой и могут
вызвать ее повреждение.
49. Воздушный метод стерилизации
Примечание:Использование
шкафов типа ШСС
для
стерилизации
запрещается.
Режимы:
180° - 60 минут - для изделий из
коррозийнонестойкого металла, толстого
стекла;
160° - 150 минут - для изделий из тонкого
стекла, силиконовой резины, полимеров.
Упаковки и сроки:
без упаковки в открытых лотках
– 6 час;
в бумажной упаковке
– по инструкции к бумаге.
50. Паровой метод стерилизации
Режимы:2 атм. 132° - 20 минут - для изделий из
коррозийностойкого металла, текстиля, стекла;
1,1 атм. 120° - 45 минут - для изделий из резины,
полимеров.
Упаковки и сроки:
биксы с бактериальными фильтрами
– 20 суток;
биксы без бактериальных фильтров
– запрещены;
в бязевой упаковке
– 3 суток;
в бумажной упаковке
– по инструкции к бумаге.
51. Контроль качества стерилизации Методы:
1. Бактериологический.2. Физический.
3. Химический.
4. Санитарно-бактериологический (берутся смывы с
поверхности ИМН на стерильность).
52. Бактериологический метод контроля
Предназначен для контроляэффективности
стерилизационного оборудования.
Проводится с помощью биотестов,
имеющие дозированное количество
спор.
Контроль рекомендуется проводить:
a) после установки или ремонта;
b) в ходе эксплуатации не менее 2х раз
в год.
53. Физический метод контроля
Проводится с помощью средствизмерения:
температуры – термометры,
термопары;
давления – манометры;
времени – таймеры.
54. Химический метод
Проводится с помощью химических индикаторов.По принципу размещения индикаторов на стерилизуемых
объектах различают два типа химических индикаторов:
- наружные (ленты, наклейки) крепятся липким слоем
на поверхности упаковок (бумага, металл, стекло и др.)
и удаляются в последствии.
- внутренние (индикаторные полоски, содержащие
на своей поверхности индикаторную краску)
размещаются внутри упаковки со стерилизуемыми
материалами вне зависимости от ее вида (бумажный
или пластиковый пакет, металлический контейнер и
др.).
55. Химический метод
Проводится с помощью тестов-индикаторов.Используются 6 классов индикаторов.
------------------------------------------------------------------
Индикаторы 1-го класса (СВИДЕТЕЛИ) индикаторы процесса стерилизации.
Размещаются:
на наружной поверхности упаковки с
медицинскими изделиями;
внутри наборов инструментов и операционного
белья.
Изменение цвета индикатора указывает на то, что
упаковка подверглась процессу стерилизации.
56. Химический метод
Индикаторы 2-го класса «БОВЕ-ДИКА»- индикаторы одной переменной.
Предназначены для оценки:
эффективности работы вакуумного
насоса;
наличия воздуха в камере парового
стерилизатора.
57. Химический метод
Индикаторы 3-го класса«БЕНЗОЙНАЯ КИСЛОТА»,
«ТИОМОЧЕВИНА» мультипараметрические
индикаторы.
Определяют только
температуру в воздушных
стерилизаторах.
58. Химический метод
Индикаторы 4-го класса«МЕДИС»,«ИНТЕСТ», «СТЕРИКОНТ»,
«СТЕРИТЕСТ» - интеграторы –
многопараметровые индикаторы.
Определяют температуру и время в
паровых и воздушных
стерилизаторах.
59. Химический метод
Индикаторы 5, 6-го классовОпределяют все критические параметры в
паровых стерилизаторах.
К примеру, при температуре 132С цвет
метки полностью изменится в течение 20
минут при условии воздействия на
интегратор насыщенного водяного пара.
60. Бракераж стерилизации
Перед извлечением простерилизованных материалов иинструментов (до вскрытия биксов, упаковок) необходимо:
• визуально оценить плотность закрытия крышки бикса или
целостность упаковки;
• проверить цвет индикаторных меток химических индикаторов, в
т.ч. на стерилизационных упаковочных материалах;
• проверить дату стерилизации;
• на бирке бикса, упаковочном пакете поставить дату, время
вскрытия и подпись вскрывавшего.
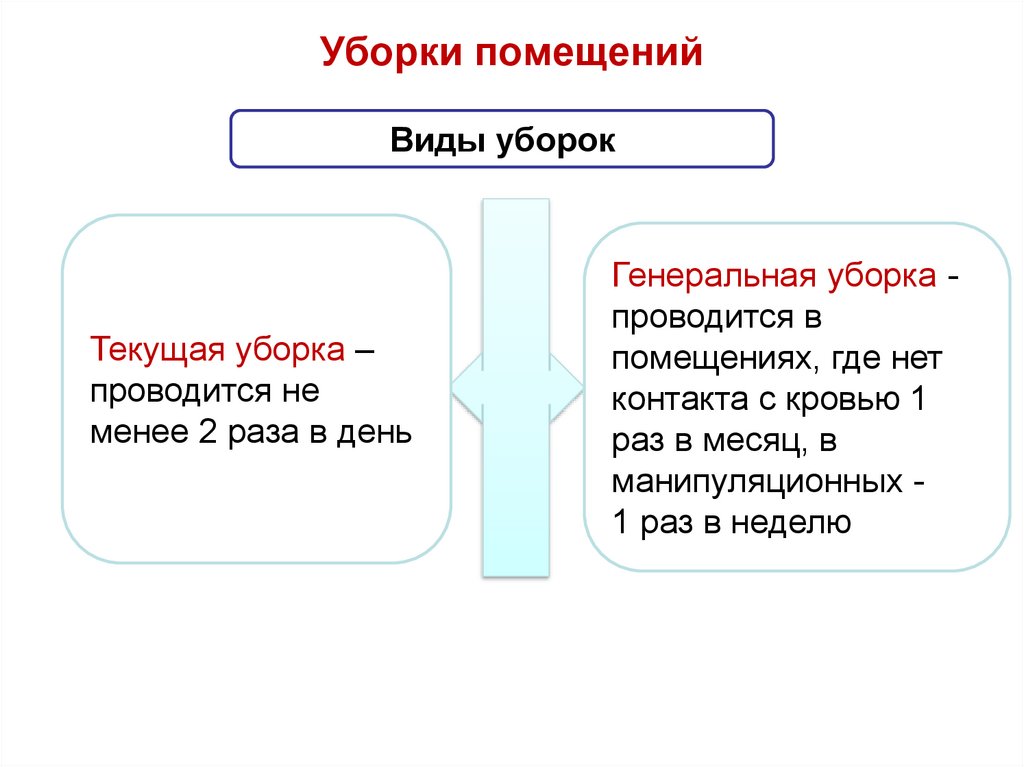
61. Уборки помещений
Виды уборокТекущая уборка –
проводится не
менее 2 раза в день
Генеральная уборка проводится в
помещениях, где нет
контакта с кровью 1
раз в месяц, в
манипуляционных 1 раз в неделю
62.
Уборочный инвентарь (тележки, МОПы (материалы,обрабатывающие поверхности), емкость, ветошь, швабры)
должен:
иметь четкую маркировку или цветовое кодирование с
учетом функционального назначения помещений и видов
уборочных работ.
63.
График проведения генеральной уборкисоставляется ежемесячно и
утверждается руководителем.
Вне графика генеральную уборку
проводят в случае получения
неудовлетворительных
результатов микробной
обсемененности внешней среды и
по эпидемическим показаниям.
64.
Уборочные работы могут выполняться каксобственными силами МО, так и с привлечением профессиональных клининговых
компаний.
Однако следует помнить, что в помещениях
класса А, а также в отделениях,
осуществляющих лечение и диагностику
COVID-19, может работать только персонал,
находящийся в штате МО.
65. Дезинфекция воздуха
Все помещения МО делятся на 4 класса чистоты.Класс чистоты –
это допустимый уровень бактериальной обсемененности
в воздухе помещений различного функционального
назначения.
66. Класс чистоты А – особочистые помещения
Операционные залы, послеоперационные палаты,реанимационные залы (палаты), палаты интенсивной
терапии, родовые залы, манипуляционные-туалетные
для новорожденных.
Бактериальная обсемененность (БО) в 1 куб.м.
воздуха должна быть:
до начала работы
не более 200;
во время работы
не более 500.
Золотистый стафилококк в воздухе
не должен быть.
67. Класс чистоты Б – чистые помещения
палаты родильниц, новорожденных (второй этапвыхаживания);
малые операционные;
рентгеноперационные, в том числе ангиографические;
стерилизационные при операционных;
чистая и стерильная зоны ЦСО.
БО в 1 куб.м. воздуха должна быть:
до начала работы
не более 500;
во время работы
не более 750.
Золотистый стафилококк в воздухе
не должен быть.
68. Класс чистоты Б – чистые помещения (продолжение)
процедурные и асептические перевязочные,процедурные бронхоскопии
БО в 1 куб.м. воздуха должна быть:
до начала работы
не более 300;
во время работы –
не нормируется.
Золотистый стафилококк в воздухе
не должен быть.
69. Класс чистоты В – условно чистые помещения
палаты, боксы,кабинеты врачей,
кабинеты функциональной диагностики, ЛФК,
массажа,
процедурные эндоскопии (кроме бронхоскопии),
процедурные магнитно-резонансной томографии и
т.д.
БО в 1 куб.м. воздуха:
до начала работы –
не нормируется;
во время работы –
не нормируется.
70. Класс чистоты Г
ЦСО - грязная зона (приема, разборки, мытья и сушкимедицинских инструментов и изделий медицинского
назначения),
физиотерапевтические кабинеты,
рентгенкабинеты,
флюорографические кабинеты,
санузлы, коридоры и т.д.
БО в 1 куб.м. воздуха должна:
до начала работы –
не нормируется;
во время работы –
не нормируется.
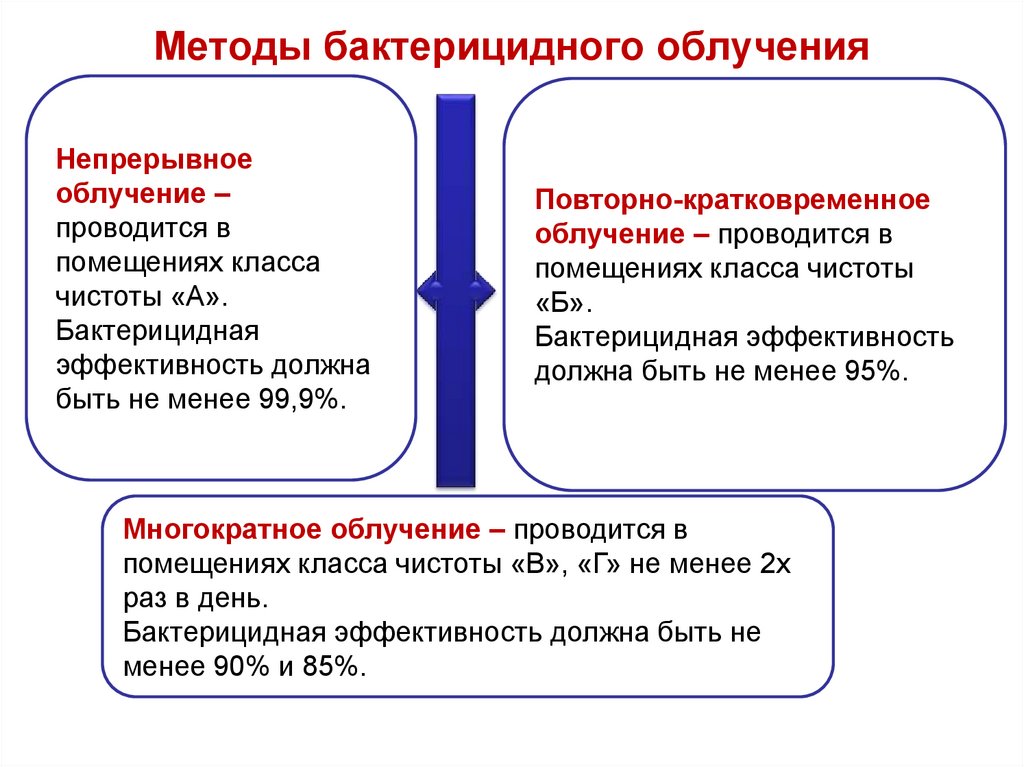
71. Методы бактерицидного облучения
Непрерывноеоблучение –
проводится в
помещениях класса
чистоты «А».
Бактерицидная
эффективность должна
быть не менее 99,9%.
Повторно-кратковременное
облучение – проводится в
помещениях класса чистоты
«Б».
Бактерицидная эффективность
должна быть не менее 95%.
Многократное облучение – проводится в
помещениях класса чистоты «В», «Г» не менее 2х
раз в день.
Бактерицидная эффективность должна быть не
менее 90% и 85%.
72.
Гигиена рук медицинскогоперсонала
73. МЕТОДИЧЕСКИЕ УКАЗАНИЯ МУ 3674-20
ОБЕЗЗАРАЖИВАНИЕРУК МЕДИЦИНСКИХ РАБОТНИКОВ И
КОЖНЫХ ПОКРОВОВ ПАЦИЕНТОВ
ПРИ ОКАЗАНИИ МЕДИЦИНСКОЙ
ПОМОЩИ
74.
В зависимости от выполняемой медицинскойманипуляции и требуемого уровня снижения
микробной контаминации кожи рук медицинский
персонал осуществляет обработку рук по одному из
способов:
Гигиеническая обработка рук;
Хирургическая обработка рук.
75.
Гигиеническое мытье рук – проводится с мылом (втом числе с антимикробными свойствами) и водой.
Цель - удаление загрязнений и снижение микробной
контаминации рук.
Гигиеническая обработка рук – проводится
спиртсодержащим кожным антисептиком.
Цель - снижение количество микроорганизмов до
безопасного уровня.
76. Подготовка рук к гигиеническим процедурам:
• ногти должны быть подстрижены (свободный крайногтевой пластины должен быть менее 5 мм),
• не допускаются накладные ногти и покрытие лаком;
• ювелирные украшения (кольца, браслеты, наручные
часы) должны быть сняты;
• царапины и порезы необходимо покрыть
бактерицидным пластырем;
• длинные рукава необходимо
завернуть.
77. Гигиеническая обработка рук
Проводится:перед надеванием перчаток, после снятия
перчаток;
перед непосредственным контактом с пациентом;
после контакта с неповрежденной кожей пациента
(например, при измерении пульса или
артериального давления);
после контакта с оборудованием, биологическими
жидкостями организма, слизистыми оболочками;
перед выполнением различных манипуляций и т.д.
78.
Ногтевые фаланги:• Наибольшие
концентрации микробов;
• чаще всего контактируют
с заражёнными
поверхностями;
• чаще всего контактируют
с пациентами.
Участки повышенного риска
79. Способ проведения гигиенической обработки рук
Основной способ гигиенической обработки рук:Обработка рук кожным антисептиком.
При явном загрязнении рук необходимо
мытье рук с мылом и водой – но это не
является заменой обработки рук кожным
антисептиком.
Мыло и антисептик вместе
использовать нельзя.
80.
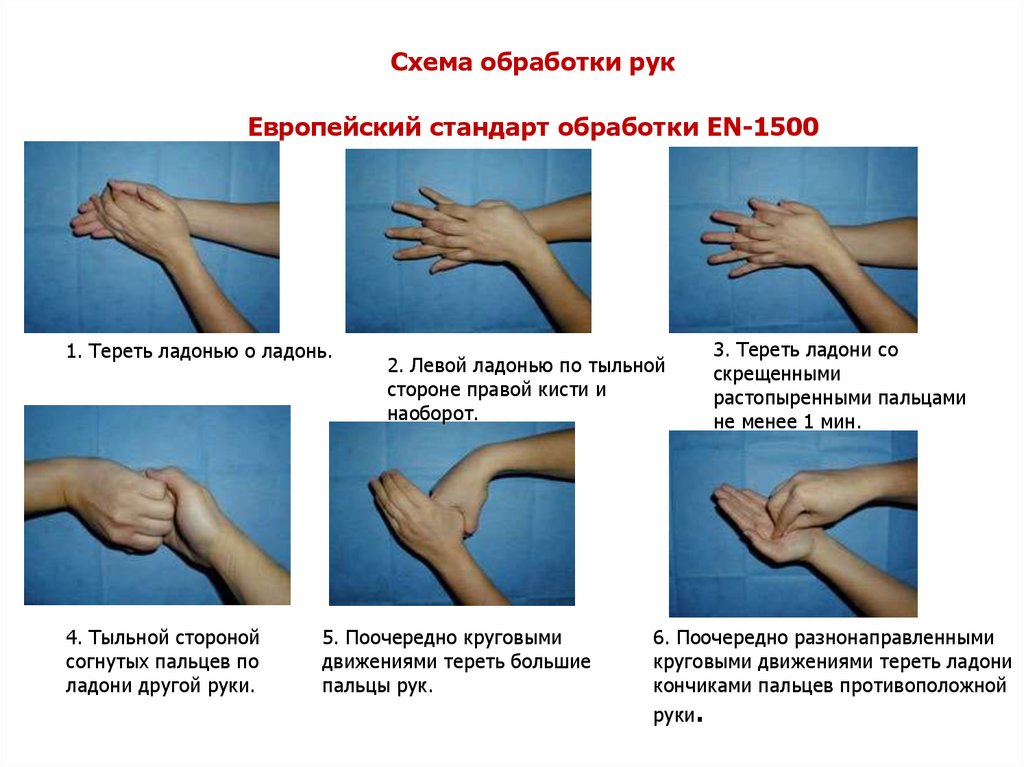
Схема обработки рукЕвропейский стандарт обработки EN-1500
1. Тереть ладонью о ладонь.
4. Тыльной стороной
согнутых пальцев по
ладони другой руки.
2. Левой ладонью по тыльной
стороне правой кисти и
наоборот.
5. Поочередно круговыми
движениями тереть большие
пальцы рук.
3. Тереть ладони со
скрещенными
растопыренными пальцами
не менее 1 мин.
6. Поочередно разнонаправленными
круговыми движениями тереть ладони
кончиками пальцев противоположной
руки.
81. Пациенты и посетители проводят гигиеническую обработку рук с использованием мыла и воды или спиртсодержащего антисептика в
следующихслучаях:
до и после контакта с поврежденными участками
кожи, повязками, слизистыми оболочками,
использованными медицинскими изделиями;
при входе в палату;
перед выходом из палаты;
перед едой;
после посещения туалета.
82.
Пациенты и посетители обязаны подчинятьсятребованиям медицинского персонала в части
соблюдения правил внутреннего распорядка и
требований гигиены рук.
83. Третий уровень - хирургическая обработка рук
Обработку рук хирургов проводят в случаях:выполнения любых оперативных вмешательств или
других процедур, манипуляций любой
продолжительности, сложности, локализации;
катетеризации магистральных сосудов;
установки инвазивного/дренажного устройства;
пункции тканей, полостей, сосудов, спинномозговых
каналов;
выполнения стерильных эндоскопических манипуляций;
приема родов.
84. Хирургическая обработка рук
Обработка рук хирургов проводится в два этапа:I этап - мытье рук жидким мылом (без антимикробных
компонентов, без применения щеток в течение двух
минут) и водой, а затем высушивание стерильным
ТКАНЕВЫМ полотенцем (салфеткой);
II этап - обработка спиртсодержащим антисептиком кистей
рук, запястий и предплечий способом втирания в кожу
(до его полного высыхания).
85.
Чтобы устранить раздражающее действие на кожу, всостав антисептиков включают
противовоспалительные, заживляющие и
увлажняющие добавки.
86. Средство для защиты и ухода
Для ухода за кожей рук перед рабочей сменой, перед обеденнымперерывом и после него, а также в конце рабочей смены
рекомендуется использовать смягчающие и увлажняющие,
питающие кожу кремы, лосьоны, бальзамы.
Медицинский персонал в 7 раз больше подтвержен развитию
кожных дерматитов.
Около 40% медицинского персонала страдают от раздражения
кожи рук.
Крем для рук это не роскошь, это ваше ПРАВО.
















































































 Медицина
Медицина








