Похожие презентации:
Электролиз. Урок химии в 11 классе
1.
Урок химии в11 классе.
2. Электролиз.
Электролиз – окислительновосстановительный процесс,протекающий на электродах
при прохождении постоянного
электрического тока через
расплав или раствор
электролита.
Электролиты: соли, щёлочи,
кислоты.
3.
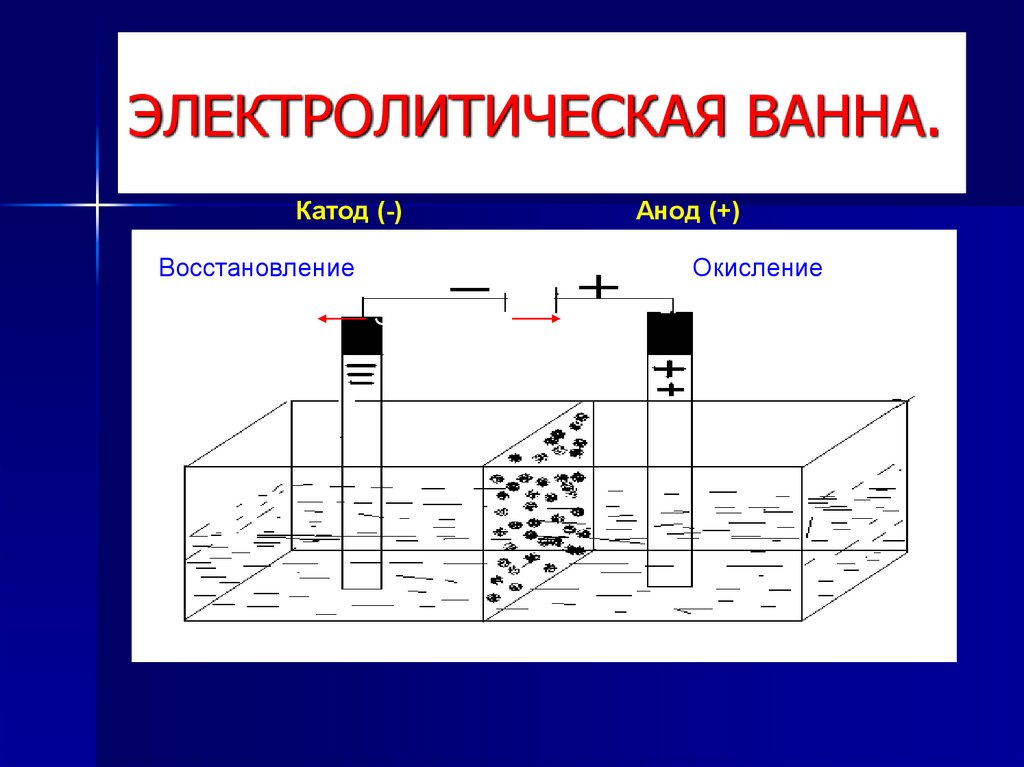
4. ЭЛЕКТРОЛИТИЧЕСКАЯ ВАННА.
Катод (-)Восстановление
Анод (+)
Окисление
Электроды
5.
Электролиз раствора CuCl2Раствор CuCl2
(–) Катод ← Cu2+ ; H2O
(+) Анод ← Cl– ; H2O
(–) Катод: Cu2+ + 2ē → Cu0
(+) Анод: 2Cl– – 2ē → Cl2↑
H2O+CuCl2 → Cu +Cl2↑+ H2O
6.
к+
н 0н
J
J -
н 0н
к
+
7.
к+
н 0н
J
J -
н 0н
к
+
8.
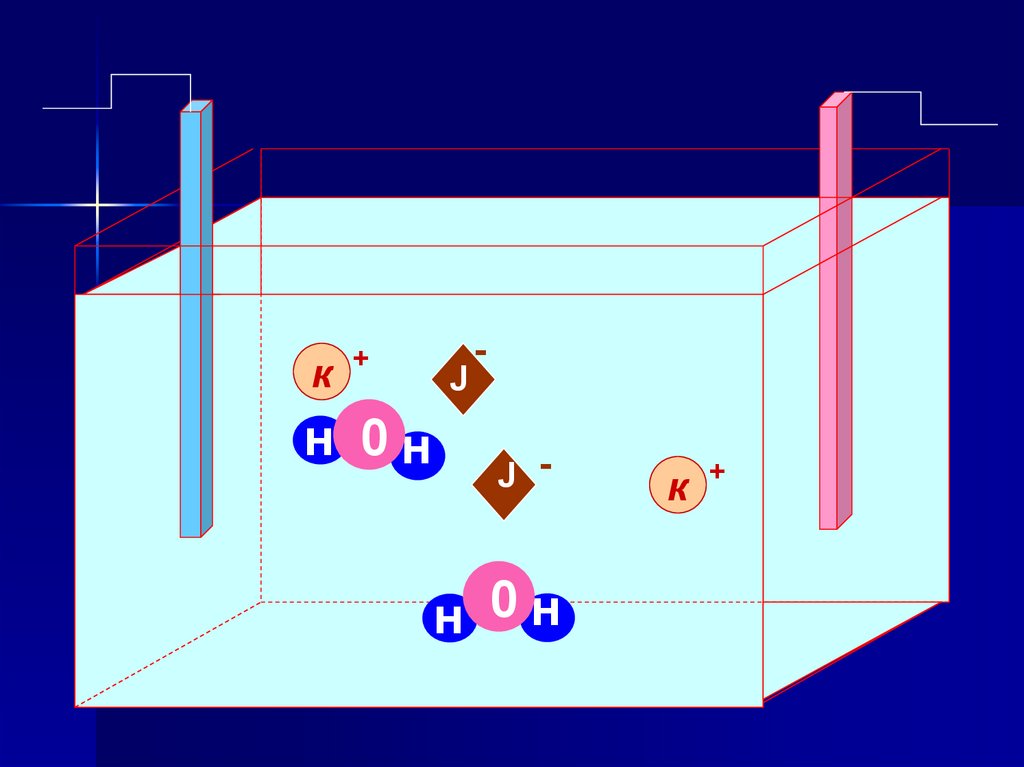
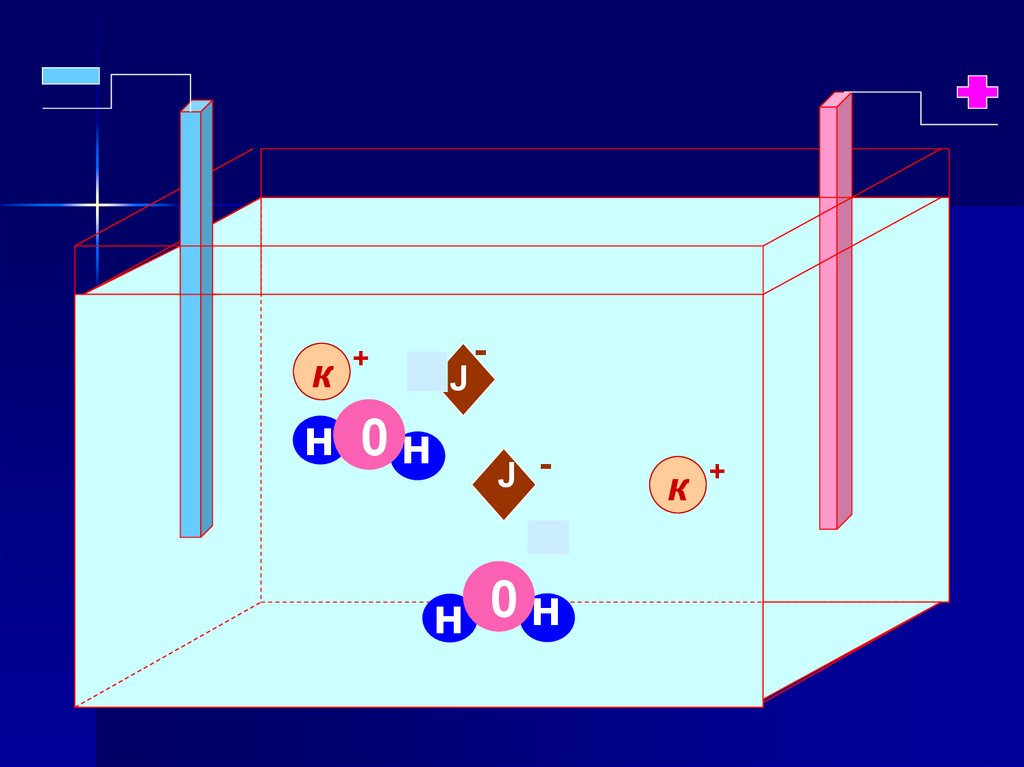
Электролиз раствора КIРаствор KI
(–) Катод ← K+ ; H2O
(+) Анод ← I- ; H2O
(–) Катод: 2H2O + 2ē →H2↑+ 2OH(+) Анод: 2I- -2ē → I2
2Н2О + 2КI → Н2+2КОН + I2
9. Процессы на катоде
Катионы активных металлов:Li+, Cs+, Rb+, K+, Ba2+, Ca2+, Na+,
Mg2+, Al3+, NH4+
Металлы не восстанавливаются, а
восстанавливаются молекулы H2O:
2H2O + 2ē → H2↑ + 2OH–
10. Процессы на катоде
Катионы малоактивныхметаллов:
Cu2+, Hg2+, Ag+, Pt2+, Au3+
Восстанавливаются только
катионы металлов:
Men+ + nē → Meo
11. Процессы на катоде
Катионы металлов среднейактивности
Mn2+, Zn2+, Cr3+, Fe2+, Co2+, Ni2+,
Sn2+, Pb2+
Катионы металлов
восстанавливаются совместно с
молекулами воды:
Men++ nē → Meo
2H2O + 2ē → H2↑+ 2OH–
12. Процессы на катоде
Катионы водорода H+Ионы H+ восстанавливаются
только при электролизе
растворов кислот:
2H++ 2ē → H2↑
13.
CuCu
2+
0
н н
2SO4
Cu
2SO4
2+
Cu
2+
0
н н
н 0н
2SO4
2+
2SO4
14.
Cuн
2+
н 0н
н
Cu
2-
SO4
Cu
2SO4
2+
Cu
2+
н 0н
н 0н
2SO4
2+
2SO4
15.
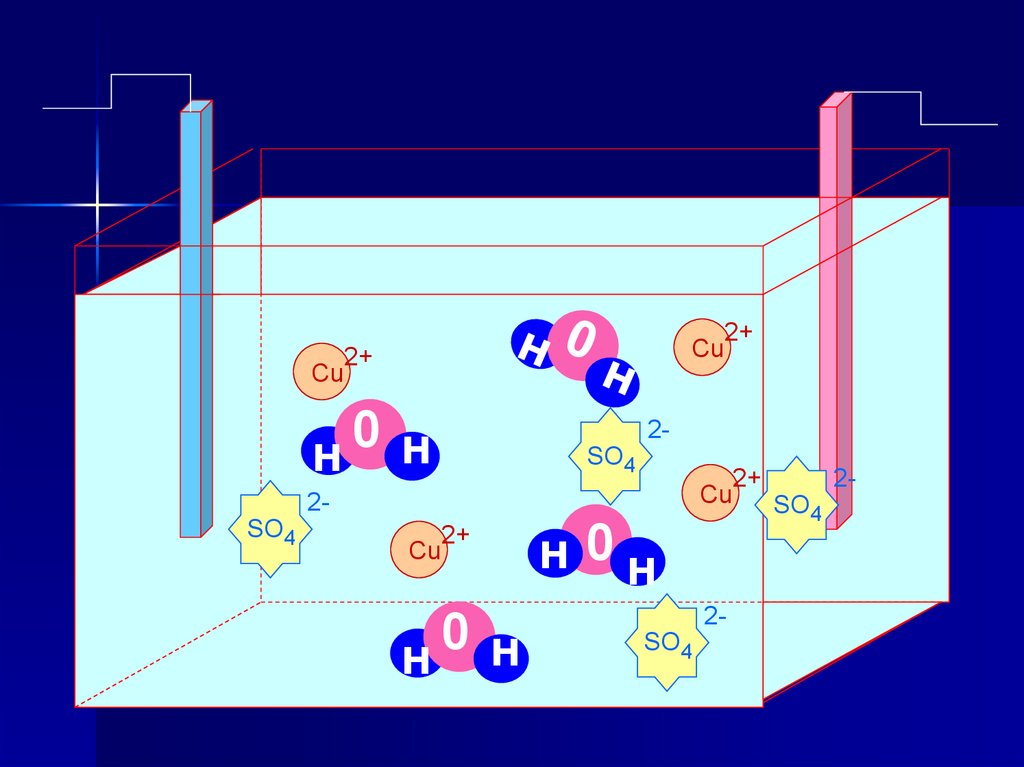
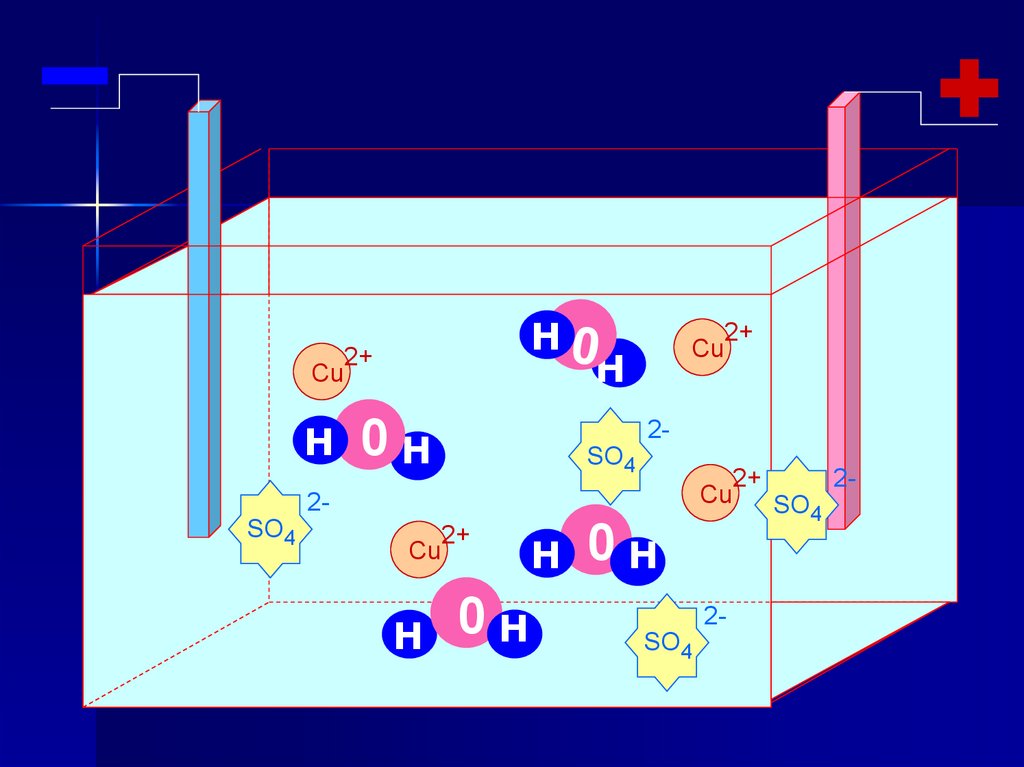
Электролиз раствора CuSO4Раствор CuSO4
(–) Катод ← Cu2+ ; H2O
(+) Анод ← SO42- ; H2O
(–) Катод: Cu2+ + 2ē → Cu0
(+) Анод: 2H2O - 4ē → O2↑+ 4H+
2H2O+2CuSO4 → 2Сu +О2↑+ 2Н2SО4
16. Процессы на аноде
1) Анионы бескислородных кислот:I–, Br–, S2–, Cl– (кроме F-)
Окисляются кислотные остатки
Am– – mē → Ao
2) Анионы OH–
Окисляются только при электролизе
растворов щёлочей
4OH– – 4ē → O2↑+ 2H2O
17. Процессы на аноде
3) Анионы кислородсодержащихкислот:
SO42–, NO3–, CO32–, PO43–
Окисляются молекулы воды:
2H2O – 4ē → O2↑+ 4H+
4) Анионы F–
Окисляются только молекулы воды
2H2O – 4ē → O2↑ + 4H+
18.
Закон электролизабыл
экспериментально
установлен
английским
физиком
Майклом
Фарадеем
в 1833 году.
(1791-1867)
19.
Применениеэлектролиза
20. Основная химическая промышленность
1) Получение галогенов, водорода.2) Получение щелочей.
3) Электросинтез органических
веществ - Получают сложные
фторорганические соединения, тетраалкильные
производные свинца, например себациновую (
декандиновую) кислоту и др.
21. Металлургия
1)Получение щелочей. (израсплавов)
2)Получение наиболее активных
металлов. (из расплавов)
3)Получение малоактивных
металлов. (из растворов)
4)Рафинирование (очистка)
металлов – очищают Cu, Ni, Pb и др.
22. Гальванотехника
Область прикладной химии,охватывающая процессы
электролитического осаждения
металлов на поверхность
металлических и неметаллических
изделий. Она включает
гальваностегию и гальванопластику.
23. Гальваностегия
Это процесс получения на поверхностиизделий прочно сцеплённых с ней
тонких металлических покрытий. Это
позволяет покрыть изделие слоем
(плёнкой) благородного металла,
защитить его от коррозии, повысить
стойкость на износ, произвести
декоративную отделку.
24. Покрытие предметов слоем благородного металла
25.
26.
27. ГАЛЬВАНОПЛАСТИКА
это процесс получения легкоотделяющихся, относительно
толстых, точных копий с различных
предметов.
28.
В 1837 г. русский ученый Б.С. Якоби открылспособ получения абсолютно точных рельефных
копий предмета. Для этого с предмета делают
слепок из пластичного материала (гипс, воск) и
помещают его в электролитическую ванну в
качестве катода. При пропускании через ванну
электрического тока слепок покрывается слоем
металла. Затем слепок отделяют от полученной
копии и используют снова. Гальванопластика
позволяет быстро изготавливать металлические
копии и воспроизводить их в любом количестве.
Так изготавливают медали, монеты, произведения
искусства.
29.
Изготовление медалей, монет.30.
В 1845 г. в Санкт – Петербурге былоорганизовано предприятие герцога
Лихтенбергского, на котором таким
способом изготавливали барельефы
для Исаакиевского и Петропавловского
соборов, Эрмитажа, Зимнего дворца,
Большого театра. Позолота прекрасно
сохранилась до наших дней.
31.
Произведения искусства:Барельефы для:
Исаакиевского собора
32.
Петропавловского собора33.
Зимнего дворца34.
Большого театра35.
Методом гальванопластики изготавливаютмедные клише для типографии, позволяющие
сделать до 40 тыс. оттисков, и медные
хромированные клише – до 1,5 млн. оттисков.
Открытие
гальванопластики
позволило
изготавливать пресс – формы из пластмассы,
резины, металла, заменяя трудоёмкие работы
высококвалифицированных токарей и граверов.
36.
Медные клише для типографии37.
Тест по теме «Электролиз»Вопрос
1. Электролиз- это…
2. При электролизе раствора
бромида
меди(II)
образуются…
3. При электролизе раствора
сульфата меди(II) образуются
на аноде …
4. При электролизе раствора
сульфата меди(II) образуются
на катоде…
__________________________
5. На аноде
процесс..
протекает
Ответ
A. Медь
Б. Кислород и серная кислота
В. Медь, бром
Г. Процесс, выделения на
электродах веществ,
связанный с окислительновосстановительными
реакциями.
Д. Окисление
38.
Тест «Электролиз»1). НА КАТОДЕ ОБЫЧНО ПРОТЕКАЮТ ПРОЦЕССЫ
1) окисления
2) восстановления
3) диссоциации электролитов на ионы
2). ПРИ ЭЛЕКТРОЛИЗЕ ВОДНОГО РАСТВОРА CaCl2 СРЕДА У КАТОДА
1) кислая
2) щелочная
3) нейтральная
3). РАСТВОР СОЛИ, ЭЛЕКТРОЛИЗ РАСТВОРА КОТОРОЙ ПРИВОДИТ К ОКИСЛЕНИЮ АНИОНА
1) KNO3
2) Na2S
3) ZnSO4
4). ПРИ ЭЛЕКТРОЛИЗЕ ВОДНОГО РАСТВОРА AgNO3 НА КАТОДЕ ОБРАЗУЕТСЯ
1) водород
2) серебро
3) азотная кислота
5). ФОРМУЛА СОЛИ, ПРИ ЭЛЕКТРОЛИЗЕ ВОДНОГО РАСТВОРА КОТОРОЙ НА КАТОДЕ ОДНОВРЕМЕННО
БУДУТ ВОССТАНАВЛИВАТЬСЯ ИОНЫ МЕТАЛЛА И ИОН ВОДОРОДА
1) СuSO4
2) Zn(NO3)2
3) MgCl2
6). СОЛЬ, МАССА КОТОРОЙ ПРИ ЭЛЕКТРОЛИЗЕ ВОДНОГО РАСТВОРА НЕ МЕНЯЕТСЯ
1) хлорид натрия
2) нитрат калия
3) нитрат серебра
7). СОЛЬ, ПРИ ЭЛЕКТРОЛИЗЕ РАСТВОРА КОТОРОЙ ОКИСЛЯЮТСЯ МОЛЕКУЛЫ ВОДЫ
1) нитрат калия
2) хлорид кальция
3) йодид калия
8). ВОДОРОД В ПРОМЫШЛЕННОСТИ ПОЛУЧАЮТ ЭЛЕКТРОЛИЗОМ ВОДНОГО РАСТВОРА СОЛИ
1) нитрата серебра
2) хлорида меди
3) хлорида натрия
4) нитрата ртути (II)
39.
Установите соответствие между формулойсоли и уравнением процесса,
протекающего на катоде при электролизе её
водного раствора:
Формула соли
Уравнение катодного процесса
А) Аl(NO3)3
Б) Сu Сl2
B) SbCl3
Г) Cu(NO3)2
1) 2H2O - 4ē → O2↑+ 4H+
2) 2H2O + 2ē →H2↑+ 2OH3) Cu2+ + 1ē → Cu+
4) Sb3+ - 2ē → Sb5+
5) Sb3+ + 3ē → Sb0
6) Cu2+ + 2ē → Cu0
40.
Установите соответствие между формулойсоли и уравнением процесса,
протекающего на аноде при электролизе её
водного раствора:
Формула соли
Уравнение анодного процесса
А) Аl(NO3)3
Б) Сu Сl2
B) SbCl3
Г) Cu(NO3)2
1) 2H2O - 4ē → O2↑+ 4H+
2) 2H2O + 2ē →H2↑+ 2OH3) 2Cl- - 2ē → Cl20
4) Sb3+ + 3ē → Sb0
5) Cl- +4H2O-8ē →ClO-4 +8H+
6) 4NO-3 – 4ē →2N2O+5O2
41. Электролиз раствора NaCl
Раствор NaCl(–) Катод ← Na+ ; H2O
(+) Анод ← Cl– ; H2O
(–) Катод: 2H2O + 2ē → H2↑+ 2OH–
(+) Анод: 2Cl– – 2ē → Cl2↑
2H2O+2NaCl → H2↑+Cl2↑+ 2NaOH
42.
Домашнее задание1) Составить схемы электролиза
раствора AgNO3
2) При электролизе раствора хлорида
меди (II) на аноде выделился газ
объёмом 2,24 л. Определите массу
хлорида меди (II) подвергшегося
электролизу.



































 Химия
Химия








