Похожие презентации:
Химическое равновесие
1. Урок на тему: « Химическое равновесие »
2. Давайте вспомним все то, что знаем о химических реакциях?
-Приведите примеры наиболее запомнившихсяхимических реакций
Окислительновосстановительные
реакции
Реакция
экзотермическая
Реакция
соединения
Реакция
нейтрализации
Ионного обмена
Каталитические
Химическая реакция
Реакция обмена
Реакция
эндотермическая
Обратимые
Реакция
разложения
Реакция
замещения
3.
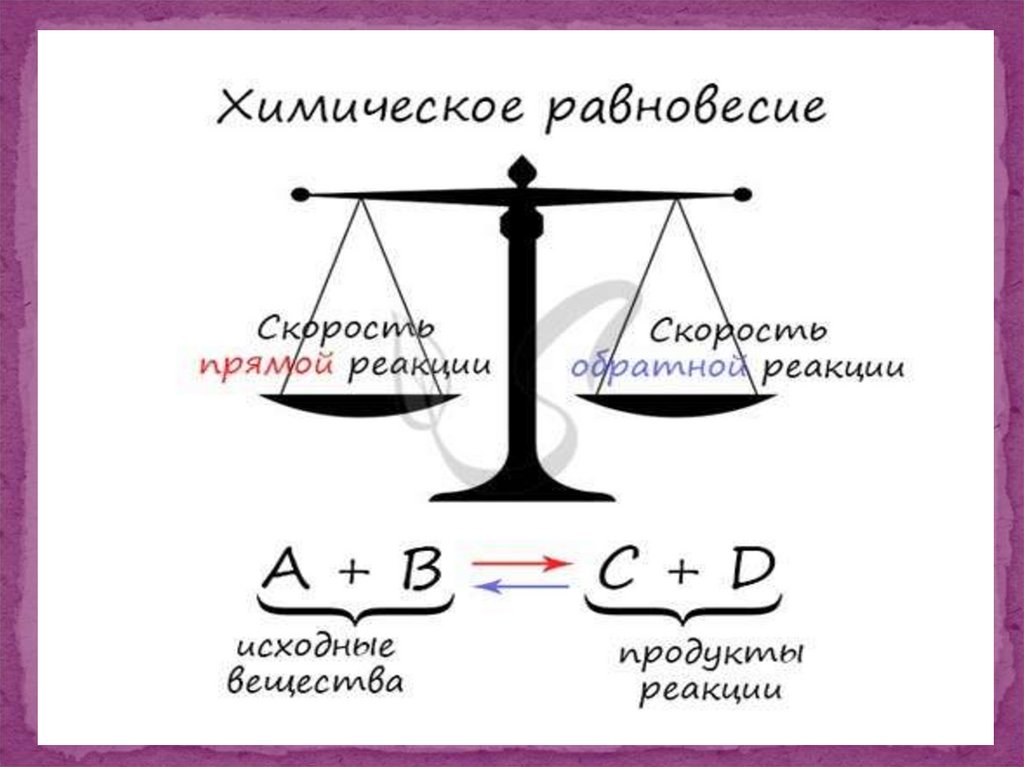
Химические реакции заключаются вовзаимодействии
реагентов
с
образованием продуктов реакцию.
Химические реакции протекают и в
прямом, и в обратном направлениях:
Реагенты ↔ Продукты
Направление протекания химической
реакции определяется условиями ее
проведения (температурой, давлением,
концентрацией веществ).
4.
5. Обратимыми называются реакции, которые одновременно протекают в двух взаимно противоположных направлениях. 3H2 + N2 ↔ 2NH3 + Q
V, моль/л·сСкорость прямой
реакции
V1 = V2
Скорость обратной
реакции
Момент равновесия
6. Если вы правильно решите химический ребус, то получится название основного правила, которому подчиняются сдвиги химического
1,2+
Р
V
2,3,4
3,4
Kr
Be
5,2
1,3,2
2
Все 3
Известен Всюду на Земле
Анри Луи Ле Шателье
Он не был королем и принцем,
Зато открыл прекрасный принцип,
Который химикам полезен.
7. Допустим, что химическая реакция представляет собой весы. На левой чаше весов находится исходные вещества, на правой – продукты
8.
Влияние, которое оказывают эти факторы нахимическую реакцию, подчиняются закономерности,
которая была высказана в общем виде в 1884 году
французским ученым Ле-Шателье .
Современная формулировка принципа
Ле-Шателье :
Если на систему, находящуюся в
состоянии равновесия, оказать внешнее
воздействие, то система перейдет в
другое состояние так, чтобы уменьшить
эффект внешнего воздействия.
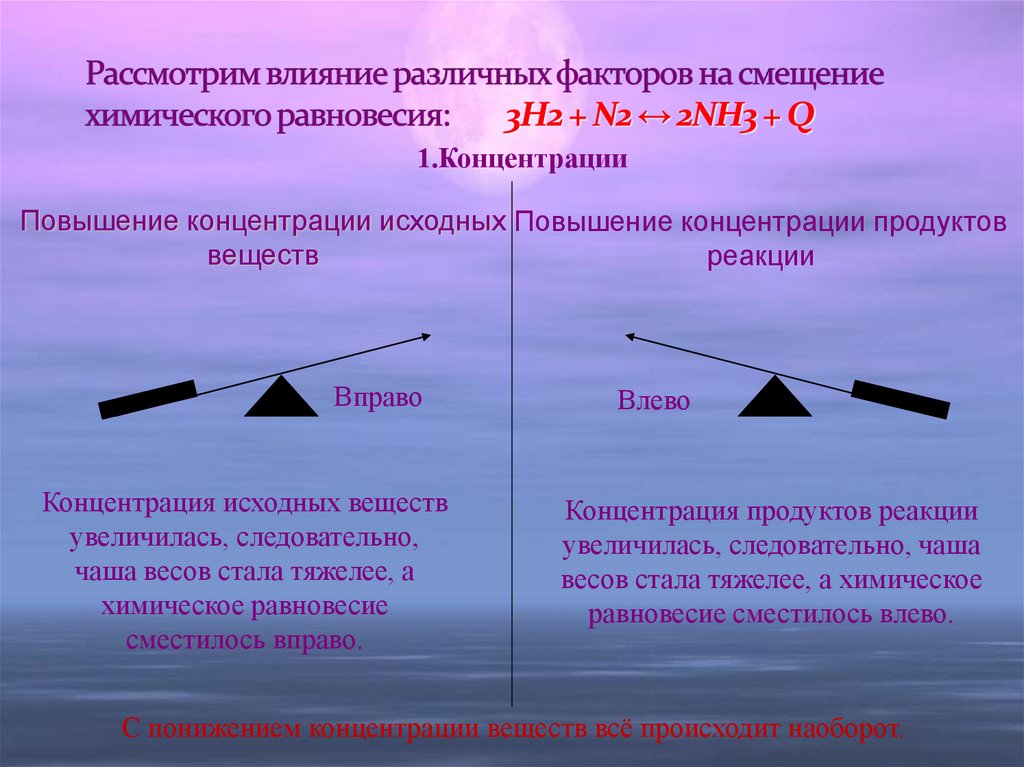
9. Рассмотрим влияние различных факторов на смещение химического равновесия: 3H2 + N2 ↔ 2NH3 + Q
1.КонцентрацииПовышение концентрации исходных Повышение концентрации продуктов
веществ
реакции
Вправо
Концентрация исходных веществ
увеличилась, следовательно,
чаша весов стала тяжелее, а
химическое равновесие
сместилось вправо.
Влево
Концентрация продуктов реакции
увеличилась, следовательно, чаша
весов стала тяжелее, а химическое
равновесие сместилось влево.
С понижением концентрации веществ всё происходит наоборот.
10. КОНЦЕНТРАЦИЯ • При повышении концентрации одного из исходных веществ равновесие сдвигается в направлении образования продуктов
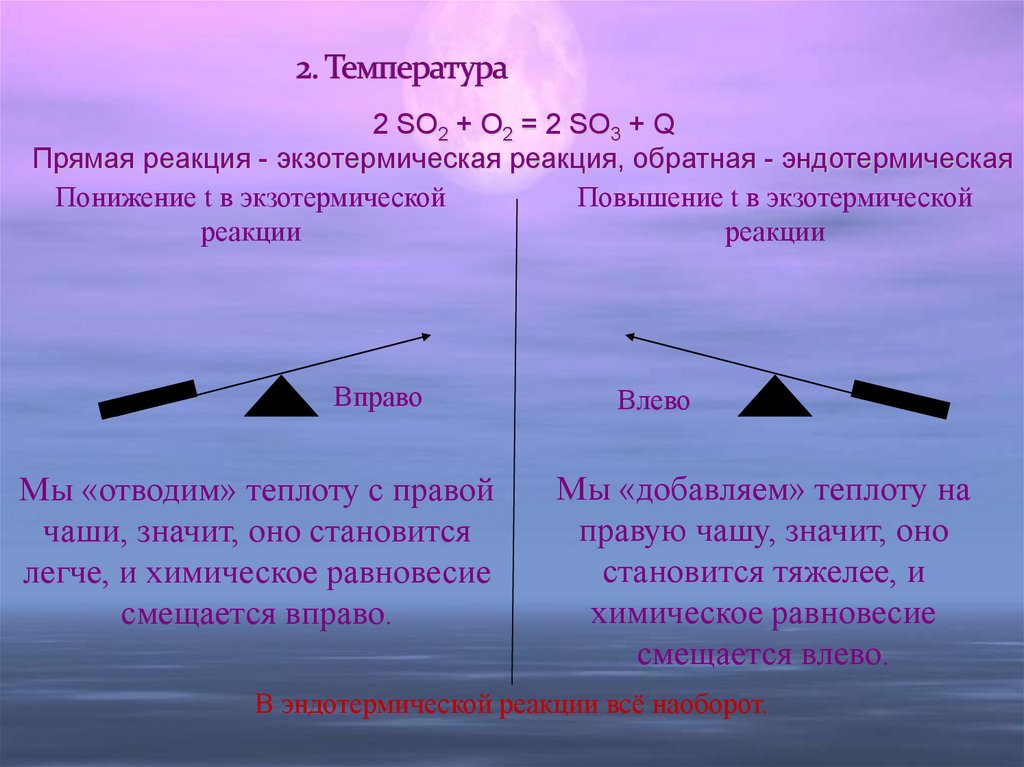
11. 2. Температура
2 SO2 + O2 = 2 SO3 + QПрямая реакция - экзотермическая реакция, обратная - эндотермическая
Понижение t в экзотермической
Повышение t в экзотермической
реакции
реакции
Вправо
Мы «отводим» теплоту с правой
чаши, значит, оно становится
легче, и химическое равновесие
смещается вправо.
Влево
Мы «добавляем» теплоту на
правую чашу, значит, оно
становится тяжелее, и
химическое равновесие
смещается влево.
В эндотермической реакции всё наоборот.
12. ТЕМПЕРАТУРА • При повышении температуры химическое равновесие сдвигается в направлении эндотермической реакции • При понижении
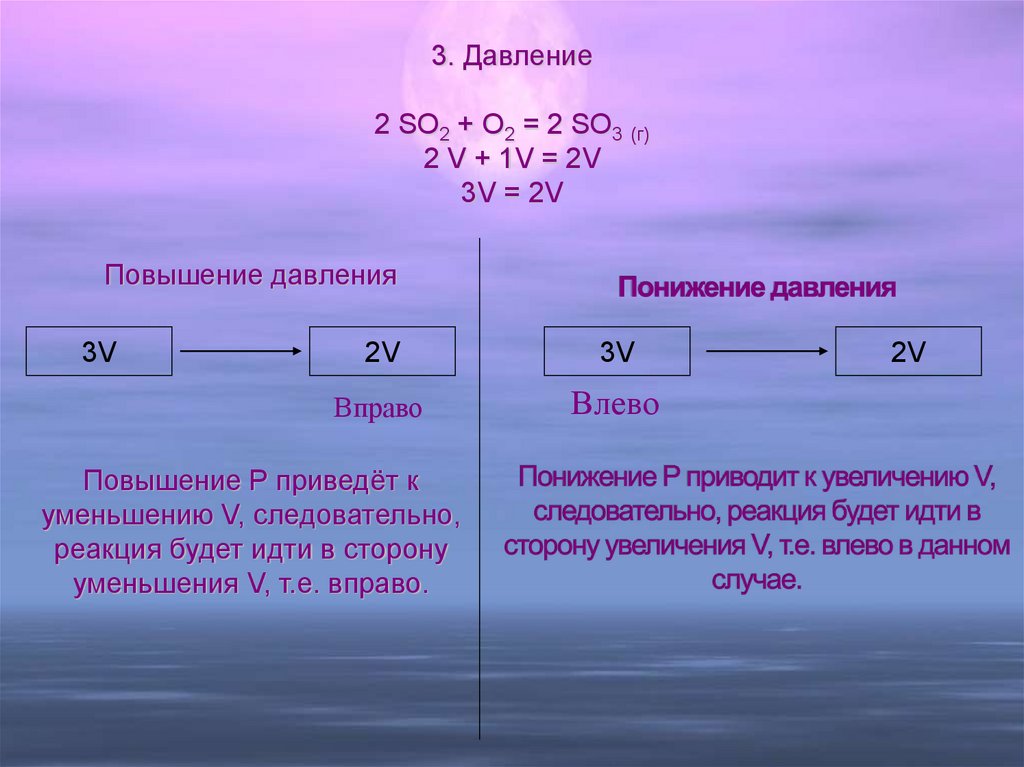
13. Понижение давления Понижение Р приводит к увеличению V, следовательно, реакция будет идти в сторону увеличения V, т.е. влево в
3. Давление2 SO2 + O2 = 2 SO3 (г)
2 V + 1V = 2V
3V = 2V
Повышение давления
3V
2V
3V
Вправо
Влево
Повышение Р приведёт к
уменьшению V, следовательно,
реакция будет идти в сторону
уменьшения V, т.е. вправо.
2V
14. ДАВЛЕНИЕ • При повышении давления химическое равновесие сдвигается в направлении образования веществ с меньшим объёмом • При
15. Химик толкает реакцию в спину: «Давай-ка тебя я немного подвину!» Она отвечает: «Ты знаешь меня: Ни часа, ни дня не могу без
16. Самостоятельная работа
I вариантКак сместится равновесие реакции:
2 NOг + O2 = 2 NO2 Г - Q
а) при понижении давления?
б) при повышении температуры
Ответ обоснуйте.
II вариант
Как повлияет на смещение равновесия:
N2г + O2 = 2 NOг – Q
а) увеличение температуры?
б) уменьшение давления?
Ответ обоснуйте.












 Химия
Химия








