Похожие презентации:
Процессы подготовки газа к транспорту
1.
Процессы подготовки газа к транспорту1
2.
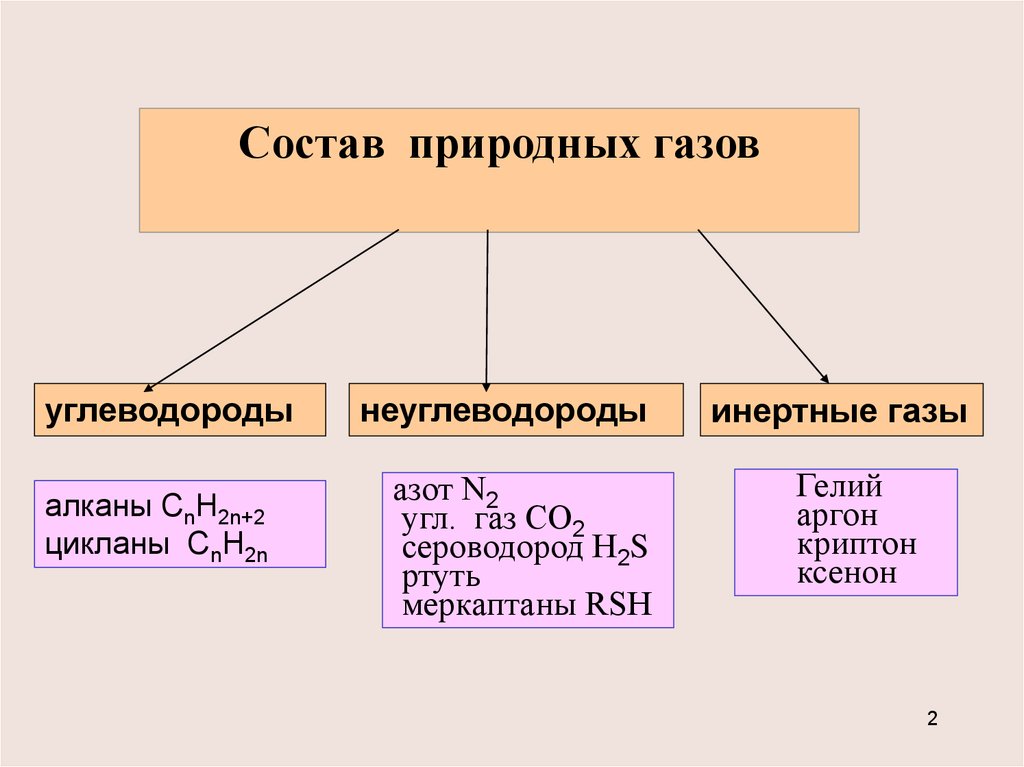
Состав природных газовуглеводороды
алканы CnH2n+2
цикланы CnH2n
неуглеводороды
азот N2
угл. газ СО2
сероводород Н2S
ртуть
меркаптаны RSH
инертные газы
Гелий
аргон
криптон
ксенон
2
3.
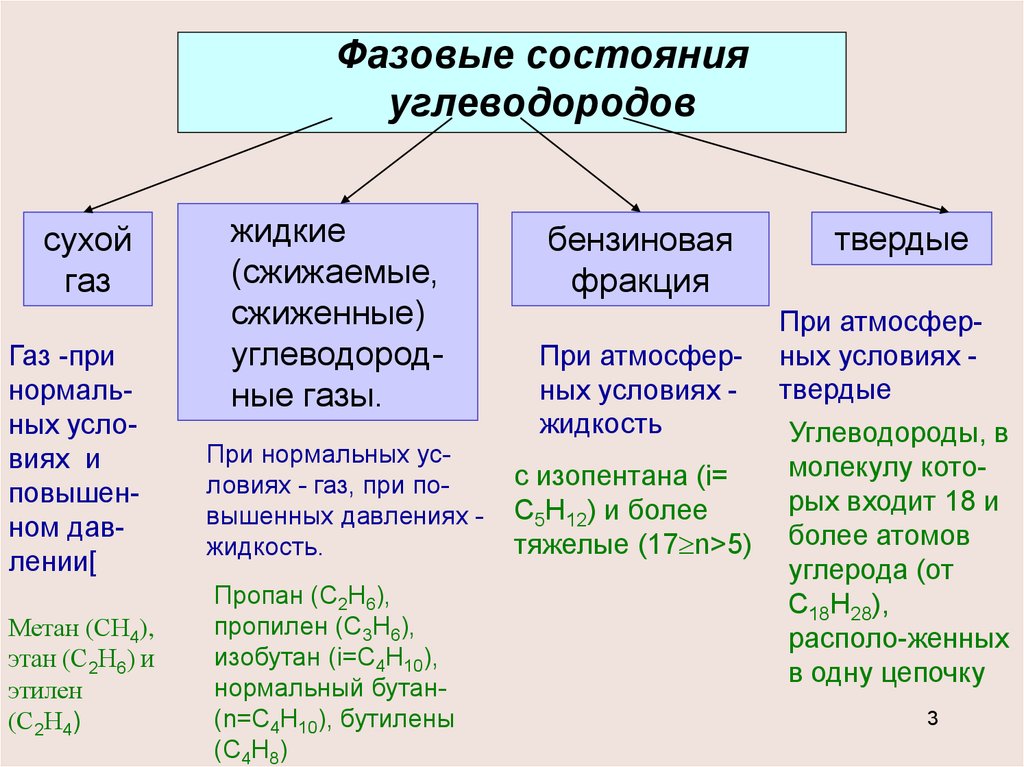
Фазовые состоянияуглеводородов
сухой
газ
Газ -при
нормальных условиях и
повышенном давлении[
Метан (СН4),
этан (С2Н6) и
этилен
(С2Н4)
жидкие
(сжижаемые,
сжиженные)
углеводородные газы.
При нормальных условиях - газ, при повышенных давлениях жидкость.
Пропан (С2Н6),
пропилен (С3Н6),
изобутан (i=С4Н10),
нормальный бутан(n=С4Н10), бутилены
(С4Н8)
бензиновая
фракция
При атмосферных условиях жидкость
с изопентана (i=
С5Н12) и более
тяжелые (17 n>5)
твердые
При атмосферных условиях твердые
Углеводороды, в
молекулу которых входит 18 и
более атомов
углерода (от
С18Н28),
располо-женных
в одну цепочку
3
4. Типовые процессы подготовки газа к транспорту
• гидромеханические процессы• теплообменные процессы
• массобменные или диффузионные процессы.
Основы понятия массобменных процессов
Массопередача – это сложный процесс, включающий в
себя перенос вещества (массы) в пределах одной фазы,
перенос вещества через границу раздела фаз и его
перенос в гранах другой фазы.
Массоотдача – это перенос вещества из фазы к границе
раздела фаз или в обратно, т.е. в пределах одной из фаз.
4
5. общие признаки массобменных процессов
1. Они применяются для разделения смесей.2. В любом процессе участвуют как минимум две фазы: жидкая и
паровая (сепарация), жидкая и газовая (абсорбция) и твердая
и жидкая (адсорбция).
3. Переход вещества из одной фазы в другую осуществляется за
счет диффузии.
4. Движущей силой массобменных процессов является разность
или градиент концентраций между фактической
концентрацией компонента в данной фазе и равновесной с
другой фазой.
5. Перенос вещества происходит через границу раздела фаз.
6. Диффузионные процессы обратимы, их направление
определяется законами фазового равновесия, фактическими
концентрациями компонентов в обоих фазах и
термобарическими условиями.
7. Переход вещества из одной фазы в другую заканчивается при
5
достижении фазового равновесия.
6. Способы выражения составов смесей и связь между ними.
1. Массовая доля.qi
mi
,
r
m
i 1
i
где mi – масса i – го компонента в растворе; r – число компонентов в
растворе.
2. Мольная доля
Ni
ni
r
n
i
i 1
где ni – число молей i – го компонента в растворе;
компонентов в растворе.
mi
ni
Mi
где Mi – молярная масса i – го компонента.
r – число
3. Объемная доля.
vi
Vi
r
V
i 1
i
где Vi – объем i – го компонента до смешения при заданных
температуре и давлении.
m
i i
Vi
где ρi – плотность i – го компонента при заданных температуре и
давлении.
6
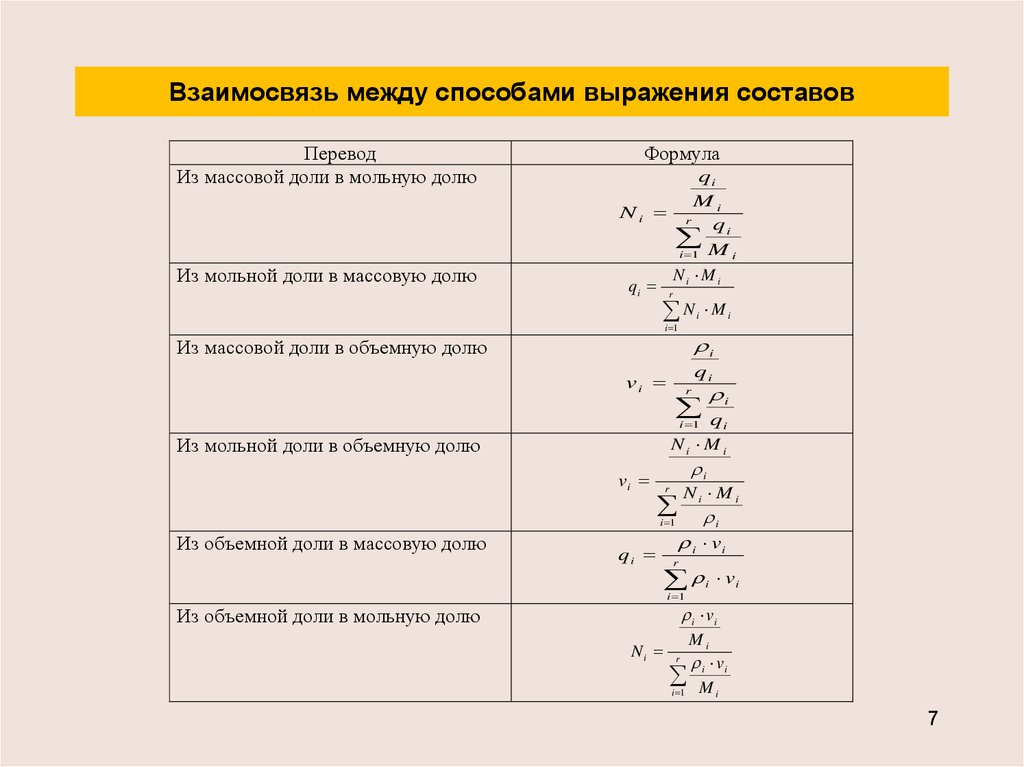
7. Взаимосвязь между способами выражения составов
ПереводИз массовой доли в мольную долю
Из мольной доли в массовую долю
Формула
qi
Mi
Ni r
qi
i 1 M i
N Mi
qi r i
Ni M i
i 1
i
Из массовой доли в объемную долю
qi
vi
i
r
qi
Ni M i
i 1
Из мольной доли в объемную долю
vi
i
Ni M i
r
i
i 1
Из объемной доли в массовую долю
qi
i vi
r
i 1
i
vi
i vi
Из объемной доли в мольную долю
Ni
Mi
r
i vi
i 1
Mi
7
8.
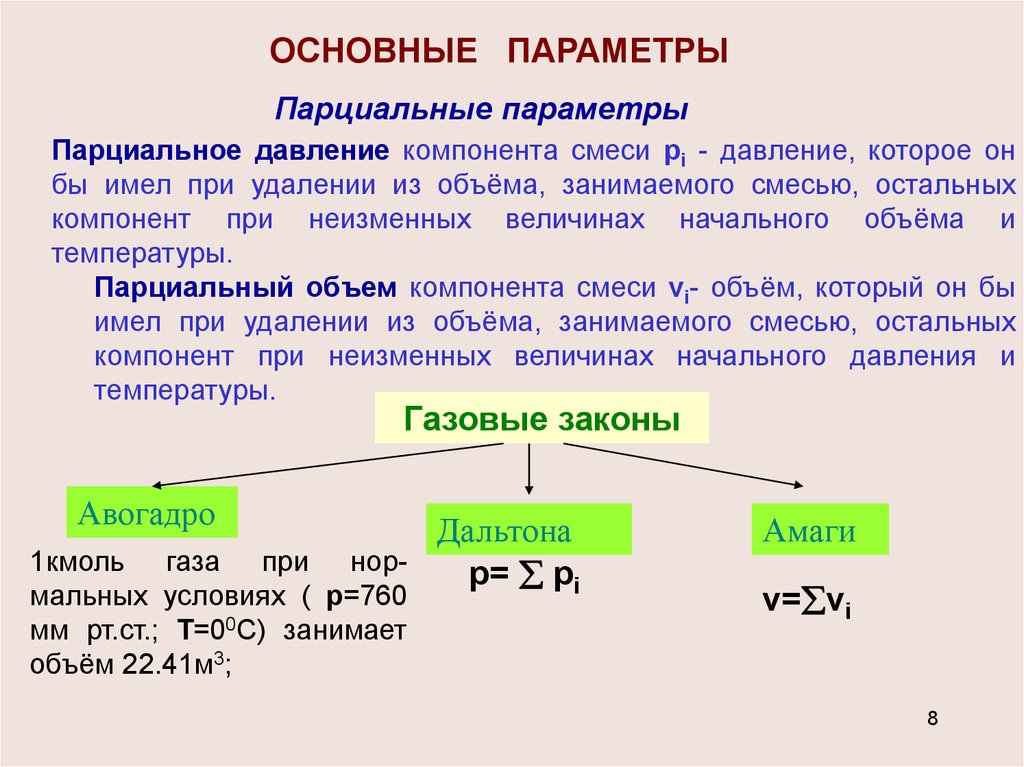
ОСНОВНЫЕ ПАРАМЕТРЫПарциальные параметры
Парциальное давление компонента смеси pi - давление, которое он
бы имел при удалении из объёма, занимаемого смесью, остальных
компонент при неизменных величинах начального объёма и
температуры.
Парциальный объем компонента смеси vi- объём, который он бы
имел при удалении из объёма, занимаемого смесью, остальных
компонент при неизменных величинах начального давления и
температуры.
Газовые законы
Авогадро
Дальтона
норр= рi
1кмоль газа при
мальных условиях ( р=760
мм рт.ст.; Т=00С) занимает
объём 22.41м3;
Амаги
v= vi
8
9.
Параметры газовых смесейплотность газа в нормальных условиях ст = М/22.41, кг/м3 ;
относительная плотность - - плотность, отнесённая к
плотности воздуха в при тех же значениях давления и
температуры;
концентрации компонент - массовые gi=Gi /G;
молярные yi=mi /m; объёмные xi=vi /v
Определение средних параметров через парциальные
давление р=pi /xi ; объём v=vi /xi;
молекулярная масса M= (xi Мi)/100=100/ (gi /Mi) ;
плотность =100/ (gi / i)=100M/ (xi Mi)/ i = (xi i).
(плотности воздуха: 0= 1,293кг/м3, 20= 1,205кг/м3); концентрации
связаны между собой соотношениями gi=xi Mi /M; yi=xi.
9
10.
Критические и приведённые термодинамическиепараметры
Критическим состоянием называется такое состояние
вещества, при котором
плотность вещества и его
насыщенного пара равны друг другу.
Параметры, соответствующие этому состоянию, называются
критическими параметрами.
Критической Ткр называется такая температура, выше
которой газ под действием давления любого значения не
может быть превращён в жидкость.
Критическое давление ркр, - зто давление, необходимое для
сжижения газа при критической температуре.
Критическим объёмом vкр называют объём, равный объёму
одного моля газа при критических значениях давления и
температуры.
10
11.
Приведённые параметрыПриведенным давлением рпр называется отношение давления
газа р к его критическому давлению ркр : pпр=p/ pкр.
Приведенной температурой Тпр называется отношение абсолютной температуры газа Т к его критическому значению Ткр:
Тпр=Т/Ткр.
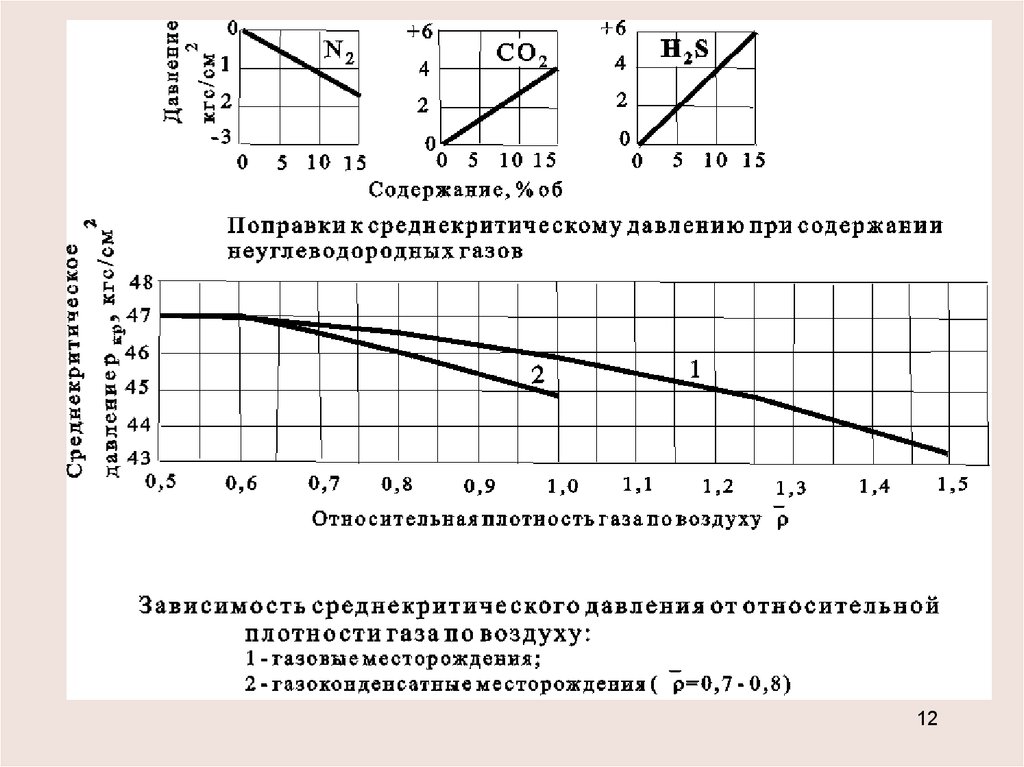
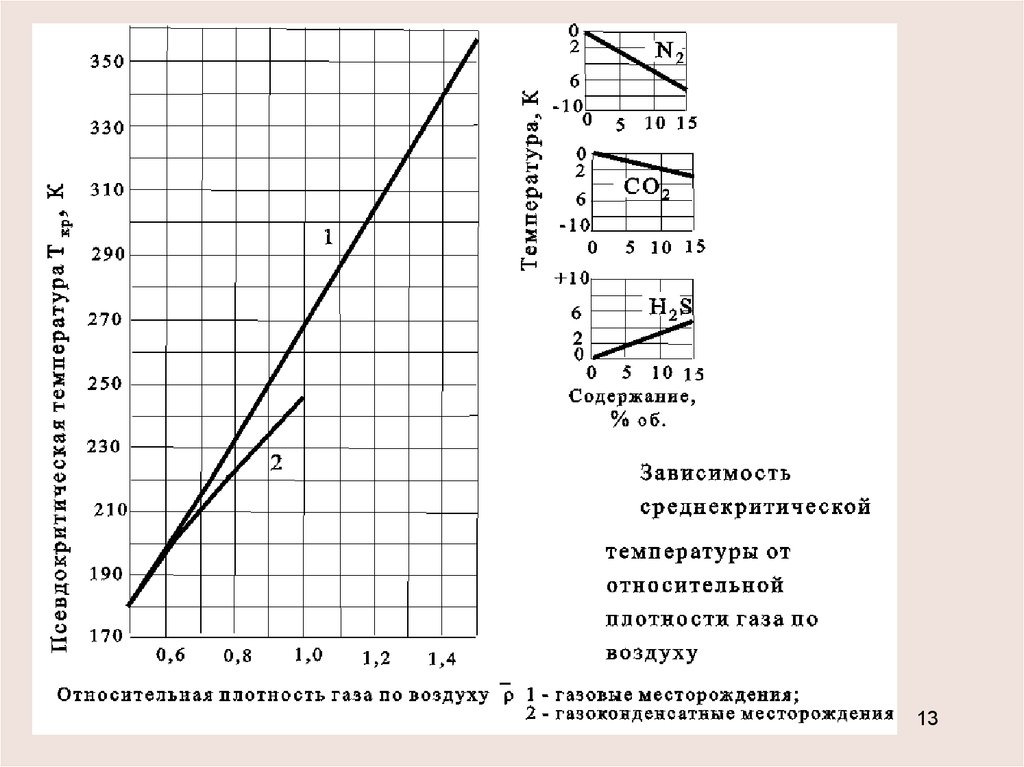
Определение критических параметров смеси
хС5+<10% или содержание N2, СО2, Н2S превышает 15%
pкр= (Pкрi xi) , Ткр = (Tкрi xi)
от 0,5 до 0,9
давление в кгс/см2 -
(газовые
месторождения) температура в К
-
ркр 49,5 3,7 ;
Ткр 93 176 ,
11
12.
1213.
1314.
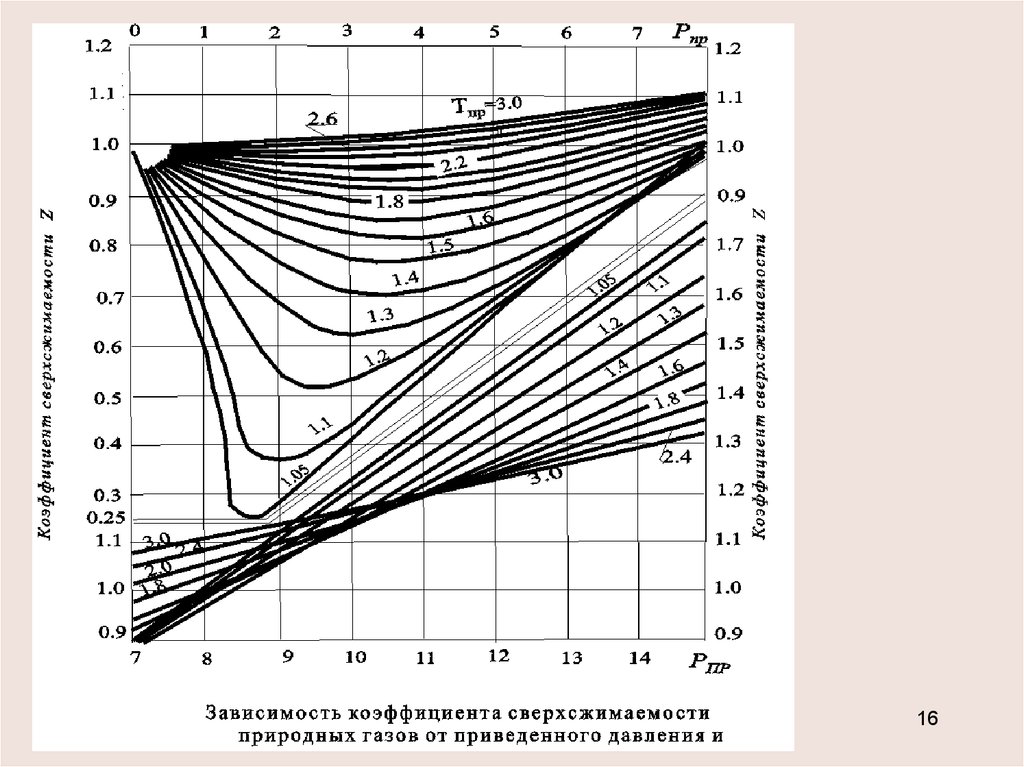
Уравнения состояния природных газовУравнением состояния называется аналитическая
зависимость между термодинамическими параметрами,
описываю-щими поведение вещества.
Совершенный газ - это газ, в котором можно
пренебречь объёмом молекул и взаимодействием
их между собой.
Уравнение состояние совершенного газа р= R T
(до 10 МПА)
Обобщенное уравнение состояния р=z R T
Многопараметрические зависимости p=f(a1,…, an, v, T)
14
15.
Обобщенное уравнение состояния р=z R TКоэффициент сверхсжимаемости z является функцией
приведенных значений давления рпр, температуры Тпр и для
тяжелых углеводородов С5+ - ацентрического фактора .
Ацентрический фактор - учитывает нецентричность сил
притяжения
Формула Эмистера: = 3/7[ lg(pкр /pст)/(Tкр /Tкип-1)]-1
Формула Гуревича (до С7, включительно):
2
Ткр
Ткр
0,006854
,
2,1898 0,1735
Ткип
100
100
где 540 Ткр 775К, 372 Ткр 625К
Ткр
Для смесей газов = (yi i), 0< i < 0,4
15
16.
1617.
Аппроксимация Платонова-Гуревичаz 0.4 lg Tп р 0.73
рп р
0.1 р п р
Формулы Хенкинсона, Томаса и Филлипса
рк р
Tк р
M
0,006894 709,604
58,718 ; МПа,
28,96
M
170,491
307,44 / 1,8. К.
28,96
Область использования - р<40МПа; хС 5+<10моль%.
Погрешность формулы: меньше 1% при p< 25МПа;
3% при p= 25- 35МПа и 5% - от 35 до 40МПа.
17










 Химия
Химия








