Похожие презентации:
Амины. Отличительная способность аминов
1.
Презентация на тему:амины.Работа,студеньок:
Сухоруковой С.С.
Никулиной Ю.Ю.
Группы:А-913-д.
2.
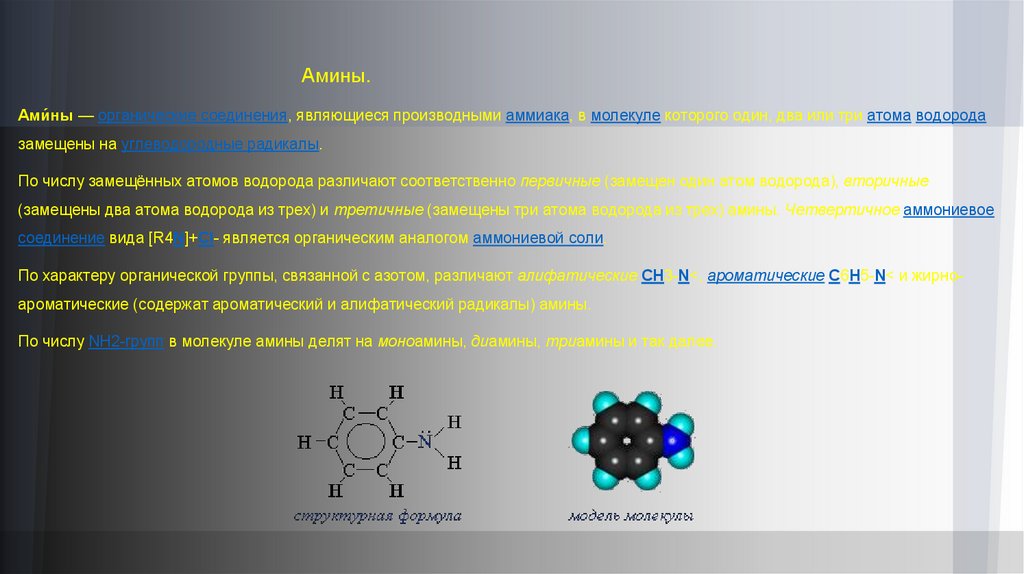
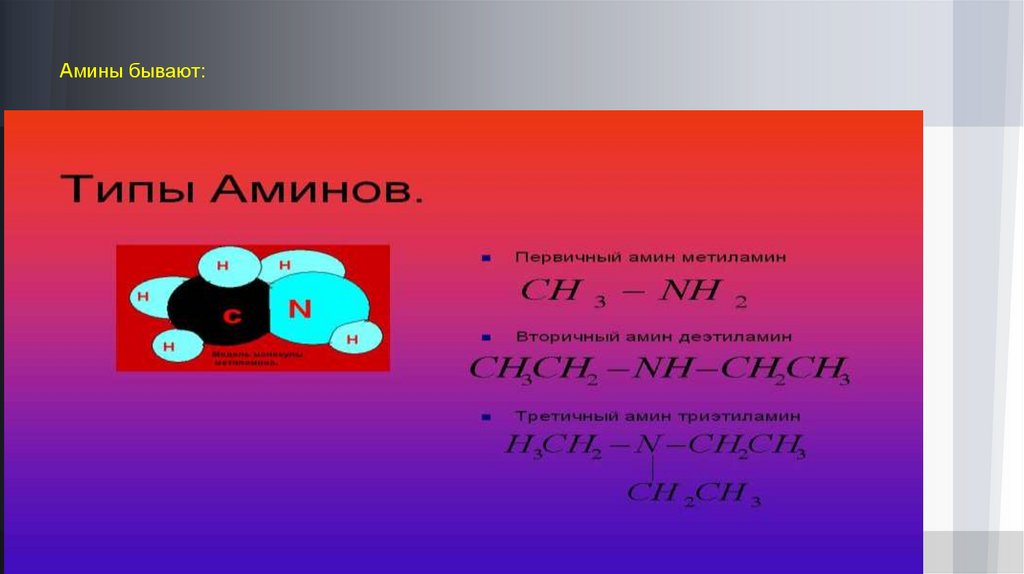
Амины.Ами́ны — органические соединения, являющиеся производными аммиака, в молекуле которого один, два или три атома водорода
замещены на углеводородные радикалы.
По числу замещённых атомов водорода различают соответственно первичные (замещен один атом водорода), вторичные
(замещены два атома водорода из трех) и третичные (замещены три атома водорода из трех) амины. Четвертичное аммониевое
соединение вида [R4N]+Cl- является органическим аналогом аммониевой соли.
По характеру органической группы, связанной с азотом, различают алифатические CH3-N<, ароматические C6H5-N< и жирноароматические (содержат ароматический и алифатический радикалы) амины.
По числу NH2-групп в молекуле амины делят на моноамины, диамины, триамины и так далее.
3.
Химические свойства.Отличительная способность аминов –
присоединять нейтральные молекулы
(например, галогеноводороды HHal, с
образованием органоаммониевых солей,
подобных аммонийным солям в
неорганической химии. Для образования
новой связи азот предоставляет
неподеленную электронную пару,
исполняя роль донора. Участвующий в
образовании связи протон Н+ (от
галогеноводорода) играет роль акцептора
(приемника), такую связь называют
донорно-акцепторной (рис. 1). Возникшая
ковалентная связь N–H полностью
эквивалентна имеющимся в амине связям
N–H.
Третичные амины также присоединяют
HCl, но при нагревании полученной соли
в растворе кислоты она распадается, при
этом R отщепляется от атома N:
(C2H5)3N + HCl ® [(C2H5)3NH]Сl
4.
[(C2H5)3NH]Сl ® (C2H5)2NH + C2H5СlПри сравнении этих двух реакций видно, что C2H5-группа и Н, как бы меняются местами, в итоге из третичного амина
образуется вторичный.
Растворяясь в воде, амины по такой же схеме захватывают протон, в результате в растворе появляются ионы ОН–, что
соответствует образованию щелочной среды, ее можно обнаружить с помощью обычных индикаторов.
C2H5NH2 + H2O ® [C2H5NH3]+ + OH–
С образованием донорно-акцепторной связи амины могут присоединять не только HCl, но и галогеналкилы RCl, при этом
образуется новая связь N–R, которая также эквивалентна уже имеющимся. Если в качестве исходного взять третичный
амин, то получается соль тетраалкиламмония (четыре группы R у одного атома N):
(C2H5)3N + C2H5I ® [(C2H5)4N]I
Эти соли, растворяясь в воде и некоторых органических растворителях, диссоциируют (распадаются), образуя ионы:
[(C2H5)4N]I ® [(C2H5)4N]+ + I–
5.
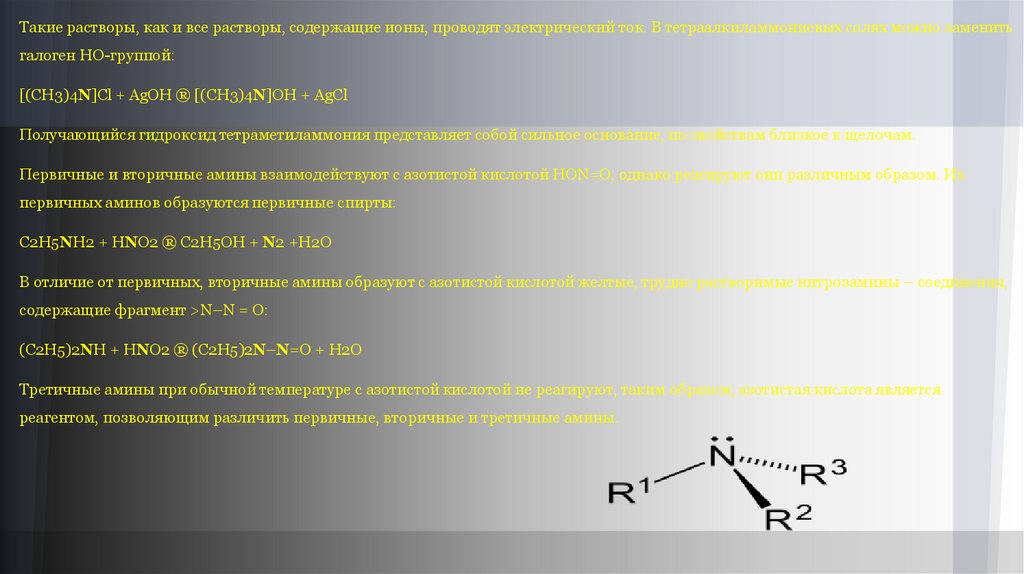
Такие растворы, как и все растворы, содержащие ионы, проводят электрический ток. В тетраалкиламмониевых солях можно заменитьгалоген НО-группой:
[(CH3)4N]Cl + AgOH ® [(CH3)4N]OH + AgCl
Получающийся гидроксид тетраметиламмония представляет собой сильное основание, по свойствам близкое к щелочам.
Первичные и вторичные амины взаимодействуют с азотистой кислотой HON=O, однако реагируют они различным образом. Из
первичных аминов образуются первичные спирты:
C2H5NH2 + HNO2 ® C2H5OH + N2 +H2O
В отличие от первичных, вторичные амины образуют с азотистой кислотой желтые, трудно растворимые нитрозамины – соединения,
содержащие фрагмент >N–N = O:
(C2H5)2NH + HNO2 ® (C2H5)2N–N=O + H2O
Третичные амины при обычной температуре с азотистой кислотой не реагируют, таким образом, азотистая кислота является
реагентом, позволяющим различить первичные, вторичные и третичные амины.
6.
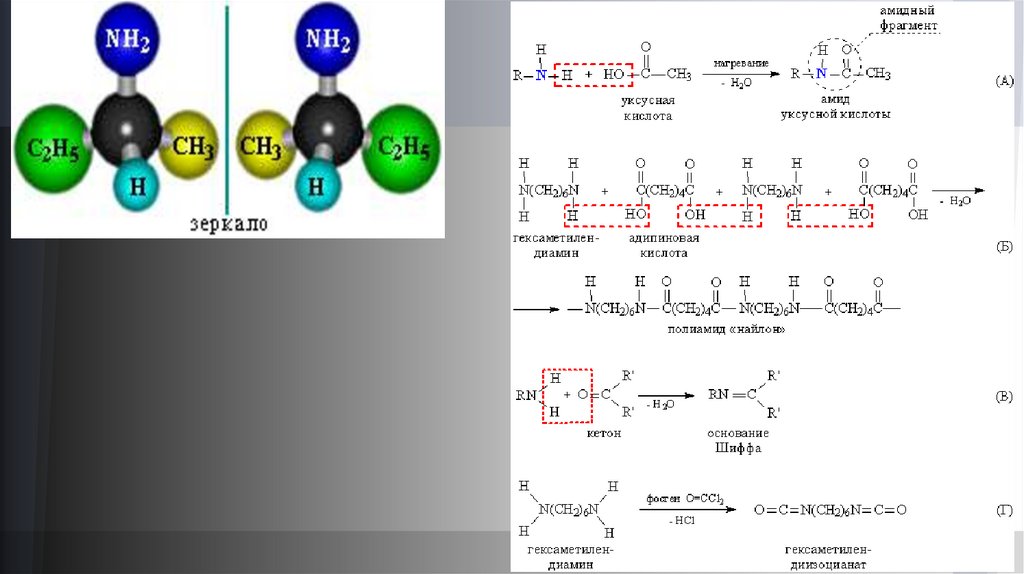
При конденсации аминов с карбоновыми кислотами образуются амиды кислот – соединения с фрагментом –С(О)N< (рис. 2А). Если вкачестве исходных соединений взять диамин и дикарбоновую кислоту (соединения, содержащие соответственно две амино- и две
карбоксильные группы, соответственно), то они взаимодействуют по такой же схеме, но поскольку каждое соединение содержит две
реагирующие группы, то образуется полимерная цепь, содержащая амидные группы (рис. 2Б). Такие полимеры называют
полиамидами.
Конденсация аминов с альдегидами и кетонами приводит к образованию так называемых оснований Шиффа – соединений,
содержащих фрагмент –N=C< (рис. 2В). На схеме В видно, что для образования двойной связи между N и С азот должен предоставить
два атома Н (для образования конденсационной воды), следовательно, в такой реакции могут участвовать только первичные амины
RNH2.
При взаимодействии первичных аминов с фосгеном Cl2С=O образуются соединения с группировкой –N=C=O, называемые
изоцианатами (рис. 2Г, получение соединения с двумя изоцианатными группами).
7.
Амины.8.
Среди ароматических аминов наиболее известен анилин (фениламин) С6Н5NH2. По свойствам он близок калифатическим аминам, но его основность выражена слабее – в водных растворах он не образует щелочную среду. Как и
алифатические амины, с сильными минеральными кислотами он может образовывать аммониевые соли [С6Н5NH3]+Сl–.
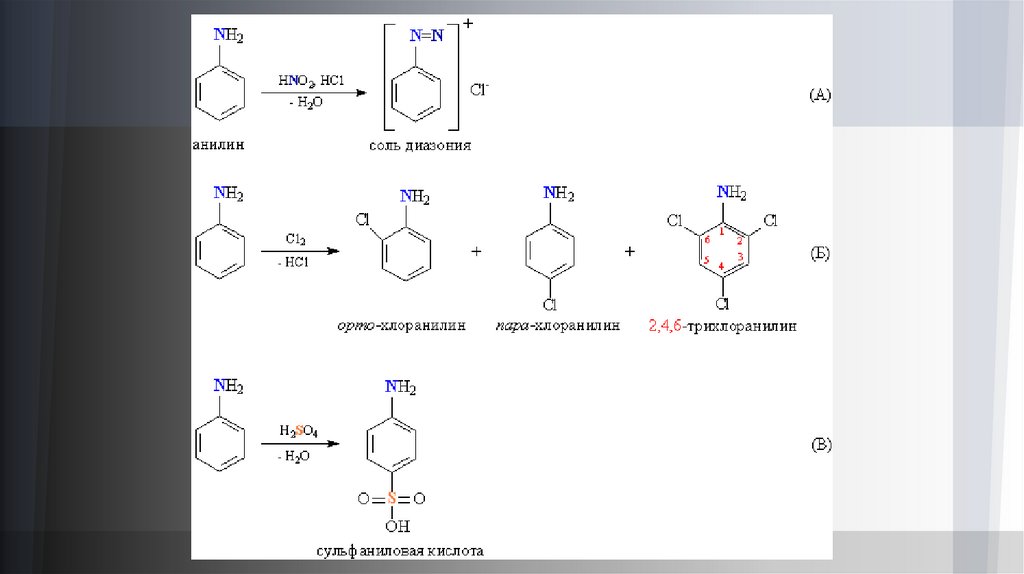
При взаимодействии анилина с азотистой кислотой (в присутствии HCl) образуется диазосоединение, содержащее
фрагмент R–N=N, оно получается в виде ионной соли, называемой солью диазония (рис. 3А). Таким образом,
взаимодействие с азотистой кислотой идет не так, как в случае алифатических аминов. Бензольное ядро в анилине
обладает реакционной способностью, характерной для ароматических соединений (см. АРОМАТИЧНОСТЬ), при
галогенировании атомы водорода в орто- и пара-положениях к аминогруппе замещаются, получаются хлоранилины с
различной степенью замещения (рис. 3Б). Действие серной кислоты приводит к сульфированию в пара-положение к
аминогруппе, образуется так называемая сульфаниловая кислота (рис. 3В).
9.
10.
Амины бывают:11.
Методы синтеза аминов.Восстановление:
Восстановление нитросоединений. Применяется главным образом для получения первичных ароматических аминов:
ArNO2 + 3Н2 → ArNH2 + 2Н2O.
Наиболее распространено каталитич. восстановление водородом (кат. - Ni, Pt или Pd) в жидкой или паровой фазе,
однако еще достаточно широко в качестве восстановителей используются металлы (Fe или Zn) и сульфиды щелочных
металлов.
Восстановление нитрозосоединений, азосоединений, гидразосоединений, органических азидов, гидроксиламинов, Nокисей, нитрозаминов металлами в кислой среде (железом, цинком, оловом) или щелочной среде (алюминий), водородом
над катализатором, алюмогидридом лития, Na2S2O4 или другими восстановителями.
Восстановление нитрилов водородом в присутствии катализатора (кат. - Ni или Со) при 100-130 °С и 0,1-10 МПа или
комплексными гидридами металлов. С хорошими выходами получаются первичные амины с примесью вторичных. Этот
метод применяется главным образом для произ-ва высших первичных и вторичных алифатич. аминов нормального
строения.
Восстановление амидов, гидразидов, изоцианатов алюмогидридом лития, дибораном.
Восстановление оксимов и гидразонов водородом в присутствии катализатора.
Восстановительное аминирование альдегидов и кетонов амином и водородом в присутствии катализатора.
RCHO + R'NH2 + H2 → RCH2NHR' + H2O
Бензиламин получается из бензальдегида, аммиака и водорода при 90 °С над никелем Ренея с выходом 89%.
12.
Восстановительное аминирование альдегидов и кетонов муравьиной кислотой (или формамидом) и амином (реакцияЛейкарта-Валлаха и Эшвейлера-Кларке).
R2CO + NH3 + HCOOH → R2CHNH2 + CO2 + H2O
Восстановлением азотистых гетероциклов получают циклические амины.
Восстановление вторичных и третичных бензиламинов водородом, с отщеплением бензильной группы.
Восстановление четвертичных аммонийных солей до третичных аминов, например, алюмогидридом лития, смесью
муравьиной кислоты с формиатом калия, фенилмеркаптидом натрия.
Гидролиз или сольволиз:
Гидролиз амидов и имидов.
RCONHR' + H2O → RCOOH + R'NH2
Гидролиз сульфамидов.
Гидролиз мочевин, уретанов, изоцианатов и изотиоцианатов.
Гидролиз N-цианамидов.
R2NCN + 2H2O → R2NH + CO2 + NH3
Гидролизом четвертичных солей имидов (алкилированных оснований Шиффа) получаются вторичные амины.
Гидролиз третичного 4-нитрозофениламина в щелочной среде (получение чистых вторичных аминов).
ONC6H4NR2 + H2O → ONC6H4OH + HNR2
13.
Обменные реакции:Реакция алкилгалогенидов с аминами.
Реакция алкилгалогенидов с амидами металлов.
Реакцией фталимида калия с алкилгалогенидами с последующим гидролизом (реакция Габриеля) получают чистые первичные
алифатические амины. Для ускорения реакции с алкилгалогенидом используют ДМФА как растворитель или добавление краун-эфира. Nалкилфталимид гидролизуют обычно при кислотном катализе, также используют расщепление гидразином, сульфидом натрия в водном ТГФ
или ацетоне, 40% метиламином.
Реакция алкилгалогенидов с уротропином, с дальнейшим распадом уротропиновой соли (реакция Делепина). Метод наиболее пригоден для
таких активных субстратов, как аллил-, бензилгалогениды, α-галогенкетоны, первичные иодиды.
Реакция алкилгалогенида с гуанидином, с последующим щелочным гидролизом.
Реакция алкилгалогенидов с солями сульфонамидов с последующим гидролизом.
Реакция активированных арилгалогенидов (чаще всего с нитро- или сульфогруппами) с аммиаком и аминами. Таким способом получают
различные нитроанилины и производные дифениламина. Аммонолиз и аминолиз арилгалогенидов с неактивированным галогеном требует
применения соединений Сu в качестве катализаторов.
Реакция алкилсульфонатов с аминами или аммиаком.
Реакция фенолов с аминами или аммиаком (реакция Бухерера).
Реакция активированных простых эфиров, тиоэфиров или лактонов и аминов.
Взаимодействие спиртов с аммиаком (аммонолиз спиртов) в присутствии катализаторов дегидратации (напр., Аl2О3, SiO2, ThO2,
алюмосиликатов, фосфатов металлов) при 300-500°С и 1-20 МПа. При этом образуются смеси первичных, вторичных и третичных аминов;
одновременно происходит диспропорционирование аминов. Этот метод применяется для производства низших алифатич. аминов, и прежде
всего метил- и этиламинов. Синтез сопровождается образованием значит, кол-в побочных продуктов - олефинов. При использовании вместо
NH3 первичных или вторичных аминов получаются вторичные и (или) третичные амины. Этот метод (аминолиз) распространен для произ-ва
N-алкил- и N,N-диалкиланилинов. Разработан аналогичный способ получения анилина взаимодействием фенола с аммиаком.
14.
Присоединение и конденсации:Присоединение аминов к ненасыщенным соединениям. Например, стирол присоединяет анилин в присутствии
металлического натрия и следов двухвалентного железа давая N,2-дифенилэтиламин с выходом 65-75%.
Вторичные амины конденсируются с альдегидами, давая замещенные диамины.
Конденсация соединений с активной метиленовой группой с формальдегидом и вторичным амином (реакция Манниха).
Конденсация спиртов, параформа и вторичным аминов с образованием аминоэфиров.
Реакция эпоксидов с аминами и аммиаком с образованием аминоспиртов.
Реакция реактивов Гриньяра с нитрилами с последующим восстановлением имина.
Реакция реактивов Гриньяра с оксимами, основаниями Шиффа.
Алкилирование аминов диазосоединениями в присутствии катализатора (CuCN или BF3). При использовании диазометана
происходит метилирование аминов.
15.
Перегруппировки:Оксимы кетонов или их сложные эфиры перегруппировываются в кислой среде в амиды, которые гидролизуются до аминов
(реакция Бекмана).
Гидразоны кетонов перегруппировываются под действием азотистой кислоты в амиды, которые гидролизуются до аминов
(реакция Пирсона).
N-Галогенимины кетонов перегруппировываются под действием пентахлорида сурьмы или ионов серебра в амиды,
которые гидролизуются до аминов (реакция Тэйлекера).
Кетоны перегруппировываются под действием азотистоводородной кислоты в амиды, которые гидролизуются до аминов
(реакция Шмидта).
Гидроксамовые кислоты под действием кислот перегруппировываются в изоцианат, который гидролизуется в амин
(перегруппировка Лоссена).
Гидразиды кислот под действием азотистой кислоты или ацилазиды перегруппировываются в изоцианат, который
гидролизуется в амин (перегруппировка Курциуса).
Амиды кислот под действием гипогалогенитов или N-галогенамиды кислот перегруппировываются в изоцианат, который
гидролизуется в амин (реакция Гофмана).
Карбоновые кислоты под действием азотистоводородной кислоты перегруппировываются в изоцианат, который
гидролизуется в амин (перегруппировка Шмидта).
Ароматизация оксимов циклических кетонов до ароматическим аминов (реакция ароматизации Соммлера-Вольфа).
Бензидиновая перегруппировка гидразобензолов.
Перегруппировка четвертичных солей бензилтриалкиламмония под действием амида натрия.
Эфиры N,N-диалкилсульфаминовой кислоты при нагревании перегруппировываются цвиттер-ион, гидролиз которого дает
третичный амин.
16.
1.Разложение:2.Термическое разложение гидробромидов арилдиалкиламинов дает вторичные и первичные
ароматические амины.
3.Осторожное разложение ацетатов четвертичных аммонийных солей при нагревании в
апротонном растворителе.
4.Нитрозирование третичных аминов дает нитрозамины, которые разлагают во вторичные
амины.
5.Бромциан деметилирует третичные амины давая N-цианамиды, которые разлагают до
вторичных аминов (реакция Брауна).
6.Декарбоксилирование альфа-аминокислот.
17.
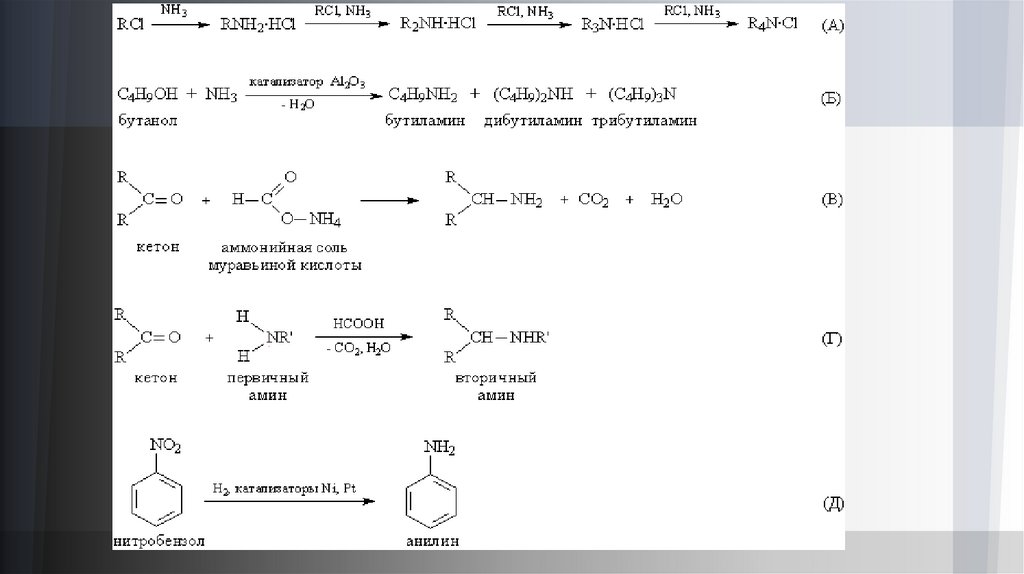
Получение аминов.При взаимодействии аммиака с галогеналкилами, например RCl, образуется смесь первичных, вторичных и
третичных аминов. Образующийся побочный продукт HCl присоединяется к аминам, образуя аммониевую
соль, но при избытке аммиака соль разлагается, что позволяет проводить процесс вплоть до образования
четвертичных аммониевых солей (рис. 4А). В отличие от алифатических галогеналкилов, арилгалогениды,
например, С6Н5Cl, реагируют с аммиаком с большим трудом, синтез возможен только при катализаторах,
содержащих медь. В промышленности алифатические амины получают каталитическим взаимодействием
спиртов с NH3 при 300–500° С и давлении 1–20 МПа, в результате получают смесь первичных, вторичных и
третичных аминов(рис. 4Б).
При взаимодействии альдегидов и кетонов с аммонийной солью муравьиной кислоты HCOONH4 образуются
первичные амины (рис. 4В), а реакция альдегидов и кетонов с первичными аминами (в присутствии
муравьиной кислоты НСООН) приводит к вторичным аминам (рис. 4Г).
Нитросоединения (содержащие группу –NO2) при восстановлении образуют первичные амины. Этот метод,
предложенный Н.Н.Зининым, мало применяется для алифатических соединений, но важен для получения
ароматических аминов и лег в основу промышленного производства анилина (рис. 4Д).
18.
19.
Как отдельные соединения амины применяются мало, например, в быту используется полиэтиленполиамин [-C2H4NH-]n (торговое названиеПЭПА) как отвердитель эпоксидных смол. Основное применение аминов – как промежуточные продукты при получении различных
органических веществ. Ведущая роль принадлежит анилину, на основе которого производится широкий спектр анилиновых красителей, причем
цветовая «специализация» закладывается уже на стадии получения самого анилина. Сверхчистый анилин без примеси гомологов называют в
промышленности «анилин для синего» (имеется в виду цвет будущего красителя). «Анилин для красного» должен содержать, помимо анилина,
смесь орто- и пара-толуидина (СН3С6Н4NH2).
Алифатические диамины – исходные соединения для получения полиамидов, например, найлона (рис. 2), широко применяемого для
изготовления волокон, полимерных пленок, а также узлов и деталей в машиностроении (полиамидные зубчатые передачи).
Из алифатических диизоцианатов (рис. 2) получают полиуретаны, которые обладают комплексом технически важных свойств: высокой
прочностью в сочетании с эластичностью и очень высоким сопротивлением истиранию (полиуретановые обувные подошвы), а также хорошей
адгезией к широкому кругу материалов (полиуретановые клеи). Широко их применяют и во вспененной форме (пенополиуретаны).
На основе сульфаниловой кислоты (рис. 3) синтезируют противовоспалительные лекарственные препараты сульфаниламиды.
Соли диазония (рис. 2) применяют в фоточувствительных материалах для светокопирования, которое позволяет получать изображение, минуя
обычную галоидосеребряную фотографию
20.
Литература:Грандберг И.И. Органическая химия. Дрофа, 2003
Бюлер К., Пирсон Д. Органические синтезы т.1 М. 1973. - С. 469-581 (способы синтеза)
Марч Дж. Органическая химия: реакции, механизмы и структура. - Т. 2. - М.: Мир, 1987
Реутов О.А., Курц А.Л., Бутин К.П. Органическая химия. - Ч.3. - М.: Бином. Лаборатория знаний, 2004. - С. 273-324
Химическая энциклопедия. - Т.1, абл-дар. - М.: Советская энциклопедия, 1988. - С. 147-149














 Химия
Химия








