Похожие презентации:
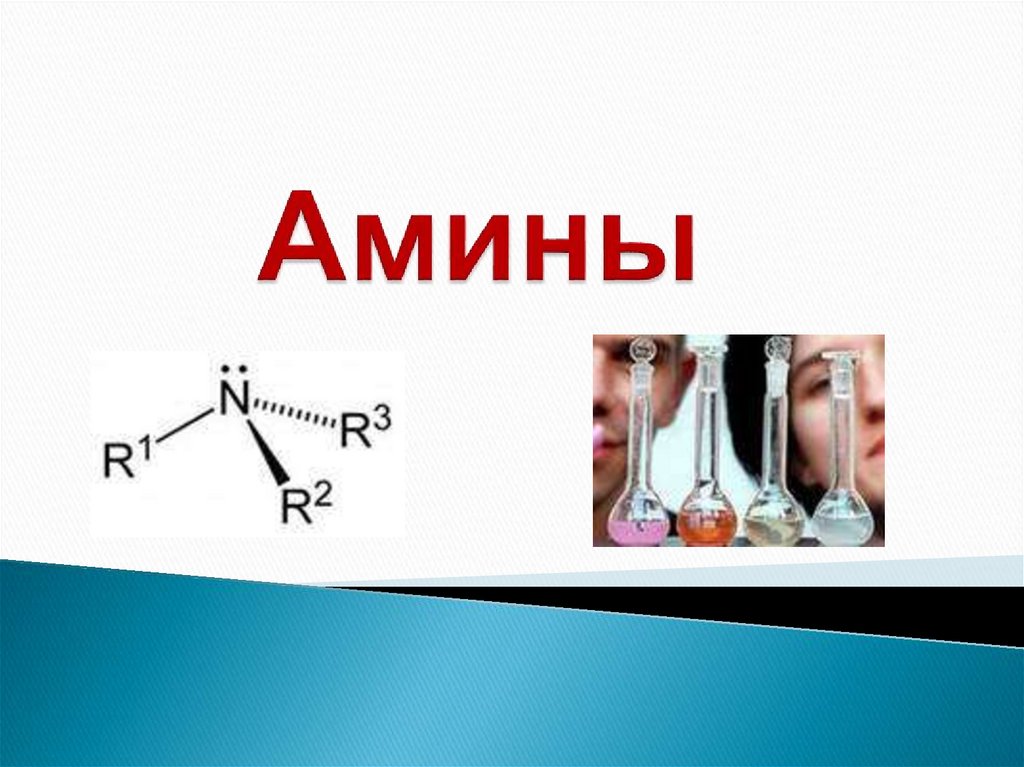
Амины
1. Амины
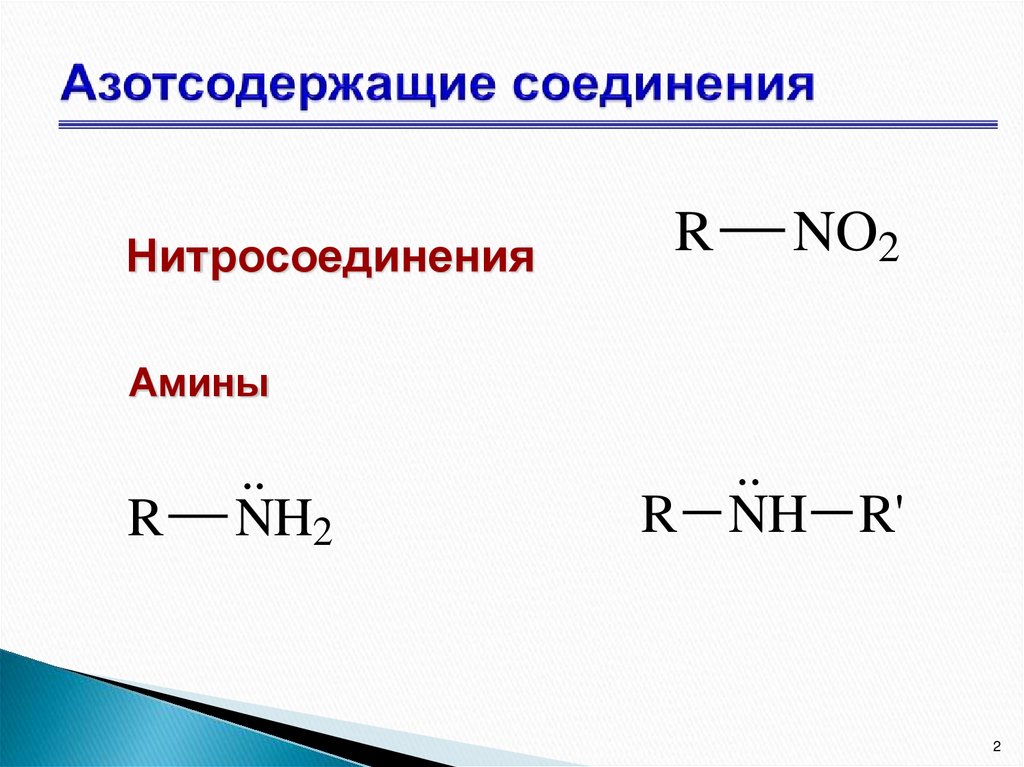
2. Азотсодержащие соединения
НитросоединенияR
NO2
Амины
R
..
NH2
..
R NH R'
2
3.
Амины – органические производныеаммиака NH3, в молекуле которого один,
два или три атома водорода замещены на
углеводородные радикалы:
RNH2,
R2NH,
R3N
Простейший представитель –
метиламин:
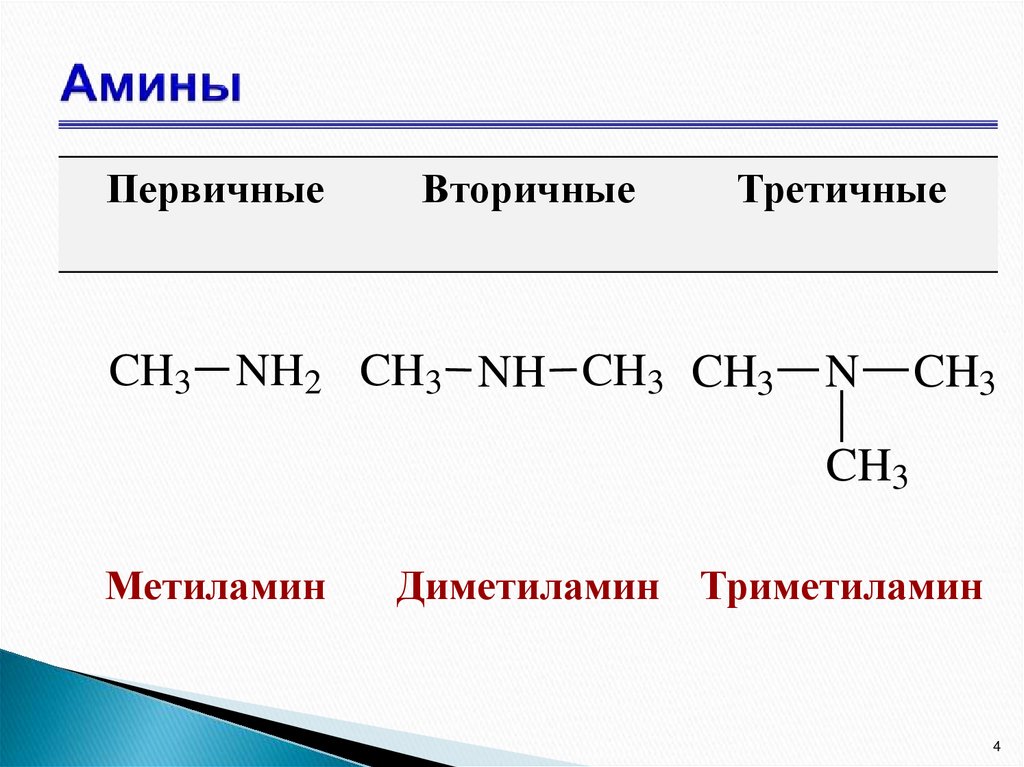
4. Амины
ПервичныеВторичные
Третичные
CH3 NH2 CH3 NH CH3 CH3
N
CH3
CH3
Метиламин
Диметиламин Триметиламин
4
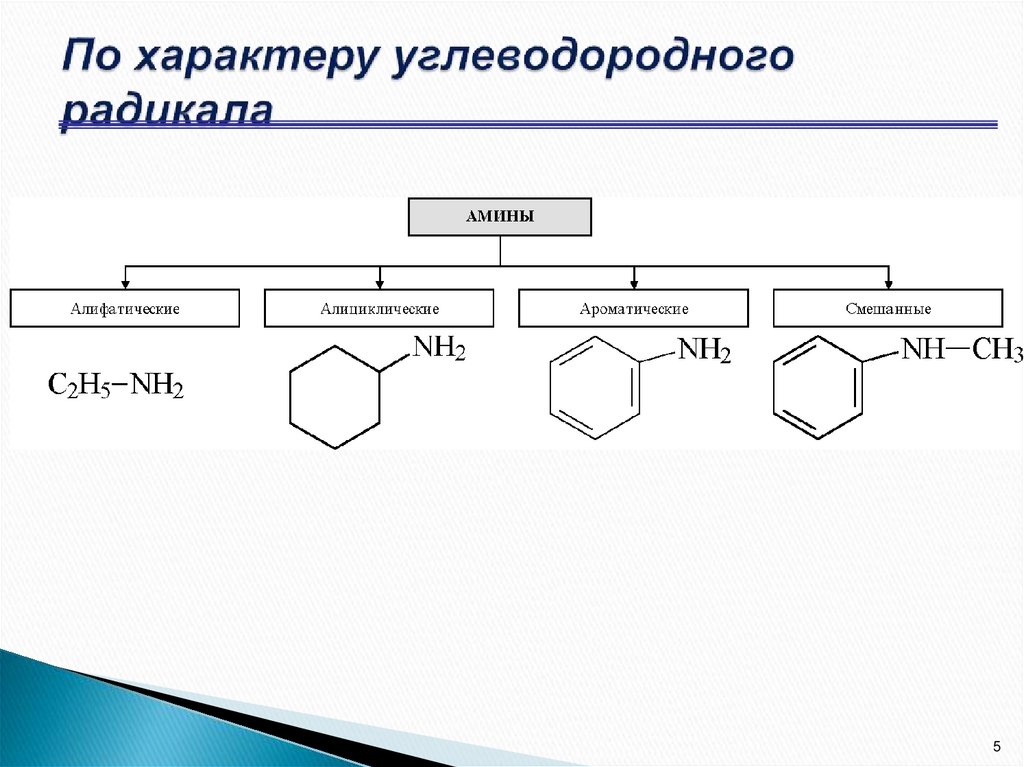
5. По характеру углеводородного радикала
56. Номенклатура аминов
В большинстве случаев названия аминов образуютиз названий углеводородных радикалов и суффикса
амин:
CH3-NH2 Метиламин
CH3-CH2-NH2 Этиламин
Различные радикалы перечисляются в
алфавитном порядке:
CH3-CH2-NH-CH3
Метилэтиламин
7. Номенклатура аминов
При наличии одинаковыхрадикалов используют
приставки ди и три:
(CH3)2NH Диметиламин
(CH3)3N
(триметиламин)
8. Амины
Номенклатура и изомерияH2NCH2CH2CH2CH2NH2
H2NCH2CH2CH2CH2CH2NH2
бутандиамин-1,4
пентандиамин-1,5
8
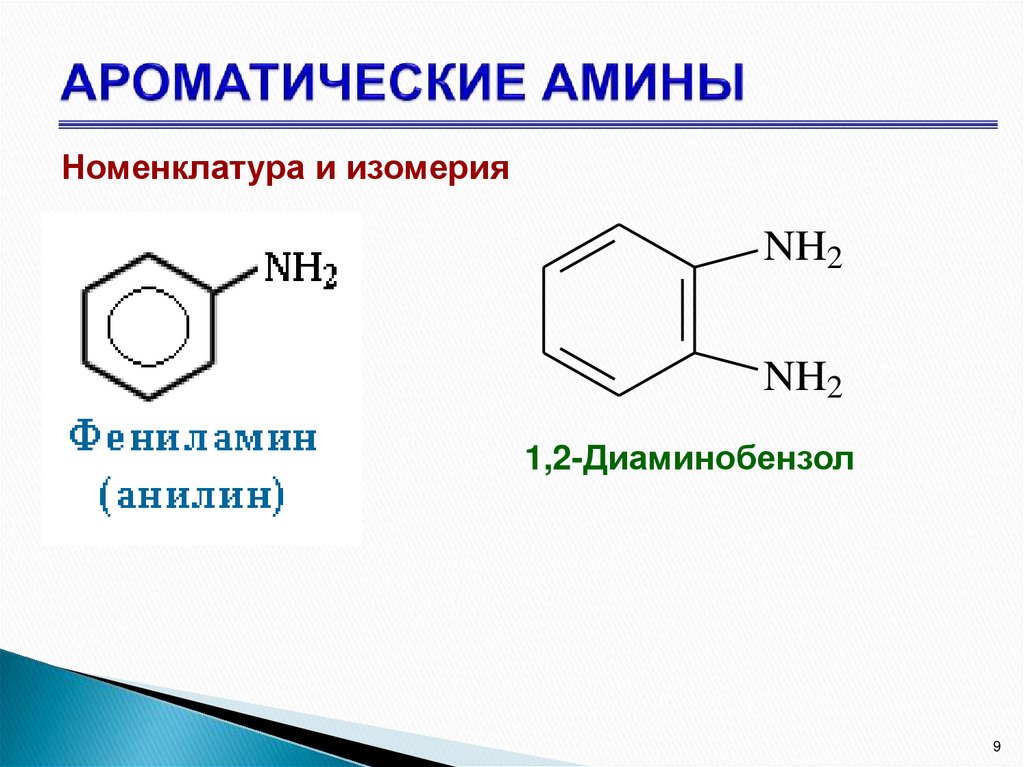
9. АРОМАТИЧЕСКИЕ Амины
Номенклатура и изомерияNH2
NH2
1,2-Диаминобензол
9
10. АРОМАТИЧЕСКИЕ Амины
Номенклатура и изомерияNH2
NO2
2-Нитроанилин
(о-нитроанилин)
2-аминотоуол
(о-аминотолуол,
о-толуидин)
10
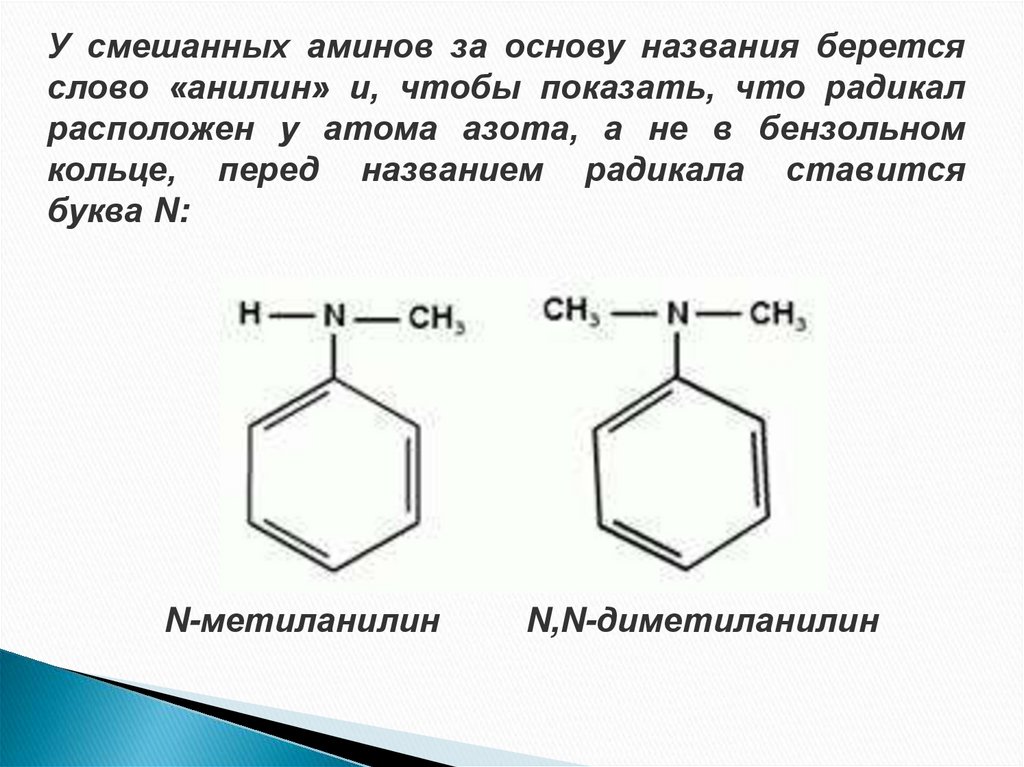
11.
У смешанных аминов за основу названия беретсяслово «анилин» и, чтобы показать, что радикал
расположен у атома азота, а не в бензольном
кольце, перед названием радикала ставится
буква N:
N-метиланилин
N,N-диметиланилин
12. Изомерия аминов
1.Структурная изомерия -
углеродного скелета, начиная с
С4H9NH2:
13. Изомерия аминов
Структурная изомерия - положенияаминогруппы, начиная с С3H7NH2:
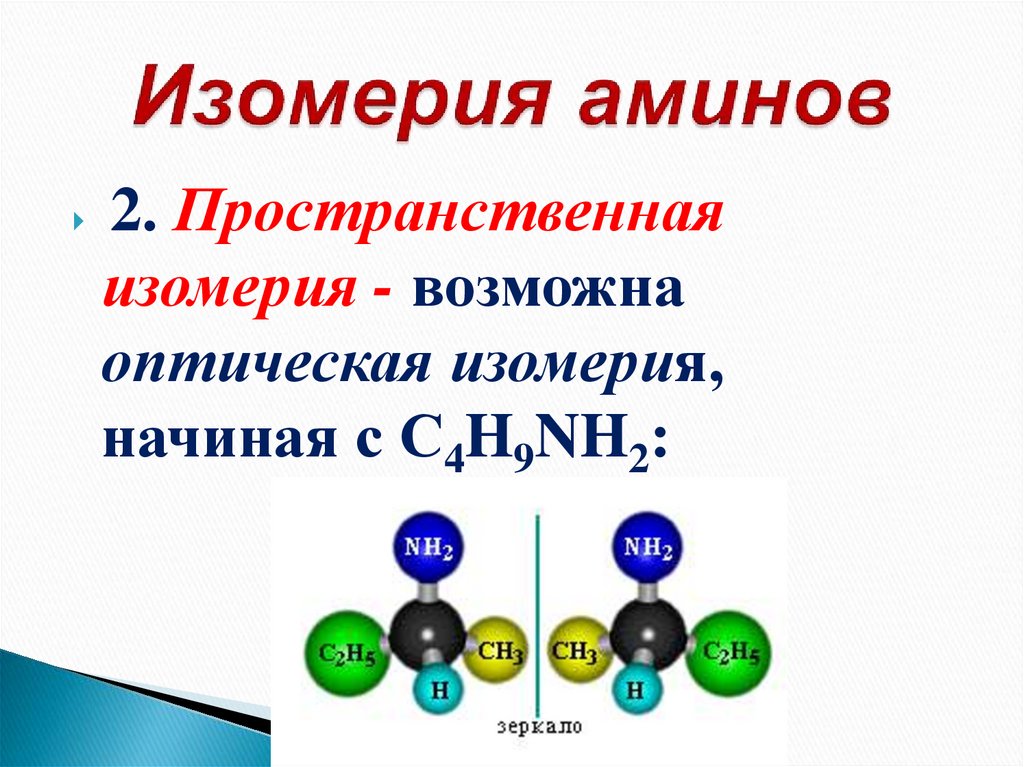
14. Изомерия аминов
2. Пространственнаяизомерия - возможна
оптическая изомерия,
начиная с С4H9NH2:
15. Физические свойства аминов
Связь N–H является полярной,поэтому первичные и вторичные
амины образуют межмолекулярные
водородные связи:
16. Физические свойства аминов
Это объясняет относительновысокую температуру кипения
аминов по сравнению с
неполярными соединениями со
сходной молекулярной массой.
Например:
17. Физические свойства аминов
Третичные амины не образуютассоциирующих водородных связей
(отсутствует группа N–H). Поэтому
их температуры кипения ниже, чем
у изомерных первичных и
вторичных аминов (триэтиламин
кипит при 89 °С,
а н-гексиламин – при 133 °С).
18. Физические свойства аминов
При обычной температуре только низшиеалифатические амины CH3NH2, (CH3)2NH и
(CH3)3N – газы (с запахом аммиака),
средние гомологи –
жидкости (с резким
рыбным запахом),
высшие –
твердые вещества без запаха.
Ароматические амины – бесцветные
высококипящие жидкости или твердые
вещества.
19.
20.
Как и аммиак, амины обладают основнымисвойствами, их растворы окрашивают
лакмусовую бумажку в синий цвет.
1. В реакции с водой амины образуют гидроксиды
алкиламмония, которые аналогичны гидроксиду
аммония.
Анилин с водой не реагирует, так как является
слабым основанием.
+
_
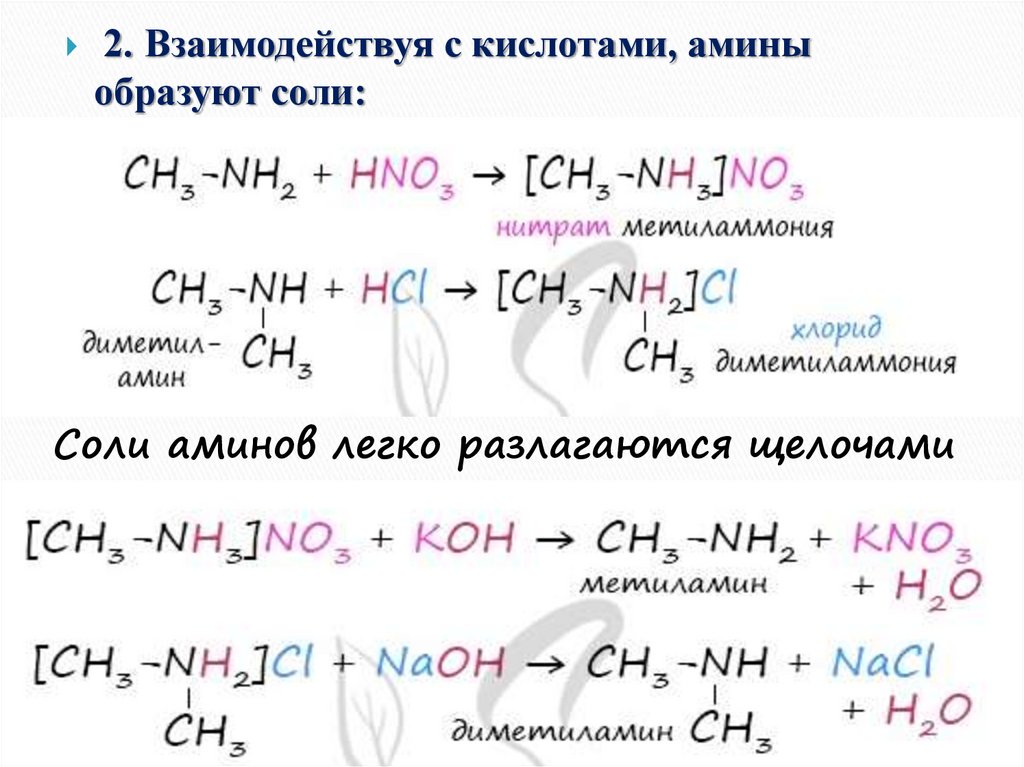
21.
2. Взаимодействуя с кислотами, аминыобразуют соли:
Соли аминов легко разлагаются щелочами
22.
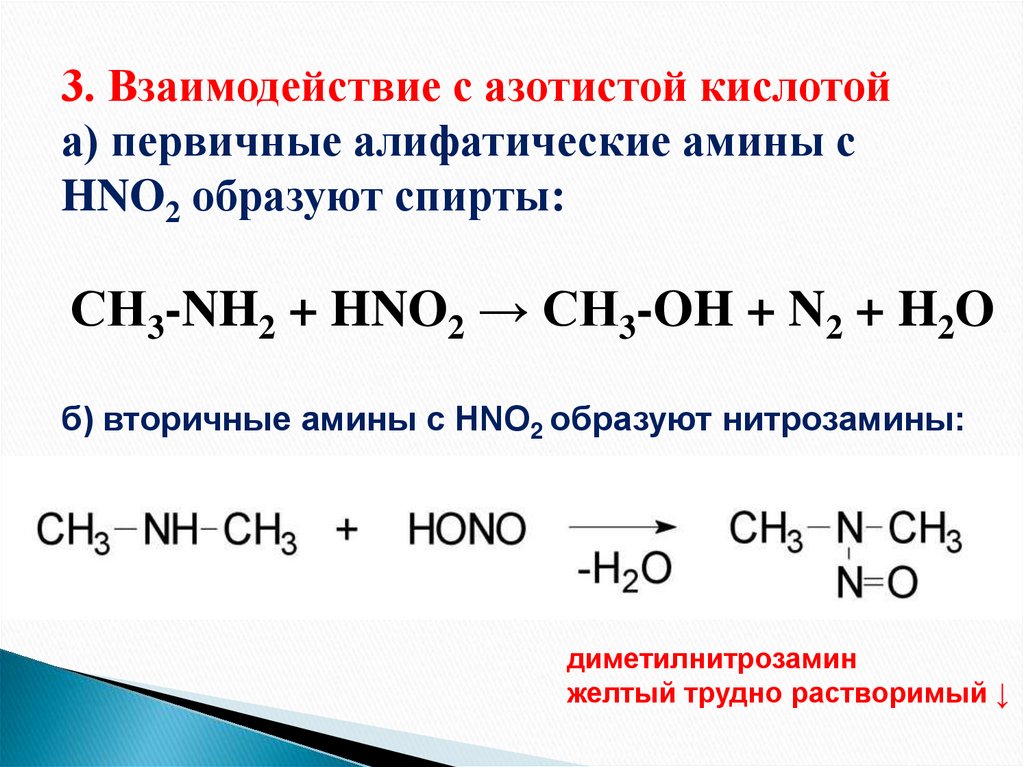
3. Взаимодействие с азотистой кислотойа) первичные алифатические амины c
HNO2 образуют спирты:
СН3-NH2 + HNO2 → СН3-OH + N2 + H2O
б) вторичные амины c HNO2 образуют нитрозамины:
диметилнитрозамин
желтый трудно растворимый ↓
23.
4. Реакция горения (полного окисления)В отличие от аммиака, низшие
газообразные амины способны
воспламеняться от открытого пламени.
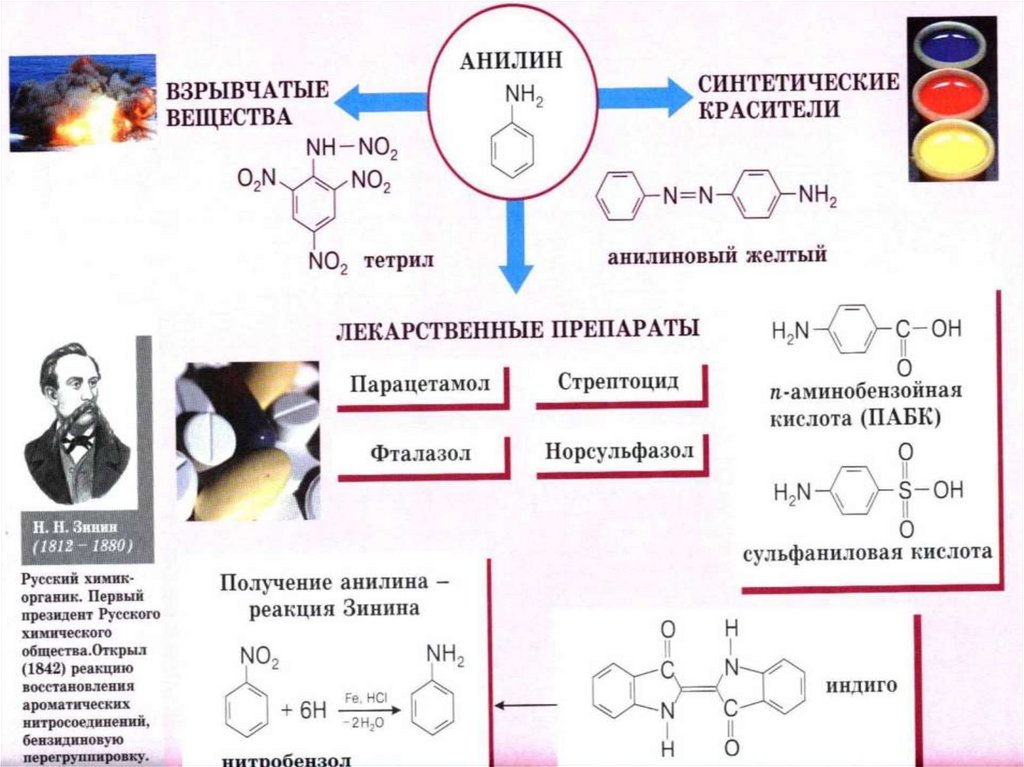
24. Анилин
(фениламин)С6H5NH2 – важнейший из
ароматических аминов:
25. Анилин
представляет собой бесцветнуюмаслянистую жидкость с характерным
запахом (т. кип. 184 °С, т. пл. – 6 °С). На
воздухе быстро окисляется и приобретает
красно-бурую окраску.
Ядовит!
26. Анилин
Для анилина характерны реакции как поаминогруппе, так и по бензольному кольцу.
Особенности этих реакций обусловлены
взаимным влиянием атомов.
С одной стороны, бензольное кольцо ослабляет
основные свойства аминогруппы по сравнению
алифатическими аминами и даже с аммиаком.
С другой стороны, под влиянием аминогруппы
бензольное кольцо становится более активным
в реакциях замещения, чем бензол.
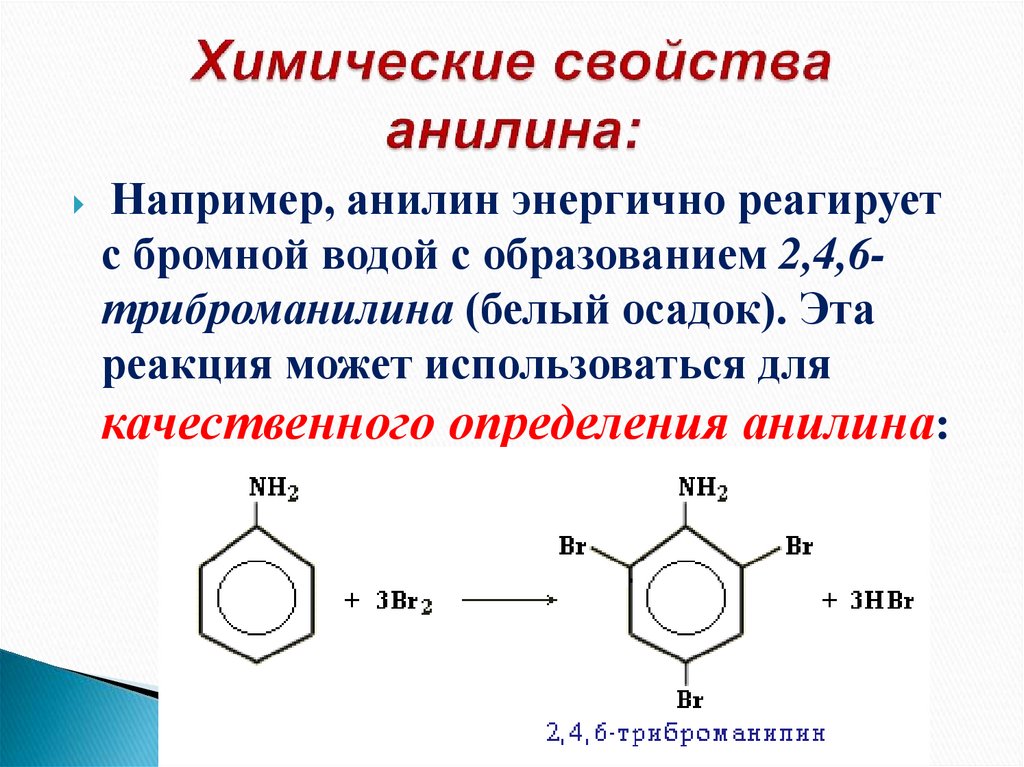
27. Химические свойства анилина:
Например, анилин энергично реагируетс бромной водой с образованием 2,4,6триброманилина (белый осадок). Эта
реакция может использоваться для
качественного определения анилина:
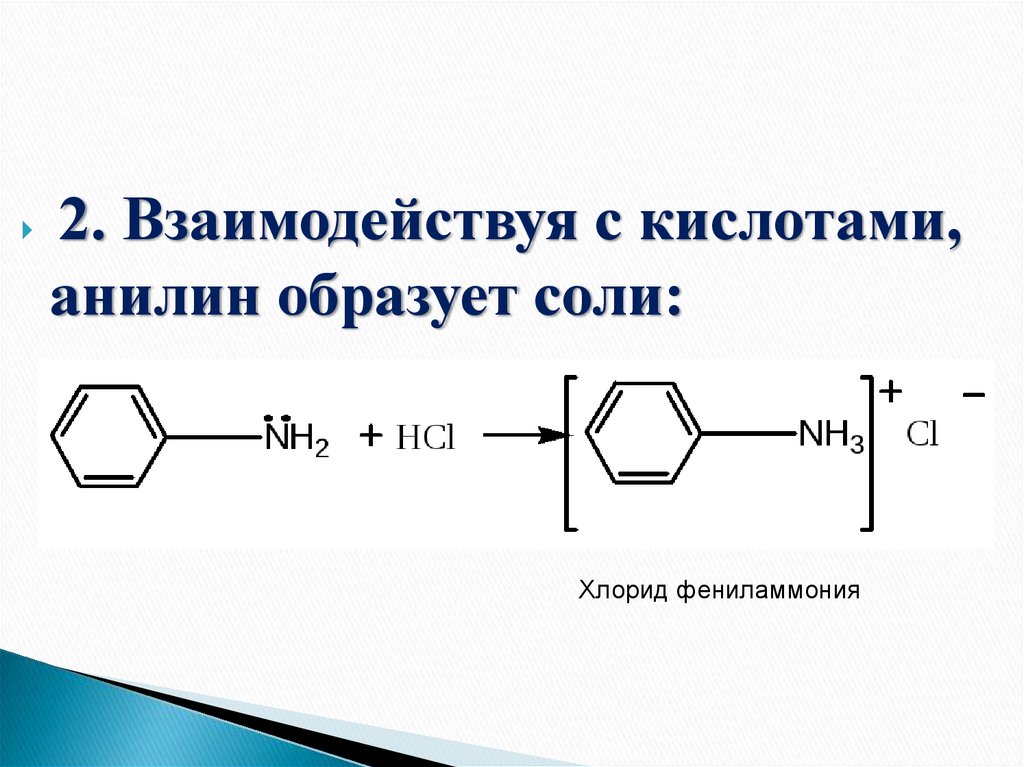
28.
2. Взаимодействуя с кислотами,анилин образует соли:
Хлорид фениламмония
29. 3. Реакция горения анилина
4C6H5NH2 + 31 O2 = 24 CO2 + 2N2 + 14 H2O4. С азотистой кислотой образуются диазосоединения:
C6H5NH2 + NaNO2 + 2HCl →
+
–
[C6H5-N≡N] Cl + NaCl + 2H2O.
хлорид фенилдиазония
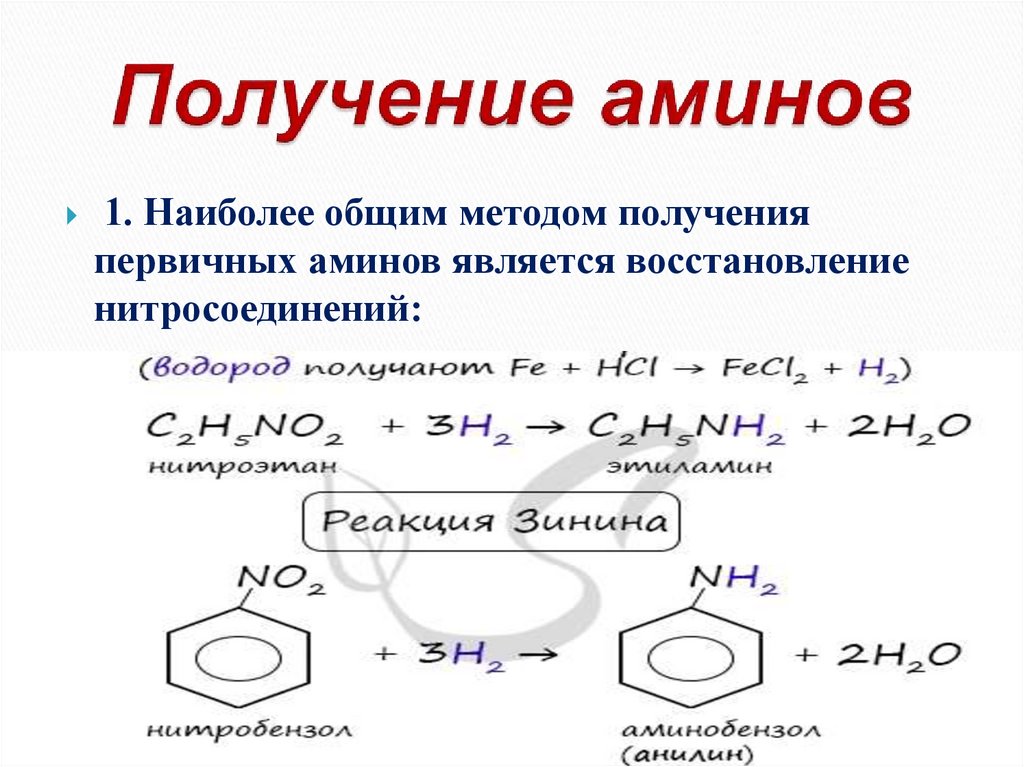
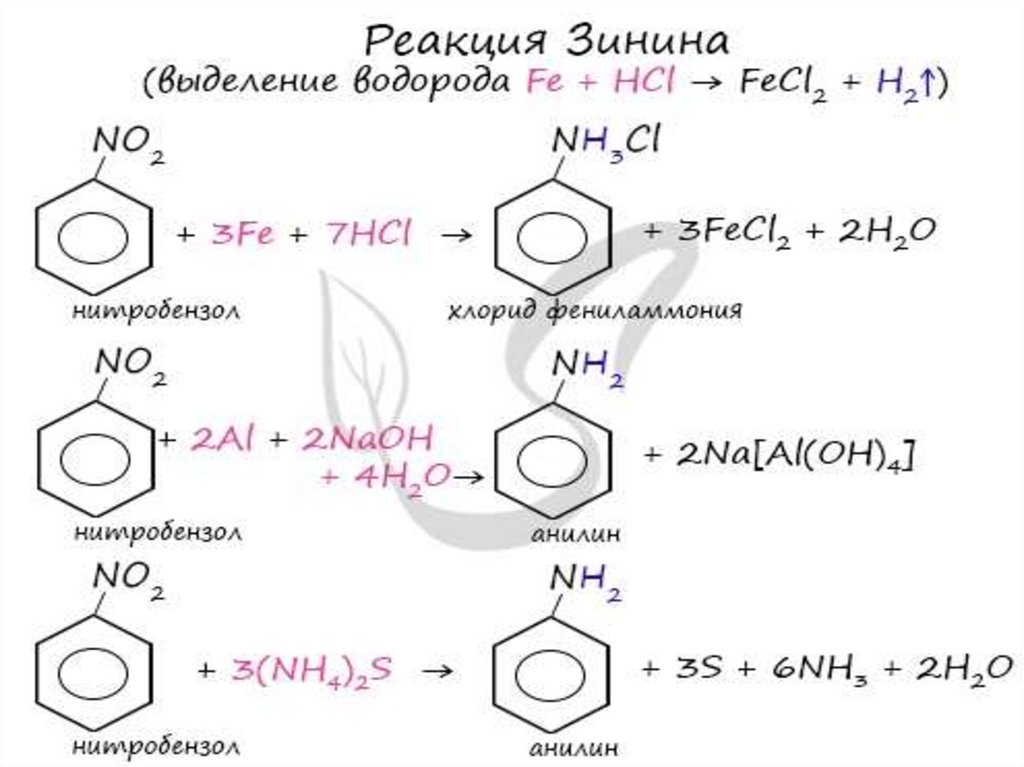
30. Получение аминов
1. Наиболее общим методом полученияпервичных аминов является восстановление
нитросоединений:
31.
32.
2. Нагревание галогеналканов с аммиаком33.
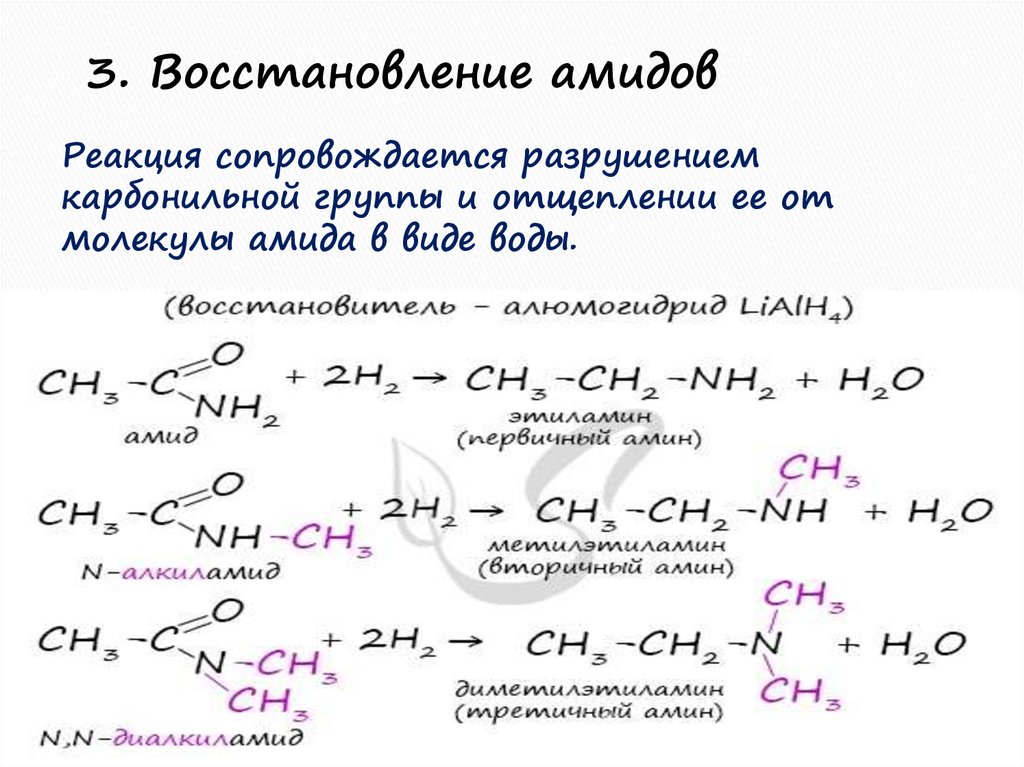
3. Восстановление амидовРеакция сопровождается разрушением
карбонильной группы и отщеплении ее от
молекулы амида в виде воды.
34.
4. Восстановление нитриловЭтим способом в промышленности
получают гексаметилендиамин,
используемый в изготовлении волокна нейлон.
35.
5. В промышленности амины получаютреакцией аммиака со спиртами, в ходе
которой происходит замещение
гидроксогруппы на аминогруппу.
36.
6. Превращение амидов карбоновых к-т впервичные амины с элиминированием СО2,
происходящее под действием
гипогалогенитов щелочных
металлов (перегруппировка Гофмана,
расщепление амидов по Гофману):
37.
38.
39.
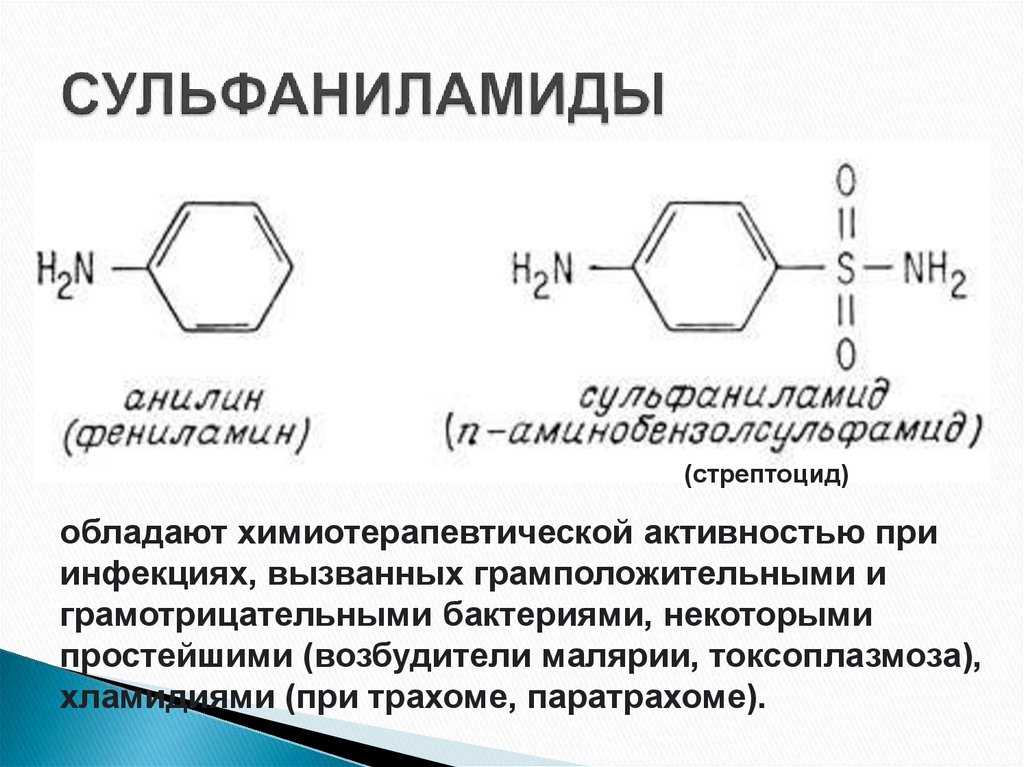
40. СУЛЬФАНИЛАМИДЫ
(стрептоцид)обладают химиотерапевтической активностью при
инфекциях, вызванных грамположительными и
грамотрицательными бактериями, некоторыми
простейшими (возбудители малярии, токсоплазмоза),
хламидиями (при трахоме, паратрахоме).
41.
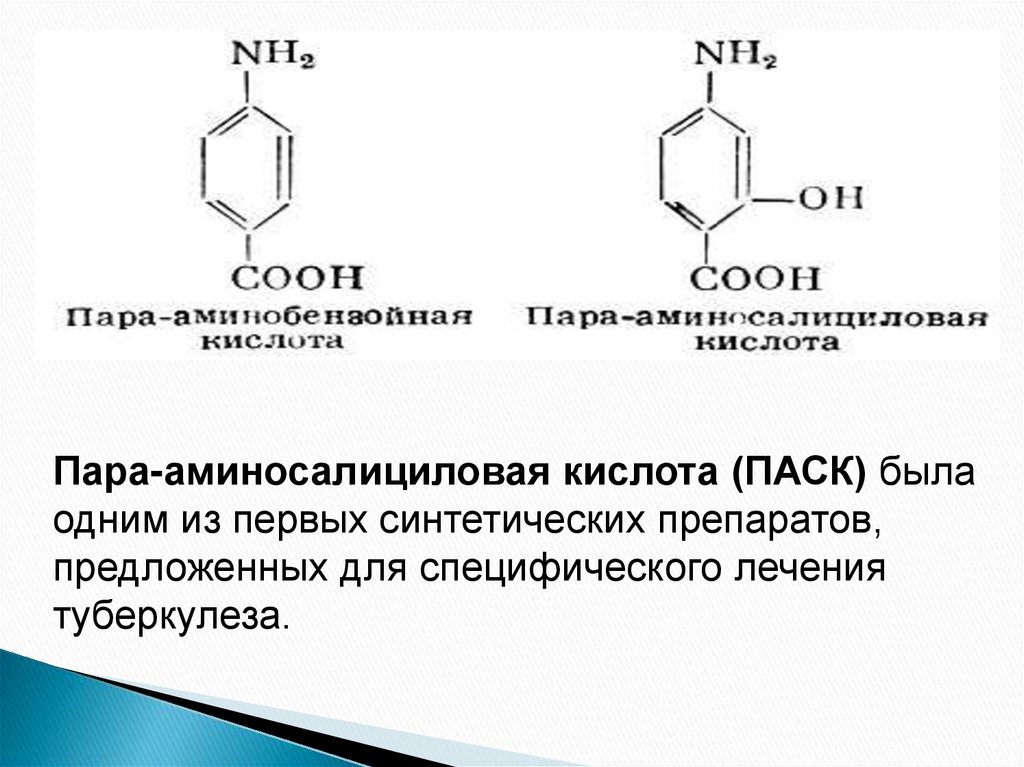
Пара-аминосалициловая кислота (ПАСК) былаодним из первых синтетических препаратов,
предложенных для специфического лечения
туберкулеза.
42.
1. Назовите следующие вещества:а) СН3-СН-NH2
│
СН3
NH2
│
в) СН3-С-СН2-СН3
│
СН3
б) (C2H5)3N
г) СН3-СН2-NH-СН3
;
43.
2. Напишите структурныеследующих веществ:
формулы
а) 2-амино-2,3,3-триметилгексан,
б) диметилэтиламин,
в) 2-амино-2,3-диметил-4-этилоктан



























 Химия
Химия








