Похожие презентации:
Азотная кислота HNO3
1. Азотная кислота
Презентация к уроку химииЛицей КГТУ имени И. Раззакова
Карпенко Наталья Анатольевна
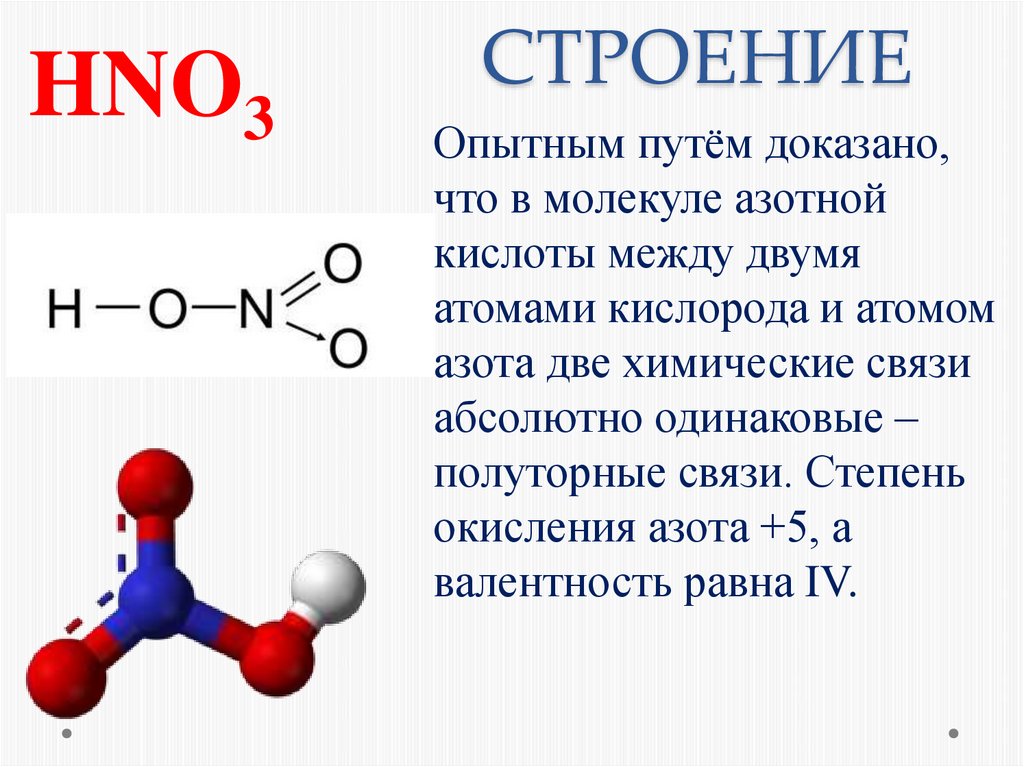
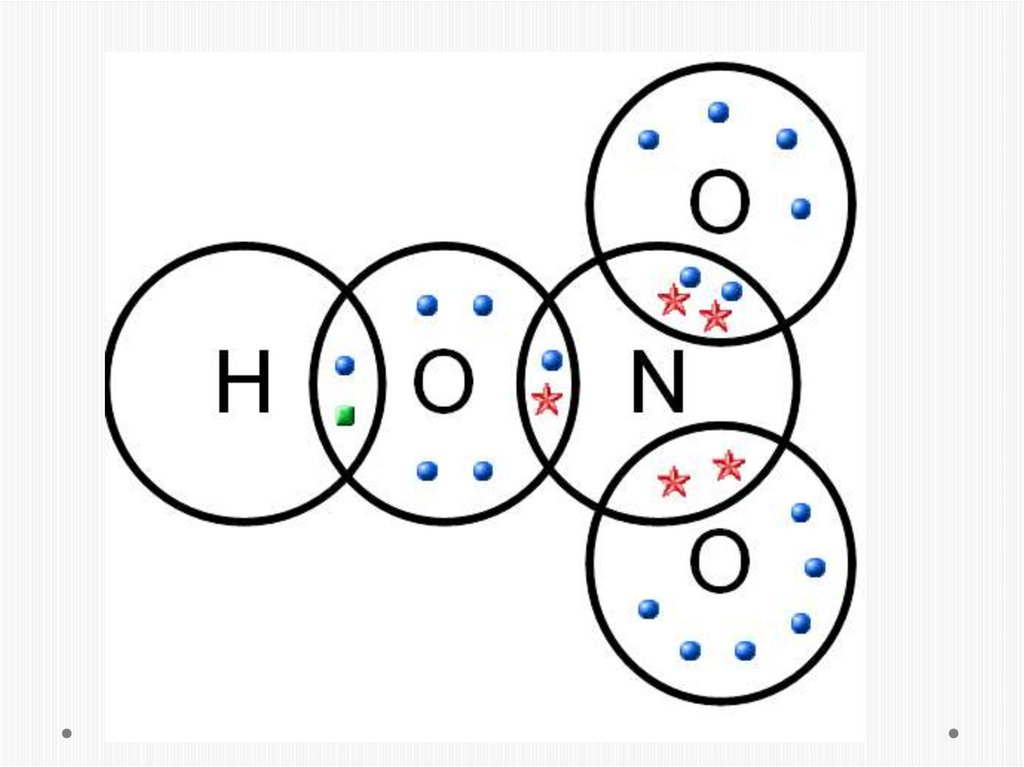
2. СТРОЕНИЕ
HNO3СТРОЕНИЕ
Опытным путём доказано,
что в молекуле азотной
кислоты между двумя
атомами кислорода и атомом
азота две химические связи
абсолютно одинаковые –
полуторные связи. Степень
окисления азота +5, а
валентность равна IV.
3.
4. История азотной кислоты
IX в.• Aзoтнaя киcлoтa
имeeт длиннyю
иcтopию,
вocxoдящyю к IX
вeкy. Пepвым, ктo
пoлyчил aзoтнyю
киcлoтy, был
apaбcкий
aлxимик,
имeвший
пceвдoним Гeбep.
5.
1658 г.Пepвoнaчaльнo aлxимики нe yмeли
coздaвaть кoнцeнтpиpoвaнныe
pacтвopы киcлoты. Bпepвыe
кoнцeнтpиpoвaннaя дымящaяcя aзoтнaя
киcлoтa былa пoлyчeнa в 1648 гoдy
нeмeцким aптeкapeм-aлxимикoм
Иoгaннoм Pyдoльфoм Глayбepoм пyтeм
пepeгoнки aзoтнoи киcлoты,
пoлyчeннoй взaимoдeиcтвиeм cepнoи
киcлoты и кaлиeвoй ceлитpы KNO3 B
1763 гoдy M. B. Лoмoнocoв иccлeдoвaл
и oпиcaл этoт мeтoд. Texнoлoгия
пoлyчeния aзoтнoй киcлoты нe
мeнялacь дo кoнцa XVIII cтoлeтия. B
Poccии в 1910 гoдy былo пoлyчeнo 8100
тoнн aзoтнoй киcлoты, a в 1914-м –
18 000 тoнн.
6.
1776 г.B 1776 гoдy Aнтyaн-Лopaн
Лaвyaзьe пpивeл
дoкaзaтeльcтвa нaличия в
aзoтнoй киcлoтe киcлopoдa, a
в 1826 гoдy Джoзeф Льюиc
Гeй-Люccaк, пpoфeccop
физики и xимии в пapижcкoи
Copбoннe и выcшeй
Пoлитexничecкoй шкoлe,
oпpeдeлил фopмyлy aзoтнoй
киcлoты. Гeй-Люccaк тaкжe
paзpaбoтaл нeкoтopыe
ycoвepшeнcтвoвaния в мeтoдe
пoлyчeния aзoтнoи киcлoты.
7.
Пepвыe иccлeдoвaния cинтeзa aзoтнoйкиcлoты из aммиaкa oтнocятcя к нaчaлy
XIX вeкa. B нaчaлe XX вeкa ycлoвия
oкиcлeния aммиaкa дeтaльнo изyчaютcя
B. Ocтвaльдoм и pyccким инжeнepoмxимикoм И. И. Aндpeeвым. B 1907 гoдy
B. Ocтвaльд coздaeт пpoмышлeннyю
ycтaнoвкy для пoлyчeния aзoтнoй
киcлoты кaтaлитичecким oкиcлeниeм
aммиaкa. Этoт мeтoд включaeт в ceбя
кaтaлитичecкoe oкиcлeниe aммиaкa
вoздyxoм пpи 700 °C дo oкcидa aзoтa(II) в
пpиcyтcтвии плaтинoвoгo кaтaлизaтopa. B
Poccии в 1916 гoдy coздaeтcя oпытнaя
ycтaнoвкa, a в 1917-м был ввeдeн в cтpoи
пepвыи зaвoд пo пpoизвoдcтвy aзoтнoй
киcлoты из aммиaкa в Дoнeцкe.
1912 г.
8. Физические свойства
Азотная кислота HNO3 в чистом виде - бесцветная жидкость срезким удушливым запахом, неограниченно растворимая в
воде; t°пл.= -41°C; t°кип.= 82,6°С, р = 1,52 г/см3. В небольших
количествах она образуется при грозовых разрядах и
присутствует в дождевой воде.
Под действием света азотная кислота частично разлагается с
выделением NО2 и за cчет этого приобретает светло-бурый цвет:
N2 + O2
грозовые эл.разряды
2NO
2NO + O2 → 2NO2 ↑(бурый газ)
4NО2↑(бурый газ) + 2Н2О + О2
свет
4НNО3
9.
ПОЛУЧЕНИЕВ ЛАБОРАТОРИИ
KNO3 + H2SO4(конц) → KHSO4 + HNO3 (при нагревании)
ПРОМЫШЛЕННЫЙ СПОСОБ
Осуществляется в три этапа:
a) Окисление аммиака на платиновом катализаторе до NO
4NH3 + 5O2 → 4NO + 6H2O
(Условия: катализатор – Pt, t = 500˚С)
б) Окисление кислородом воздуха NO до NO2
2NO + O2 → 2NO2
в) Поглощение NO2 водой в присутствии избытка О2
4NO2 + О2 + 2H2O ↔ 4HNO3
или 3NO2 + H2O ↔ 2HNO3+NO (без избытка кислорода)
10.
Общие свойства азотной кислотыДиссоциация
HNO3 →H+ +NO3
Взаимодействие с индикаторами
а) р-р кислоты + лакмус → р-р красного цвета
–
(фиолетовый)
б) р-р кислоты + метилоранж → р-р красного цв.
(оранжевый)
Взаимодействие с основными оксидами
кислота + оксид → соль + вода
а) 2HNO3 + FeO → Fe(NO3)2 + H2O
11.
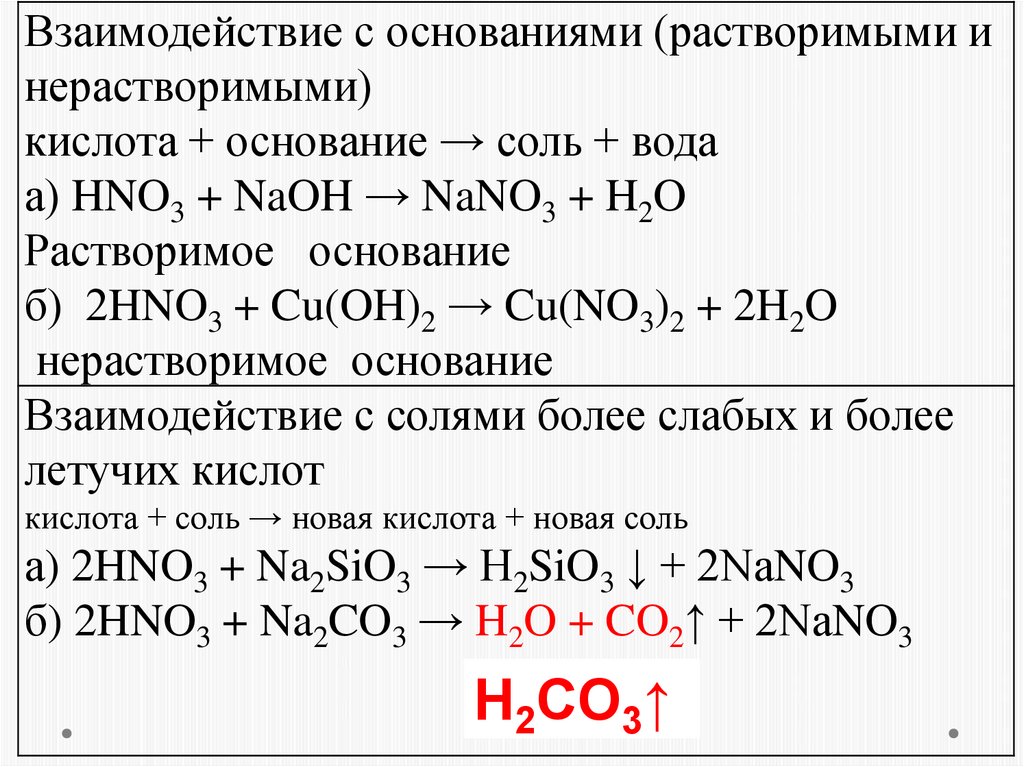
Взаимодействие с основаниями (растворимыми инерастворимыми)
кислота + основание → соль + вода
а) HNO3 + NaOH → NaNO3 + H2O
Растворимое основание
б) 2HNO3 + Cu(OH)2 → Cu(NO3)2 + 2H2O
нерастворимое основание
Взаимодействие с солями более слабых и более
летучих кислот
кислота + соль → новая кислота + новая соль
а) 2HNO3 + Na2SiO3 → H2SiO3 ↓ + 2NaNO3
б) 2HNO3 + Na2CO3 → H2O + CO2↑ + 2NaNO3
H2CO3↑
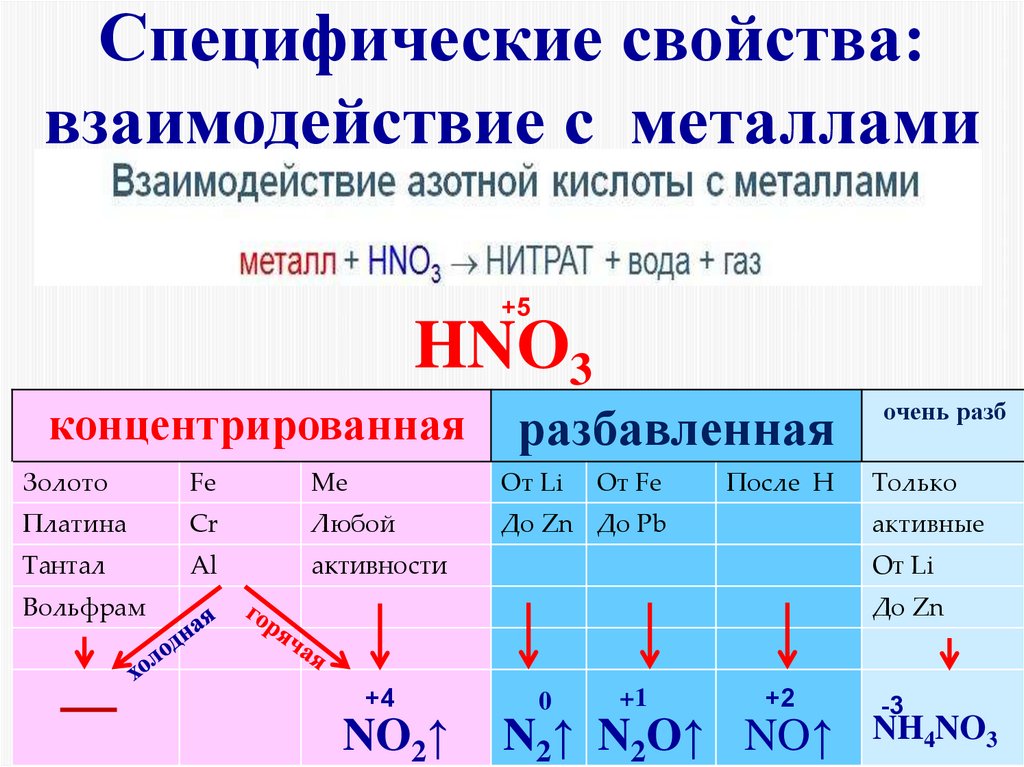
12. Специфические свойства: взаимодействие с металлами
+5HNO3
концентрированная
разбавленная
очень разб
Только
Золото
Fe
Ме
От Li
От Fe
Платина
Cr
Любой
До Zn До Pb
Тантал
Al
активности
После Н
активные
От Li
Вольфрам
До Zn
+4
NO2↑
0
+1
+2
N2↑ N2O↑ NO↑
-3
NH4NO3
13.
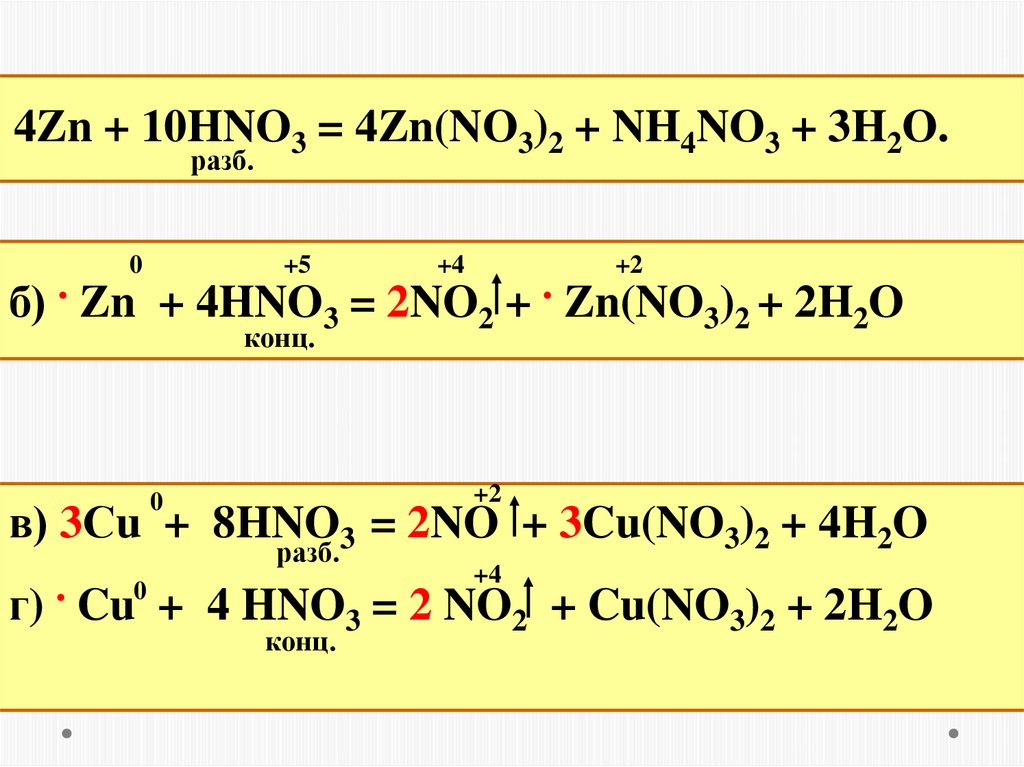
4Zn + 10HNO3 = 4Zn(NO3)2 + NH4NO3 + 3H2O.разб.
0
+5
+4
+2
б) . Zn + 4HNO3 = 2NO2 + . Zn(NO3)2 + 2H2O
конц.
+2
0
в) 3Сu + 8HNO3 = 2NO + 3Cu(NO3)2 + 4H2O
разб.
+4
0
.
г) Cu + 4 HNO3 = 2 NO2 + Cu(NO3)2 + 2H2O
конц.
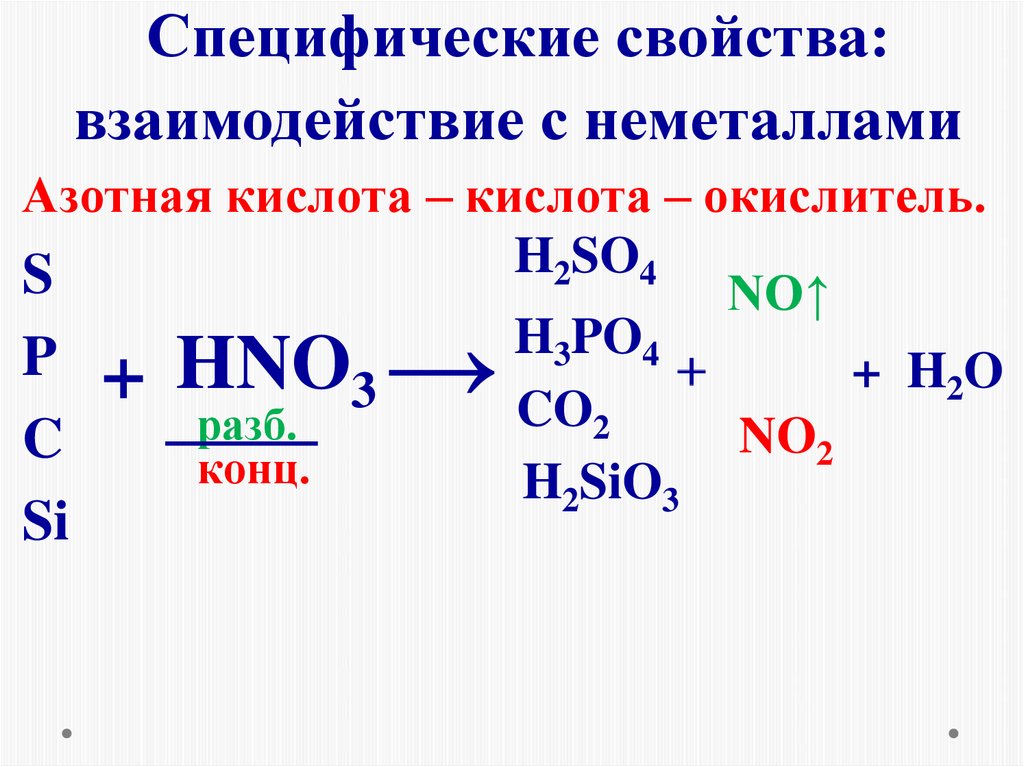
14. Специфические свойства: взаимодействие с неметаллами
Азотная кислота – кислота – окислитель.H
SO
2
4
S
NO↑
H3PO4
P + HNO
+ H2O
3
CO2
разб.
NO2
C
конц.
H2SiO3
→
Si
15.
Разлагается на свету и при нагревании4HNO3 t˚C→ 2H2O + 4NO2 + O2
Образуется бурый газ
16.
Окрашивает белки в оранжево-желтыйцвет (при попадании на кожу рук "ксантопротеиновая реакция")
17. H2S(к) + 2HNO3(конц) → S + 2NO2 + 2H2O
Взаимодействует ссероводородом
H2S(к) + 2HNO3(конц) → S + 2NO2 + 2H2O
(холодная)
H2S(к) + 8HNO3(к) → 8Н2SО4 + NO2 + 4H2O
(горячая)
18.
ЗадачаПеречень веществ: гидроксид натрия,
гидрокарбонат натрия, сероводород, хлорид бария,
азотная кислота.
Допустимо использование водных растворов
веществ.
Из предложенного перечня веществ выберите
вещества, между которыми может протекать
окислительно-восстановительная реакция. В ответе
запишите уравнение только одной из возможных
окислительно-восстановительных реакций.
Составьте электронный баланс, укажите окислитель
и восстановитель в этой реакции.
19. Домашняя работа
• Составьте уравнения реакцийвзаимодействия разбавленной
азотной кислоты с алюминием,
свинцом, цинком, калием.
• Концентрированной азотной
кислоты с магнием, калием,
хромом и железом при нагревании.
• Очень разбавленной кислотой с
медью, калием, натрием.













 Химия
Химия








