Похожие презентации:
Серная кислота и её свойства
1.
Тема урока:«Серная кислота
и её свойства»
2.
Цель урока:Изучить свойства концентрированной серной кислоты.
Сравнить свойства концентрированной и разбавленной серной
кислоты
3.
Маршрут путешествияСтанция
Практическая
Станция
Экологическая
Станция
Сказочная
Станция
Экзаменационная
Станция
Экспериментальная
Станция
Информационная
Станция
Менделеевская
4.
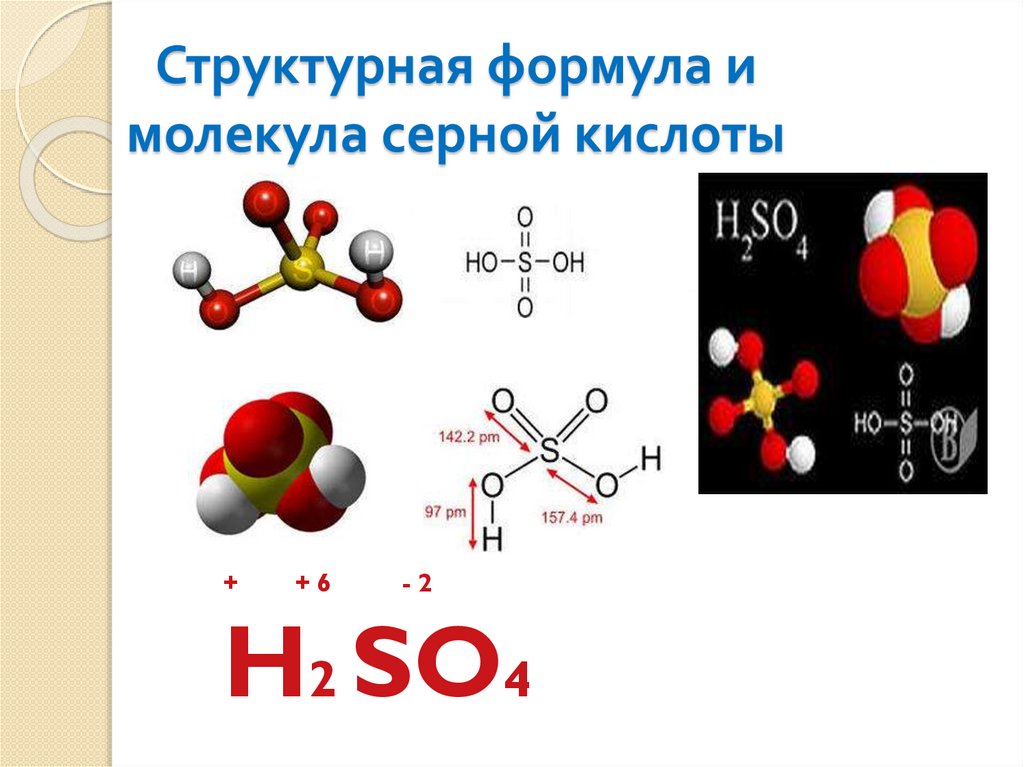
Структурная формула имолекула серной кислоты
+
+6
-2
H2 SO4
5.
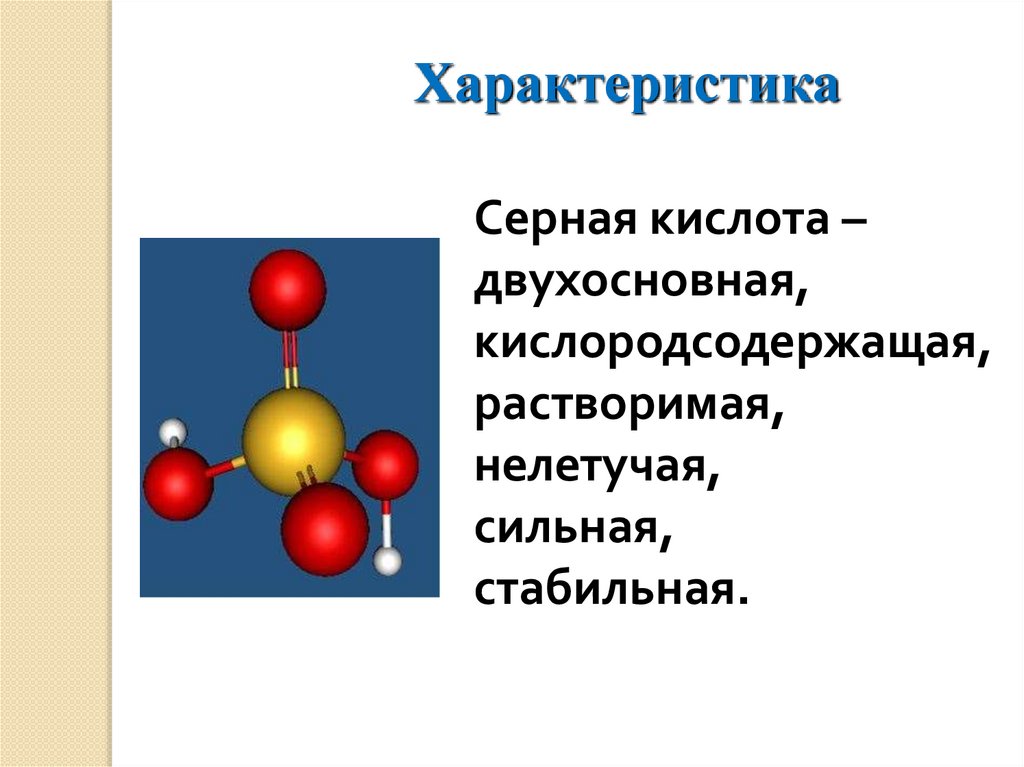
ХарактеристикаСерная кислота –
двухосновная,
кислородсодержащая,
растворимая,
нелетучая,
сильная,
стабильная.
6.
Физические свойствасерной кислоты
Бесцветная маслянистая
жидкость
=1,83кг/дм3
Большая вязкость
Обладает сильным
гигроскопическим свойством
t кип. = 340ºС
7.
«Опыт - это единственный верныйпуть спрашивать природу и
слышать ответ в ее лаборатории».
(Д.И.Менделеев)
8.
Лабораторные опыты:Химические свойства
разбавленной серной кислоты
1. Ознакомьтесь с инструкцией по
выполнению лабораторных опытов
(учебник стр. 198-199)
2.При выполнении опытов соблюдайте
правила техники безопасности.
3.Оформите отчет о работе.
4. Сделайте вывод о результатах
эксперимента.
5. Приведите рабочее место в порядок
9.
Химические свойстваразбавленной серной кислоты
Взаимодействие с металлами
( до Н )
Zn + H2SO4 → ZnSO4 + H2↑
Mg + H2SO4 → MgSO4 + H2↑
Cu + H2SO4 →
10.
Взаимодействиес оксидами металлов
CuO + H2SO4 → CuSO4 + H2O
CuO + 2H+ → Cu2+ + H2O
ZnO + H2SO4 → ZnSO4 + H2O
ZnO + 2H+ → Zn2+ + H2O
11.
Взаимодействие с основаниями2NaOH + H2SO4 → Na2SO4 +2 H2O
H+ + ОН- → H2O
NaOH + H2SO4 → NaHSO4 +H2O
Кислая соль гидросульфат натрия
Cu(OH)2 + H2SO4 → CuSO4 +2H2O
Cu(OH)2 + 2H+ → Cu2+ +2H2O
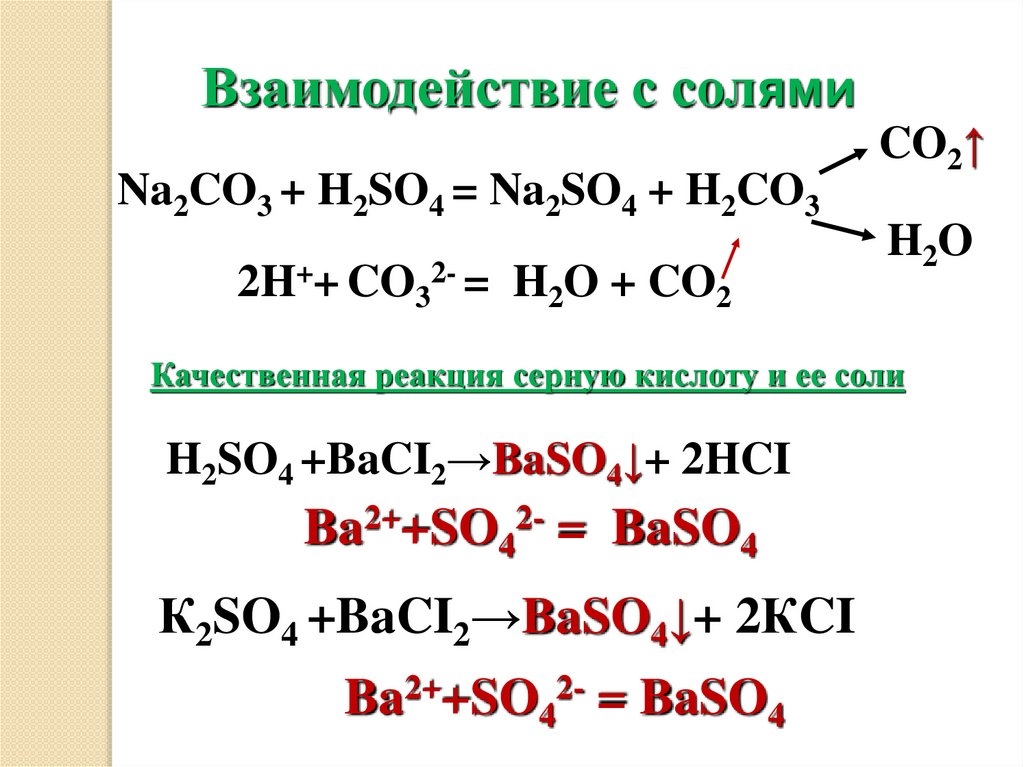
12.
Взаимодействие с солямиNa2CO3 + H2SO4 = Na2SO4 + H2CO3
2H++ CO32- = H2O + CO2
CO2↑
H 2O
Качественная реакция серную кислоту и ее соли
H2SO4 +BaCI2→BaSO4↓+ 2HCI
Ba2++SO42- = BaSO4
К2SO4 +BaCI2→BaSO4↓+ 2КCI
Ba2++SO42- = BaSO4
13.
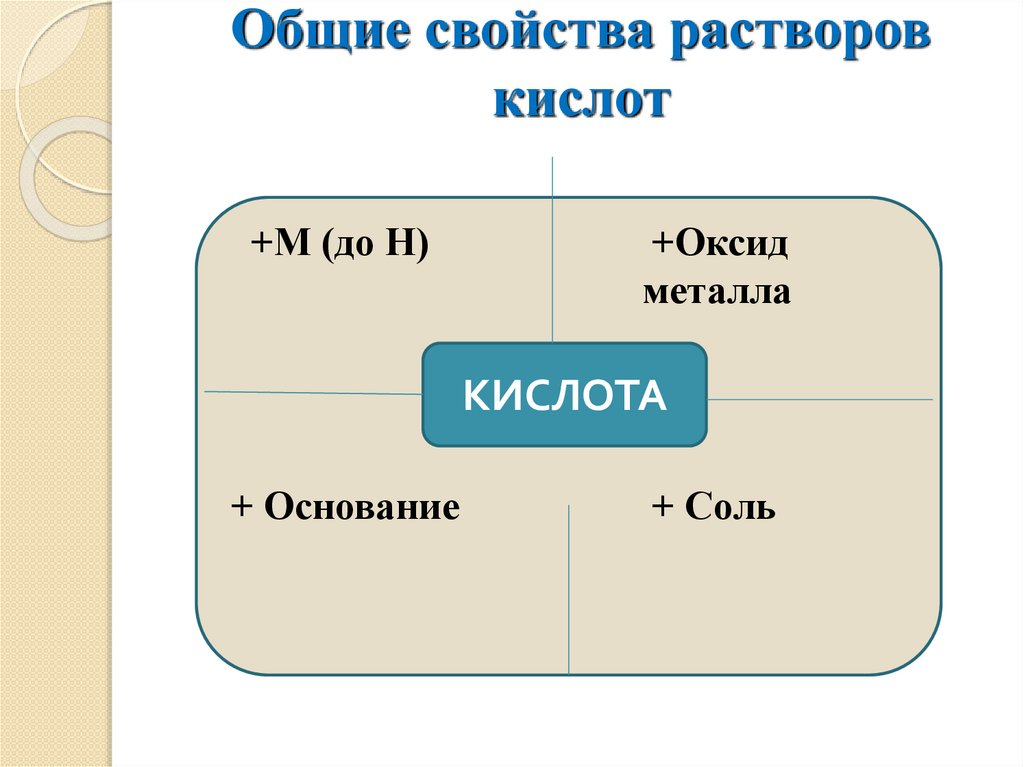
Общие свойства растворовкислот
+М (до Н)
+Оксид
металла
КИСЛОТА
+ Основание
+ Соль
14.
Правило разбавления кислотН2О
Сначала вода, потом кислота –
иначе случится большая беда!
15.
Обугливание сахарозысерной кислотой
C12H22O11 + 2H2SO4→11C + 13H2O + CO2 + 2SO2 +Q
16.
Разрушающее действиеконцентрированной серной кислоты
(обугливание древесины)
Серная кислота - сильное водоотнимающее средство:
она отнимает молекулы воды от органических
соединений.
17.
Взаимодействие серной кислоты с металлами18.
Окислительные свойства конц. H2SO4H2SO4(конц.)
H2S
+ M → M2(SO4)n + S
SO2
+ H2O
Hg0 + H2S+6O4 → S+4O2 + Hg+2SO4 + H2О
Hg0 - 2е → Hg+2 2
2
S+6 + 2е→ S+4
1 восстановитель
1 окислитель
Hg0 + 2H2S+6O4 → S+4O2 + Hg+2SO4 + 2H2О
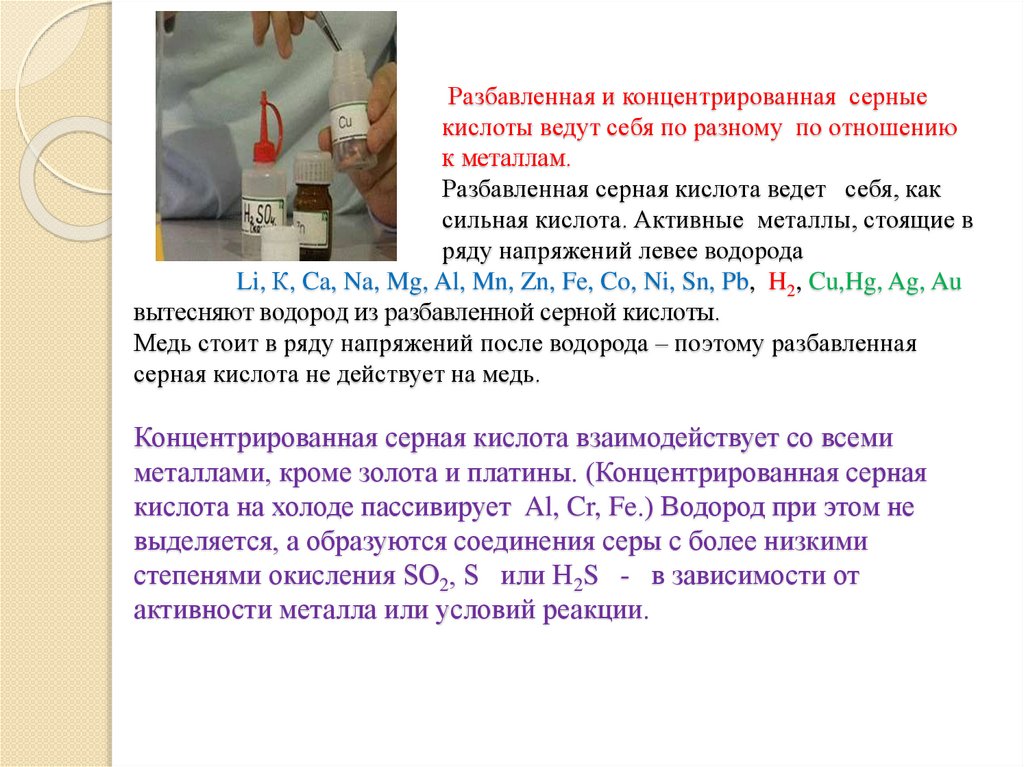
19.
Разбавленная и концентрированная серныекислоты ведут себя по разному по отношению
к металлам.
Разбавленная серная кислота ведет себя, как
сильная кислота. Активные металлы, стоящие в
ряду напряжений левее водорода
Li, К, Ca, Na, Mg, Al, Mn, Zn, Fe, Co, Ni, Sn, Pb, H2, Cu,Hg, Ag, Au
вытесняют водород из разбавленной серной кислоты.
Медь стоит в ряду напряжений после водорода – поэтому разбавленная
серная кислота не действует на медь.
Концентрированная серная кислота взаимодействует со всеми
металлами, кроме золота и платины. (Концентрированная серная
кислота на холоде пассивирует Al, Cr, Fe.) Водород при этом не
выделяется, а образуются соединения серы с более низкими
степенями окисления SO2, S или H2S - в зависимости от
активности металла или условий реакции.
20.
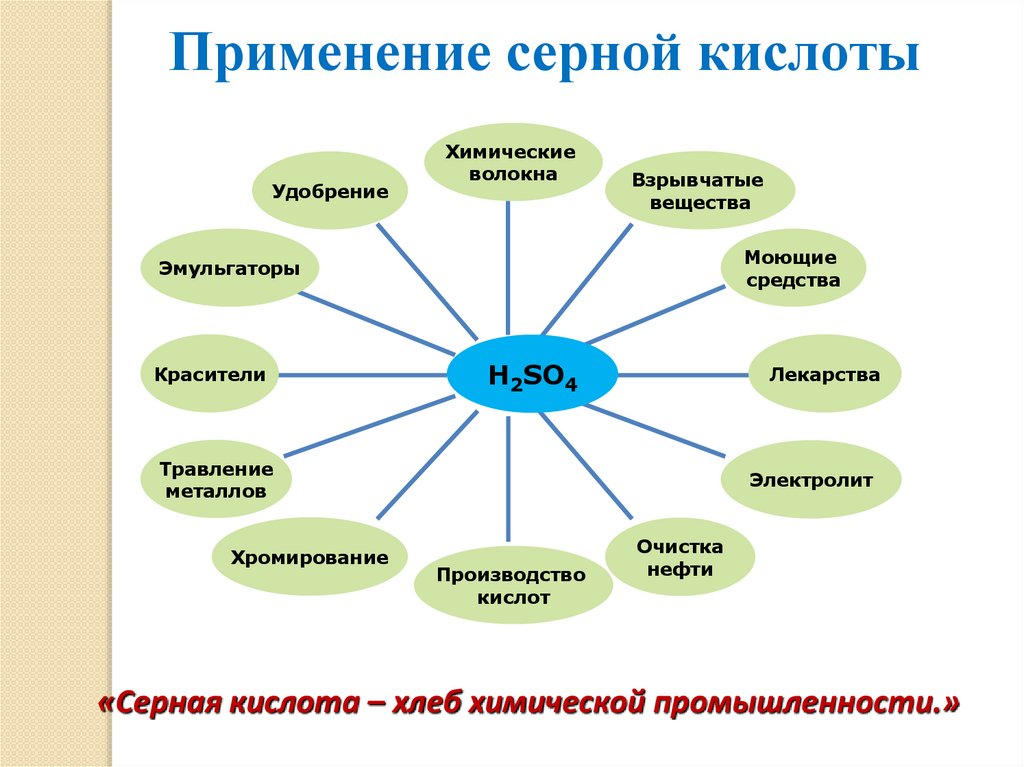
Применение серной кислотыУдобрение
Химические
волокна
Взрывчатые
вещества
Моющие
средства
Эмульгаторы
Красители
H2SO4
Лекарства
Травление
металлов
Хромирование
Электролит
Производство
кислот
Очистка
нефти
«Серная кислота – хлеб химической промышленности.»
21.
Схема образованиякислотных дождей
22.
Тест1.Формулы продуктов взаимодействия концентрированной серной
кислоты с серебром
1) H2 и Ag2SO4
2) SO2 , H2O и Ag2SO4
3) H2 S , H2O и Ag2SO4
4) реакция не идет
2. Ионное уравнение реакции MgO + 2H+ = Mg2+ + H2O соответствует
взаимодействию
1) магния и серной кислоты
2) оксида магния и серной кислоты
3) гидроксида магния и серной кислот
4) карбоната магния и серной кислоты
3. Формула вещества, проявляющего только окислительные свойства
1) H2S
2) H2SO3
3) H2SO4
4) SO2
4.Сумма коэффициентов в уравнении реакции AI + H2SO4 = AI2(SO4)3 + H2
равна
1) 10
2) 11
3) 9
4) 8
5.В концентрированной серной кислоте окислителем является
1) кислород
2) водород
3) сера
4) все три элемента
6.В разбавленной серной кислоте окислителем является
1) кислород
2) водород
3) сера
4) все три элемента
7. Разбавляя концентрированную серную кислоту, необходимо
1) вливать воду в кислоту 2) вливать кислоту в воду
3) без разницы
23.
Ключ для проверки теста1)
2
2) 2
3) 3
4) 3
5) 3
6) 2
7) 2
«5» - 7 заданий
«4» – 6 заданий
«3» - 4-5 заданий
24.
Домашнее задание§ 23, упр. 5,7 + карточка с задачами
(по желанию)
1. Такие виды рыб, как форель и хариус, очень чувствительны к
чистоте воды. Если в 1 л природной воды содержится 3∙10-6моль
серной кислоты (которая может попадать в реки с промышленными
стоками или за счет «кислотных дождей»), то мальки этих рыб
погибают. Вычислите ту массу серной кислоты в 1 л воды, которая
представляет собой смертельную дозу для мальков форели и
хариуса.
2. «Кислотные дожди» - следствие деятельности человека: при
сжигании
различного топлива (бензина, керосина, нефти,
угля) в атмосферу выделяется огромное количество диоксида серы.
Взаимодействуя с кислородом воздуха и атмосферной влагой этот
оксид превращается
в
серную
кислоту.
Определите
концентрацию серной кислоты,
полученной
из
газовых
выбросов химзавода, содержащих 20 кг
диоксида
серы.
Объем воды, в которой будет растворена
полученная серная
кислота, примите равным 10 000м3 .

















 Химия
Химия








