Похожие презентации:
Аминокислоты: состав, строение, свойства, применение. Структура белка
1.
Аминокислоты:состав, строение,
свойства, применение.
Структура белка.
2.
Цели1.Изучить теоретический
материал по теме
2.Уяснить роль аминокислот и
белков в жизнедеятельности
человека
3.Закрепить теоретический
материал на конкретных
примерах
3.
План:1. Определение аминокислот.
2. Состав и строение аминокислот.
3. Химические свойства аминокислот.
4. Понятие о белках. Классификация.
5. Строение белковых молекул.
6. Свойства белков.
7. Функции белков.
4.
Белки и пептидыприродного происхождения
состоят из -аминокислот
5.
Аминокислоты - это органическиекислоты, у которых водород у
-углеродного атома заменен
на NH2 - группу
6.
Свойства белков определяютсястроением и химическим
поведением
-аминокислот
7.
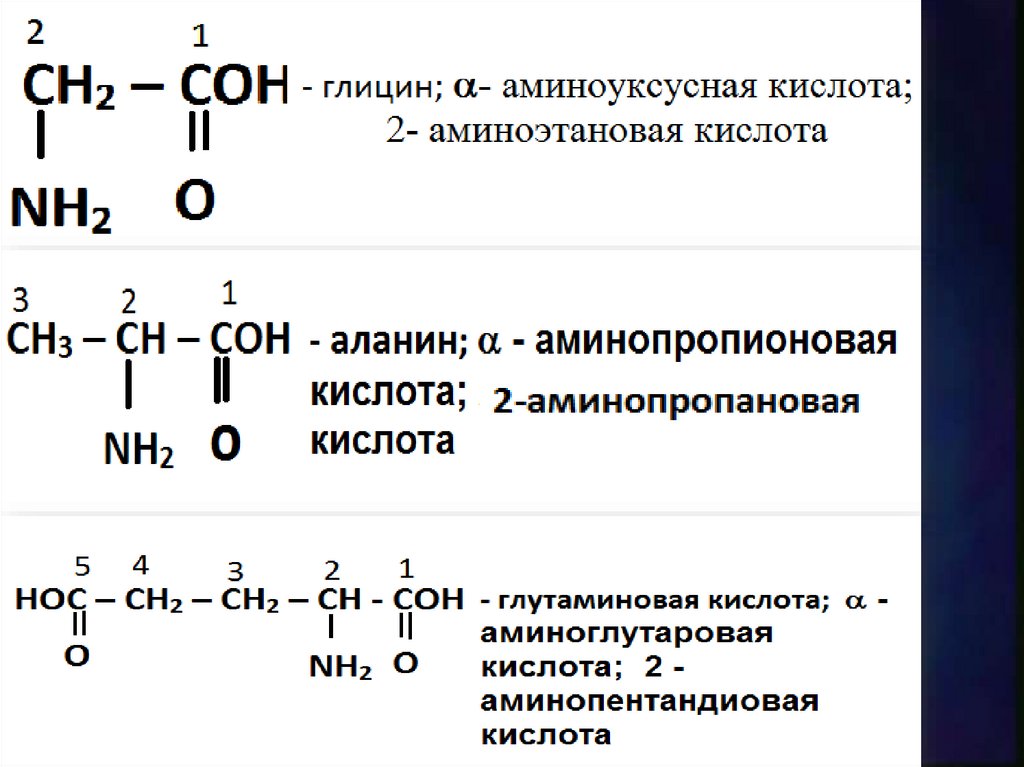
Общая формула:R - CH - C-OH
NH2 O
8.
Номенклатура9.
10.
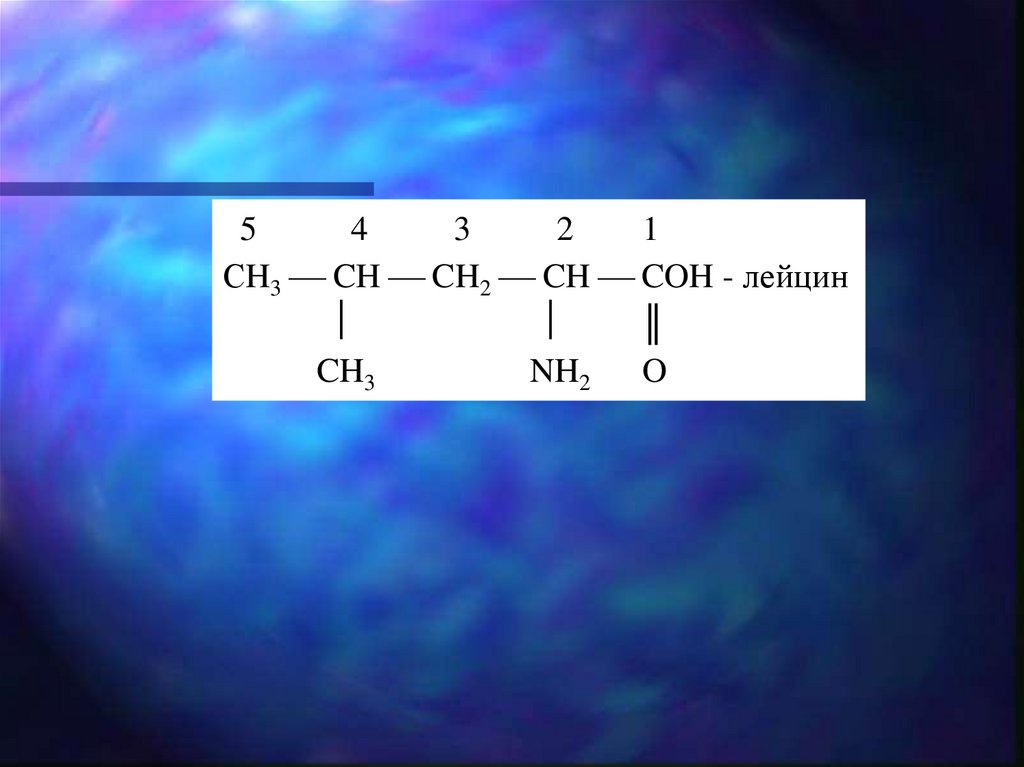
54
3
2
1
СH3 CH CH2 CH COH - лейцин
║
CH3
NH2
O
11.
ПолучениеИз галогенпроизводных действием аммиака
12.
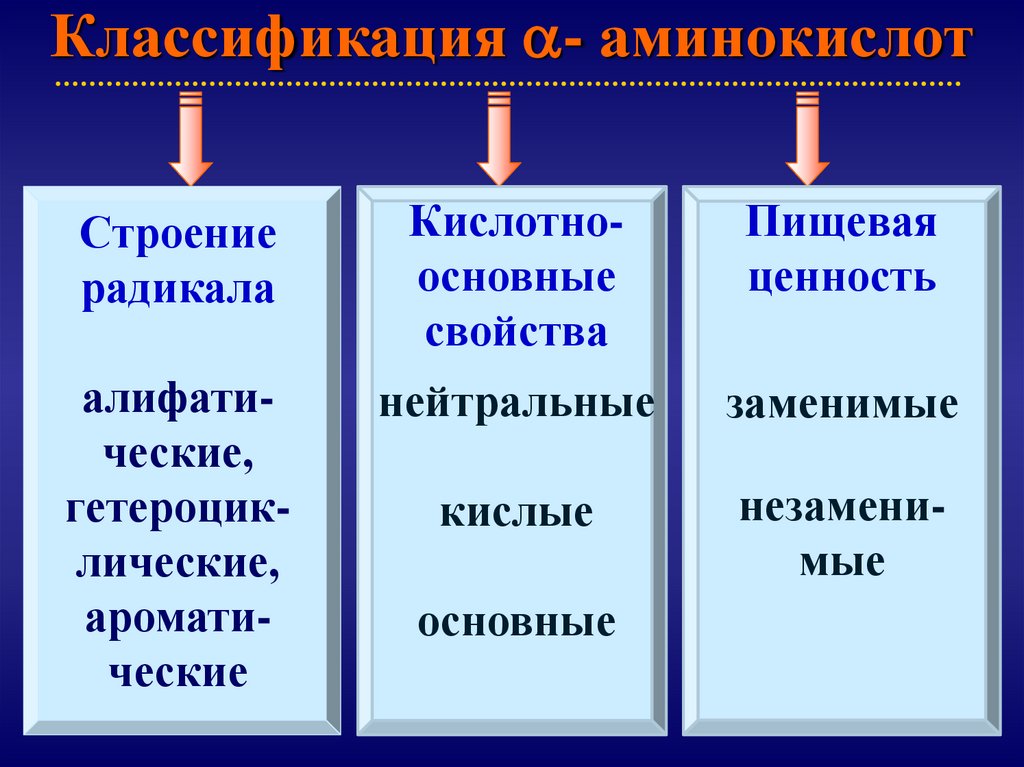
Классификация - аминокислотСтроение
радикала
Кислотноосновные
свойства
Пищевая
ценность
алифатические,
гетероциклические,
ароматические
нейтральные
заменимые
кислые
незаменимые
основные
13.
В состав белковвходят 20 различных
- аминокислот
14.
заменимые1. Аланин;
2. Аспарагиновая
кислота;
3. Аспарагин;
4. Глутаминовая
кислота;
5. Глутамин;
6. Тирозин;
7. Серин;
8. Глицин;
9. Пролин;
10. Цистеин.
незаменимы
е
1. Аргинин;
2. Валин;
3. Лейцин;
4. Изолейцин;
5. Треонин;
6. Метионин;
7. Лизин;
8. Фенилаланин;
9. Триптофан;
10. Гистидин.
15.
Информационныйматериал
16.
Изучение аминокислотного составаразличных продуктов показало, что белки
животного происхождения больше
соответствуют структуре человеческого
тела, а аминокислотный состав белков
яиц был принят за идеальный, поскольку
их усвоение организмом человека
приближается к 100%.
Очень высока степень усвоения и
других продуктов животного
происхождения: молока - 96%, мяса и
рыбы - 93%.
17.
В то же время белки хлеба и овощейусваиваются на 80%, картофеля и бобовых
- на 70%. У значительной части населения
земного шара отмечается определенный
дефицит 3 аминокислот: лизина,
триптофана, метионина, которые
лимитируют полноту усвоения пищи.
Поэтому благоприятны сочетания
растительных и молочных продуктов,
различных мучных изделий с творогом,
мясом.
18.
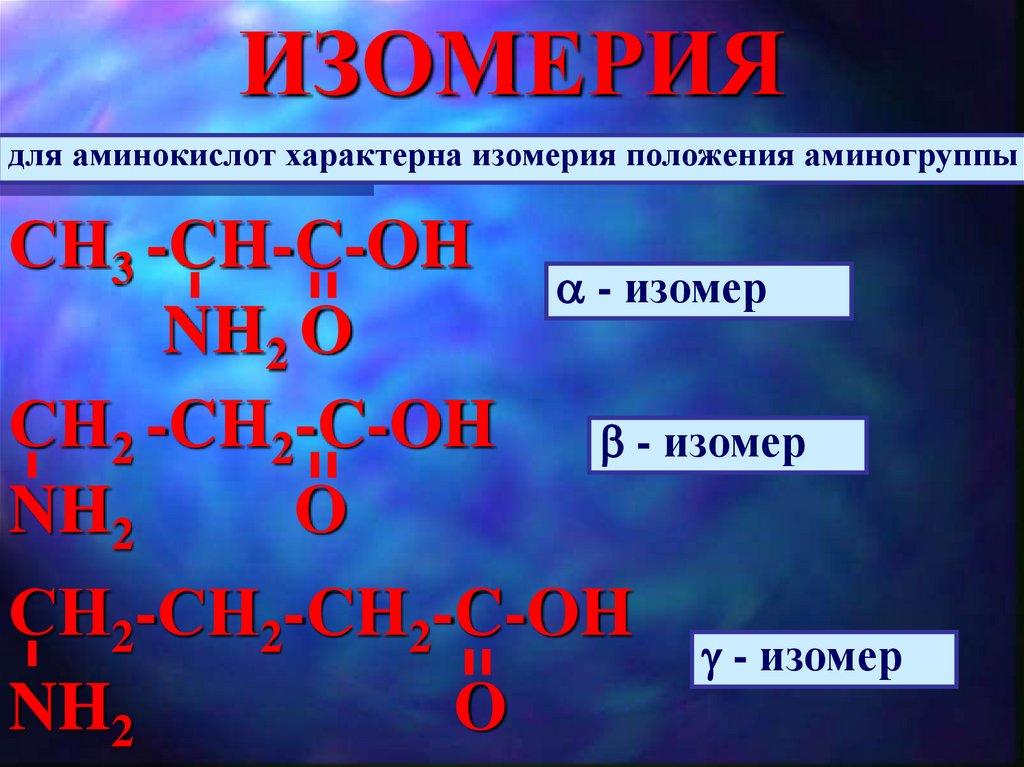
ИЗОМЕРИЯдля аминокислот характерна изомерия положения аминогруппы
СН3 -CH-C-OH
- изомер
NH2 O
СН2 -CH2-C-OH
- изомер
NH2
O
СН2-СН2-CH2-C-OH
- изомер
NH2
O
19.
ИЗОМЕРИЯВ молекулах аминокислот имеются асимметричные атомы характерная оптическая изомерия
O
C OH
Н-С-NН2
O
C
OH
Н2N-С-Н
R
R
D-аминокислота
L-аминокислота
20.
Способы получения:I. Химический способ: а) аминокислота
получается в результате гидролиза
белка; б) из галогенопроизводной к-ты
действием аммиака:
21.
Химические свойства- аминокислоты амфотерны:
за счет аминогруппы NH
2
– основные свойства
за счет карбоксильной
– кислотные свойства
-C-OH
O
22.
Химические свойства- аминокислоты –соединения со
смешанными функциями:
проявляют свойства
кислот и аминов
23.
Химические свойстваВ среде, близкой к нейтральной,
- аминокислоты образуют
биполярный ион:
R - CH - C-OH
NH2 O
R - CH - C-O
+
NH3 O
-
24.
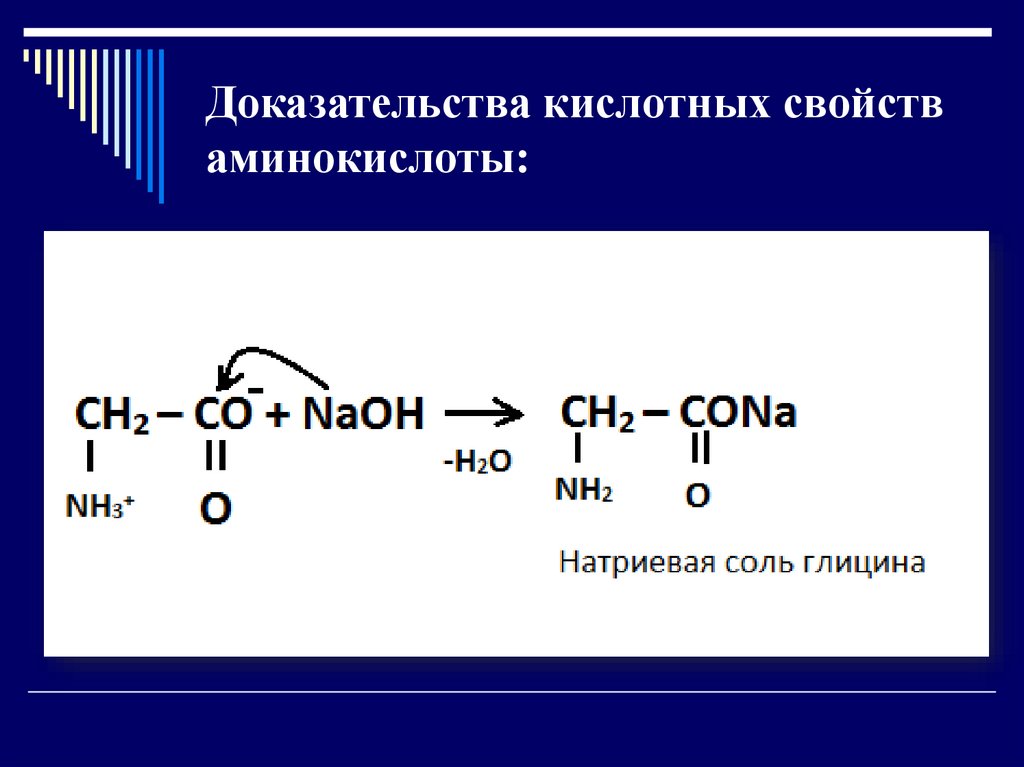
Доказательства кислотных свойстваминокислоты:
25.
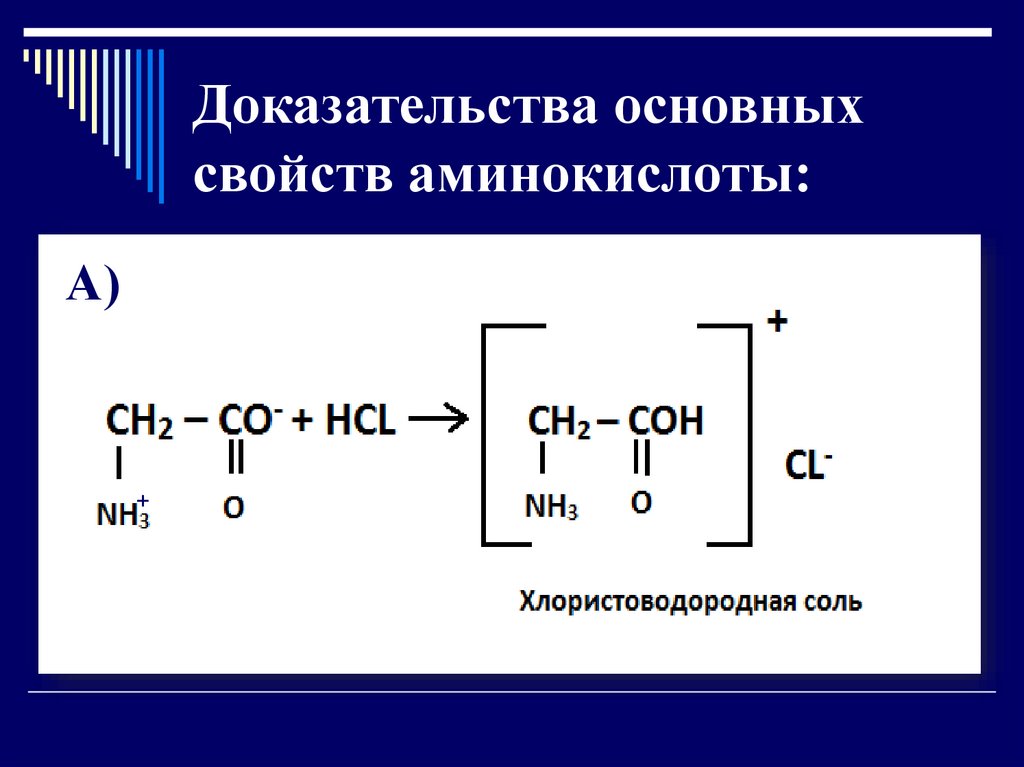
Доказательства основныхсвойств аминокислоты:
А)
+
26.
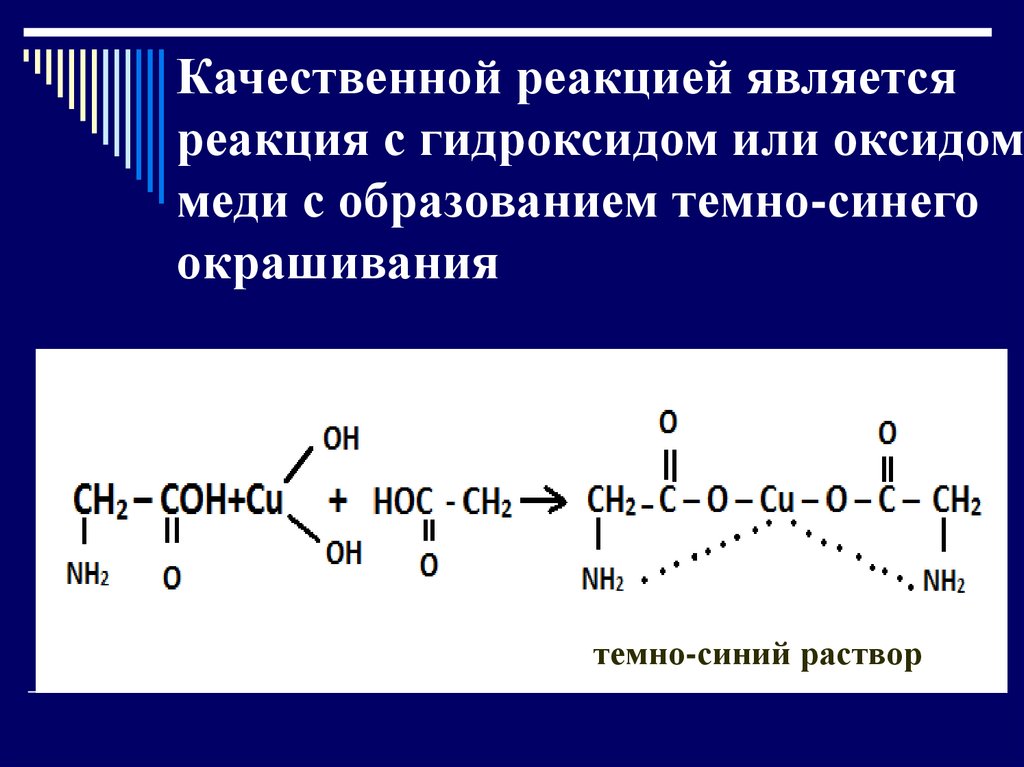
Качественной реакцией являетсяреакция с гидроксидом или оксидом
меди с образованием темно-синего
окрашивания
темно-синий раствор
27.
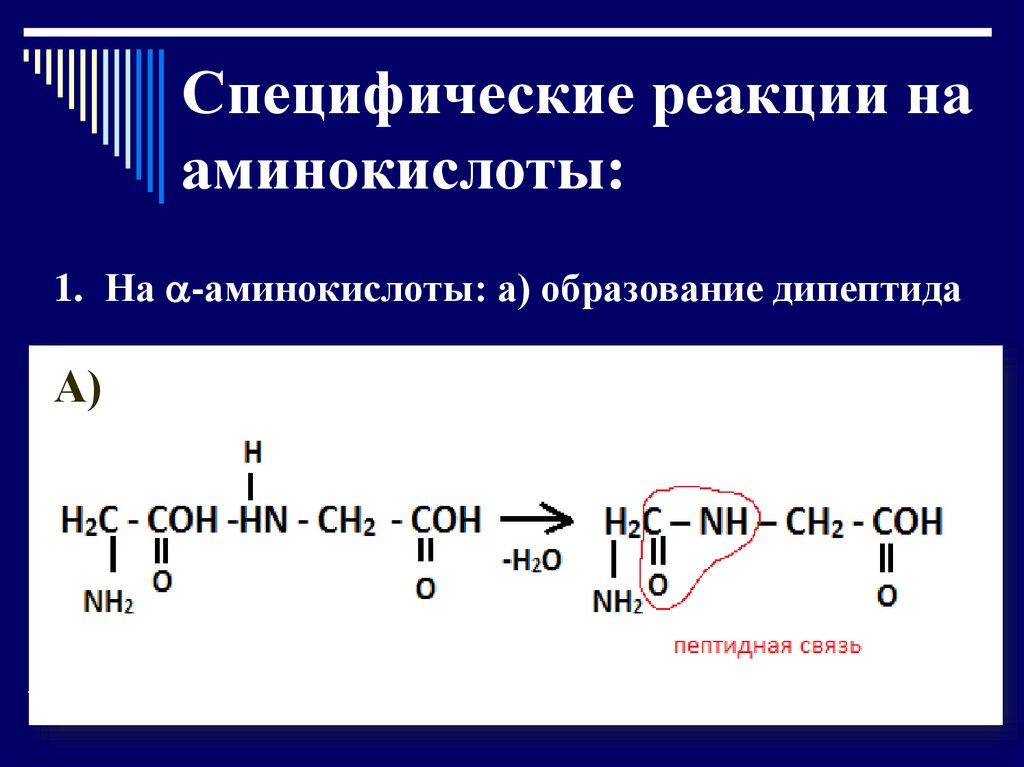
Специфические реакции нааминокислоты:
1. На -аминокислоты: а) образование дипептида
А)
28.
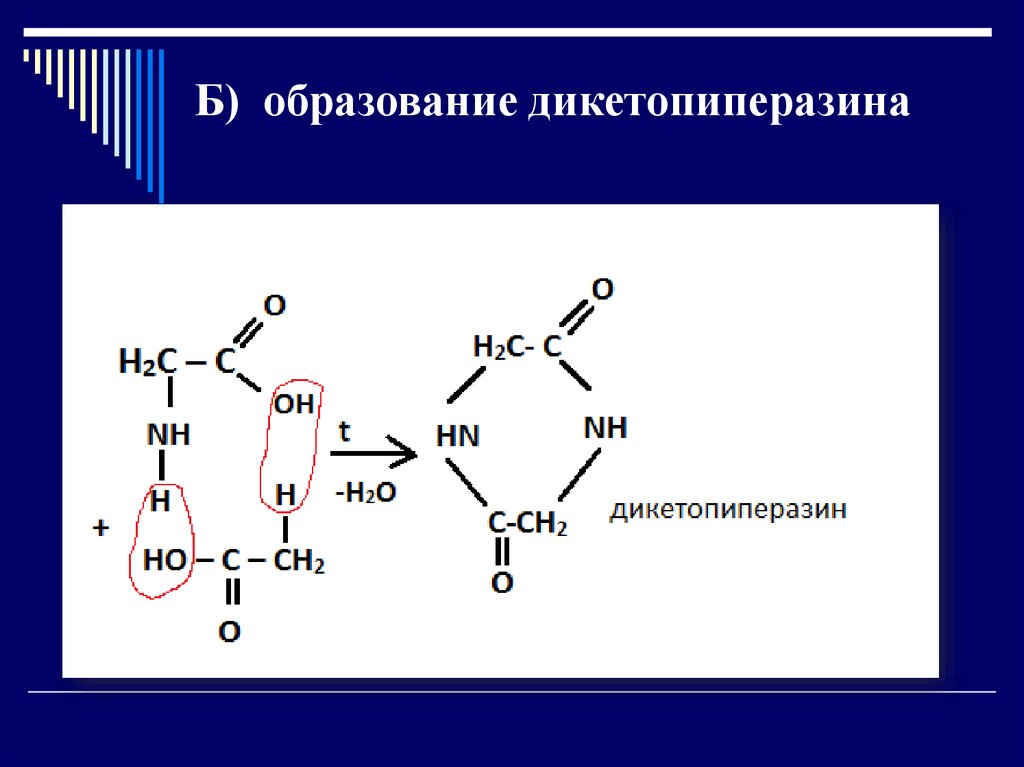
Б) образование дикетопиперазина29.
2. На с отщеплением аммиака,с образованием непредельной
кислоты:
30.
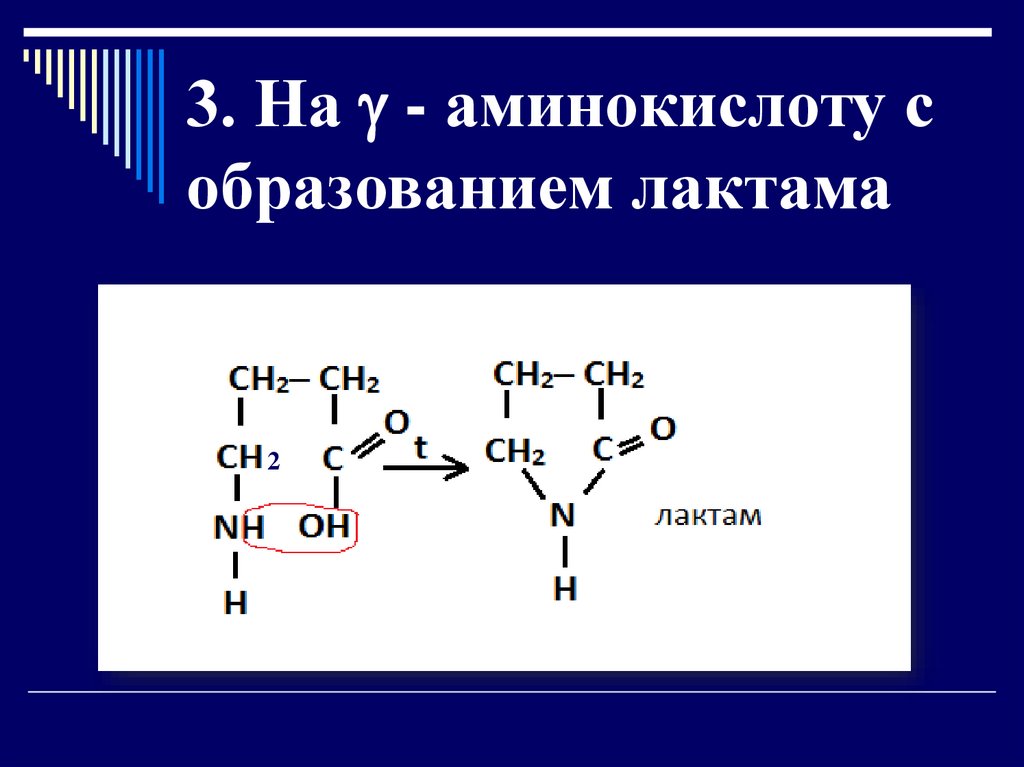
3. На - аминокислоту собразованием лактама
2
31.
Химические свойстваБелки – высокомолекулярные
соединения, состоящие из
- аминокислот, связанных
пептидными связями:
H
- C-NO
32.
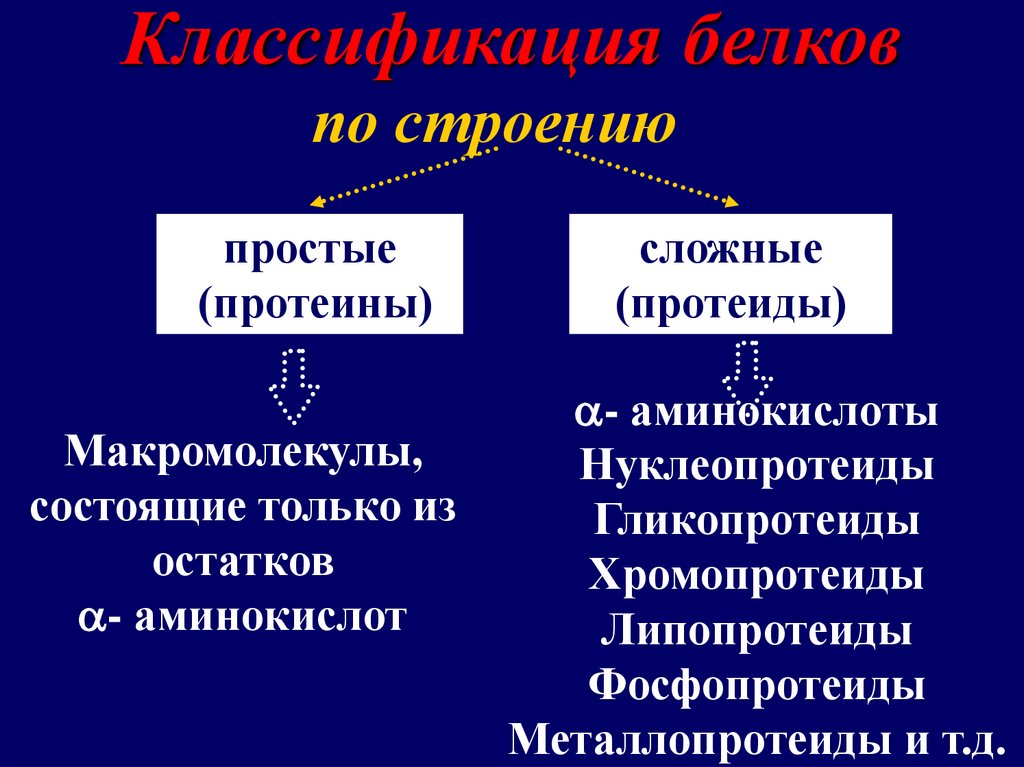
Классификация белковпо строению
простые
(протеины)
Макромолекулы,
состоящие только из
остатков
- аминокислот
сложные
(протеиды)
- аминокислоты
Нуклеопротеиды
Гликопротеиды
Хромопротеиды
Липопротеиды
Фосфопротеиды
Металлопротеиды и т.д.
33.
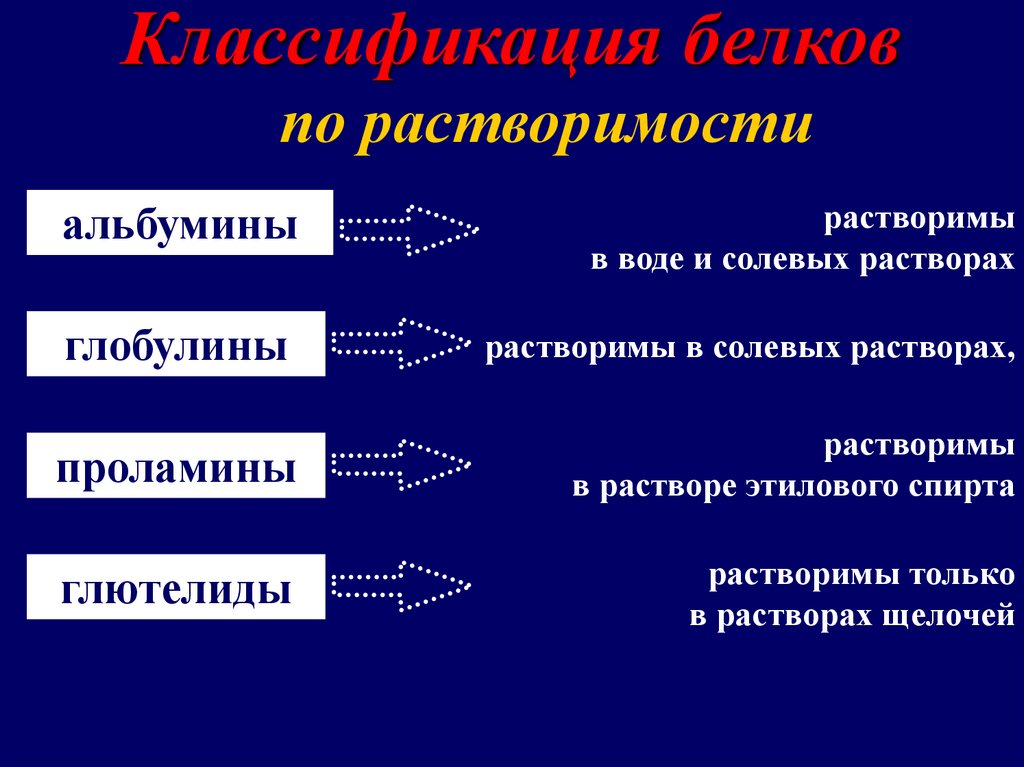
Классификация белковпо растворимости
альбумины
растворимы
в воде и солевых растворах
глобулины
растворимы в солевых растворах,
проламины
растворимы
в растворе этилового спирта
глютелиды
растворимы только
в растворах щелочей
34.
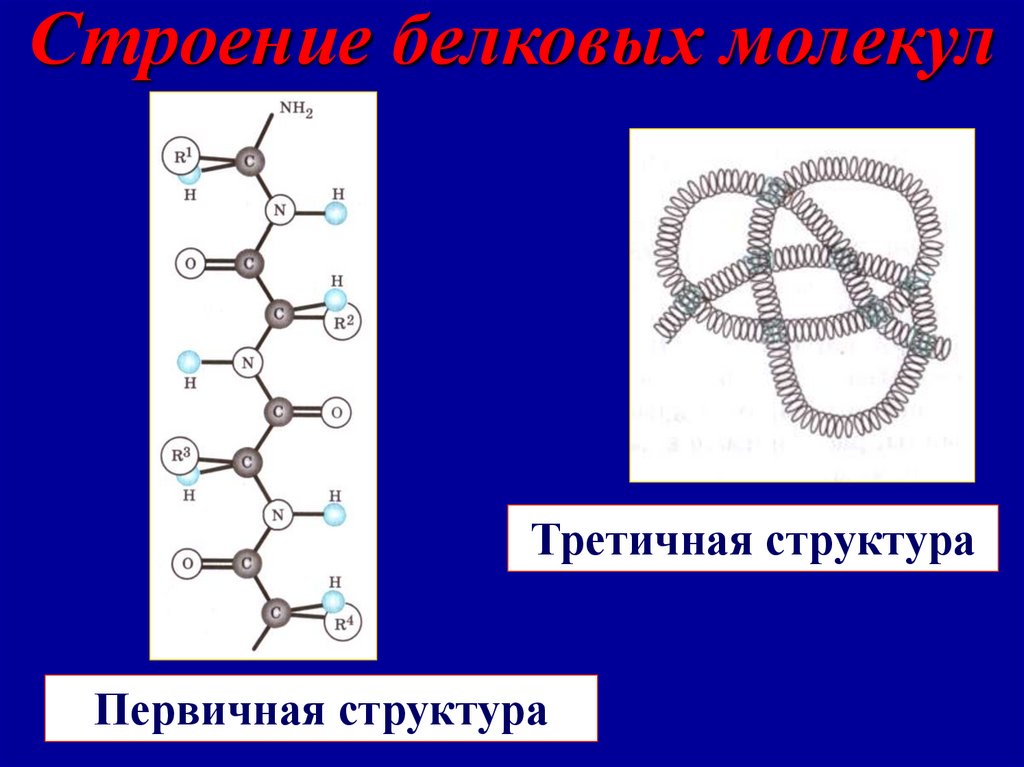
Строение белковых молекулпервичная
вторичная
третичная
четвертичная
Число или последовательность аминокислотных остатков в полипептидной
цепи
-спираль, образованная в результате
скручивания полипептидной цепи за
счет водородных связей между
группами
Пространственная конфигурация спирали, поддерживается за счет дисульфидных и др. связей. Полипептидные
цепи скручены в клубок «глобулу» или
в виде «фибрилл» - нитей.
Совместная укладка нескольких
полипептидных цепей в
конгломераты – субъединицы
35.
Строение белковых молекулТретичная структура
Первичная структура
36.
Свойства белков1. Высокомолекулярны.
2. В зависимости от рН среды белки ведут себя
как катионы или анионы.
При определенных значениях рН среды
число «+» и «-» зарядов в молекуле
одинаково. Значение рН, при котором белки
электронейтральны, имеют наименьшие
вязкость и растворимость, называется
изоэлектрической точкой.
3. Гидрофильны – способны связывать воду.
4. Амфотерны.
37.
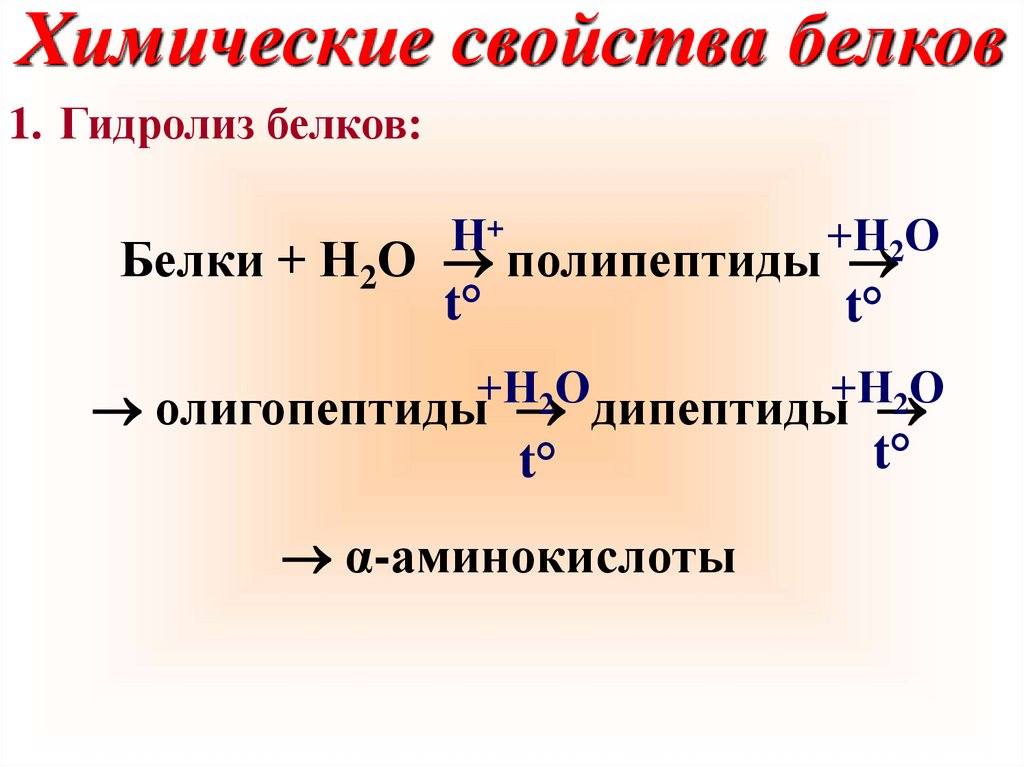
Химические свойства белков1. Гидролиз белков:
Н+
+Н2О
Белки + Н2О полипептиды
t°
t°
+Н
О
+Н
О
2
2
олигопептиды дипептиды
t°
α-аминокислоты
t°
38.
Химические свойства белков2. Обратимое осаждение (высаливание):
Белки в
растворе
+спирт, соли Na+, K+, NH4+
Белка
3. Необратимое осаждение (денатурация):
Белки в +соли тяжелых металлов
растворе
Белок
с измененной
вторичной и
щелочи, кислоты, t°, γ-лучи третичной
структурой
39.
3. Необратимое осаждение (денатурация):Белок
с
Белки в растворе
измененной
щелочи, кислоты, t°,
вторичной
γ-лучи, фенол,
и третичной
формалин, танин
структурой
щелочи, кислоты, t °, γ-лучи
+соли тяж. мет.
40.
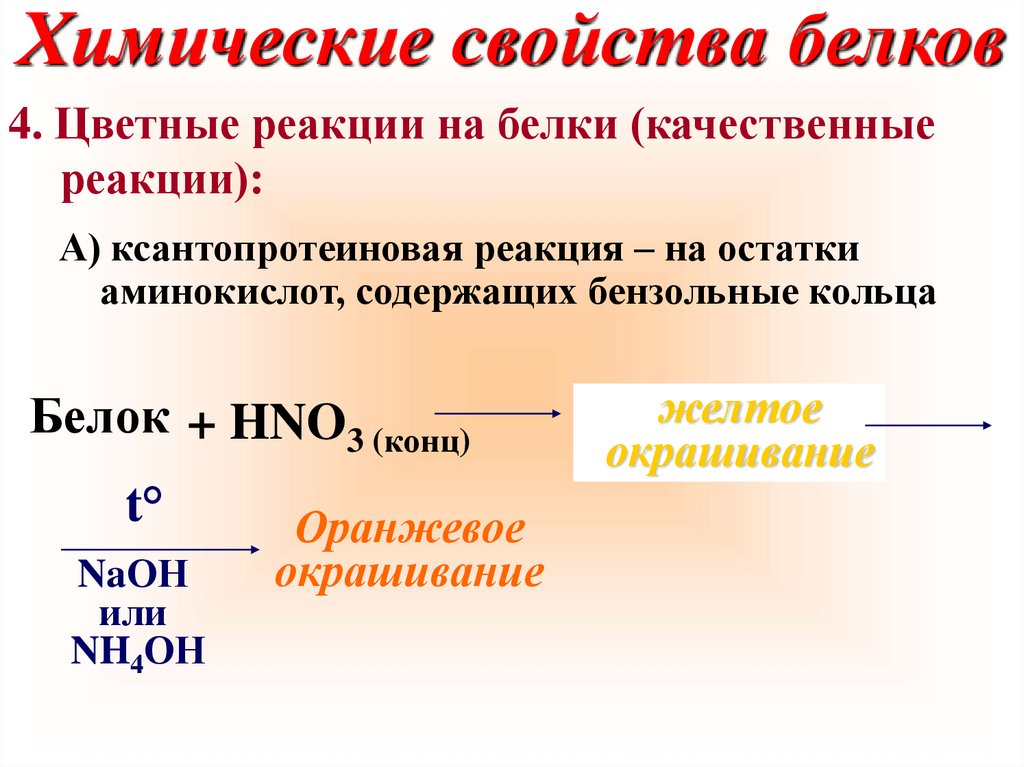
Химические свойства белков4. Цветные реакции на белки (качественные
реакции):
А) ксантопротеиновая реакция – на остатки
аминокислот, содержащих бензольные кольца
Белок + HNO3 (конц)
t°
NaОН
или
NH4ОН
Оранжевое
окрашивание
желтое
окрашивание
41.
Химические свойства белков4. Цветные реакции на белки (качественные
реакции):
Б) биуретовая реакция – на пептидные связи
Белок + CuSO4 (насы.)+ NaОН (конц.)
Яркофиолетовое
окрашивание
42.
Химические свойства белков4. Цветные реакции на белки (качественные
реакции):
В) цистеиновая реакция – на остатки аминокислот,
содержащих серу
Белок + NaОН t° + Pb(CH3COO)2
PbS ↓
Черный осадок
43.
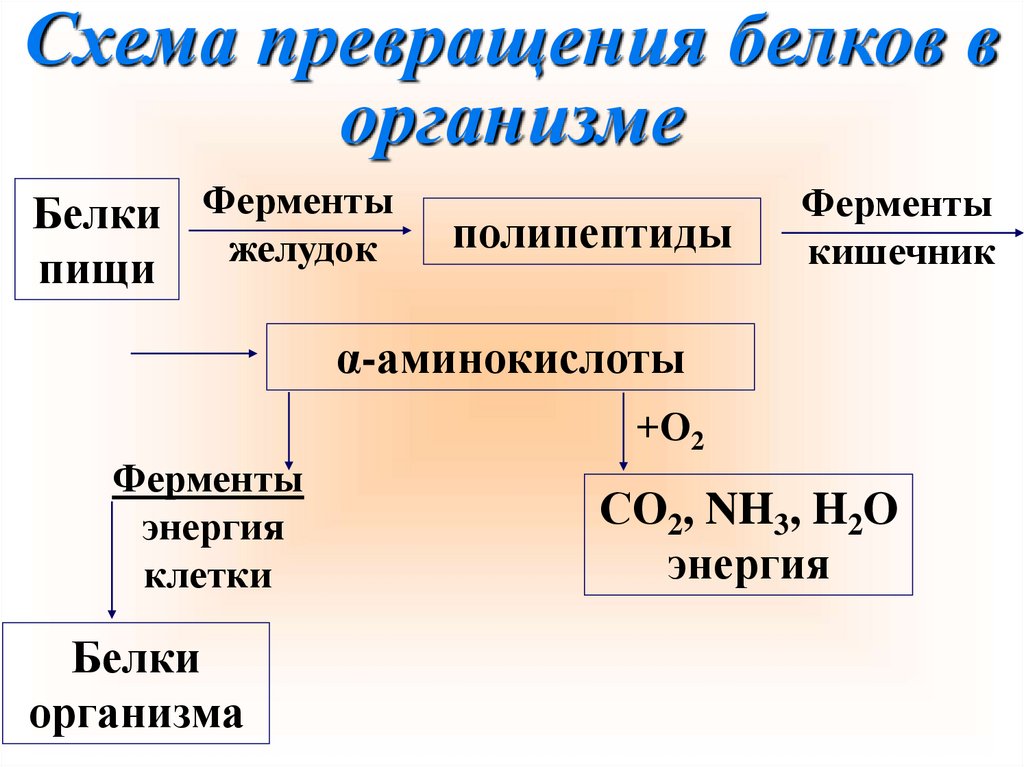
Схема превращения белков ворганизме
Белки Ферменты
желудок
пищи
полипептиды
Ферменты
кишечник
α-аминокислоты
+О2
Ферменты
энергия
клетки
Белки
организма
СО2, NH3, H2O
энергия
44.
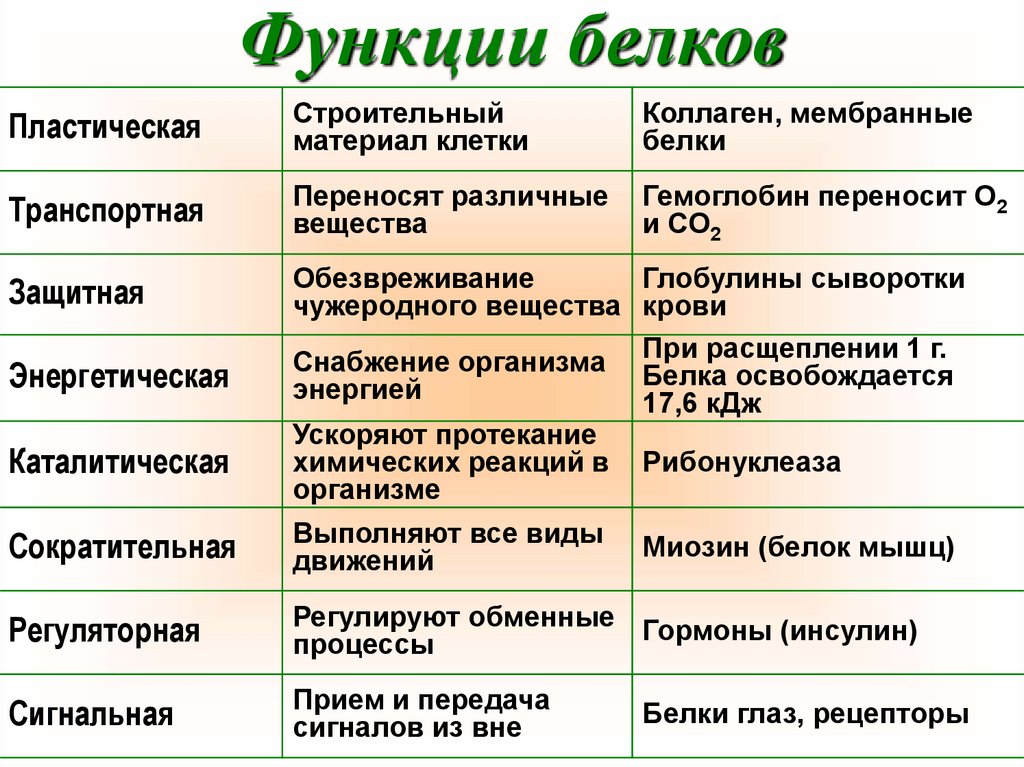
Функции белковПластическая
Строительный
материал клетки
Коллаген, мембранные
белки
Транспортная
Переносят различные
вещества
Гемоглобин переносит О2
и СО2
Защитная
Обезвреживание
Глобулины сыворотки
чужеродного вещества крови
расщеплении 1 г.
Снабжение организма При
Белка освобождается
энергией
17,6 кДж
Энергетическая
Каталитическая
Ускоряют протекание
химических реакций в
организме
Рибонуклеаза
Сократительная
Выполняют все виды
движений
Миозин (белок мышц)
Регуляторная
Регулируют обменные Гормоны (инсулин)
процессы
Сигнальная
Прием и передача
сигналов из вне
Белки глаз, рецепторы
45.
Суточная потребность человека внезаменимых аминокислотах
Название
Потребность в аминокислоте,
аминокислот
мг\кг массы тела
Аргинин
Изолецин
Лейцин
Лизин
Метионин
Фенилаланин
Треонин
Триптофан
Валин
Взрослые не нуждаются
10
14
12
13
14
7
4
10
46.
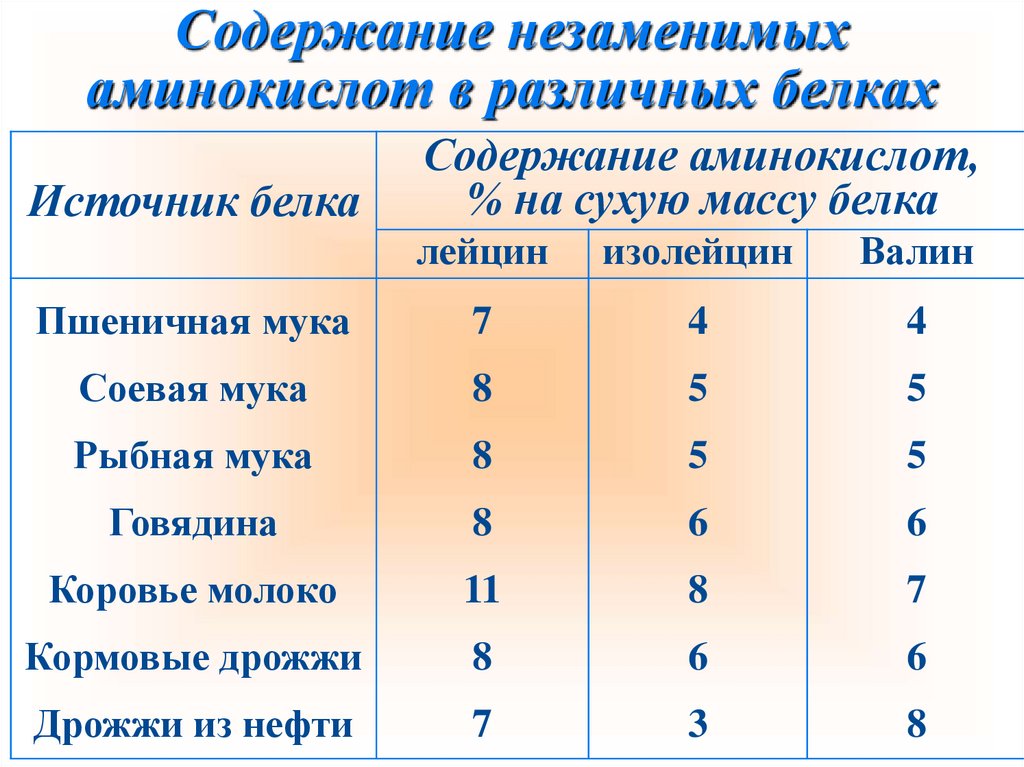
Содержание незаменимыхаминокислот в различных белках
Источник белка
Содержание аминокислот,
% на сухую массу белка
лейцин
изолейцин
Валин
Пшеничная мука
7
4
4
Соевая мука
8
5
5
Рыбная мука
8
5
5
Говядина
8
6
6
Коровье молоко
11
8
7
Кормовые дрожжи
8
6
6
Дрожжи из нефти
7
3
8




























 Химия
Химия








