Похожие презентации:
Аминокислоты и белки
1.
ОМСКИЙ ГОСУДАРСТВЕННЫЙМЕДИЦИНСКИЙ УНИВЕРСИТЕТ
КАФЕДРА ХИМИИ
α-Аминокислоты и белки
1. α-Аминокислоты. Строение,
номенклатура, изомерия, классификация.
2. α-Аминокислоты. Физические и
химические свойства.
3. Пептиды и белки. Строение,
номенклатура, изомерия, классификация,
физические и химические свойства.
Лектор: Ирина Петровна Степанова, доктор
биологических наук, профессор, зав. кафедрой
химии
2.
ЦЕЛИ ЛЕКЦИИОБУЧАЮЩАЯ: сформировать знания о
классификации -аминокислот и белков, их
физических свойствах и реакционной
способности.
РАЗВИВАЮЩАЯ: расширить кругозор
обучающихся на основе интеграции знаний,
развить логическое мышление.
ВОСПИТАТЕЛЬНАЯ: содействовать
формированию у обучающихся устойчивого
интереса к изучению дисциплины.
3.
Медико-биологическое значение темыИз остатков аминокислот
построены такие важные
соединения
как белки,
которые участвуют
практически во всех процессах
in vivo: биосинтез алкалоидов,
порфиринов, тетрапиррольных
пигментов, мочевины и т.д.
С нарушениями метаболизма аминокислот
связаны наследственные заболевания как
фенилкетонурия и алкаптонурия.
4.
Медико-биологическое значение темыНекоторые
аминокислоты
являются
лекарственным
и препаратами.
5.
Медико-биологическое значение темы6.
-АминокислотыПептиды
и
белки
построены
из
20 -аминокислот, информация о положении
которых в белковой молекуле записана
цифровым трёхбуквенным кодом в ДНК и РНК.
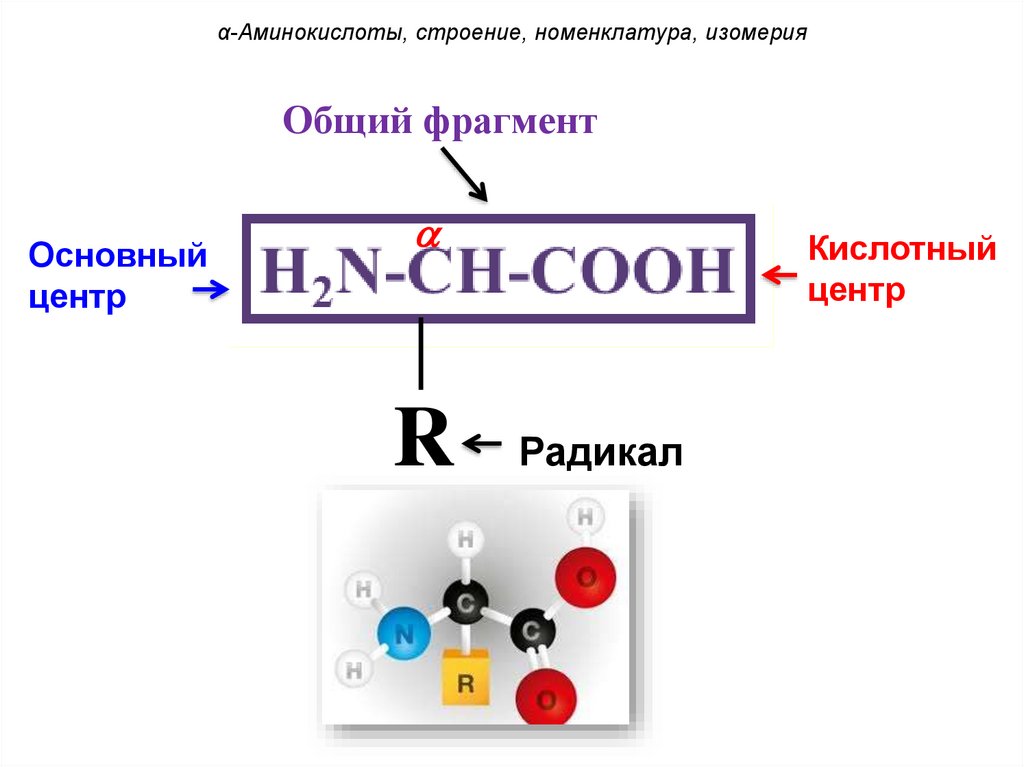
-Аминокислоты – гетерофункциональные
соединения – производные карбоновых
кислот, у которых один атом водорода у
-углеродного звена замещен на
аминогруппу.
7.
α-Аминокислоты, строение, номенклатура, изомерияОбщий фрагмент
Основный
центр
Кислотный
центр
R
Радикал
8.
Классификация α-аминокислот9.
α-Аминокислоты, строение, номенклатура, изомерия10.
α-Аминокислоты, строение, номенклатура, изомерия11.
α-Аминокислоты, строение, номенклатура, изомерияI. По строению углеводородного радикала
α-аминокислоты делят на 7 групп:
I. Моноаминомонокарбоновые
II. Моноаминодикарбоновые
III. Диаминомонокарбоновые
IV. Гидроксиаминокислоты
V.Серосодержащие аминокислоты
VI. Ароматические
VII. Гетероциклические
12.
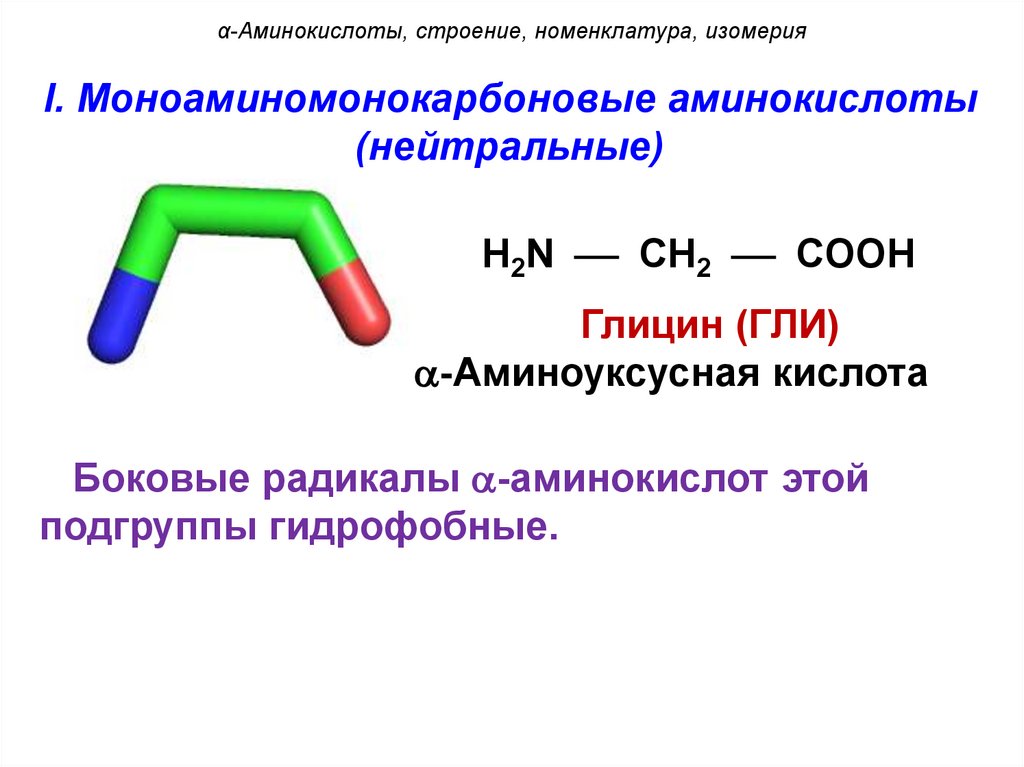
α-Аминокислоты, строение, номенклатура, изомерияI. Моноаминомонокарбоновые аминокислоты
(нейтральные)
H2N CH2 COOH
Глицин (ГЛИ)
-Аминоуксусная кислота
Боковые радикалы -аминокислот этой
подгруппы гидрофобные.
13.
α-Аминокислоты, строение, номенклатура, изомерияH2N CH COOH
CH3
Аланин (АЛА)
-Аминопропионовая
кислота
14.
α-Аминокислоты, строение, номенклатура, изомерияH2N CH COOH
CH CH3
CH3
Валин (ВАЛ)
-Амино- -метилмасляная
кислота
15.
α-Аминокислоты, строение, номенклатура, изомерияH2N CH COOH
CH2
CH CH3
CH3
Лейцин (ЛЕЙ)
-Амино- -метилвалериановая кислота
16.
α-Аминокислоты, строение, номенклатура, изомерияH2N CH COOH
CH CH3
CH2
CH3
Изолейцин (ИЛЕ)
-Амино- -метилвалериановая кислота
17.
α-Аминокислоты, строение, номенклатура, изомерияII. Моноаминодикарбоновые аминокислоты
(кислые)
H2N CH COOH
CH2
COOH
Аспарагиновая кислота (АСП)
-Аминоянтарная кислота
18.
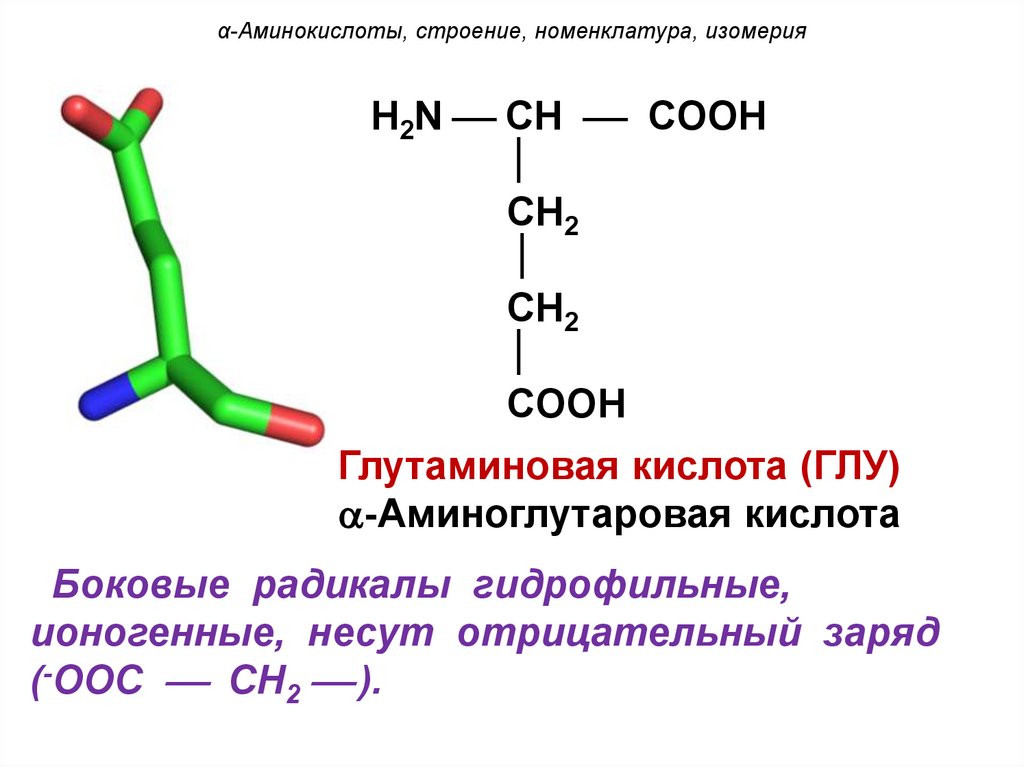
α-Аминокислоты, строение, номенклатура, изомерияH2N CH COOH
CH2
CH2
COOH
Глутаминовая кислота (ГЛУ)
-Аминоглутаровая кислота
Боковые радикалы гидрофильные,
ионогенные, несут отрицательный заряд
(-OOC CH2 ).
19.
α-Аминокислоты, строение, номенклатура, изомерияH2N CH COOH
CH2
CONH2
Аспарагин (АСН)
В состав белков входят амиды данных
кислот.
20.
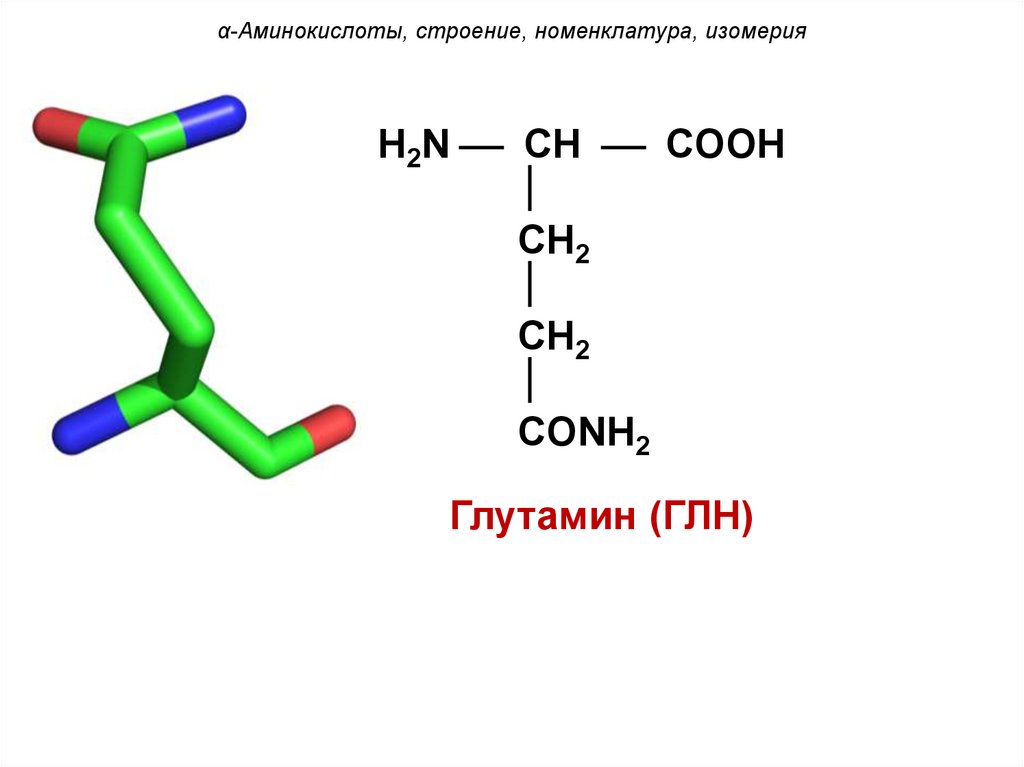
α-Аминокислоты, строение, номенклатура, изомерияH2N CH COOH
CH2
CH2
CONH2
Глутамин (ГЛН)
21.
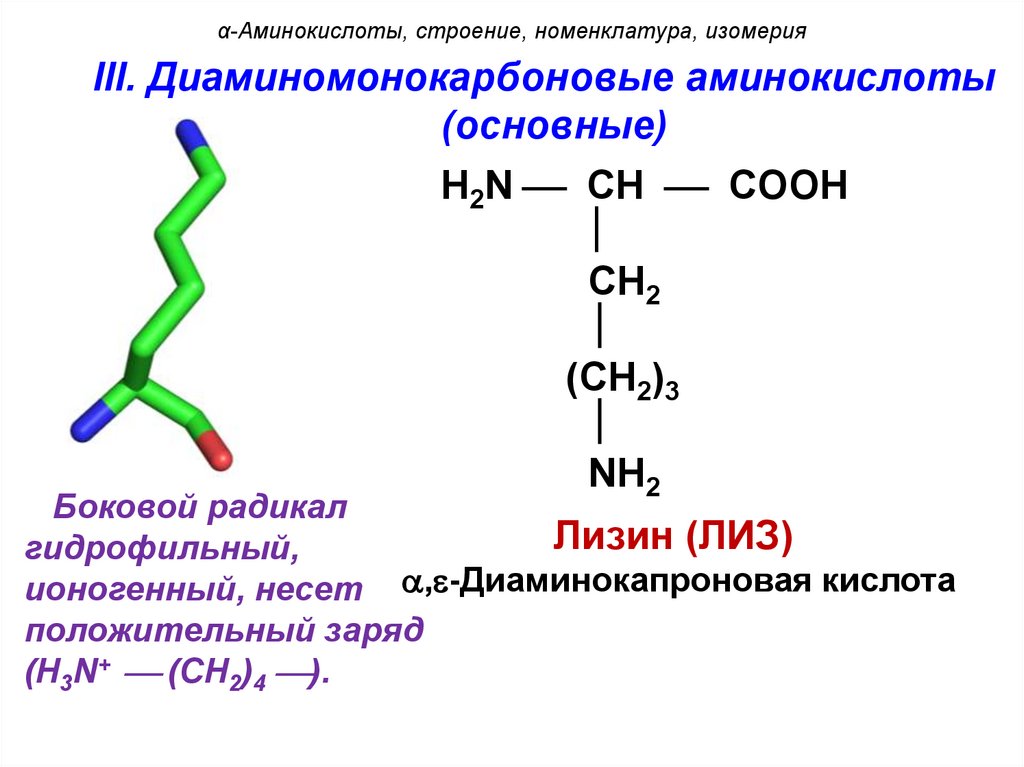
α-Аминокислоты, строение, номенклатура, изомерияIII. Диаминомонокарбоновые аминокислоты
(основные)
H2N CH COOH
CH2
(CH2)3
NH2
Боковой радикал
Лизин (ЛИЗ)
гидрофильный,
ионогенный, несет , -Диаминокапроновая кислота
положительный заряд
(H3N+ (CH2)4 ).
22.
α-Аминокислоты, строение, номенклатура, изомерияH2N CH COOH
CH2
Аргинин (АРГ)
(CH2)2
-Амино- -гуанидино
валериановая кислота
NH
C=NH
Боковой радикал гидрофильный,
ионогенный, несёт
NH2
положительный заряд
(H2N+ = C NH ( CH2 )3 ).
NH2
23.
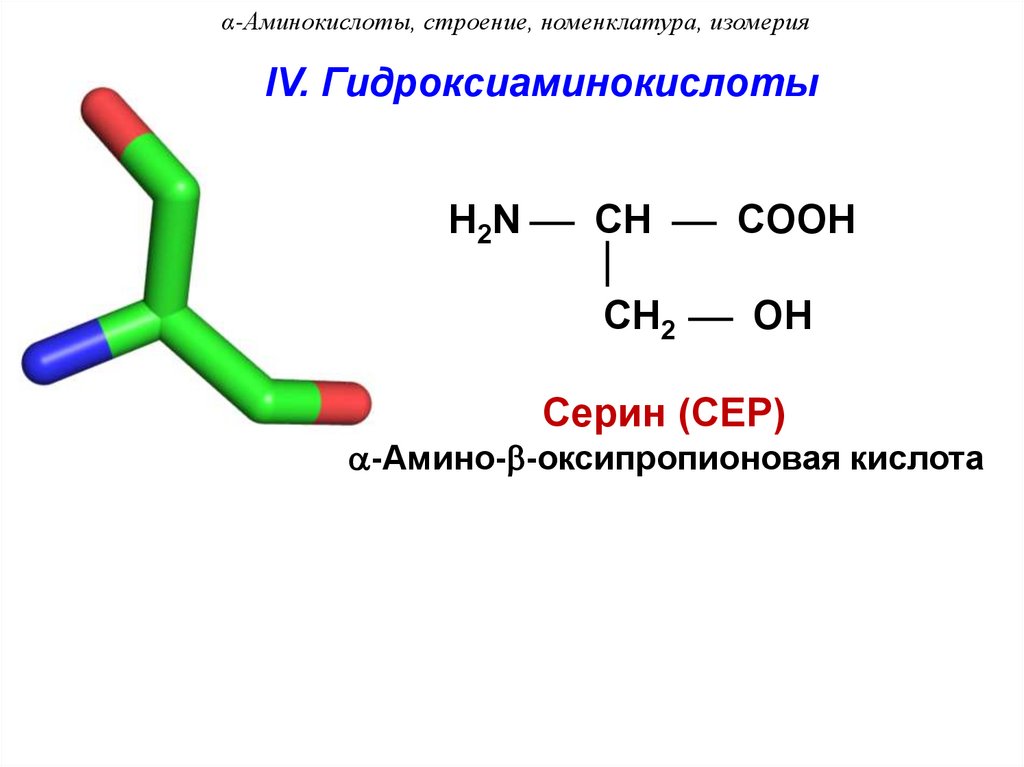
α-Аминокислоты, строение, номенклатура, изомерияIV. Гидроксиаминокислоты
H2N CH COOH
CH2 OH
Серин (СЕР)
-Амино- -оксипропионовая кислота
24.
α-Аминокислоты, строение, номенклатура, изомерияH2N CH COOH
CH OH
CH3
Треонин (ТРЕ)
-Амино- -оксимасляная
кислота
Боковые радикалы гидрофильные, но
неионогенные (имеют спиртовую природу).
25.
α-Аминокислоты, строение, номенклатура, изомерияV. Серосодержащие аминокислоты
H2N CH COOH
CH2 SH
Цистеин (ЦИС)
-Амино- -меркаптопропионовая
кислота
Боковой радикал гидрофильный, ионогенный,
несёт отрицательный заряд (- S CH2 ).
26.
α-Аминокислоты, строение, номенклатура, изомерияH2N CH COOH H2N CH COOH
CH2 S S CH2
Цистин (ЦИС-ЦИС)
, -Диамино- , -димеркаптопропионовая
кислота
Боковой радикал гидрофобный.
27.
α-Аминокислоты, строение, номенклатура, изомерияH2N CH COOH
CH2
CH2 S CH3
Метионин (МЕТ)
-Амино- -метилтиомасляная
кислота
Боковой радикал гидрофобный.
28.
α-Аминокислоты, строение, номенклатура, изомерияVI. Ароматические -аминокислоты
H2N CH COOH
CH2
Фенилаланин (Фен)
-Амино- -фенилпропионовая
кислота
Боковой радикал гидрофобный.
29.
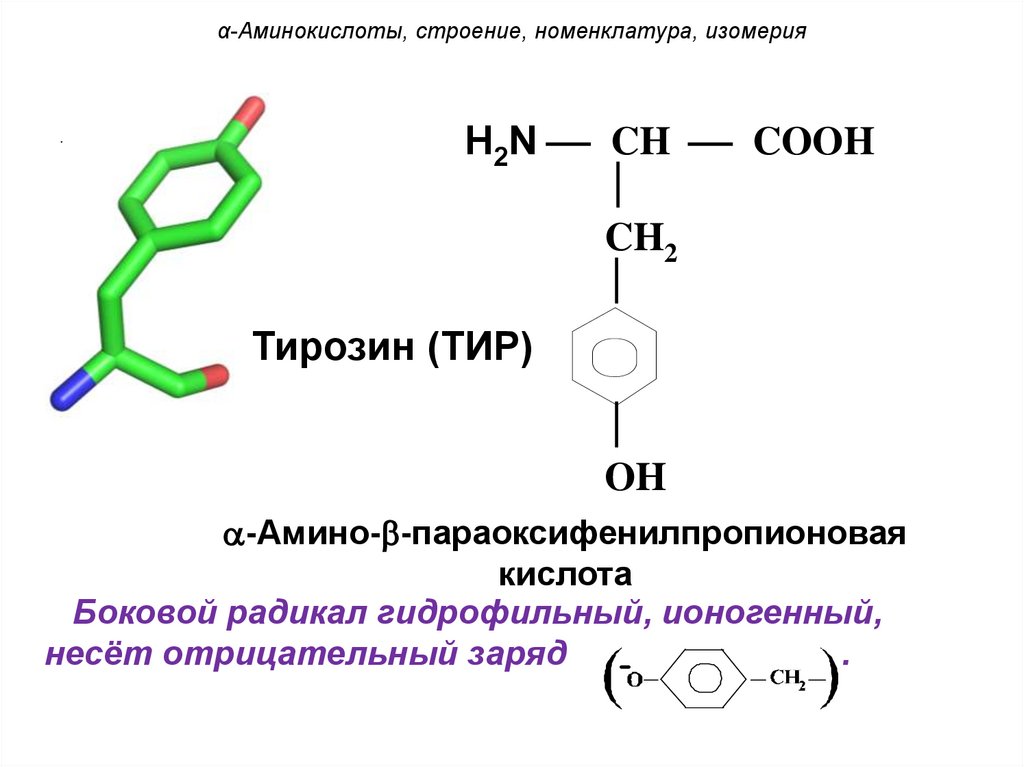
α-Аминокислоты, строение, номенклатура, изомерия.
H2N CH COOH
CH2
Тирозин (ТИР)
OH
-Амино- -параоксифенилпропионовая
кислота
Боковой радикал гидрофильный, ионогенный,
несёт отрицательный заряд
.
30.
α-Аминокислоты, строение, номенклатура, изомерияVII. Гетероциклические -аминокислоты
H2N CH COOH
CH2
Гистидин (ГИС)
HN
N
N
NH
α-Амино- -имидазолилпропионовая
кислота
Боковой радикал гидрофильный,
ионогенный, несёт положительный
заряд
H
31.
α-Аминокислоты, строение, номенклатура, изомерияH2N CH COOH
CH2
Триптофан (ТРИ)
H
-Амино- -индолилпропионовая
кислота
Боковой радикал гидрофобный.
32.
α-Аминокислоты, строение, номенклатура, изомерияИминокислоты
OH
H
Пролин (ПРО)
H
Оксипролин (ОПР)
У пролина боковой радикал гидрофобный,
у оксипролина – гидрофильный, ионогенный.
33.
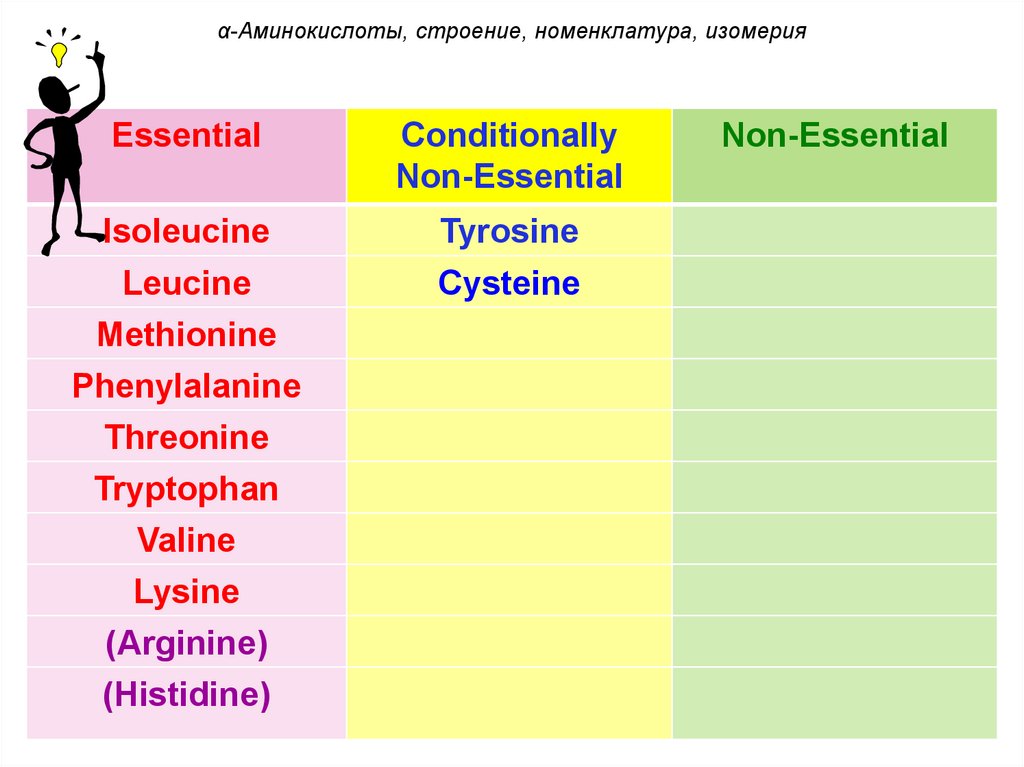
α-Аминокислоты, строение, номенклатура, изомерияII. По способности синтезироваться в
организме аминокислоты делятся на
незаменимые, условно заменимые и
заменимые.
К незаменимым
аминокислотам относят:
валин, изолейцин, лейцин,
триптофан, метионин,
фенилаланин, лизин,
треонин (аргинин и
гистидин относятся к
частично заменимым).
34.
α-Аминокислоты, строение, номенклатура, изомерияEssential
Isoleucine
Leucine
Methionine
Phenylalanine
Threonine
Tryptophan
Valine
Lysine
(Arginine)
(Histidine)
Conditionally
Non-Essential
Non-Essential
35.
α-Аминокислоты, строение, номенклатура, изомерияEssential
Conditionally
Non-Essential
Isoleucine
Leucine
Methionine
Phenylalanine
Threonine
Tryptophan
Valine
Lysine
(Arginine)
(Histidine)
Tyrosine
Cysteine
Non-Essential
36.
α-Аминокислоты, строение, номенклатура, изомерияEssential
Conditionally
Non-Essential
Non-Essential
Isoleucine
Leucine
Methionine
Phenylalanine
Threonine
Tryptophan
Valine
Lysine
(Arginine)
(Histidine)
Tyrosine
Cysteine
Alanine
Aspartate
Asparagine
Glutamate
Glutamine
Glycine
Serine
Proline
37.
α-Аминокислоты, строение, номенклатура, изомерия38.
Изоэлектрическая точка -аминокислотыВ твердом состоянии и водных растворах при
нейтральных значениях pH -аминокислоты
существуют преимущественно в виде
внутренних солей – цвиттер-ионов:
O
O
CH3 CH C
CH3 CH C
+
O
OH
NH
NH
2
3
цвиттер-ион
39.
α-Аминокислоты, строение, номенклатура, изомерияВ сильнокислой среде преобладает катионная
форма, в сильнощелочной – анионная.
+
CH3 CH
COOH
+
NH3
-H
+
+H
CH3 CH
COO -
+
NH3
+
-H
+
+H
CH3 CH
COO-
NH2
катионная
форма
цвиттер-ион
анионная
форма
Сильнокислая
среда
Нейтральная
Сильнощелочная
среда
40.
α-Аминокислоты, строение, номенклатура, изомерияЗначение pH, при котором концентрация
диполярных ионов максимальна, а
минимальные концентрации катионных и
анионных форм -аминокислоты равны,
называется изоэлектрической точкой (pI).
В изоэлектрической точке суммарный
заряд молекулы кислоты равен 0.
41.
α-Аминокислоты, строение, номенклатура, изомерияДля моноаминомонокарбоновых кислот pI ≈ 5-6,
pI моноаминодикарбоновых кислот (Asp, Glu) ≈ 3,
pI диаминомонокарбоновых кислот (His, Lys, Arg) ≈ 8-11.
Если pH меньше pI, AK имеет положительный
заряд и движется к катоду. Если pH больше pI,
AK имеет отрицательный заряд и движется к
аноду. Диполярные ионы не перемещаются в
электрическом поле.
42.
α-Аминокислоты, строение, номенклатура, изомерияНа этом основано разделение
-аминокислот методом
электрофореза.
43.
α-Аминокислоты, строение, номенклатура, изомерияIn vivo при физиологических значения рН
α-аминокислоты и белки находятся в
анионной форме, отрицательный заряд
которой уравновешивается катионами
натрия и калия.
44.
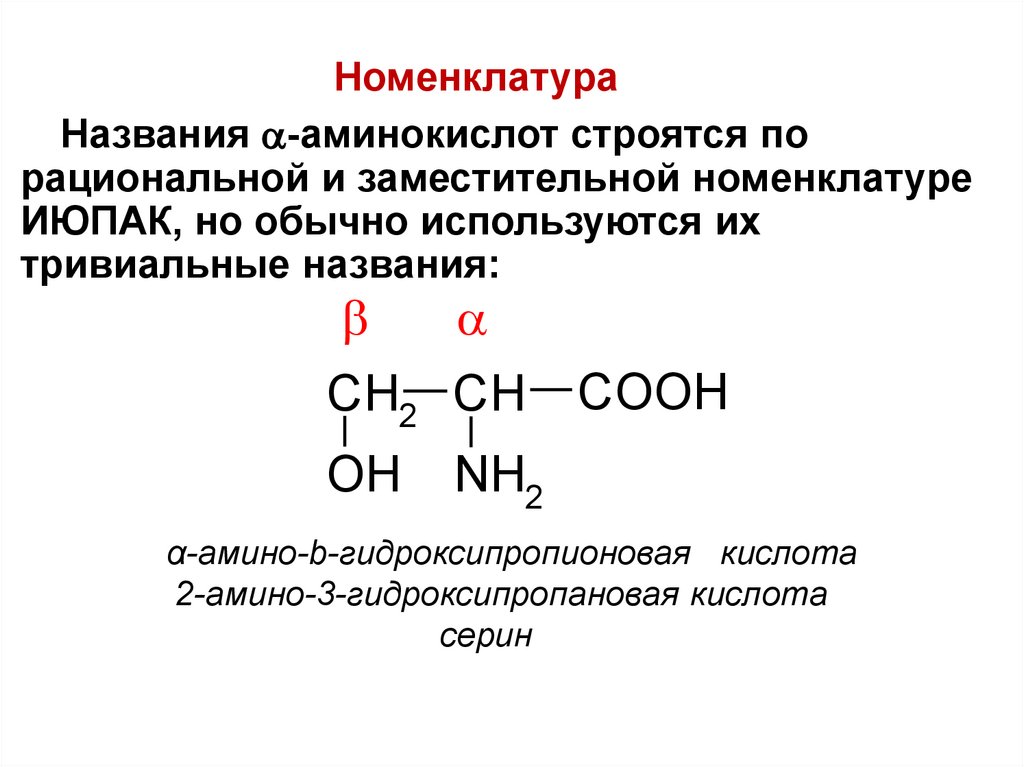
НоменклатураНазвания -аминокислот строятся по
рациональной и заместительной номенклатуре
ИЮПАК, но обычно используются их
тривиальные названия:
CH2 CH
OH
COOH
NH2
α-амино-b-гидроксипропионовая кислота
2-амино-3-гидроксипропановая кислота
серин
45.
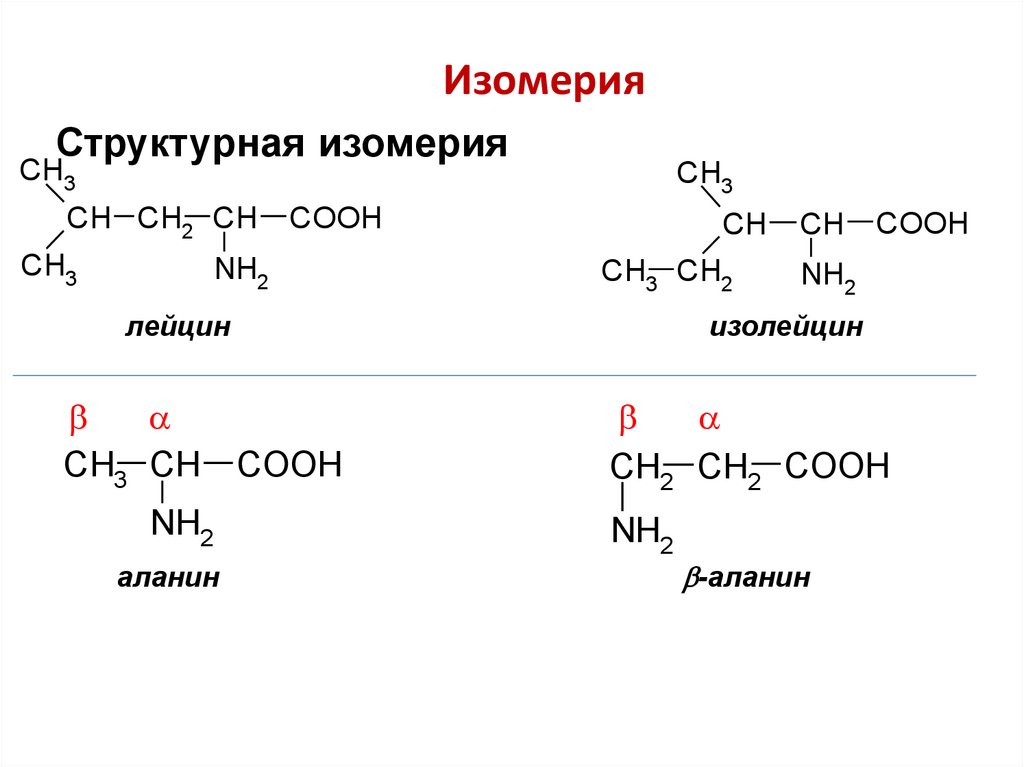
ИзомерияСтруктурная изомерия
CH3
CH CH2 CH
CH3
CH3
COOH
NH2
CH
CH3 CH2
лейцин
CH3 CH
NH2
аланин
CH
COOH
NH2
изолейцин
COOH
CH2 CH2 COOH
NH2
-аланин
46.
Стереоизомерияα - Аминокислоты – хиральные соединения,
обладающие оптической активностью.
Исключение составляет глицин:
H2N CH2 COOH
Зеркало Венеры, 1898,
Edward Jones.
Все объекты на этой
картине имеют зеркальные
отображения.
47.
α-Аминокислоты, строение, номенклатура, изомерияОтносительная конфигурация
-аминокислот определяется по
положению –NН2 группы у
α-углеродного звена.
Расположение аминогруппы
слева соответствует L-, справа –
D-конфигурации.
Почти все природные -аминокислоты
принадлежат к L-ряду.
48.
α-Аминокислоты, строение, номенклатура, изомерияСтереоизомерия
COOH
COOH
NH2
H
Формулы Фишера
H
H2N
R
R
COOH
COOH
H
NH2
R
D-аминокислота
Формулы с
H клиновидными
связями
H2N
R
L-аминокислота
49.
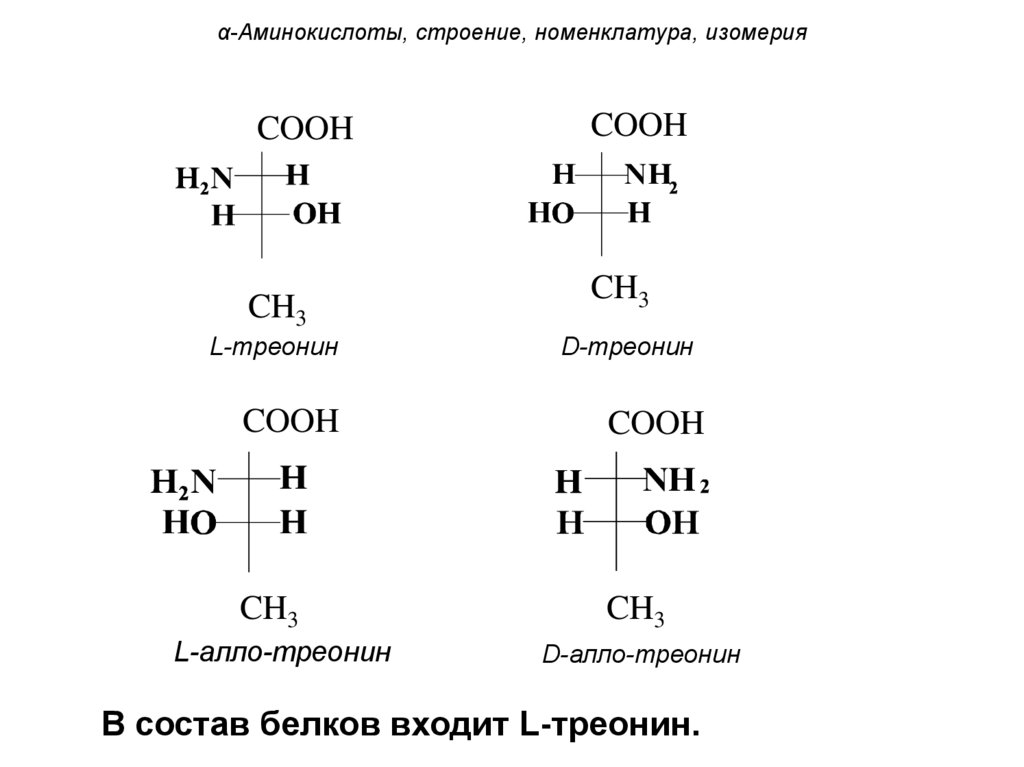
α-Аминокислоты, строение, номенклатура, изомерияCOOH
CH3
COOH
CH3
L-треонин
D-треонин
COOH
COOH
CH3
CH3
L-алло-треонин
D-алло-треонин
В состав белков входит L-треонин.
50.
Физические свойства-Аминокислоты – кристаллические
вещества. Имеют высокие температуры
плавления (выше 200 С), нелетучие,
растворимые в воде и нерастворимые в
неполярных органических растворителях.
Способность -аминокислот
растворятся в воде является важным
фактором обеспечения их биологического
функционирования – с нею связаны
всасываемость -аминокислот, их
транспорт в организме и т.п.
51.
Химические свойства-Аминокислоты – амфотерные соединения.
I. Реакции по группе -COOH
1. Солеобразование:
CH3 CH
NH2
аланин
COOH
+
NaOH
CH3 CH
COONa + H2O
NH2
2-аминопропионат натрия
52.
Химические свойства2. Реакция этерификации:
R
CH
NH2
COOH
+ CH3OH
HCl газ
R
CH
COOCH3
+
H2O
NH2
Метиловый эфир
аминокислоты
Используется для защиты карбоксильной группы
в синтезе пептидов
53.
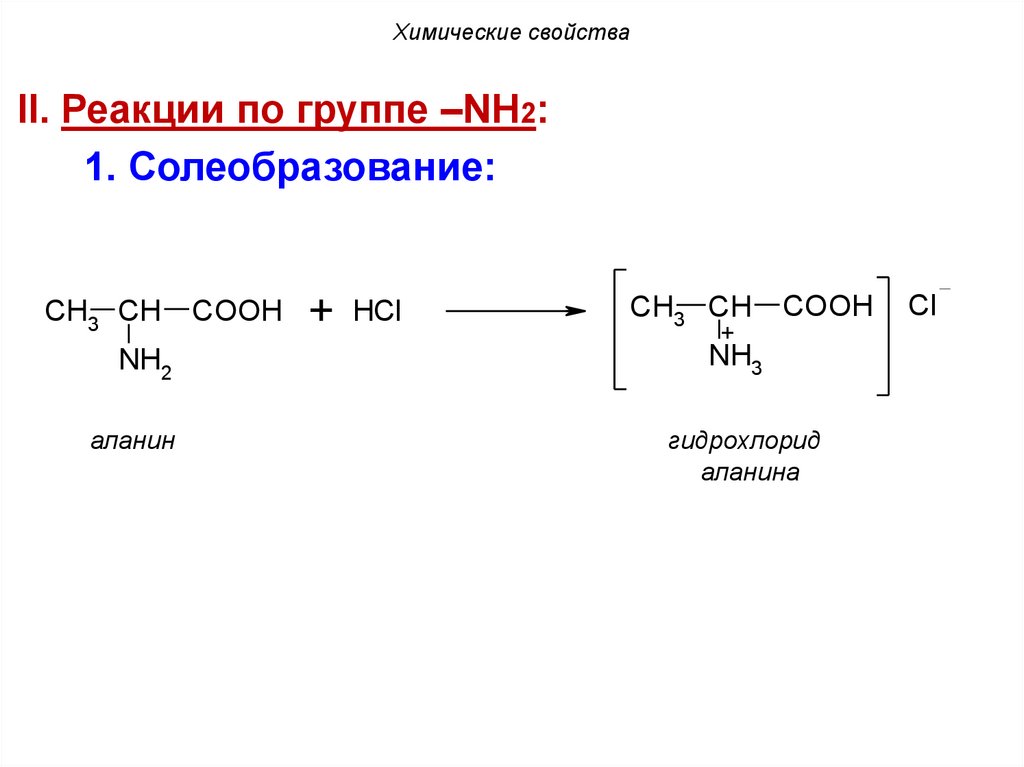
Химические свойстваII. Реакции по группе –NH2:
1. Солеобразование:
CH3 CH
COOH
+ HCl
CH3 CH
COOH
+
NH2
NH3
аланин
гидрохлорид
аланина
Cl
54.
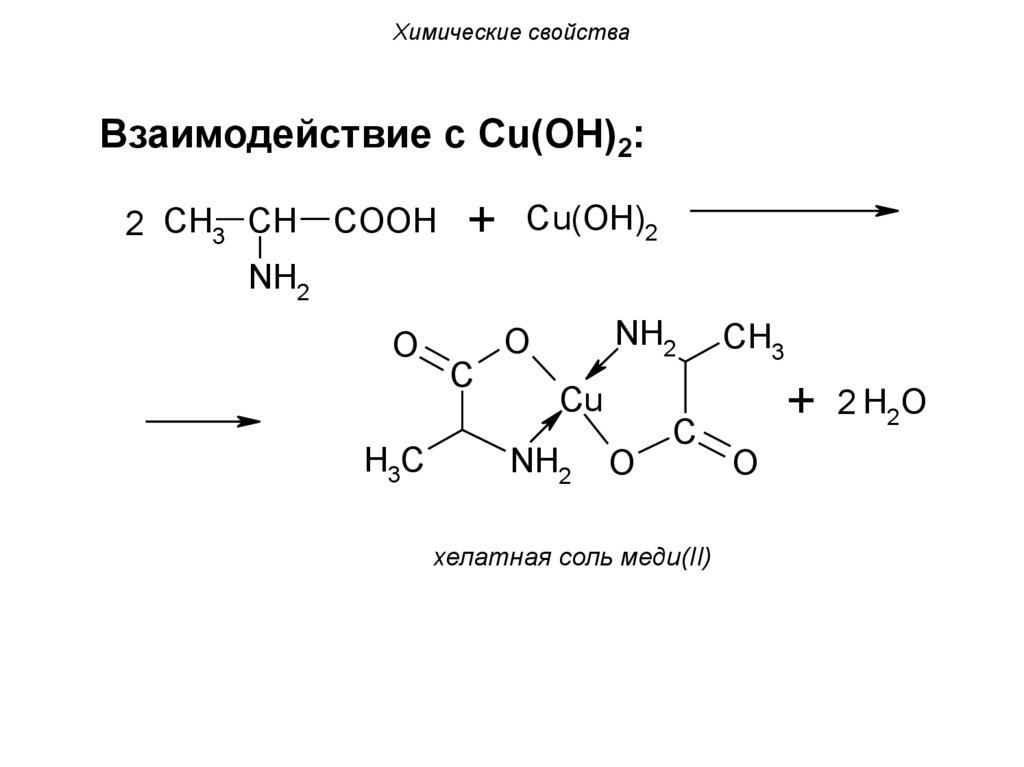
Химические свойстваВзаимодействие с Cu(OH)2:
2 CH3 CH
COOH
+ Cu(OH)2
NH2
O
H3C
NH2
O
C
CH3
+ 2 H2O
Cu
NH2
O
C
хелатная соль меди(II)
O
55.
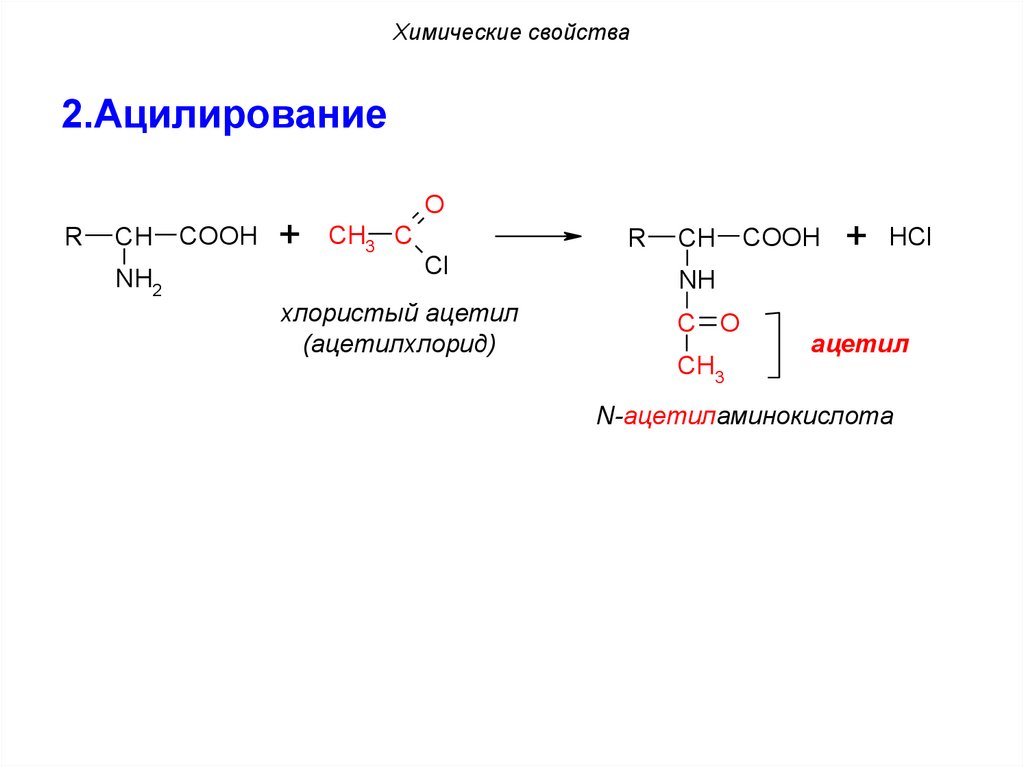
Химические свойства2.Ацилирование
O
R
CH
NH2
COOH
+ CH3 C
R
Cl
хлористый ацетил
(ацетилхлорид)
CH
COOH
+ HCl
NH
C O
CH3
ацетил
N-ацетиламинокислота
56.
Химические свойстваIII. Биологически важные химические реакции
57.
Химические свойства1. Декарбоксилирование – путь образования
биогенных аминов из -аминокислот.
Процесс идет с участием ферментов
декарбоксилаз:
N
N
CH2
H
гистидин
CH
COOH
декарбоксилаза
N
N
NH2
CO2
CH2
H
CH2
NH2
гистамин
Гистамин – важнейший медиатор аллергических реакций и
нейромедиатор, депонируется главным образом в тучных клетках
соединительной ткани и в базофильных гранулоцитах крови.
58.
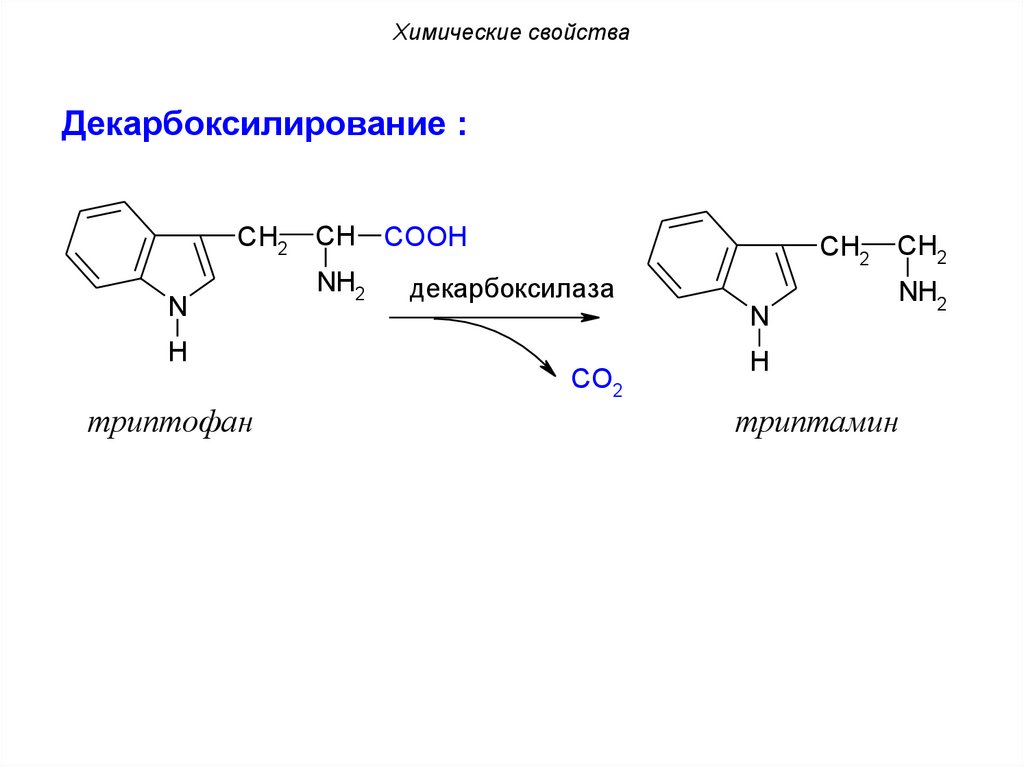
Химические свойстваДекарбоксилирование :
CH2
N
CH
NH2
COOH
CH2
декарбоксилаза
N
H
CO2
триптофан
CH2
NH2
H
триптамин
59.
Химические свойства2. Дезаминирование – это реакция удаления
аминогруппы путем окислительного,
восстановительного, гидролитического или
внутримолекулярного дезаминирования.
В организме преобладает путь окислительного
дезаминирования с участием ферментов
дегидрогеназ и кофермента – НАД+.
60.
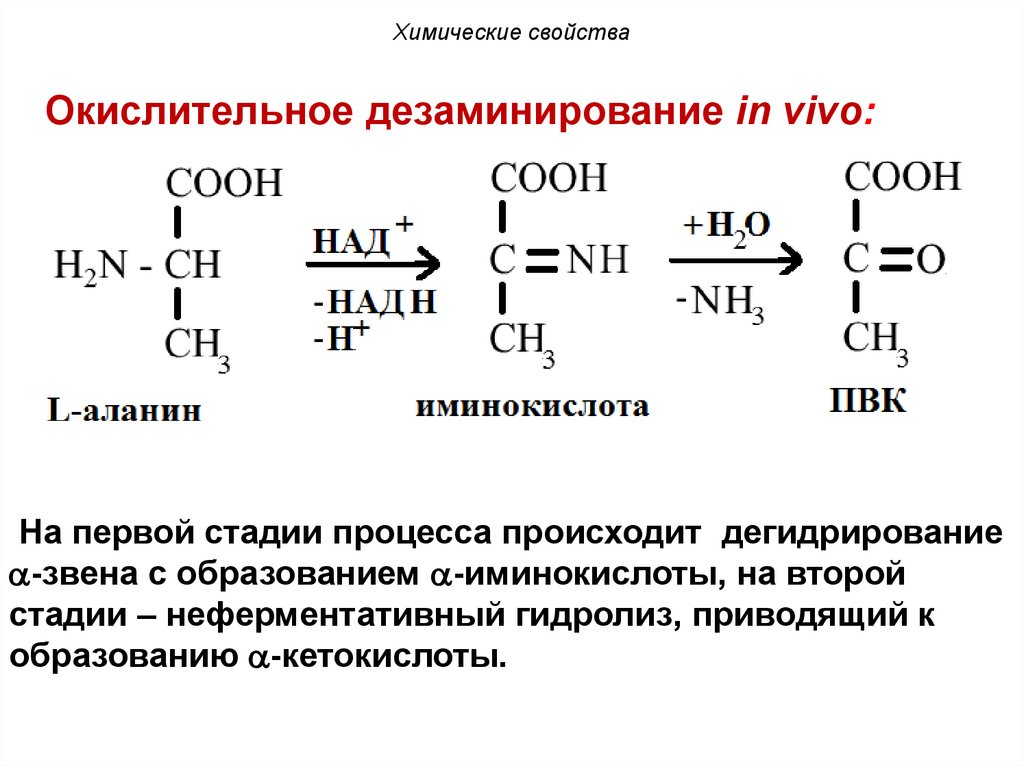
Химические свойстваОкислительное дезаминирование in vivo:
На первой стадии процесса происходит дегидрирование
-звена с образованием -иминокислоты, на второй
стадии – неферментативный гидролиз, приводящий к
образованию -кетокислоты.
61.
Химические свойства3. Трансаминирование (переаминирование) –
это путь синтеза необходимых -аминокислот
из -кетонокислот.
При этом донором аминогруппы является
-аминокислота, находящаяся в избытке, а
акцептором аминогруппы – -кетонокислота
(ПВК, ЩУК, -кетомаслянная кислота).
Процесс происходит с участием фермента –
аминотрансферазы (трансаминазы) и кофермента
пиридоксальфосфата.
62.
Химические свойстваТрансаминирование:
Процесс трансаминирования связывает обмен
белков и углеводов в организме, регулирует
содержание и синтез заменимых -аминокислот.
63.
Пептиды и белкиDiet cures more than lancet
64.
Пептиды и белкиПептиды (греч. πεπτος – питательный)
и белки – биополимеры, построенные из
-аминокислот.
Пептиды содержат до 100, белки свыше
100, олигопептиды – не более 10
аминокислотных остатков. Молекулярная
масса пептидов до 10000, белков от 10000
до нескольких миллионов.
65.
Функции белков• ферментативная
• транспортная
• гормональная
сигнальная
• структурная
collagen
двигательная
защитная
энергетическая
actin
66.
Пептиды и белкиКлассификация пептидов и белков
I. По составу белки делят на простые
(неконъюгированные) и сложные
(конъюгированные). Сложные белки состоят из
белковой и небелковой простетической
группы.
По ряду характерных свойств простые белки
можно разделить на несколько подгрупп:
альбумины, глобулины, гистоны, протамины,
проламины, склеропротеины.
К сложным белкам относятся:
фосфопротеины, нуклеопротеины,
хромопротеины, гликопротеины,
липопротеины.
67.
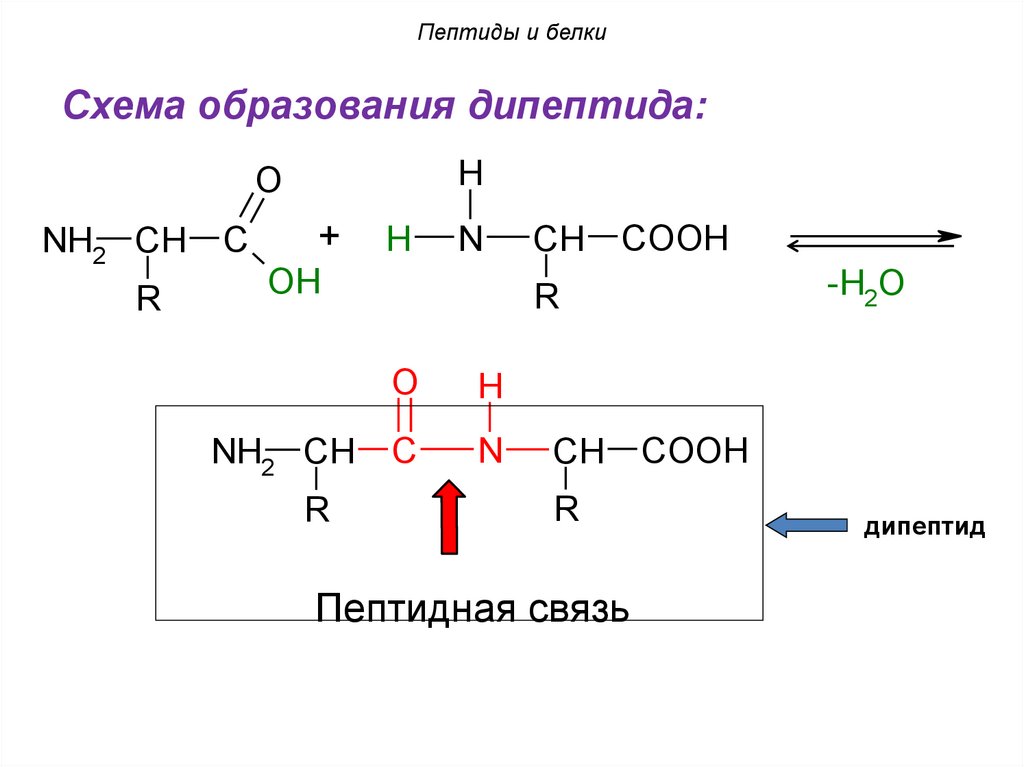
Пептиды и белкиСхема образования дипептида:
H
O
NH2 CH
R
C
+
H
N
OH
NH2 CH
R
CH
COOH
-H2O
R
O
H
C
N
CH
R
Пептидная связь
COOH
дипептид
68.
Пептиды и белкиСхема образования трипептида:
H
O
NH2 CH
CH3 CH
H
C
N
OH
H
CH C
CH2
+
OH
O
H
N
OH
CH
CH2
+
Треонин
OH
Фенилаланин
NH2 CH
CH3 CH
O
H
O
H
C
N
CH C
N
CH2
Тирозин
CH
CH2
OH
OH
Треонил-Фенилаланил-Тирозин
COOH
COOH
-H2O
69.
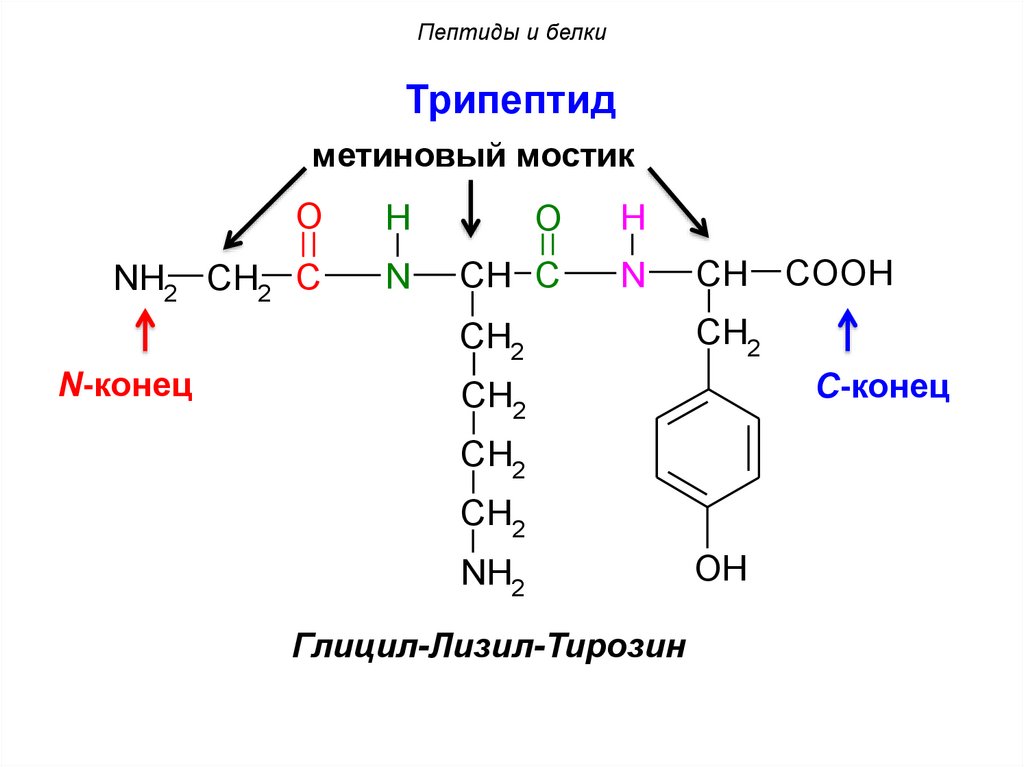
Пептиды и белкиТрипептид
метиновый мостик
O
H
O
H
NH2 CH2 C
N
CH C
N
CH2
N-конец
CH
CH2
С-конец
CH2
CH2
CH2
NH2
Глицил-Лизил-Тирозин
COOH
OH
70.
Пептиды и белкиНазвания пептидов строятся путём
последовательного перечисления аминокислотных
остатков, начиная с N-конца, с добавлением
суффикса -ил, кроме последней С-концевой
аминокислоты, для которой сохраняется её полное
название. Для остатка аспарагиновой кислоты
используется название аспартил.
71.
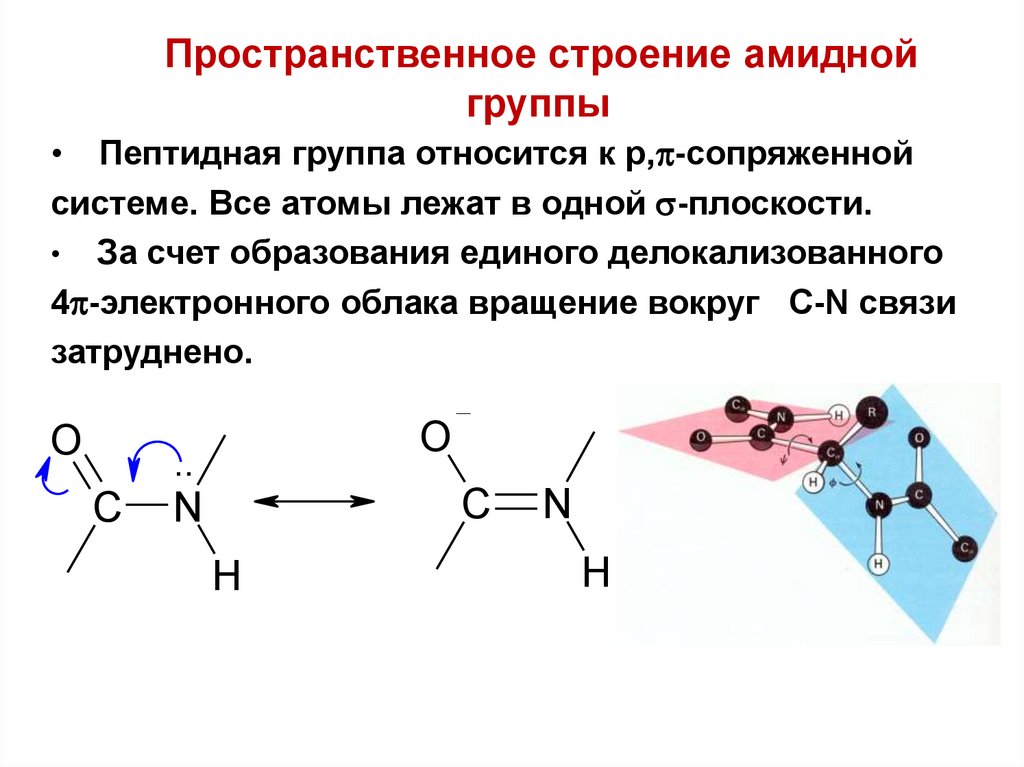
Пространственное строение амиднойгруппы
• Пептидная группа относится к р, -сопряженной
системе. Все атомы лежат в одной -плоскости.
• За счет образования единого делокализованного
4 -электронного облака вращение вокруг С-N связи
затруднено.
O
O
..
C
C
N
H
N
H
72.
Пептиды и белкиТрипептид
NH2 CH
O
H
O
H
C
N
CH C
N
CH2
CH3
CH
CH2
SH
CH2
COOH
Глутамил-Аланил-Цистеин
COOH
73.
Изоэлектрическая точка белкаИзоэлектрическая точка белка (pI) – это
значение
pH
раствора,
при
котором
макромолекула
белка
находится
в
изоэлектрическом состоянии (заряд молекулы
равен нулю).
Схематично диссоциацию при pH 7
гидратации) можно представить в виде:
H2N – R – COOH + H2O
-HO + +H N–R–COO- + H+
3
биполярный ион
(цвиттер-форма)
(с
учетом
HO+H3N – R – COOH
74.
Пептиды и белкиВ кислой среде белок заряжается положительно:
+H N – R – COO- + H+
3
+H N – R – COOH,
3
в щелочной – отрицательно:
+H N – R – COO- + OH3
HO+H3N – R – COO-,
В нейтральной среде заряд белковой молекулы
определяется соотношением количества свободных
групп –COOH и –NH2 и степенью их диссоциации.
Чем больше карбоксильных групп (–COOH), тем
выше отрицательный заряд, и белок будет
проявлять свойства слабой кислоты. Преобладание
амино-групп (-NH2) сообщает белку основные
свойства и положительный заряд.
75.
Пептиды и белкиpI для нейтрального белка находится в
нейтральной среде, для кислого – в кислой,
для основного – в щелочной.
Пептид: Тре-Фен-Тир содержит одну -COOH и одну -NH2
группы
pI равен 5-6.
Пептид: Гли-Лиз-Тир содержит одну -COOH и две -NH2
группы
pI равен 8-11.
Пептид: Глу-Ала-Цис содержит две -COOH и одну -NH2
группы
pI равен 3.
pH ˂ pI – молекула белка несет положительный
заряд, pH > pI – молекула белка отрицательный
заряд.
76.
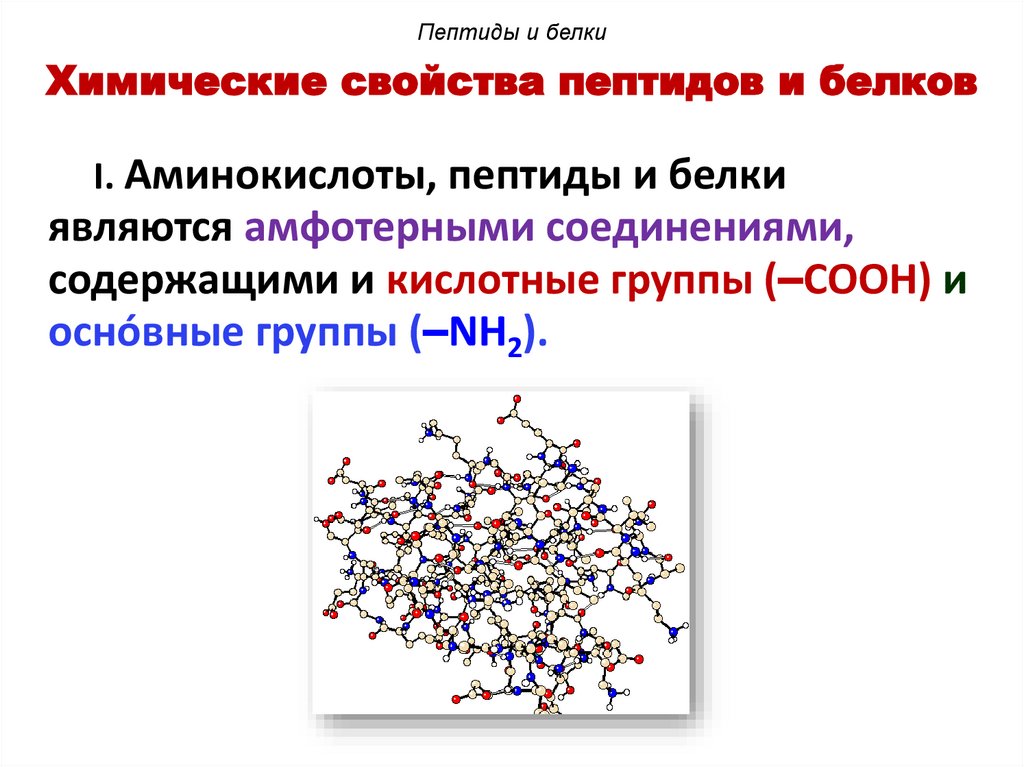
Пептиды и белкиХимические свойства пептидов и белков
I. Аминокислоты, пептиды и белки
являются амфотерными соединениями,
содержащими и кислотные группы (–COOH) и
оснóвные группы (–NH2).
77.
Пептиды и белкиII. По месту пептидных связей молекулы
белков гидролизуются:
а) in vivo с участием ферментов – пептидаз.
Среди пептидаз выделяют:
• эндопептидазы, расщепляющие связи внутри
макромолекулы;
• экзопептидазы, отщепляющие N- или C-концевую
-аминокислоту.
В организме белки расщепляются полностью, т.к.
для жизнедеятельности необходимы только
свободные -аминокислоты.
78.
Пептиды и белкиб) Гидролиз in vitro происходит в
сильнокислой или сильнощелочной среде
и используется для расшифровки состава
белков. В настоящее время расшифрован
состав 1500 белков, в том числе
ферментов и гормонов.
79.
Пептиды и белкиЦветные реакции
Биуретовая реакция
В реакцию вступают все пептиды и белки,
содержащие не менее двух пептидных связей.
Реактив – свежеприготовленный раствор
гидроксида меди(II). Пептиды и белки
реагируют аналогично биурету.
80.
Пептиды и белкиБиурет образуется из мочевины при
медленном нагревании до температуры
150 - 160 С.
O
O
O
O
H2N - C - NH2 + H2N - C - NH2 H2N - C - NH - C - NH2
- NH3
Биурет
81.
Пептиды и белкиПри взаимодействии пептидов с ионами
меди(II) в щелочных растворах образуется
хелатный комплекс (фиолетовое окрашивание).
82.
Пептиды и белкиНингидриновая реакция на -аминокислоты
Реактив – нингидрин. Продукт реакции
имеет сине-фиолетовый цвет.
O
O
OH
OH
O
+ RCHCOOH
NH2
O
+ RCHO + CO 2 + 3H2O
N
O
O
83.
Пептиды и белкиКсантопротеиновая
реакция
Определяет присутствие в
белке ароматических и
гетероциклических
-аминокислот:
• триптофана,
• фенилаланина,
• тирозина,
• гистидина.
84.
Пептиды и белкиРеактив: конц. HNO3
Образуется нитросоединение, окрашенное в желтый
цвет. При добавлении к нему щёлочи окраска
становится оранжевой.
85.
Химические свойства пептидов и белковРеакция Миллона на тирозин
Реактив Миллона: раствор
HgNO3 и Hg(NO2)2 в
разбавленной HNO3,
содержащей примесь HNO2.
86.
Пептиды и белкиРеактив Миллона взаимодействует с тирозином с
образованием ртутной соли нитропроизводного
тирозина, окрашенной в розовато-красный цвет:
87.
Пептиды и белкиРеакция Фоля
Это реакция на цистеин или цистин. При щелочном
гидролизе образуется сероводород, который, реагируя
со щелочью, дает сульфиды натрия или калия. При
добавлении ацетата свинца(II) образуется осадок.
88.
Пептиды и белкиосадок сульфида свинца(II) серо-черного цвета
89.
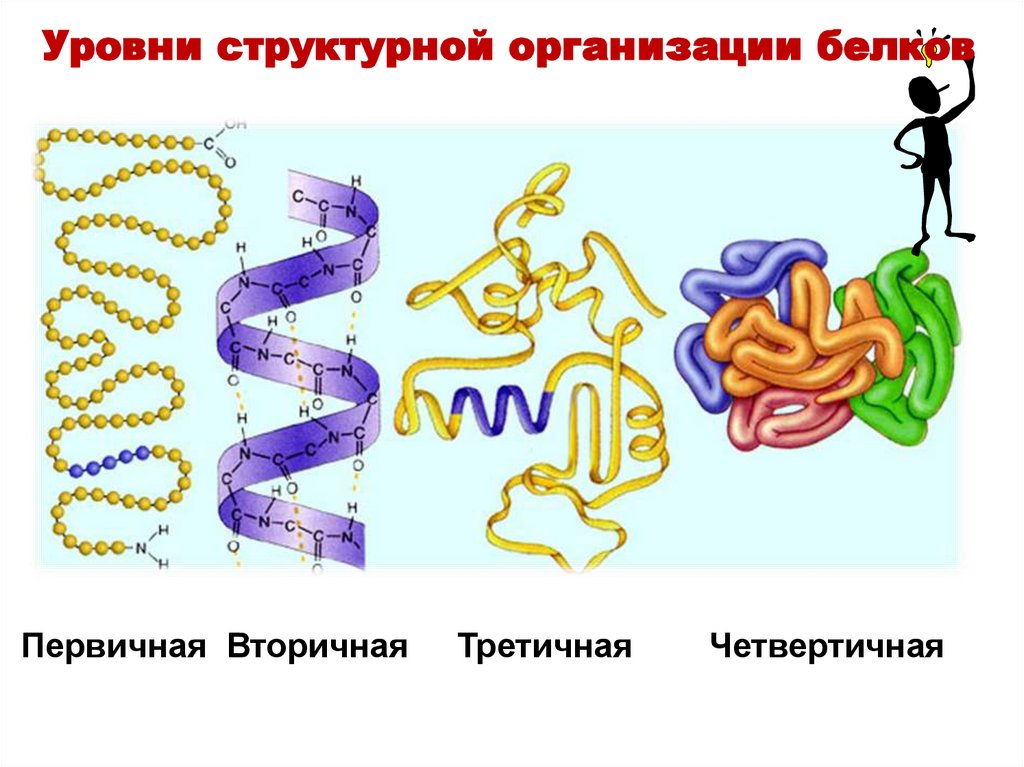
Уровни структурной организации белковПервичная Вторичная
Третичная
Четвертичная
90.
Пептиды и белки91.
Пептиды и белкиПервичная структура
Первичная структура –последовательность
аминокислотных остатков в молекуле
белка или пептида:
NH2-Tyr-Pro-Lys-Gly-Phe-Tyr-Lys-COOH.
Первичная структура определяет уровни
структурной организации белка.
92.
Пептиды и белкиЗамена Глу в шестом положении -цепи
гемоглобина на Вал приводит к серповидноклеточной анемии (sickle cell anemia).
93.
Пептиды и белки20 аминокислот могут дать примерно
100000000000000000000000000000000000000000
000000000000000000000000000000000000000000
000000000000000000000000000000000000000000
000000000000000000000000000000000000000000
000000000000000000000000000000000
белков,
состоящих из 150 остатков аминокислот.
Это астрономическое число – число гугол
умноженное на число гугол
(число гугол – это 10100)
94.
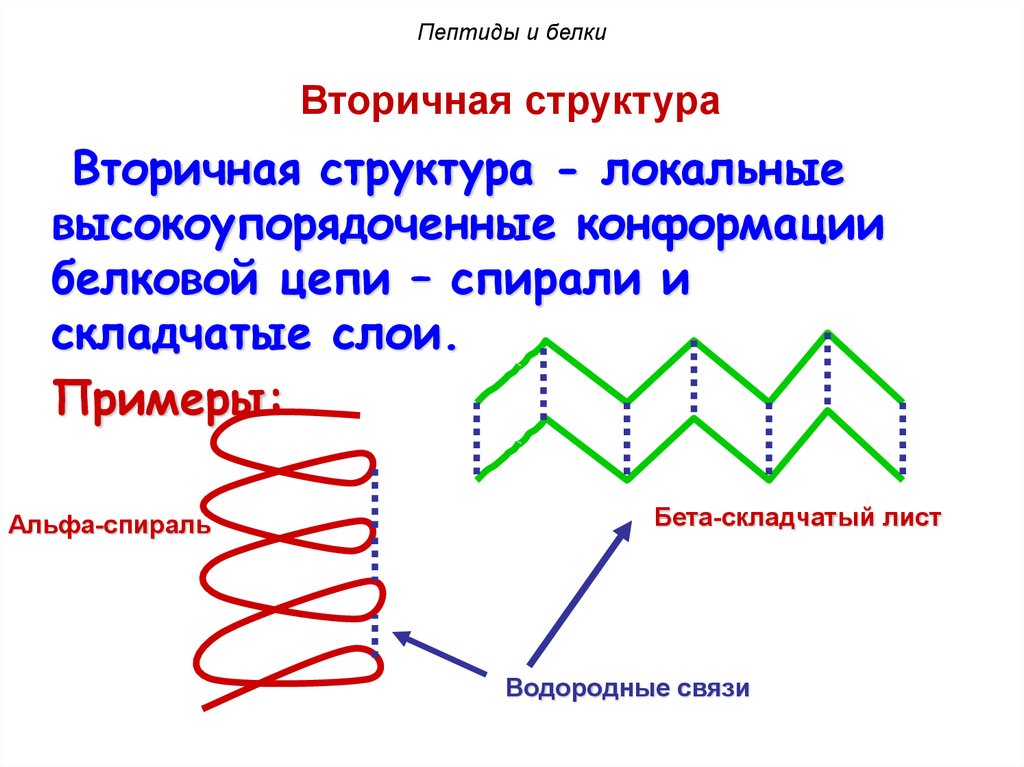
Пептиды и белкиВторичная структура
Вторичная структура - локальные
высокоупорядоченные конформации
белковой цепи – спирали и
складчатые слои.
Примеры:
Альфа-спираль
Бета-складчатый лист
Водородные связи
95.
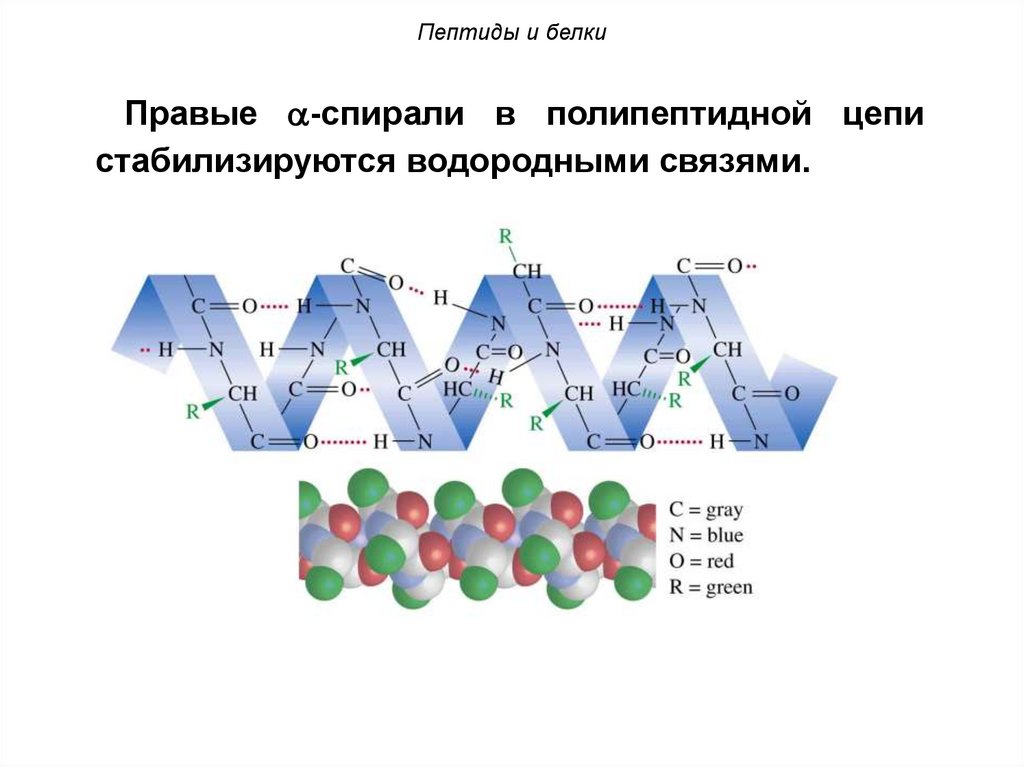
Пептиды и белкиПравые -спирали в полипептидной цепи
стабилизируются водородными связями.
96.
Пептиды и белкиВодородные связи в -спиралях
-Вал-Фен-Тир-Ала-Лей-
H
N
CH
CH3 CH
O
H
O
H
O
H
O
H
C
N
CH C
N
CH C
N
CH C
N
CH2
CH2
CH3
O
CH
C
CH2
CH
H3C
CH3
CH3
OH
Остатки АК: Первый
Второй
Третий
Четвёртый
-спираль – 413 спираль: остаток -аминокислоты образует
водородную связь с четвёртым по цепи остатком -аминокислоты; в
образующемся цикле 13 атомов.
97.
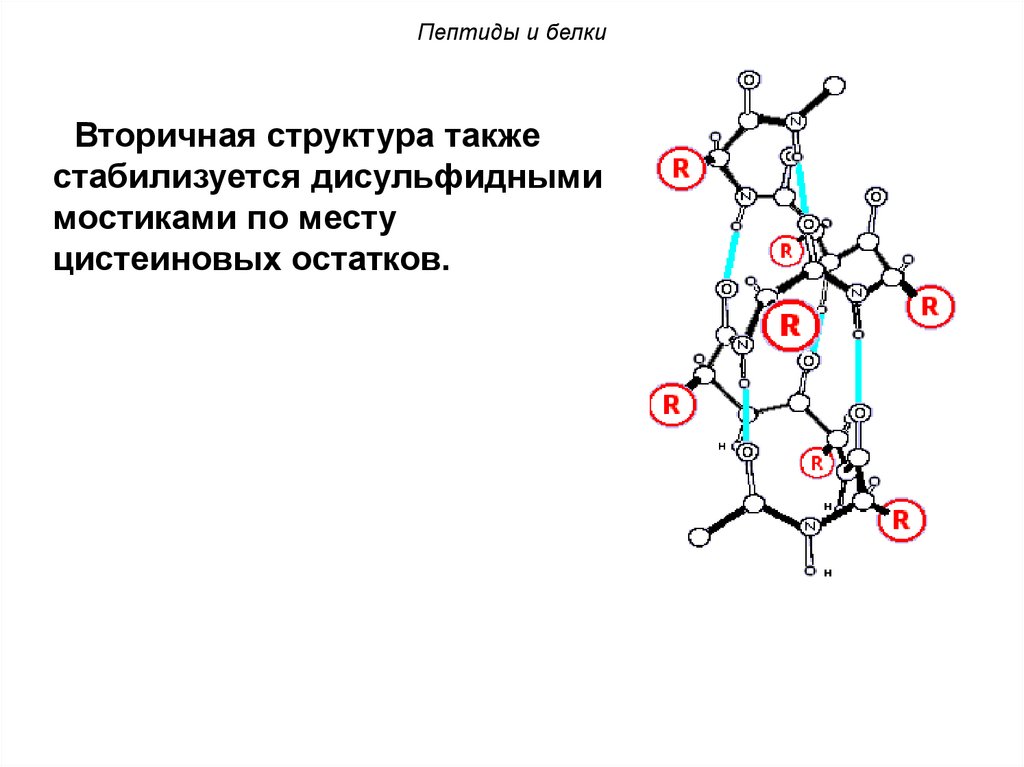
Пептиды и белкиВторичная структура также
стабилизуется дисульфидными
мостиками по месту
цистеиновых остатков.
98.
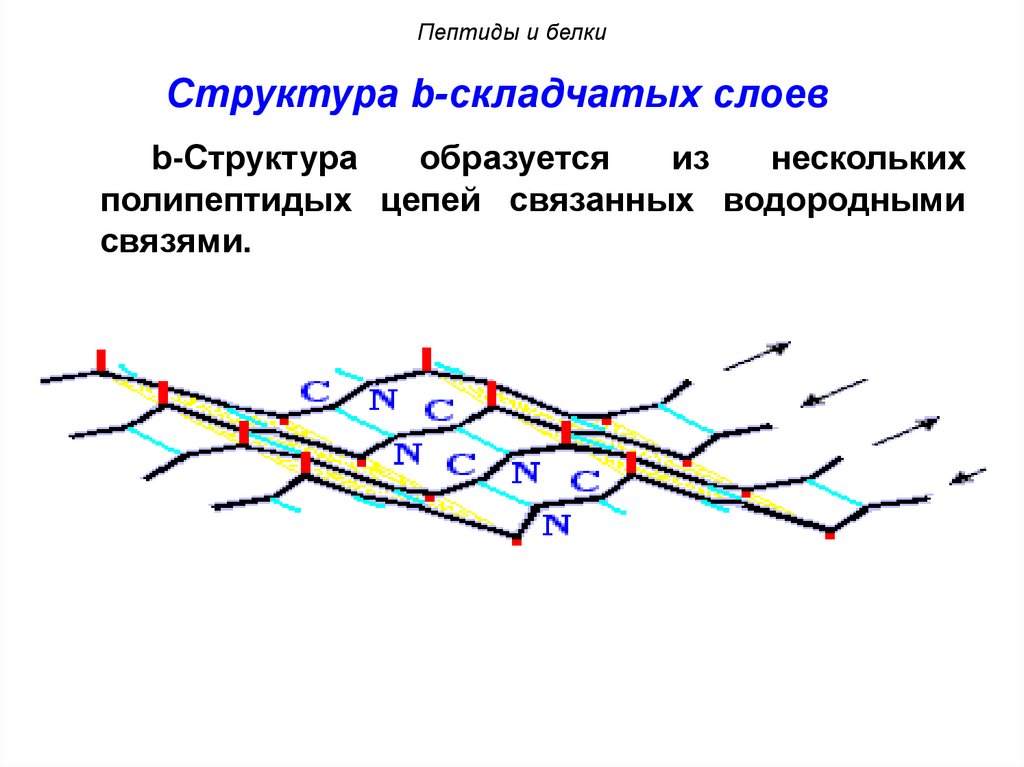
Пептиды и белкиСтруктура b-складчатых слоев
b-Структура
образуется
из
нескольких
полипептидых цепей связанных водородными
связями.
99.
Пептиды и белкиOH
HO
COOH
CH3
CH O
NH2 CH
C
CH3 O
N
CH C
...H
CH3 CH
C
N
CH2 C
CH2 O
N
CH C
...
...
O
NH2 CH
O
H
H
O
O
CH2
N
CH
COOH
...
O
H
N
CH C
N
CH C
N
CH C
N
CH
H
CH2
H
CH2
H
CH3
H
CH2
COOH
CH
CH3
H3C
CH3
OH
Тре-Ала-Гли-Сер-Асп
Вал-Фен-Тир-Ала-Лей
100.
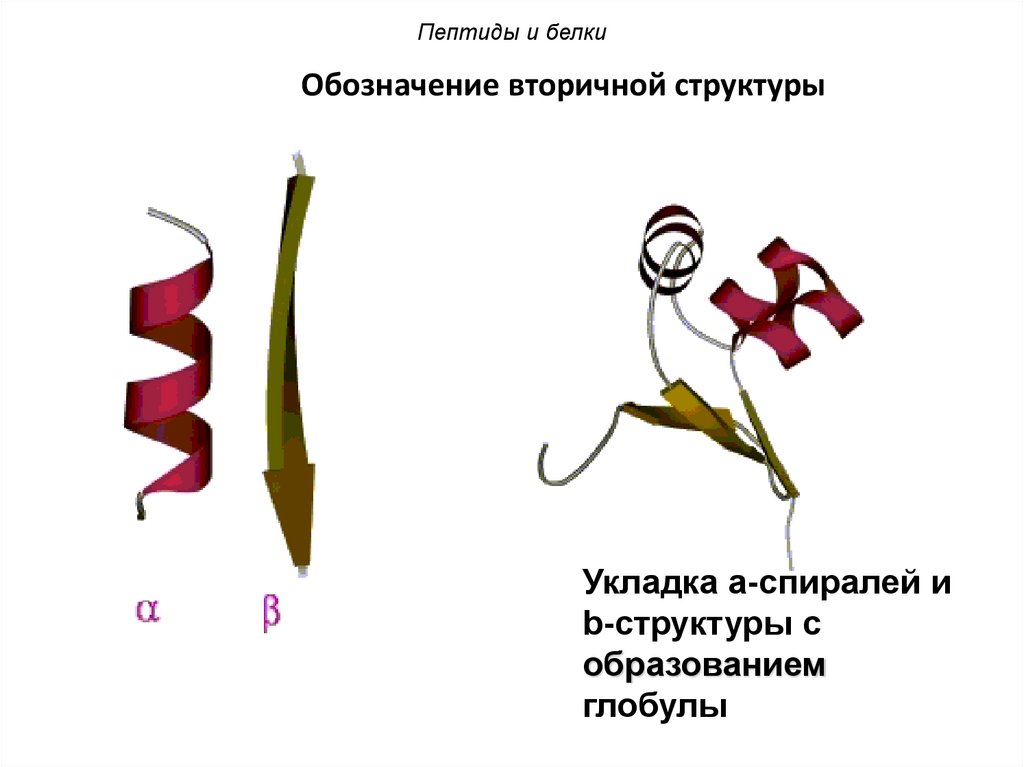
Пептиды и белкиОбозначение вторичной структуры
Укладка a-спиралей и
b-структуры с
образованием
глобулы
101.
Пептиды и белкиТретичная структура
Третичная структура – форма белковой
молекулы; трёхмерная структура белка.
Укладка нерегулярных областей и α- и b-структур в
глобулу определяет третичную структуру белка.
Альфа-спираль
Бета-спираль
102.
Пептиды и белкиТретичная структура стабилизируется за
счёт:
• ковалентных связей
(дисульфидные –S–S– связи)
• ионных связей
(Глу-COO- H3N+-Лиз)
• водородных связей
(Глу-COO-…HO-Тир)
• гидрофобных взаимодействий
(Вал, Лей, Иле, Фен).
103.
Пептиды и белкиУровни структурной организации белка
104.
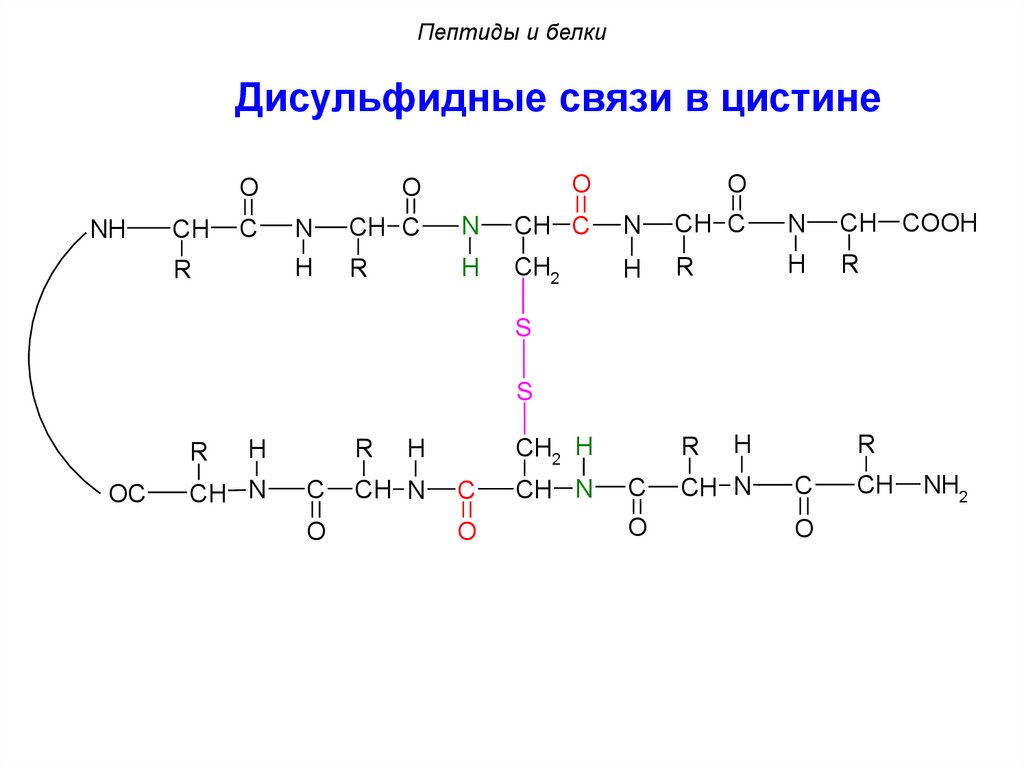
Пептиды и белкиДисульфидные связи в цистине
NH
CH
C
R
O
O
O
O
N
CH C
N
CH C
N
CH C
N
CH
H
R
H
CH2
H
R
H
R
COOH
S
S
R
OC
R
H
CH N
C
O
CH2 H
H
CH N
C
O
CH N
R
C
O
H
CH N
R
C
O
CH
NH2
105.
Пептиды и белкиДисульфидные связи
Структура лизоцима.
Дисульфидные связи
показаны пунктиром
106.
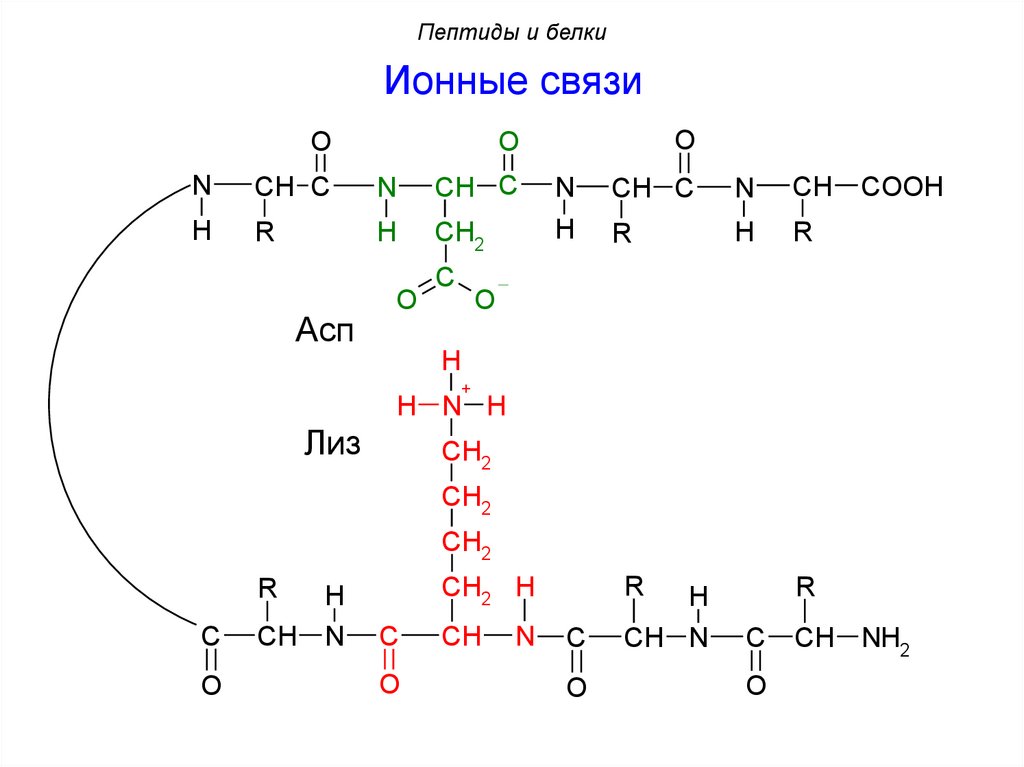
Пептиды и белкиИонные связи
O
O
O
N
CH C
N
CH C
N
CH C
N
CH
H
R
H
CH2
H
R
H
R
Асп
O
C
COOH
O
H
+
H N H
Лиз
CH2
CH2
CH2
R
C
O
CH
H
N
R
CH2 H
C
O
CH
N
C
O
H
CH N
R
C
O
CH NH2
107.
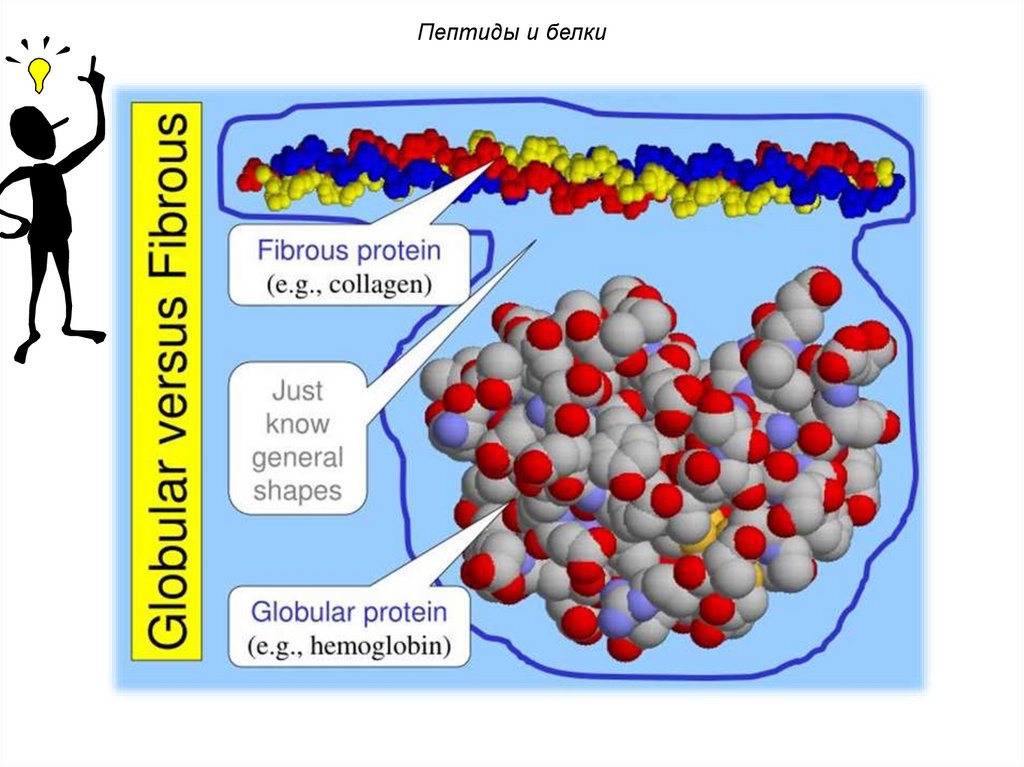
Пептиды и белкиПо третичной структуре белки делят на 2
вида:
глобулярные – для них характерна
-спиральная структура (яичный белок,
ферменты, глобин в составе гемоглобина);
фибриллярные – для них характерна
-структура (белки мышечной ткани –
миоинозин, бетта-кератин волос).
108.
Пептиды и белки109.
Пептиды и белкиГлобулярные белки выполняют функции,
требующие подвижности и, следовательно,
растворимости.
Они участвуют в регуляции жизненных
процессов:
гемоглобин
переносит
кислород из лёгких в ткани, ферменты
катализируют
многочисленные
химические реакции, протекающие в
организме,
антитела
обеспечивают
защиту от чужеродных организмов и т.д.
110.
Пептиды и белкиФибриллярные белки нерастворимы,
склонны к образованию волокон и потому
служат основным строительным
материалом животных клеток.
К числу фибриллярных белков
относятся кератин (в коже, волосах, рогах,
ногтях, перьях), коллаген (в сухожилиях),
миозин (в мышцах).
111.
Пептиды и белкиСериновая протеаза – трипсин
(КФ 3.4.21)
Родопсин
112.
Пептиды и белкиАцилтрансфераза (КФ 2.3…)
Пиктатлиаза С (КФ 4.2.2.2)
113.
Пептиды и белкиПараллельные -слои
карбоангидразы
(КФ 4.2.1.1)
Антипараллельные -слои
лектина
114.
Пептиды и белкиМитохондриальная
супероксиддисмутаза (КФ 1.15.1.1)
115.
Пептиды и белкиГлиоксилаза I (КФ 4.4.1.5)
Figura 4: Cofactores
116.
Пептиды и белкиЦитохром C
117.
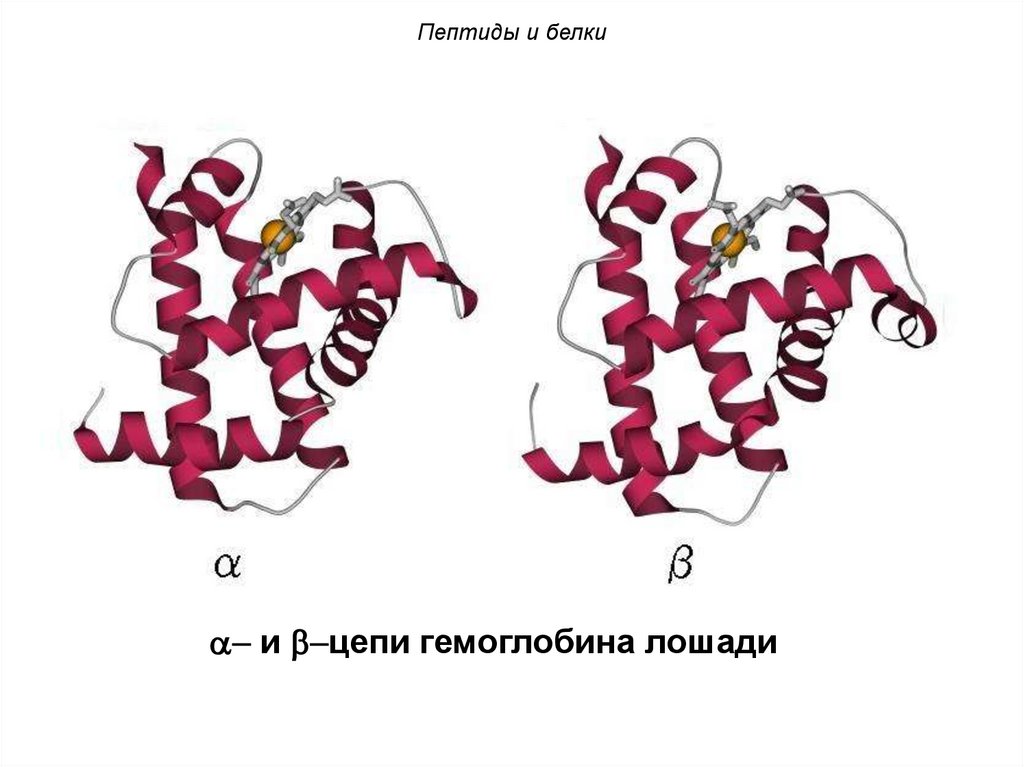
Пептиды и белки- и -цепи гемоглобина лошади
118.
Пептиды и белкиМембранные белки
119.
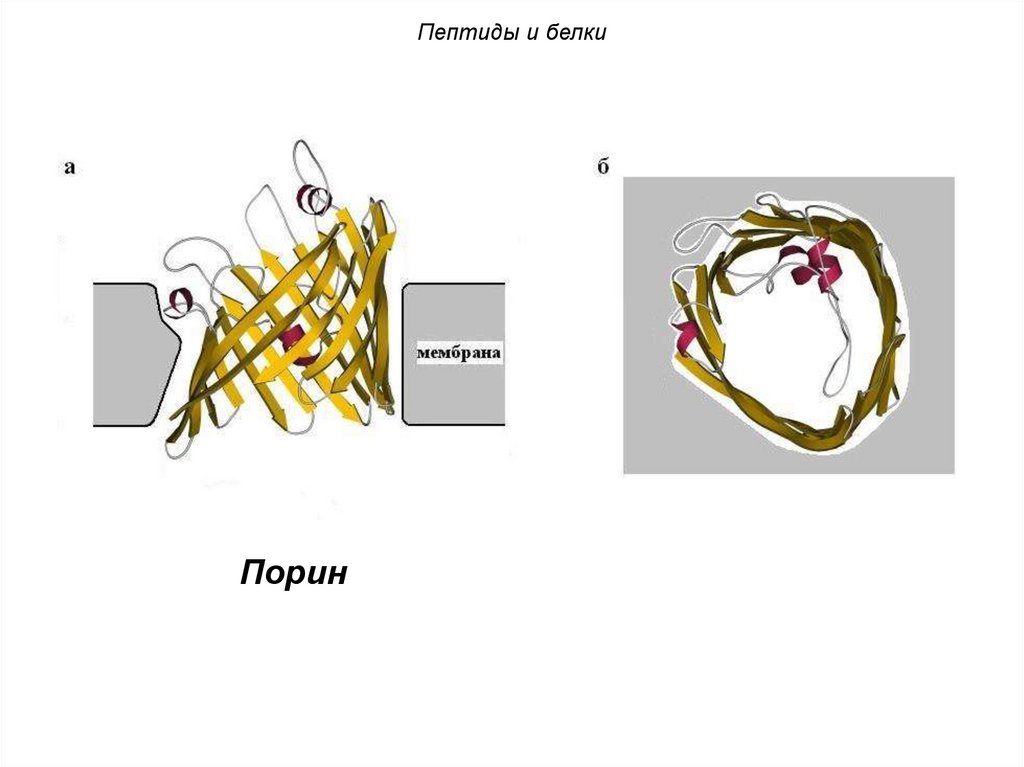
Пептиды и белкиПорин
120.
Пептиды и белкиФолдинг – сворачивание белковой цепи с образованием
нативной структуры.
121.
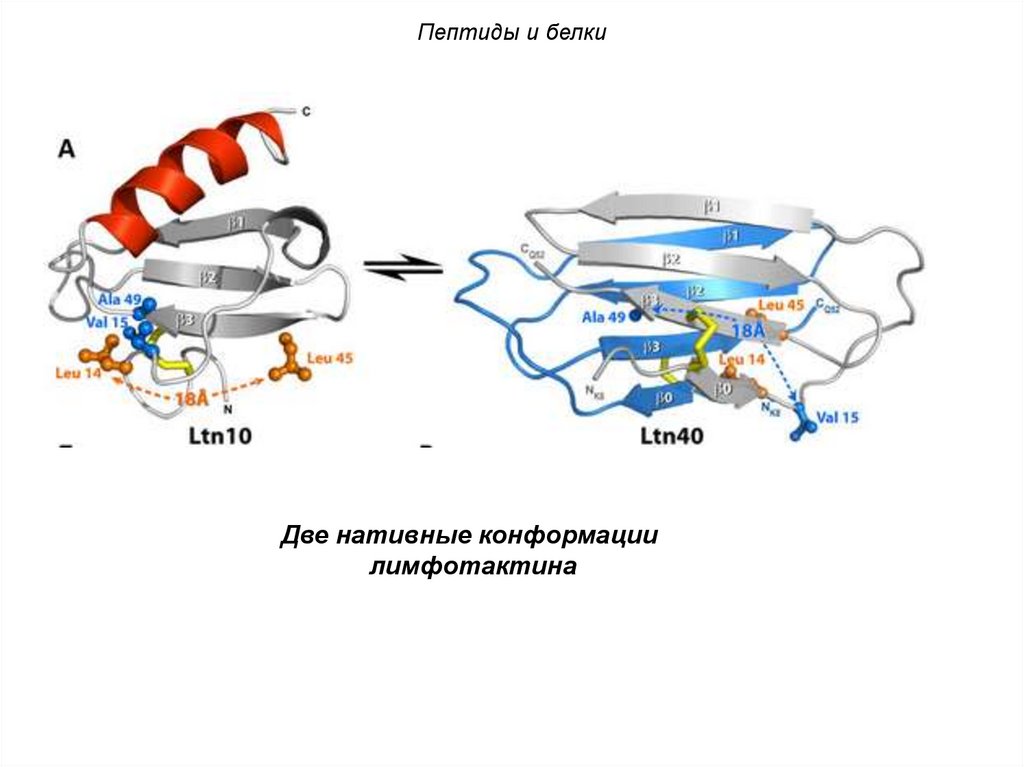
Пептиды и белкиДве нативные конформации
лимфотактина
122.
Пептиды и белкиБелок PrPC
Этот белок может
существовать в двух
конформациях –
“здоровой” PrPC, которую
можно обнаружить в
здоровых клетках и
“патологической” – PrPSc,
которая является
прионом. Для PrPC формы
характерно преобладание
-спиралей, а для PrPSc –
наличие -складчатых
слоёв.
123.
Пептиды и белкиГубчатые энцефалопатии (прионные
болезни)
Пространственная
структура приона –
аномального
инфекционного
белка.
Болезнь
Крейтцфельда-Якоба
Новый вариант
Крейцфельда-Якоба –
коровье бешенство
Болезнь Герстманна–
Штройсслера
Летальная семейная Абориген с
инсомния,
Южных гор
куру
Папуа-Новая
Гвинея.
124.
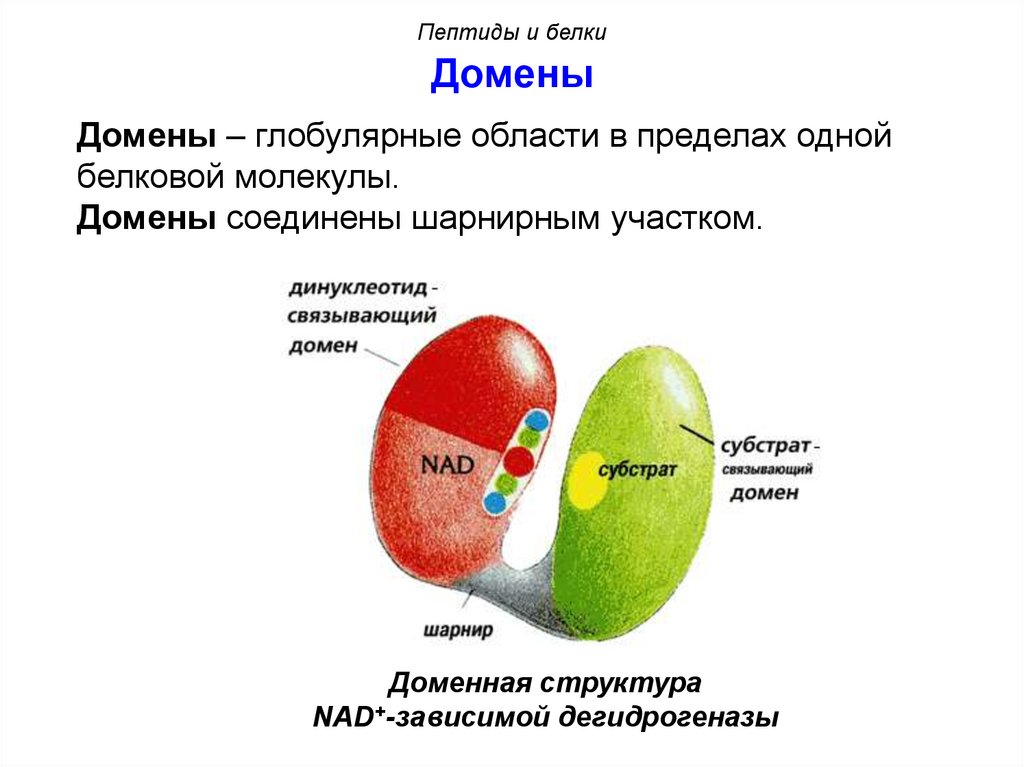
Пептиды и белкиДомены
Домены – глобулярные области в пределах одной
белковой молекулы.
Домены соединены шарнирным участком.
Доменная структура
NAD+-зависимой дегидрогеназы
125.
Пептиды и белкиЧетвертичная структура
Четвертичная структура – агрегат нескольких
белковых молекул, образующих одну структуру.
Взаимодействия: ионные, водородные, гидрофобные,
ковалентные (дисульфидные).
Протомер – отдельная полипептидная цепь.
Субъединица – функциональная единица.
Субъединица
126.
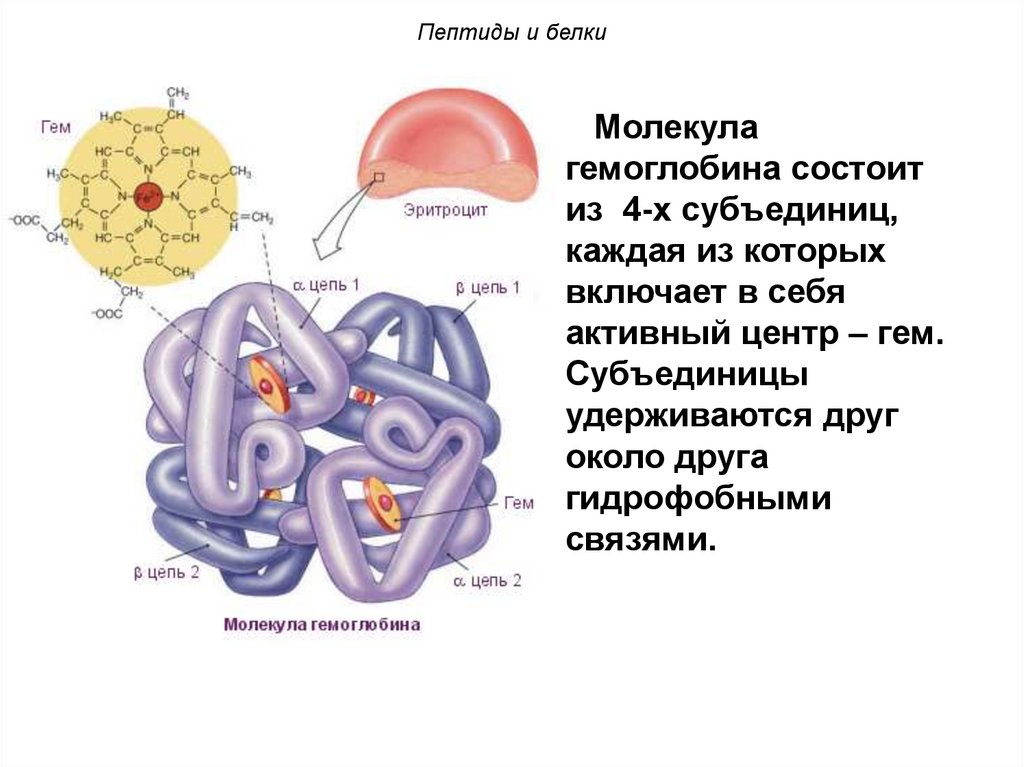
Пептиды и белкиМолекула
гемоглобина состоит
из 4-х субъединиц,
каждая из которых
включает в себя
активный центр – гем.
Субъединицы
удерживаются друг
около друга
гидрофобными
связями.
127.
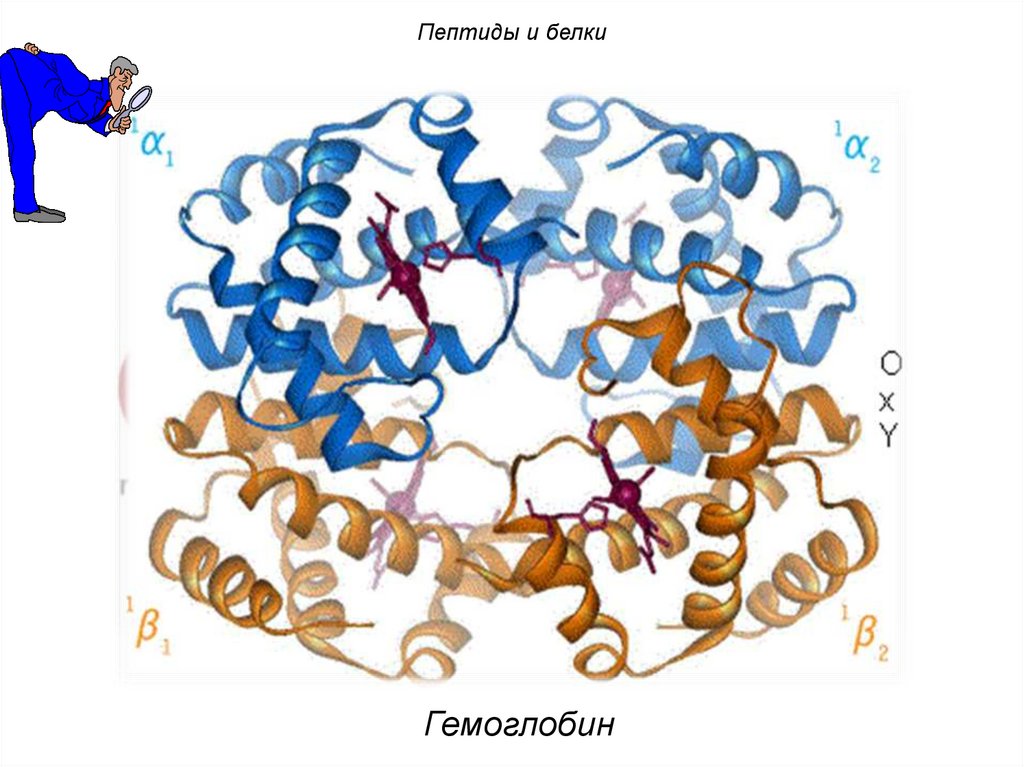
Пептиды и белкиГемоглобин
128.
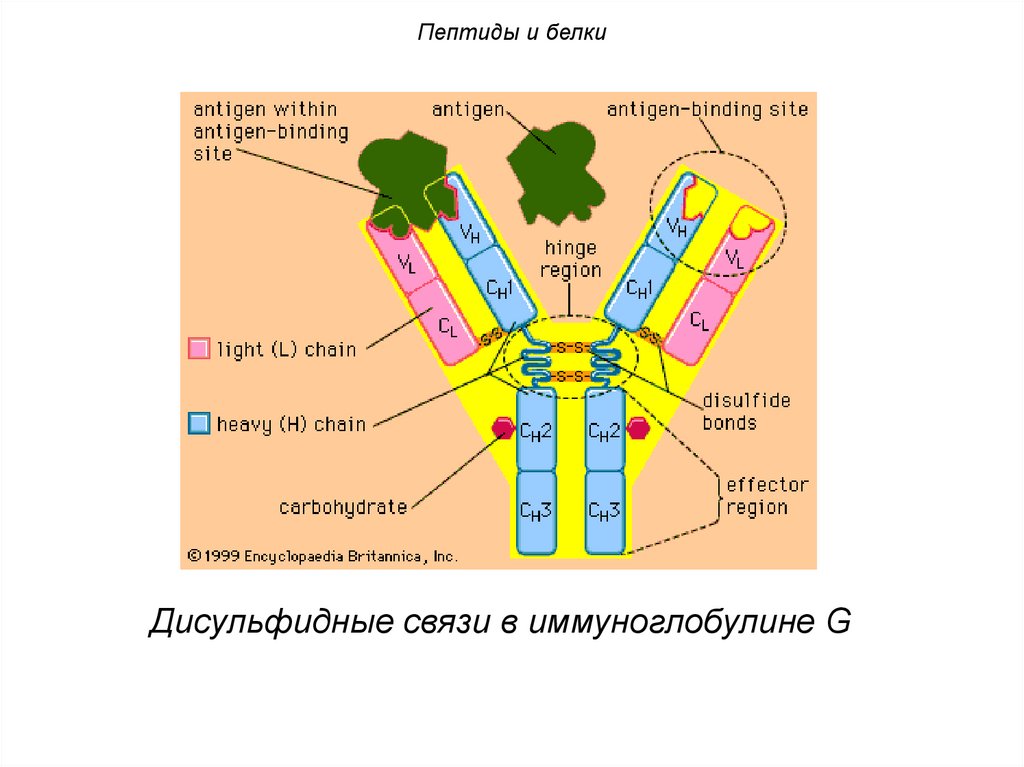
Пептиды и белкиДисульфидные связи в иммуноглобулине G
129.
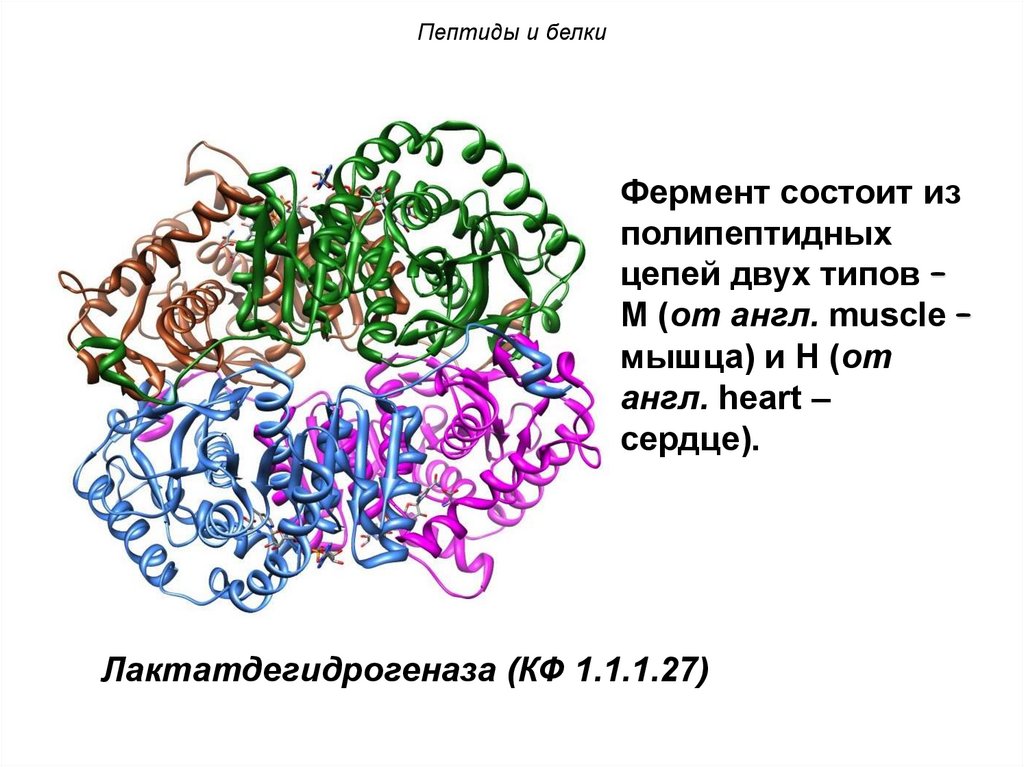
Пептиды и белкиФермент состоит из
полипептидных
цепей двух типов –
М (от англ. muscle –
мышца) и Н (от
англ. heart –
сердце).
Лактатдегидрогеназа (КФ 1.1.1.27)
130.
Пептиды и белкиПример четвертичной структуры – вирус табачной
мозаики: 2130 одинаковых молекул белка
расположены вокруг РНК вируса.
131.
Вопросы для самоконтроля1. Приведите классификацию α-аминокислот в
зависимости от характера радикала.
2. Охарактеризуйте химические свойства
a-аминокислот.
3. Перечислите известные Вам цветные
реакции на α-аминокислоты и белки.
4. Какие уровни структурной организации
белков Вы знаете?
132.
Спасибо за Вашевнимание!




























































































 Химия
Химия








