Похожие презентации:
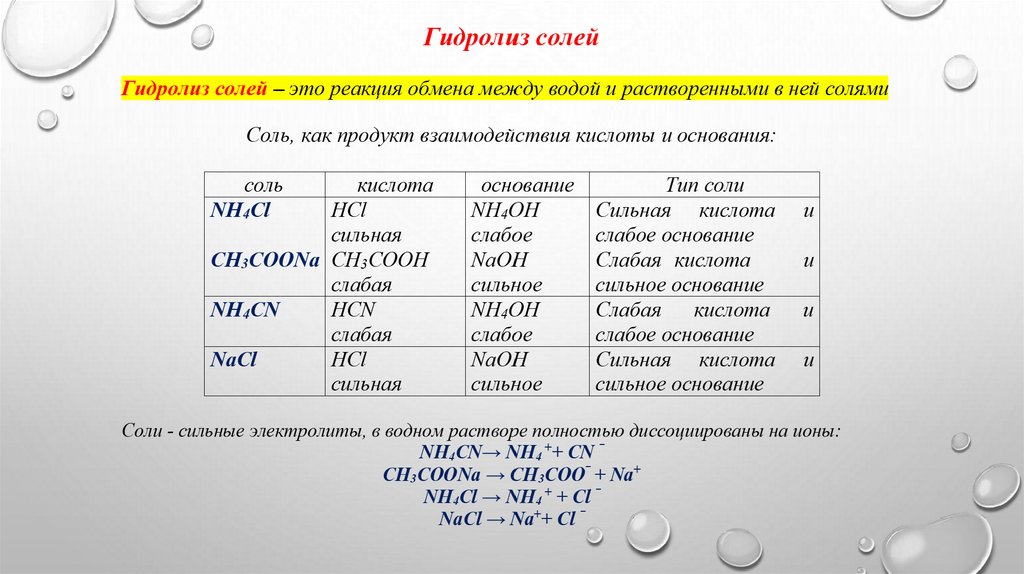
Гидролиз солей
1.
2.
1. Соль NH4Cl образована сильной кислотой НCl и слабым основанием NH4OHВ воде соль полностью диссоциирует на ионы: NH4Cl → NH4+ + Cl ‾
Гидролиз по катиону NH4+ (катионы соли взаимодействуют с водой, образуется слабое
основание и избыточное количество ионов H+)
Ионное уравнение гидролиза: NH4+ + Н2О <=> NH4OH + H+ кислая среда (рН <7)
степень гидролиза
= CГ / C0
где СГ - равновесная концентрация гидролизованных ионов;
С0 - исходная концентрация ионов соли, подвергающихся гидролизу.
Гидролиз – обратимый равновесный процесс
Кс =
КГ = Кс·[Н2О] =
=
=
Константа гидролиза КГ
Определяется природой реагентов
Не зависит от концентрации
Увеличивается с ↑Т, т.к. НГ 0 (эндотермический процесс)
3.
Связь константы гидролиза КГ и степени гидролиза[NH4OH] = [H+] = ∙C0 и
КГ = ( ∙C0)2 / (1- )∙C0 =
[NH4+] = (1- )∙C0
(аналогично закону Оствальда)
Если <<1, то КГ ≈ 2∙C0
и
=
=
Степень гидролиза увеличивается
с ↑ Т, т.к. НГ 0
с ↓ С0 (разбавление раствора)
Алгоритм расчета рН водного раствора соли, образованной сильной кислотой и
слабым основанием: рН =-lg аН+
аН+= γН+∙CН+
в разбавленных растворах γН+=1 и аН+= CН+
рН =-lg аН + = -lg CН+ = -lg ∙C0= -lg C0
= -lg
С0 - исходная концентрация катионов соли
4.
2. Соль Na2CO3 образована сильным основанием NaOH и слабой кислотой H2CO3В воде соль полностью диссоциирует на ионы: Na2CO3 → 2Na+ + CO32Гидролиз по аниону CO32- (анионы соли взаимодействуют с водой, образуется слабую
кислоту и избыточное количество ионов ОH-)
Гидролиз многозарядных ионов протекает ступенчато
Ионное уравнение гидролиза по 1 ой ступени:
CO3 2-+ Н2О <=> HCO3- + OH- щелочная среда (рН>7)
КС1=
КГ1= КС1·[Н2О] =
=
=
В выражение для расчета константы гидролиза по первой ступени КГ1 входит
константа диссоциации слабого электролита по последней ступени
5.
Ионное уравнение гидролиза по 2- ой ступени: НCO3‾ + Н2О <=> H2CO3 + OH ‾КС2=
КГ2 = Кс2·[Н2О] =
=
= K
KB
Д 1 кисл
КД2 < КД1 =>
КГ1 > КГ2
гидролиз идет преимущественно по первой ступени
Алгоритм расчета рН водного раствора соли, образованной слабой кислотой и
сильным основанием: рOН=-lg аОН‾
аОН‾ = γ ОН‾ ∙СОН‾
в разбавленных растворах γ ОН‾ =1 и а ОН‾ = с ОН‾
рОН=-lg аОН‾= -lg С ОН‾ = -lg ∙С0= -lg C0
рН=14 – рOH
С0 - исходная концентрация анионов соли
= -lg
6.
3. Соль NH4CN образована слабой кислотой HCN и слабым основанием NH4ОНВ воде соль полностью диссоциирует на ионы: NH4СN→ NH4 ++ CN ‾
Ионное уравнение гидролиза:
Гидролиз и по катиону NH4+ (катионы соли взаимодействуют с водой, образуется слабое
основание и избыточное количество ионов H+)
NH4+ + Н2О <=> NH4OH + H+
и по аниону CN‾ (анионы соли взаимодействуют с водой, образуется слабую кислоту и
избыточное количество ионов ОH-)
СN ‾ + Н2О <=> HСN + OH‾
Суммарный процесс гидролиза:
NН4+ + СN + Н2О NН4ОН + НСN
(анионы и катионы соли одновременно взаимодействуют с водой, рН среды определяется
соотношением КД-осн и КД-кисл)
КГ =
KB
K Д осн К Д кисл
КД(NH4OH)=1,79 10-5 > КД(НСN) =7,9 10-10 pH > 7
7.
= КГ = КСтепень гидролиза не зависит от С0:
Концентрация ионов Н не зависит от С0:
+
CН+=
КВ
Д осн К Д кисл
К В К Д кисл
К Д осн
Алгоритм расчета рН водного раствора соли, образованной слабой кислотой и
слабым основанием: рН =-lg аН+
аН+= γН+∙CН+
в разбавленных растворах γН+=1 и
рН =-lg аН + = -lg CН+ = -lg
аН+= CН+
К В К Д кисл
К Д осн
Если в результате гидролиза образуются труднорастворимые или газообразные вещества,
то равновесие полностью смещается в сторону продуктов гидролиза и делает его
необратимым
Например:
Al2S3 + 6H2O = 2Al(OH)3 + 3H2S
8.
4.Соль NaCl образована сильной кислотой НCl и сильными основанием NaОН
В воде соль полностью диссоциирует на ионы: NaСl→ Na ++ Cl ‾
Гидролиз не идет, рН ᵙ 7
Гидролиз – обратимый равновесный процесс, характеризуется константой гидролиза
Сместить гидролитическое равновесие в сторону усиления гидролиза можно путем
разбавления
повышения температуры (эндотермическая реакция)
удаления продуктов гидролиза из сферы реакции
9.
Пример 1. Рассчитайте константу гидролиза сульфит-иона по 1-й и 2-й ступени исделайте вывод о возможности протекания гидролиза по 2-й ступени.
Решение: запишем уравнения гидролиза иона SO32- по двум ступеням и выражения для
соответствующих констант гидролиза:
1 ступень, ионное уравнение гидролиза: SO3²ˉ + H2O HSO3 ‾+ OHˉ,
Выражение для константы гидролиза: KГ1 = [НSO3ˉ]· [OHˉ] / [SO3²ˉ] = KВ / KД2
2 ступень, ионное уравнение гидролиза: HSO3‾ + H2O H2SO3 + OHˉ
Выражение для константы гидролиза: KГ2 = [H2SO3] · [OH‾] / [HSO3‾] = KВ / KД1
Уравнение диссоциации слабой сернистой кислоты:
1) H2SO3 Н++ HSO3‾ KД1 = 1,7·10-2
2) HSO3‾ Н++ SO3²ˉ
КД2 = 6, 3·10-8
Для расчета КГ по 1-й ступени следует использовать константу диссоциации слабого
электролита по последней ступени и наоборот:
KГ1 = 10-14 /6, 3·10-8= 1,59·10-7
KГ2 = 10-14 /1, 7·10-2= 5,9·10-13
KГ1>> KГ2
=> малая величина КГ2 свидетельствует о том, что гидролиз сульфит-иона
по 2-й ступени практически не идет
10.
Пример 2. Рассчитайте рН и определите реакцию среды 0,01 М водного раствора КNО2.Решение: Соль КNО2 образована сильным основанием КОН и слабой кислотой HNO2
c0
c0
c0
В воде соль полностью диссоциирует на ионы: КNО2 → K+ + NO2¯
Гидролиз по аниону NO2¯ (анионы соли взаимодействуют с водой, образуется слабую кислоту
и избыточное количество ионов ОH-)
Ионное уравнение гидролиза:
NO2¯+ Н2О <=> HNO2 + OH¯
с равн: c0 - β‧c0
β‧c0
β‧c0
щелочная среда (рН>7)
Выражение для константы гидролиза:
KГ = [HNO2]· [OHˉ] / [NO2ˉ] = KВ / KД = 10-14/4,6‧10-4 = 2,2‧10-9
=
=√ (2,2‧10-9/0,01) = 4,7‧10-4
[OHˉ]= β‧c0= 4,7‧10-4‧0,01=4,7‧10-6 моль/л
pH = 14 – рОН= 8,67
рОН = - lg[OHˉ]= 5,33
11.
2 способ расчета - через материальный баланс:cравн
NО2 + НОН
со – x
NO2со
x
со - x
cисход
c
cравн
НNО2+ ОН
x
x
НNO2
0
x
x
OН0
x
x
KГ = [HNO2]· [OHˉ] / [NO2ˉ] = х2/с0-х = 2,2‧10-9
-
x = [ОН ] = 4,65 10 6 моль/л
-
pOH = -lg[ОН ] = 5,33
pH = 14 - 5,33 = 8,67










 Химия
Химия








