Похожие презентации:
Гидролиз солей
1. Гидролиз солей
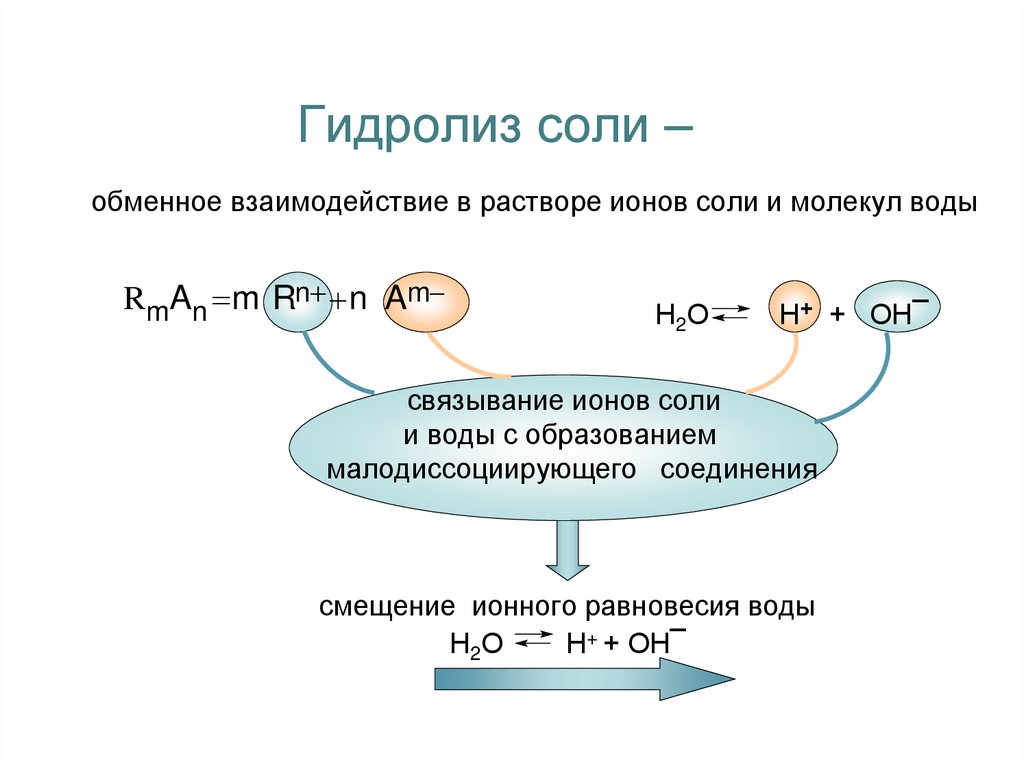
2. Гидролиз соли –
обменное взаимодействие в растворе ионов соли и молекул водыRmAn m Rn n Am
Н 2О
Н+ + ОН¯
связывание ионов соли
и воды с образованием
малодиссоциирующего соединения
смещение ионного равновесия воды
Н 2О
Н+ + ОН¯
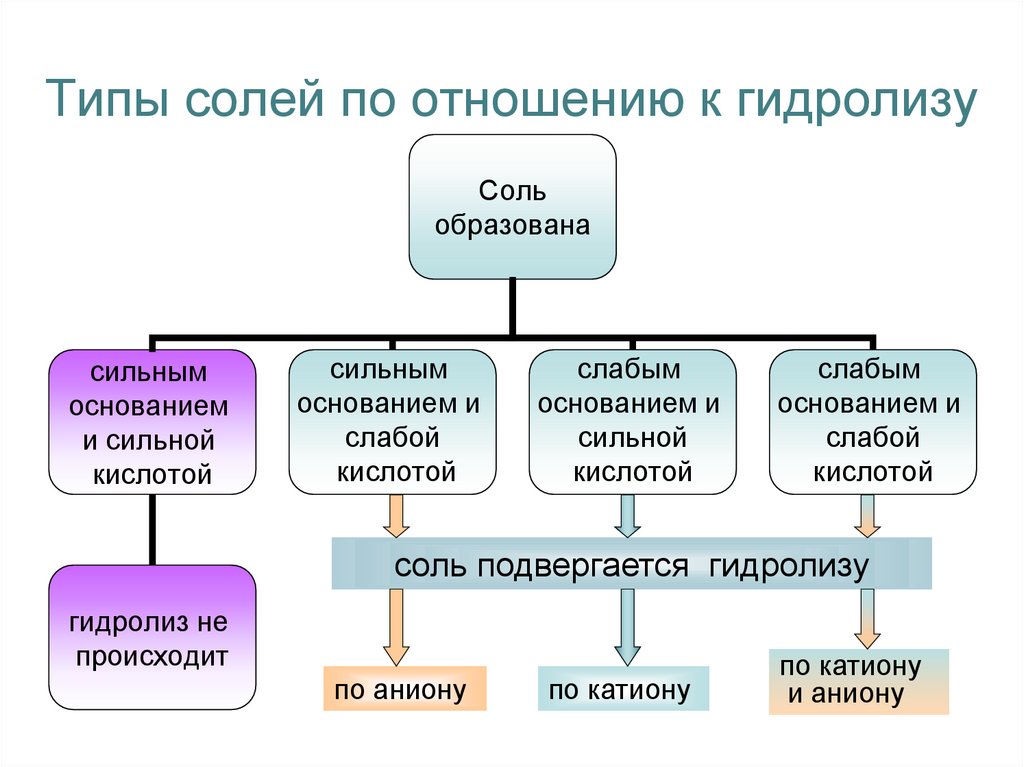
3. Типы солей по отношению к гидролизу
Сольобразована
сильным
основанием
и сильной
кислотой
сильным
основанием и
слабой
кислотой
слабым
основанием и
сильной
кислотой
слабым
основанием и
слабой
кислотой
соль подвергается гидролизу
гидролиз не
происходит
по аниону
по катиону
по катиону
и аниону
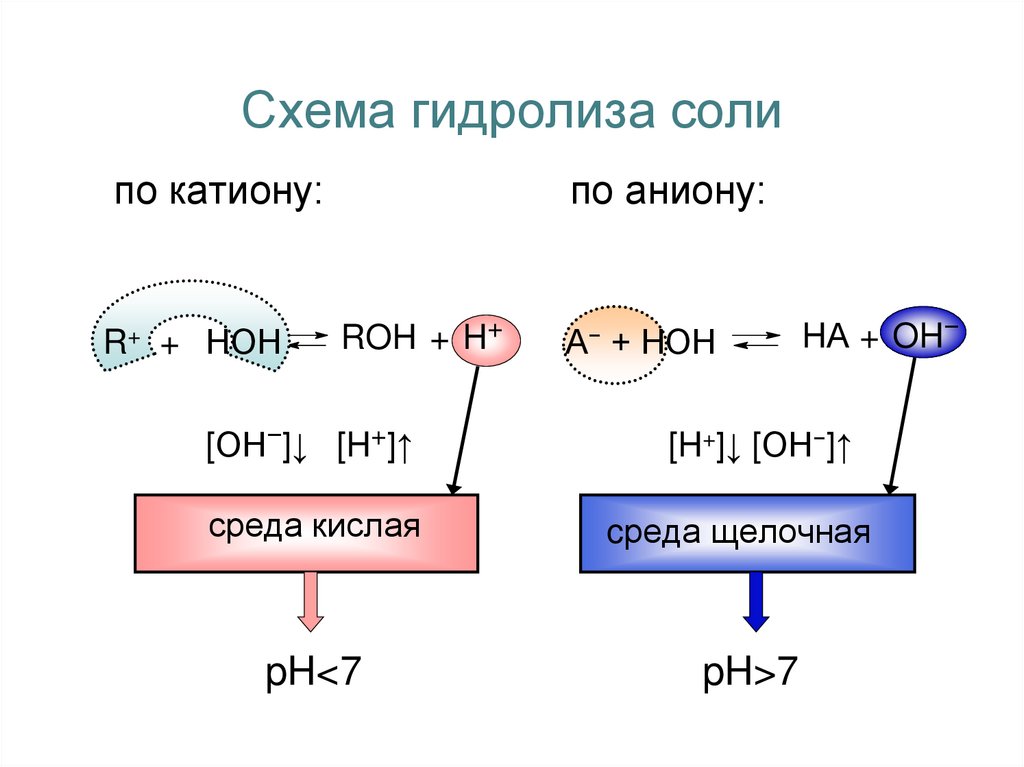
4. Схема гидролиза соли
по катиону:R+ + НОН
по аниону:
ROH + H+
А− + НОН
HА + OH−
[ОН−]↓ [H+]↑
[H+]↓ [ОН−]↑
среда кислая
cреда щелочная
pH<7
pH>7
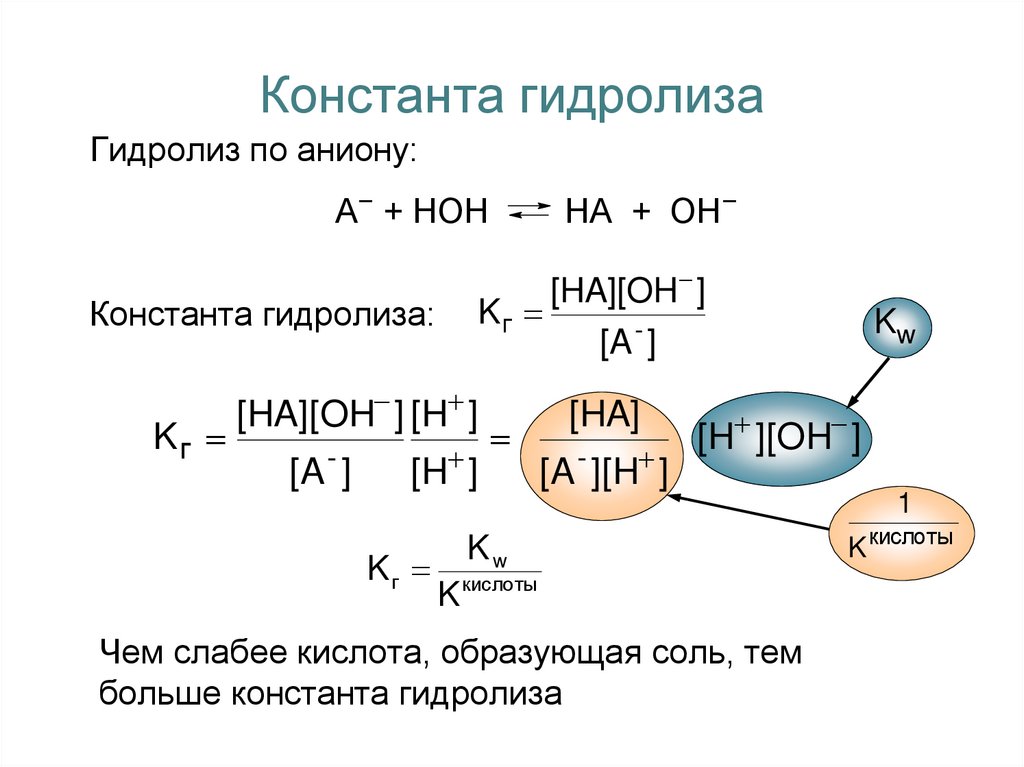
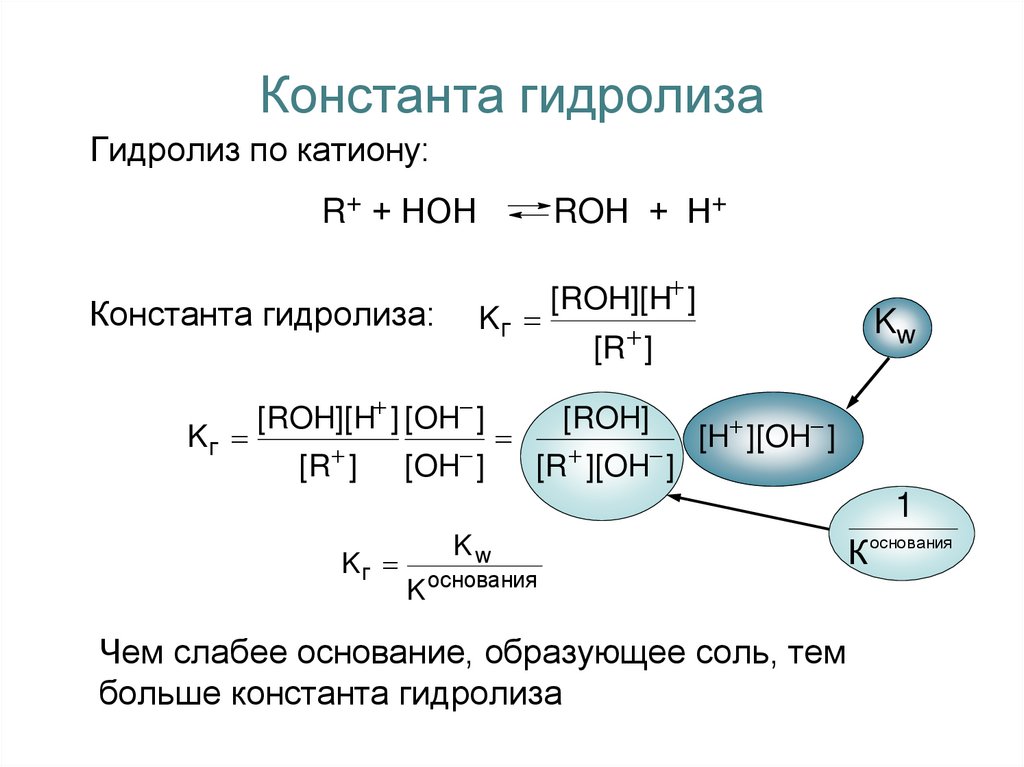
5. Константа гидролиза
Гидролиз по аниону:А− + НОН
Константа гидролиза:
Kг
[HA][OH ]
Kг
[A - ]
[HA][OH ] [H ]
[A - ]
НА + ОН−
[H ]
[HA]
[A - ][H ]
Kw
[H ][OH ]
1
Kг
Kw
K кислоты
Чем слабее кислота, образующая соль, тем
больше константа гидролиза
K кислоты
6. Константа гидролиза
Гидролиз по катиону:R+ + НОН
Константа гидролиза:
Kг
ROН + Н+
Kг
[ROH][H ] [OH ]
[R ]
[OH ]
[ROH][H ]
Kw
[R ]
[ROH]
[R ][OH ]
[H ][OH ]
1
Kг
Kw
K основания
Чем слабее основание, образующее соль, тем
больше константа гидролиза
К основания
7.
8. Степень гидролиза соли -
Степень гидролиза соли отношение количества вещества (соли), подвергшегосягидролизу, к общему количеству растворенного вещества
h
nгидр
Размерность – доли ед., %
n
При комнатной температуре степень гидролиза соли обычно
невелика:
Формула соли
Концентрация
раствора, моль/л
h,%
при 298 К (250С)
NH4Cl
Na2CO3
CН3СООNH4
0,01
0,1
0,1
0,01
2,7
0,5
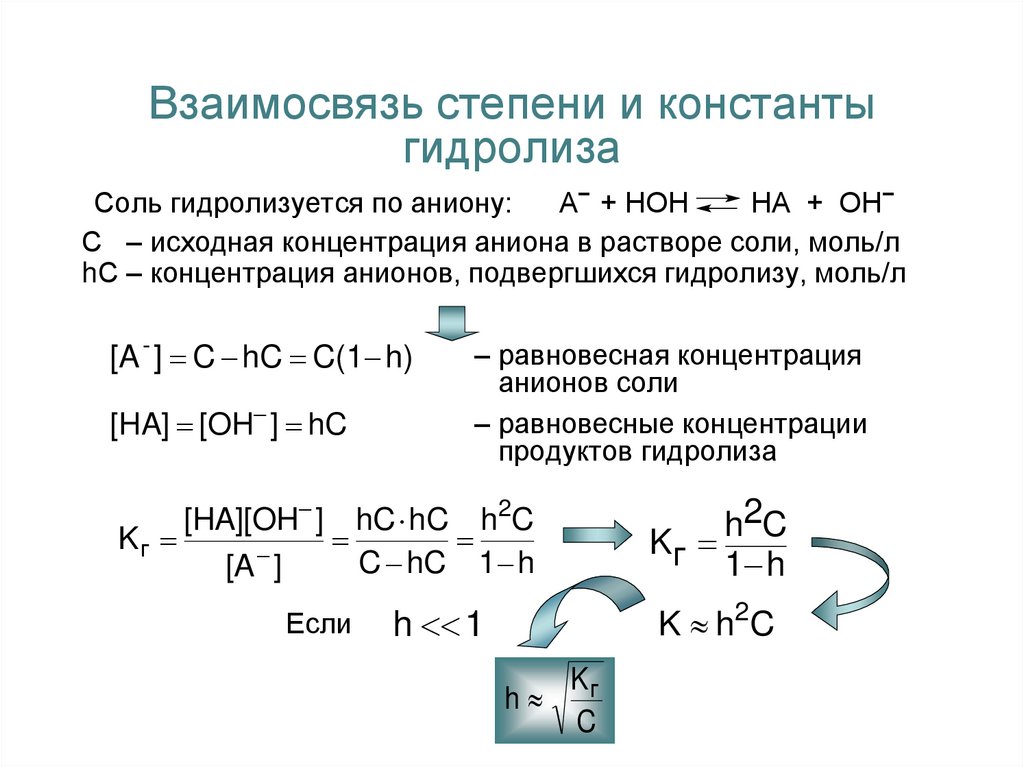
9. Взаимосвязь степени и константы гидролиза
Соль гидролизуется по аниону:А− + НОН
НА + ОН−
С – исходная концентрация аниона в растворе соли, моль/л
hС – концентрация анионов, подвергшихся гидролизу, моль/л
[A - ] C hC C(1 h)
[HA] [OH ] hC
– равновесная концентрация
анионов соли
– равновесные концентрации
продуктов гидролиза
[HA][OH ] hC hC h2C
Kг
C hC 1 h
[A ]
Если
h2C
Kг
1 h
h 1
K h 2C
h
Kг
C
10.
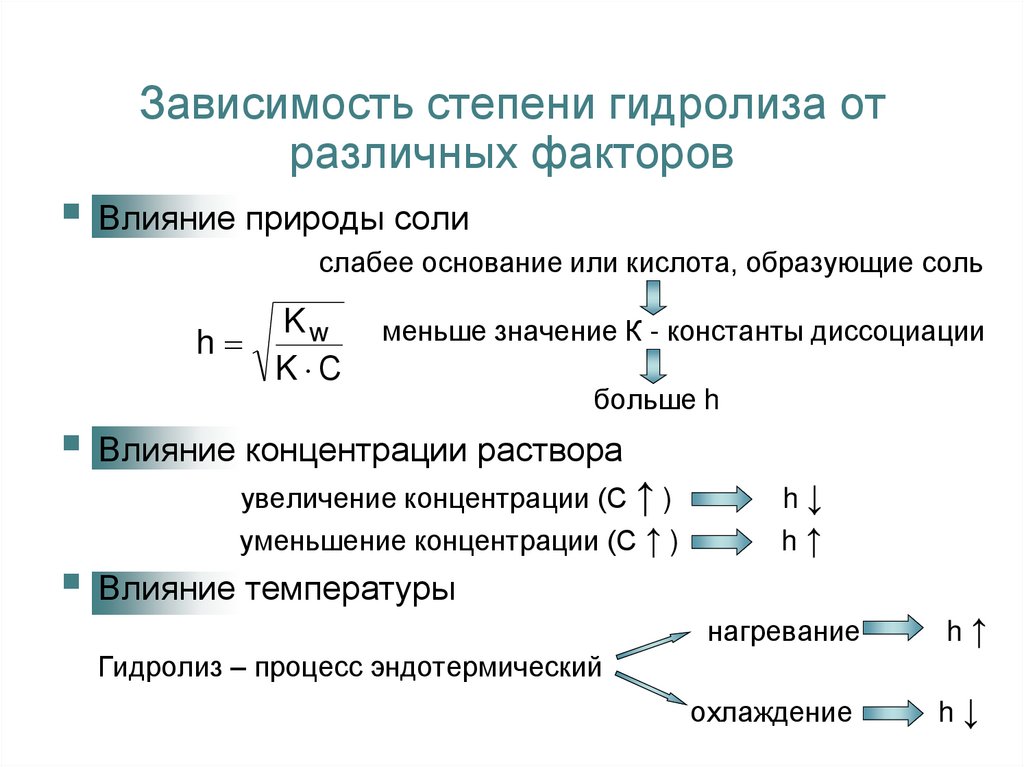
11. Зависимость степени гидролиза от различных факторов
Влияние природы солислабее основание или кислота, образующие соль
Kw
h
K С
меньше значение К - константы диссоциации
больше h
Влияние концентрации раствора
увеличение концентрации (С ↑ )
уменьшение концентрации (С ↑ )
Влияние температуры
h↓
h↑
нагревание
h↑
охлаждение
h↓
Гидролиз – процесс эндотермический
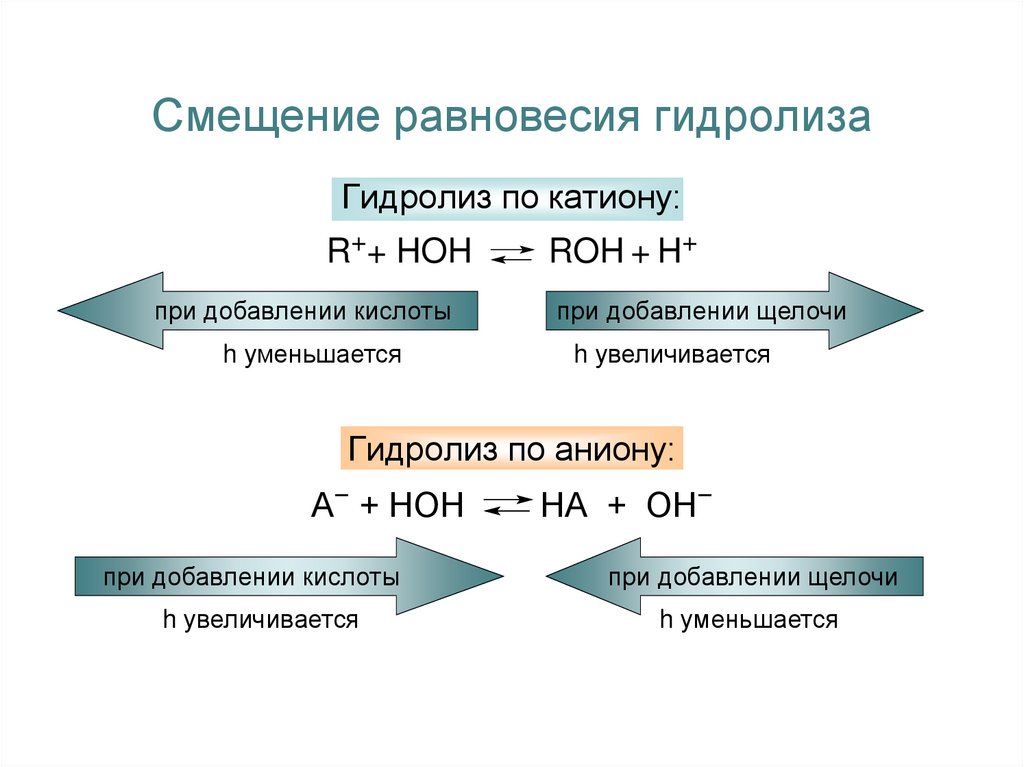
12. Смещение равновесия гидролиза
Гидролиз по катиону:R++ HOH
при добавлении кислоты
h уменьшается
ROH + H+
при добавлении щелочи
h увеличивается
Гидролиз по аниону:
А− + НОН
НА + ОН−
при добавлении кислоты
при добавлении щелочи
h увеличивается
h уменьшается
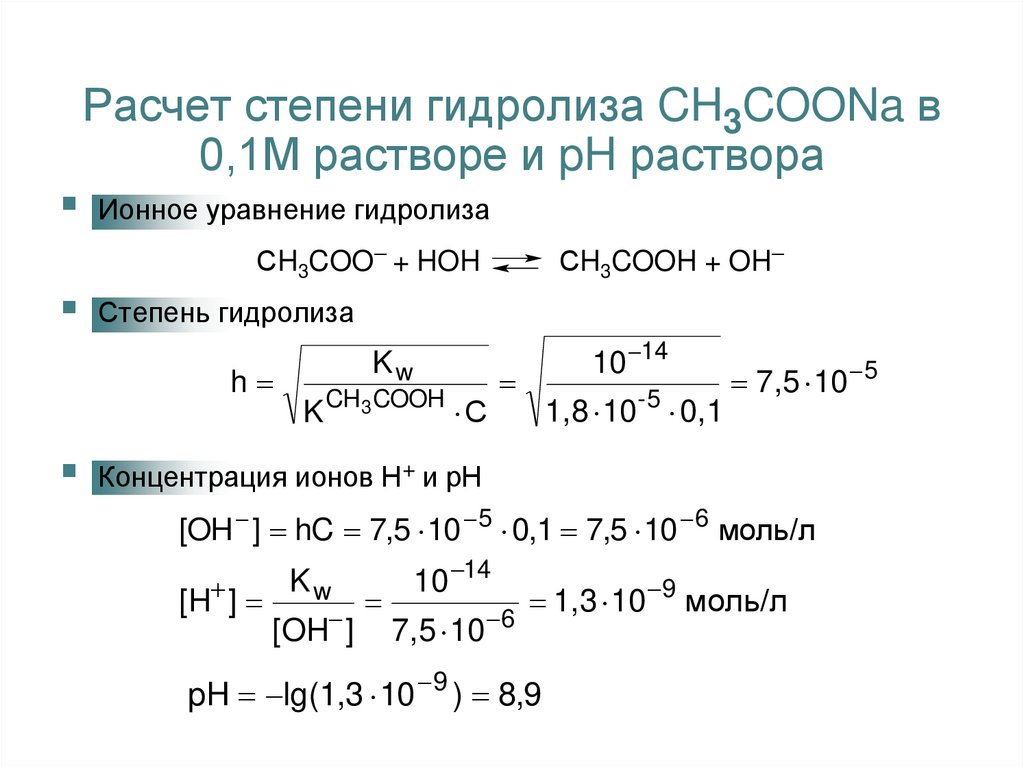
13. Расчет степени гидролиза CH3COONa в 0,1М растворе и pH раствора
Ионное уравнение гидролизаСH3COO + HOH
СH3COOH + OH
Степень гидролиза
h
Kw
K CH3 COOH С
10 14
1,8 10 - 5 0,1
7,5 10 5
Концентрация ионов Н+ и рН
[OH ] hC 7,5 10 5 0,1 7,5 10 6 моль/л
[H ]
Kw
[OH ]
10 14
7,5 10
9
1,3
10
моль/л
6
pH lg(1,3 10 9 ) 8,9
14.
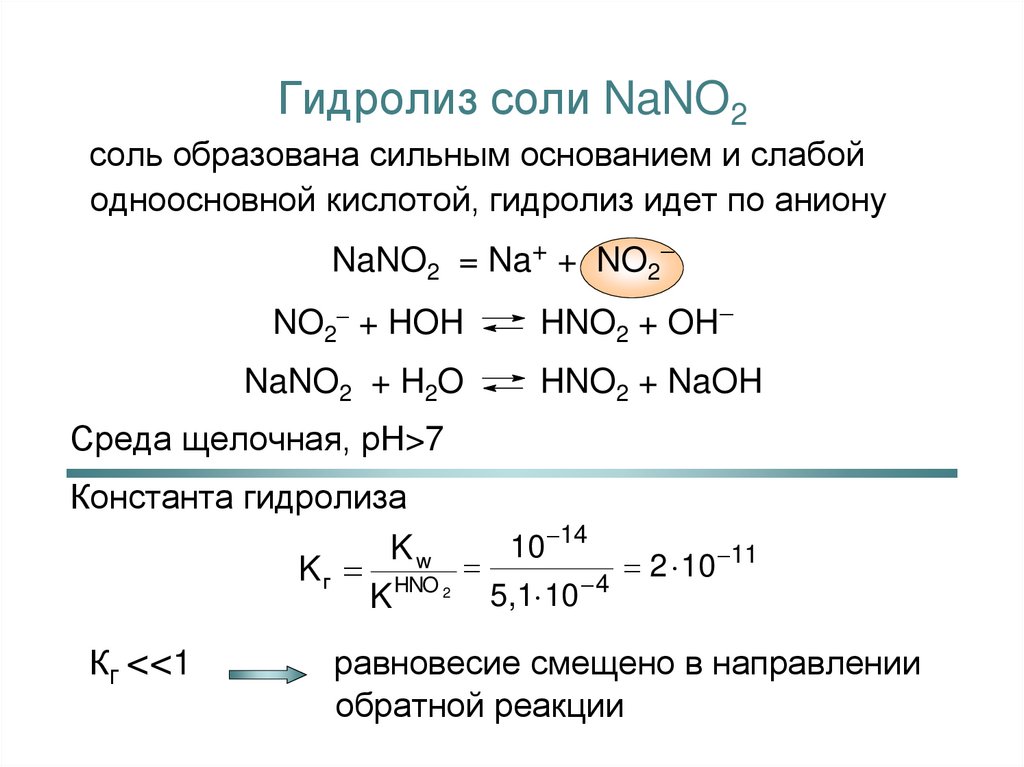
15. Гидролиз соли NaNO2
соль образована сильным основанием и слабойодноосновной кислотой, гидролиз идет по аниону
NaNO2 = Na+ + NO2
NO2 + HOH
HNO2 + OH
NaNO2 + H2O
HNO2 + NaOH
Среда щелочная, рН>7
Константа гидролиза
10 14
Kw
11
2
10
K г HNO 2
5,1 10 4
K
Кг <<1
равновесие смещено в направлении
обратной реакции
16. Гидролиз соли К2СО3
K2CO3 = 2K+ + CO32Соль образована сильным основанием и слабой
двухосновной кислотой. Гидролиз идет по аниону,
возможны две ступени гидролиза
Уравнения гидролиза по I ступени:
CO32 + HOH
HCO3 + OH
K2CO3 + H2O
KHCO3 + KOH
Уравнения гидролиза по II ступени:
HCO3 + HOH
KHCO3 + HOH
Среда щелочная, рН>7
H2CO3 + OH
H2CO3 + KOH
17. Расчет констант гидролиза К2СО3
По первой ступени:[HCO3 ] [OH ]
K г1
[CO32 ]
[HCO3 ][OH ][H ]
[CO32 ][H ]
Kw
2CO 3
KH
2
10 14
4
2,1
10
4,8 10 11
По второй ступени:
Kг2
[H2CO3 ][OH ]
[HCO3 ]
[H2CO3 ][OH ][H ]
[HCO3 ][H ]
Kw
K1H2CO3
10 14
8
2,2
10
4,5 10 7
Кг1 Кг
2
гидролиз протекает преимущественно по I ступени
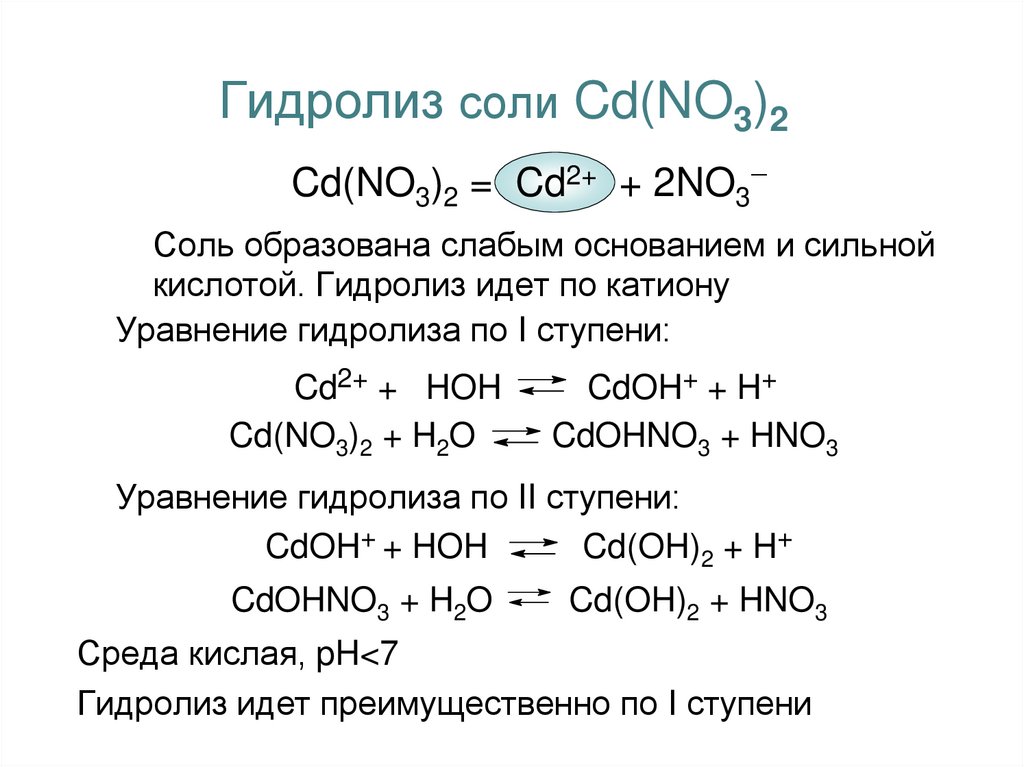
18. Гидролиз соли Cd(NO3)2
Cd(NO3)2 = Cd2+ + 2NO3Соль образована слабым основанием и сильной
кислотой. Гидролиз идет по катиону
Уравнение гидролиза по I ступени:
Cd2+ + HOH
Cd(NO3)2 + H2O
CdOH+ + H+
CdOHNO3 + HNO3
Уравнение гидролиза по II ступени:
CdOH+ + HOH
Cd(OH)2 + H+
CdOHNO3 + H2O
Cd(OH)2 + HNO3
Среда кислая, pH<7
Гидролиз идет преимущественно по I ступени
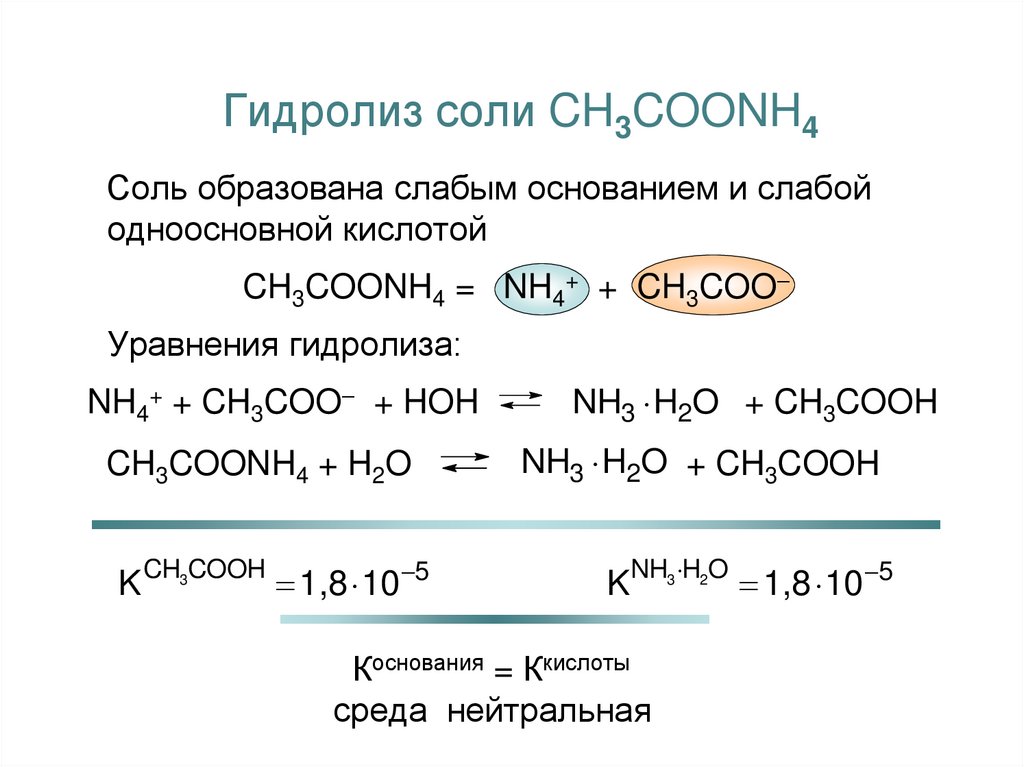
19. Гидролиз соли CH3COONH4
Соль образована слабым основанием и слабойодноосновной кислотой
CH3COONH4 = NH4+ + CH3COO
Уравнения гидролиза:
NH4+ + CH3COO + HOH
NH3 H2O + CH3COOH
CH3COONH4 + H2O
NH3 H2O + CH3COOH
K CH3COOH 1,8 10 5
KNH3 H2O 1,8 10 5
Коснования = Ккислоты
среда нейтральная
20. Гидролиз солей слабых кислот и слабых оснований
Соли слабого основания и слабой многоосновной кислоты врастворе полностью гидролизованы
(NH4)2S + H2O
NH4HS + NH3 H2O
NH4HS + HOH
NH3 H2O + H2S
Соли слабых одноосновных кислот и слабых оснований при
гидролизе образуют осадки основных солей:
Al(CH3COO)3 + HOH
Al(OH)(CH3COO)2 + HOH
Al(OH)(CH3COO)2↓ + CH3COOH
Al(OH)2CH3COO↓ + CH3COOH
Гидролиз некоторых солей, образованных летучими или
малорастворимыми слабыми кислотами и слабыми
основаниями протекает необратимо:
Al2S3 + 6H2O = 2Al(OH)3↓ + 3H2S↑
Такие соли в водных растворах не существуют
21. Необратимый совместный гидролиз
- с участием катионов Al3+, Fe3+, Cr3+, NH4+ и анионов2
2
CO3 , SiO3 , S
кислоты
2
проходит с образованием слабого основания и
2AlCl3 + 3Na2S + 6H2O = 2Al(OH)3↓ + 3H2S↑+ 6NaCl
2Al3+ + 3S2 + 6H2O = 2Al(OH)3 + 3H2S
2NH4Cl + Na2SiO3 + (H2O) = 2NH3↑ + H2SiO3↓ + 2NaCl
2NH4+ + SiO32 + (H2O) = 2NH3 + H2SiO3
- солей слабых оснований типа M(OH)2 и солей угольной кислоты
проходит с образованием основных солей и угольной кислоты
2CuSO4 + 2Na2CO3 + H2O = (CuOH)2CO3↓ + CO2↑ + 2Na2SO4
2Cu2+ + 2CO32 + H2O = (CuOH)2CO3 + CO2









 Химия
Химия








