Похожие презентации:
Пурины. Строение пурина. (Лекция 9)
1.
Химия биологическиактивных веществ
Лекция 9
Пурины
N
N
N
N
2.
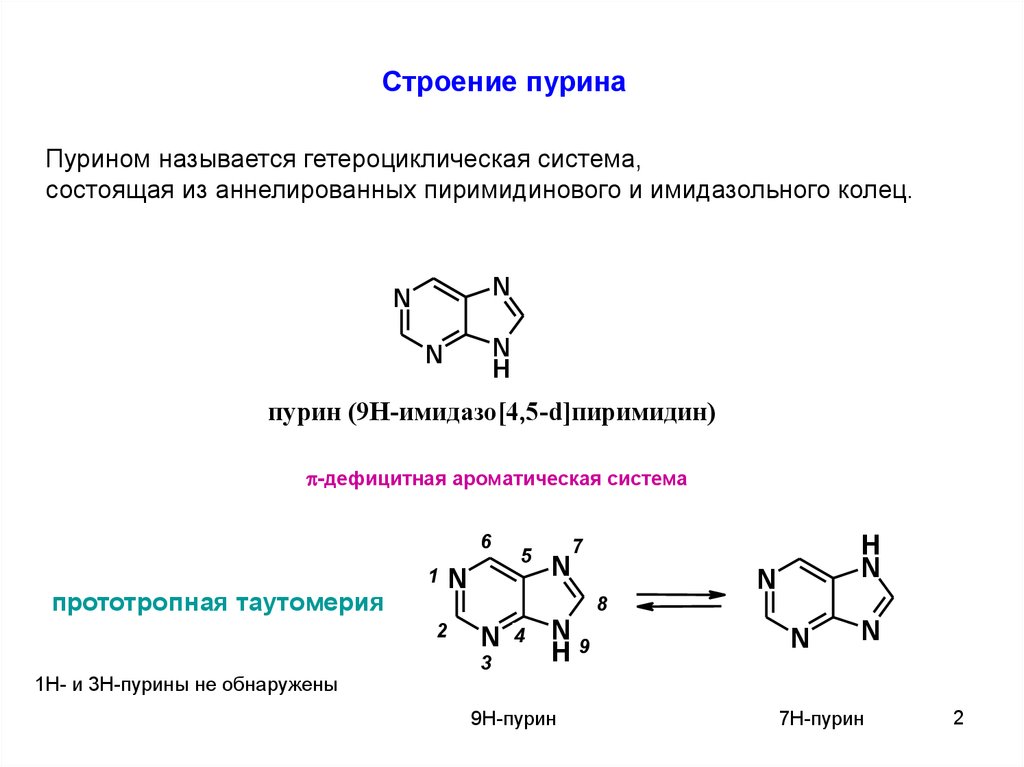
Строение пуринаПурином называется гетероциклическая система,
состоящая из аннелированных пиримидинового и имидазольного колец.
N
N
N
H
N
пурин (9Н-имидазо[4,5-d]пиримидин)
p-дефицитная ароматическая система
6
1
прототропная таутомерия
N
N
H
N
7
N
8
2
1Н- и 3Н-пурины не обнаружены
5
N
3
4
N9
H
9Н-пурин
N
N
7Н-пурин
2
3
3.
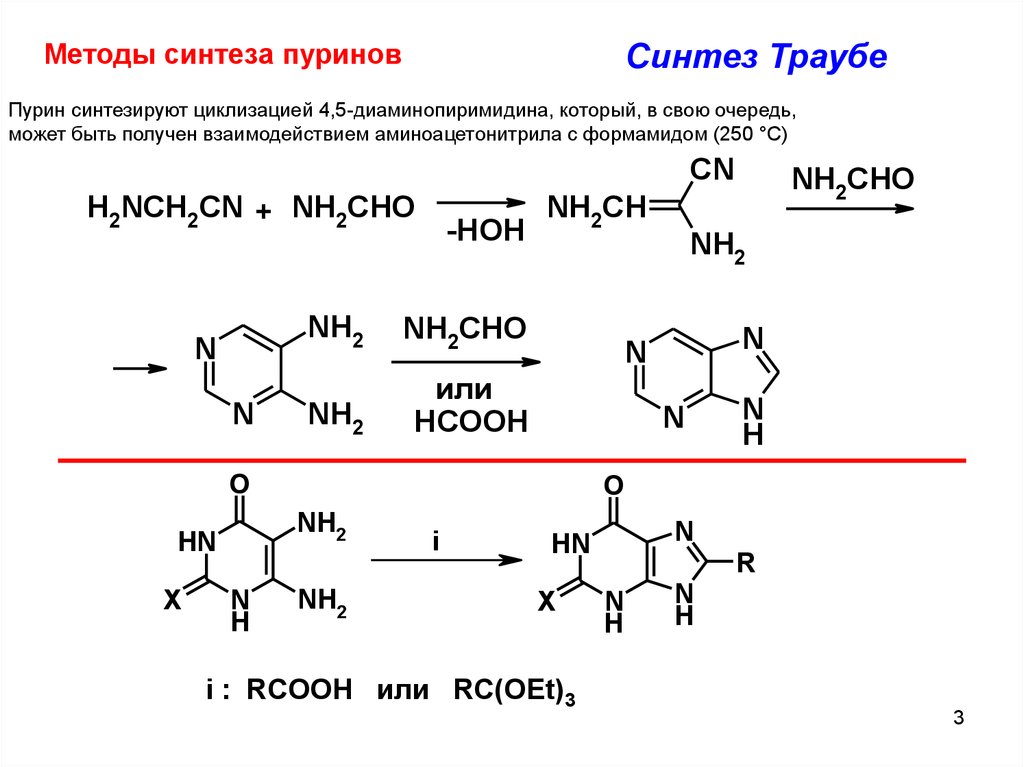
Синтез ТраубеМетоды синтеза пуринов
Пурин синтезируют циклизацией 4,5-диаминопиримидина, который, в свою очередь,
может быть получен взаимодействием аминоацетонитрила с формамидом (250 °С)
CN
H2NCH2CN + NH2CHO
N
N
-HOH
NH2
NH2CHO
NH2
или
HCOOH
NH2CH
X
N
H
N
N
N
H
O
NH2
HN
NH2
N
O
NH2CHO
NH2
i
N
HN
X
R
N
H
N
H
i : RCOOH или RC(OEt)3
3
4
4.
Восстановление нитрозоаминоурациловO
R"
X
O
NO
N
N
R'
Zn, HCO2H
R"
NH2
X
N
N
R'
H
N
O
NH2
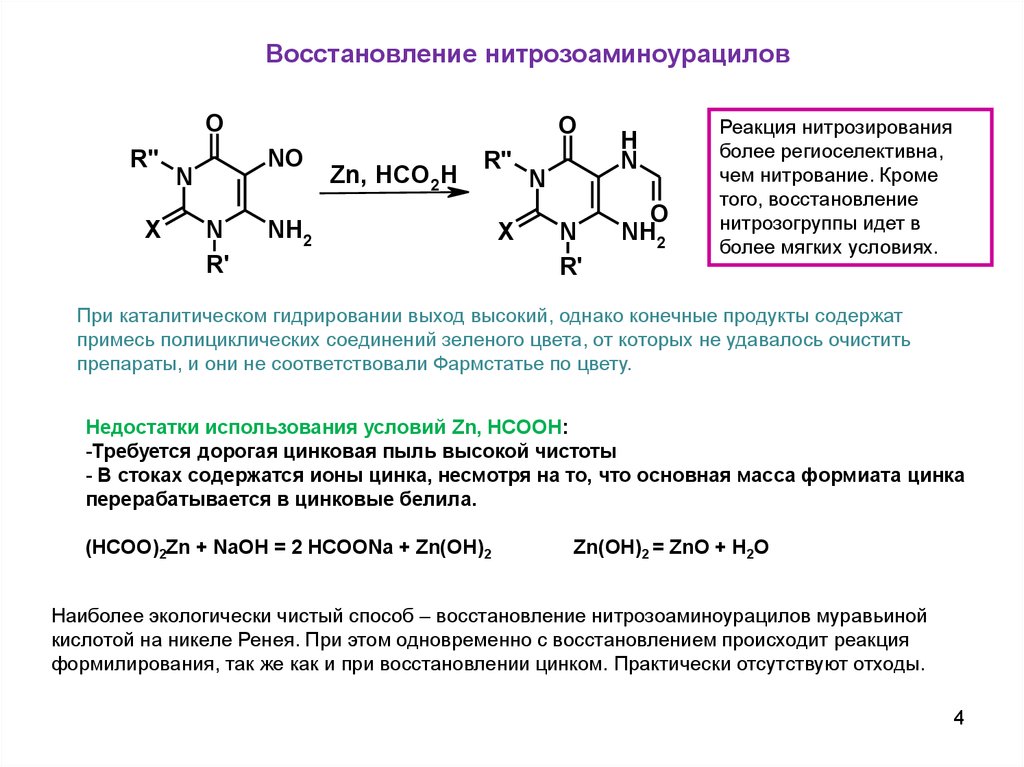
Реакция нитрозирования
более региоселективна,
чем нитрование. Кроме
того, восстановление
нитрозогруппы идет в
более мягких условиях.
При каталитическом гидрировании выход высокий, однако конечные продукты содержат
примесь полициклических соединений зеленого цвета, от которых не удавалось очистить
препараты, и они не соответствовали Фармстатье по цвету.
Недостатки использования условий Zn, HCOOH:
-Требуется дорогая цинковая пыль высокой чистоты
- В стоках содержатся ионы цинка, несмотря на то, что основная масса формиата цинка
перерабатывается в цинковые белила.
(HCOO)2Zn + NaOH = 2 HCOONa + Zn(OH)2
Zn(OH)2 = ZnO + H2O
Наиболее экологически чистый способ – восстановление нитрозоаминоурацилов муравьиной
кислотой на никеле Ренея. При этом одновременно с восстановлением происходит реакция
формилирования, так же как и при восстановлении цинком. Практически отсутствуют отходы.
4
5.
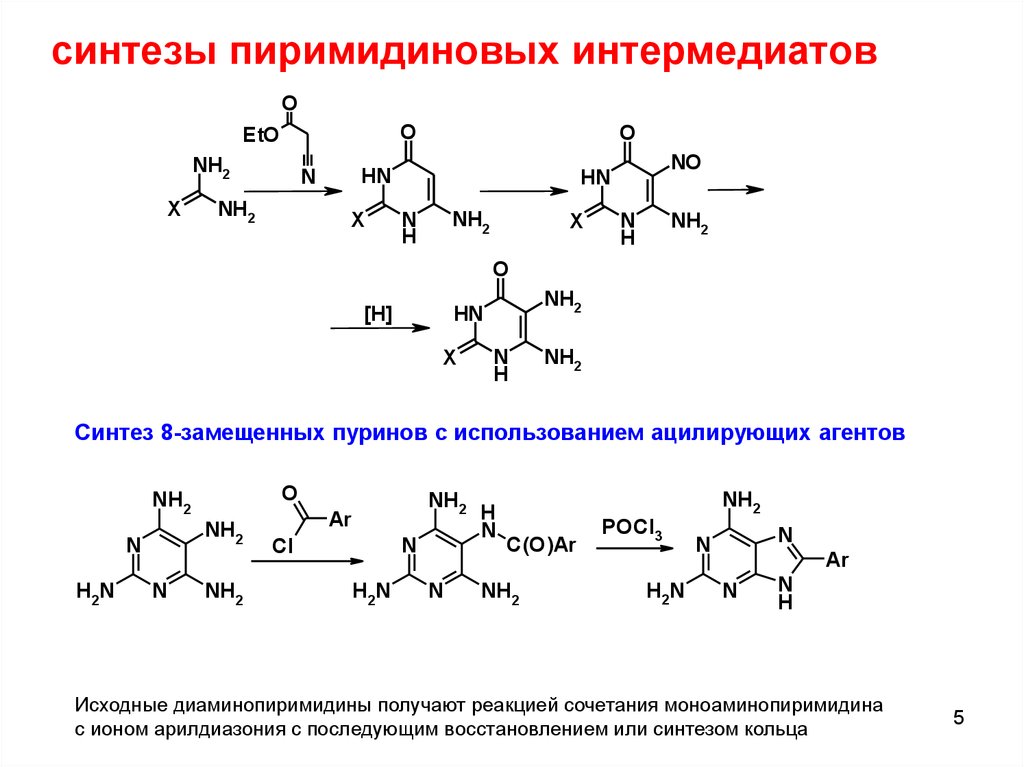
синтезы пиримидиновых интермедиатовO
O
EtO
NH2
X
HN
N
NH2
O
X
NO
HN
NH2
N
H
X
NH2
N
H
O
NH2
HN
[H]
X
N
H
NH2
Синтез 8-замещенных пуринов с использованием ацилирующих агентов
O
NH2
NH2
N
H2N
N
NH2
NH2
Ar
N
Cl
H2N
N
H
N
NH2
C(O)Ar
NH2
POCl3
H2N
N
N
Ar
N
N
H
Исходные диаминопиримидины получают реакцией сочетания моноаминопиримидина
с ионом арилдиазония с последующим восстановлением или синтезом кольца
5
6.
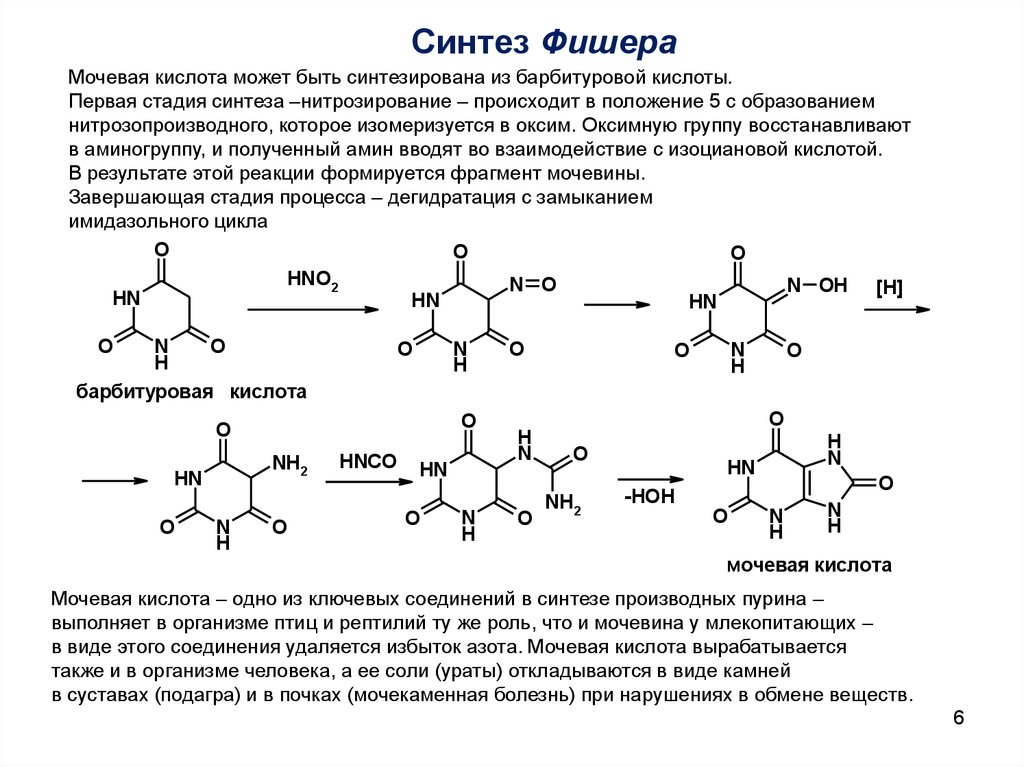
Синтез ФишераМочевая кислота может быть синтезирована из барбитуровой кислоты.
Первая стадия синтеза –нитрозирование – происходит в положение 5 с образованием
нитрозопроизводного, которое изомеризуется в оксим. Оксимную группу восстанавливают
в аминогруппу, и полученный амин вводят во взаимодействие с изоциановой кислотой.
В результате этой реакции формируется фрагмент мочевины.
Завершающая стадия процесса – дегидратация с замыканием
имидазольного цикла
O
O
O
HNO2
N O
N OH [H]
HN
HN
HN
N
O
H
барбитуровая кислота
O
N
H
O
O
O
NH2
HN
O
N
H
O
HNCO
HN
O
N
H
O
N
H
O
O
O
H
N
O
O
NH2
H
N
HN
O
-HOH
O
N
H
N
H
мочевая кислота
Мочевая кислота – одно из ключевых соединений в синтезе производных пурина –
выполняет в организме птиц и рептилий ту же роль, что и мочевина у млекопитающих –
в виде этого соединения удаляется избыток азота. Мочевая кислота вырабатывается
также и в организме человека, а ее соли (ураты) откладываются в виде камней
в суставах (подагра) и в почках (мочекаменная болезнь) при нарушениях в обмене веществ.
6
7.
синтезы на основе имидазолаO
N
H2N
H2N
NH2
N
H
Me
N
N
O
H2N
O2 N
CH3
N
N
N
H2N
Cl
O2 N
Me
N
KCN
N
NC
O2 N
O
Me
N
H2N
N
HCONH2
N
H
N
H
X
HNO3
H2SO4
N
HN
NH2
X
Cl
O
H2N
NH2
CH3
N
N
N
N
Me
N
N
Me
N
N
7
8.
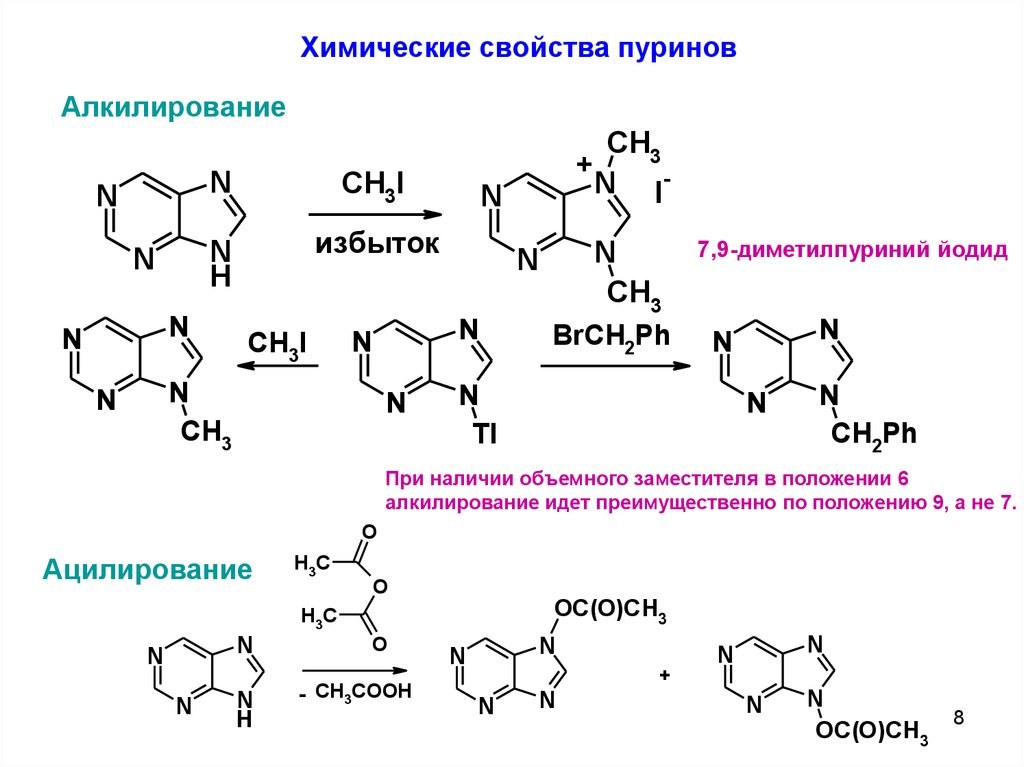
Химические свойства пуриновАлкилирование
N
N
N
CH3I
N
H
избыток
N
N
CH3I
N
CH3
N
N
N
N
N
N
+
CH3
N I-
N
CH3
BrCH2Ph
7,9-диметилпуриний йодид
N
N
N
Tl
N
N
CH2Ph
При наличии объемного заместителя в положении 6
алкилирование идет преимущественно по положению 9, а не 7.
O
Ацилирование
H3C
O
OC(O)CH3
H3C
N
N
N
N
H
O
- CH3COOH
N
N
+
N
N
N
N
N
N
OC(O)CH3
87
9.
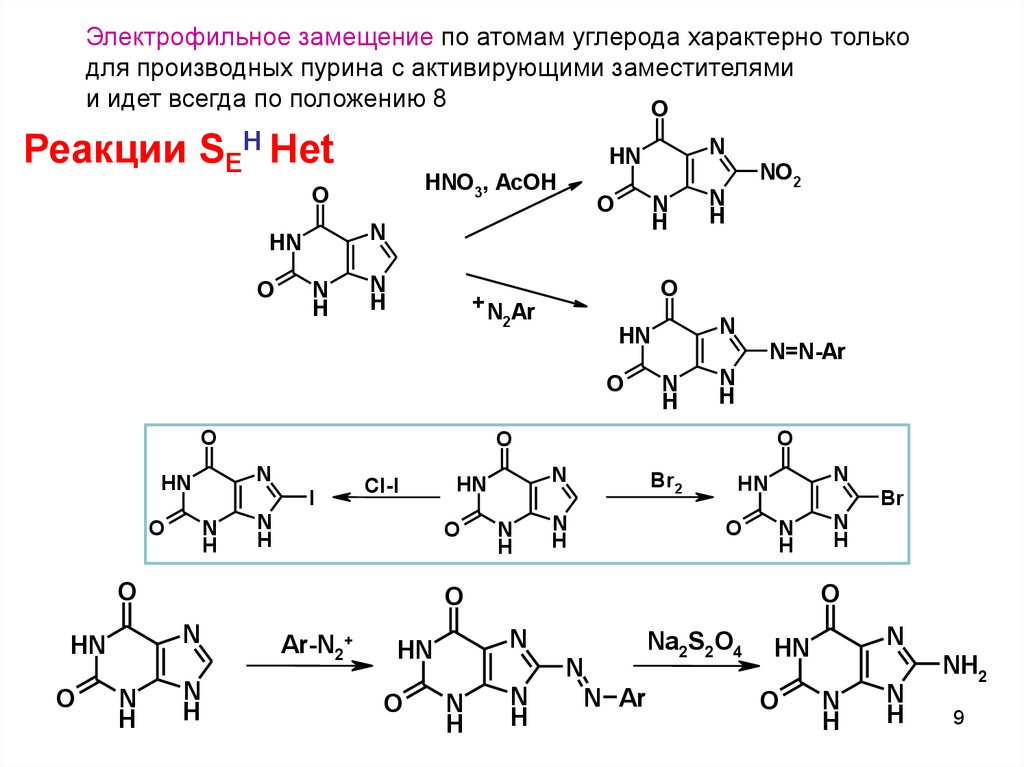
Электрофильное замещение по атомам углерода характерно толькодля производных пурина с активирующими заместителями
и идет всегда по положению 8
O
Реакции SEH Het
HNO3, AcOH
O
O
N
H
N
HN
O
N
H
N
H
O
I
Cl-I
N
H
O
N=N-Ar
N
H
N
H
O
N
H
N
H
Br2
N
HN
O
Br
N
H
N
H
Ar-N2+
N
HN
O
N
H
N
H
O
O
N
N
H
N
HN
N
HN
O
O
HN
N
H
O
N
N
H
O
NO2
O
+ N Ar
2
O
HN
N
HN
N
H
N
N Ar
Na2S2O4
N
HN
O
N
H
N
H
NH2
98
10.
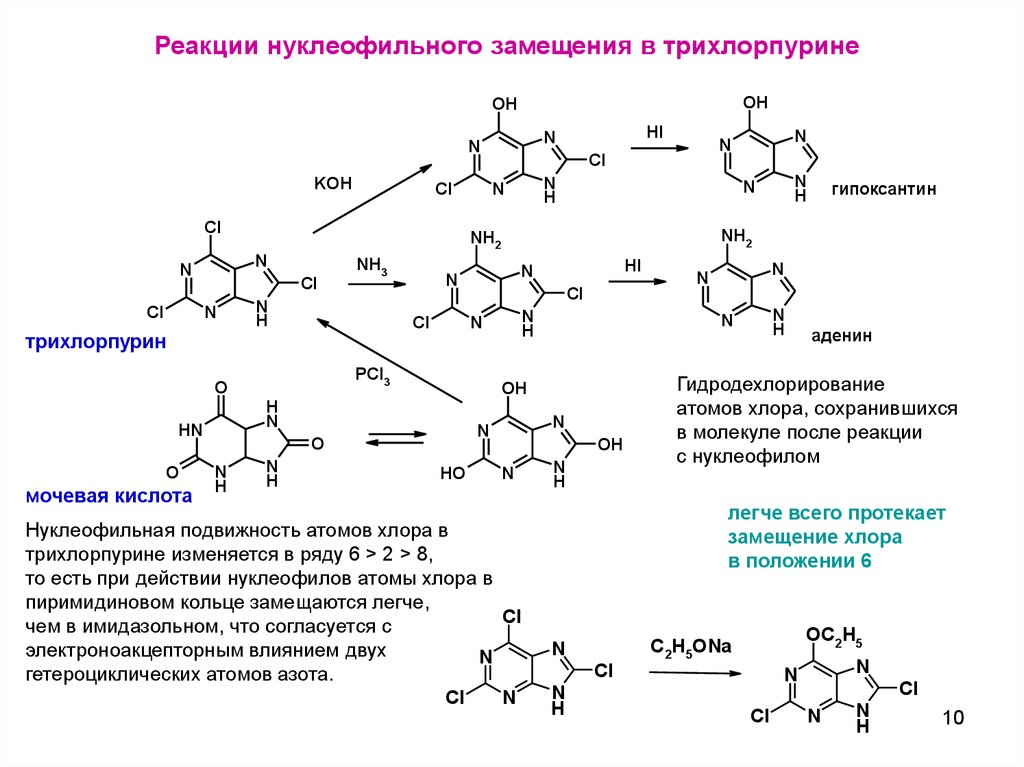
Реакции нуклеофильного замещения в трихлорпуринеOH
OH
KOH
Cl
Cl
N
Cl
трихлорпурин
O
мочевая кислота
NH3
N
H
Cl
N
N
HO
OH
N
Нуклеофильная подвижность атомов хлора в
трихлорпурине изменяется в ряду 6 > 2 > 8,
то есть при действии нуклеофилов атомы хлора в
пиримидиновом кольце замещаются легче,
Cl
чем в имидазольном, что согласуется с
электроноакцепторным влиянием двух
N
гетероциклических атомов азота.
Cl
гипоксантин
N
N
N
N
H
N
OH
O
N
H
N
H
N
H
N
N
H
HI
N
PCl3
N
H
N
NH2
N
Cl
O
HN
N
H
NH2
N
N
N
N
Cl
N
Cl
HI
N
N
N
H
аденин
Гидродехлорирование
атомов хлора, сохранившихся
в молекуле после реакции
с нуклеофилом
легче всего протекает
замещение хлора
в положении 6
OC2H5
C2H5ONa
N
Cl
N
H
N
N
Cl
Cl
N
N
H
10
11.
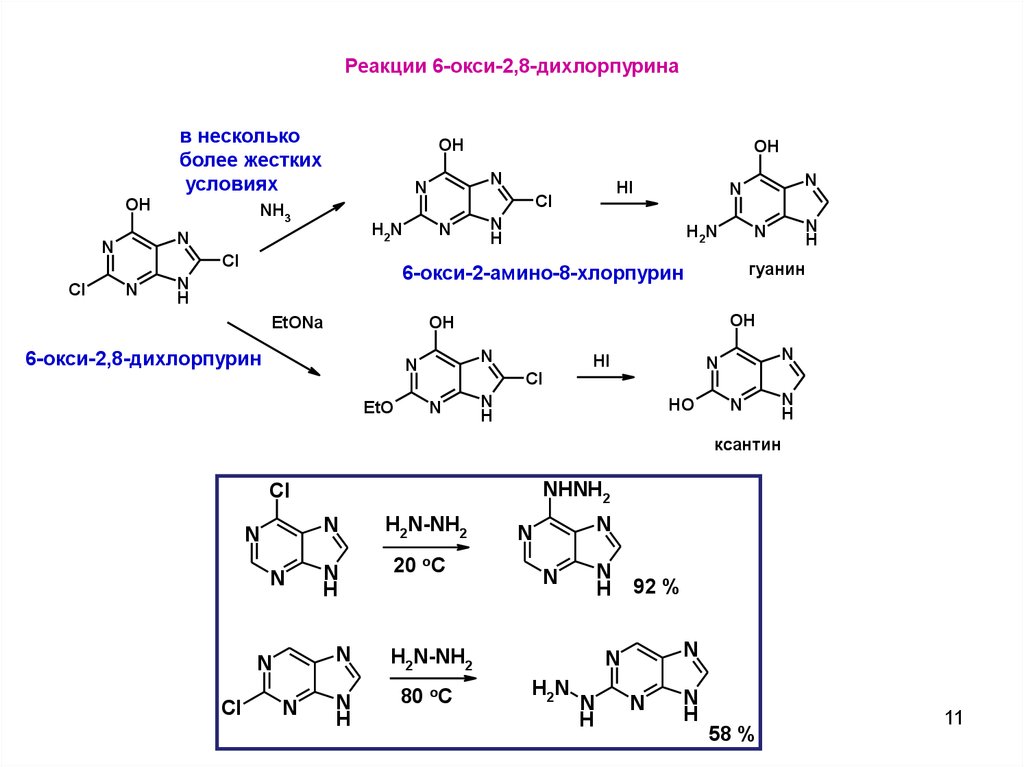
Реакции 6-окси-2,8-дихлорпуринав несколько
более жестких
условиях
OH
NH3
Cl
N
HI
Cl
N
H2N
OH
N
N
N
N
Cl
OH
N
H
EtONa
гуанин
OH
OH
6-окси-2,8-дихлорпурин
N
N
EtO
N
H
N
H2N
6-окси-2-амино-8-хлорпурин
N
H
N
N
HI
N
N
Cl
N
N
H
HO
N
N
H
ксантин
NHNH2
Cl
N
N
N
N
Cl
N
N
H
H2N-NH2
20 oC
N
H2N-NH2
N
H
80 oC
N
N
N
H
N
92 %
N
N
H2N
N
H
N
N
H
58 %
11
12.
Характеристика производных пуринаO
NH2
N
N
H2N
аденин
O
HN
N
H
N
CH3
N
N
теобромин
O
N
HN
N
H
O
гипоксантин
O
H3C
N
HN
гуанин
N
N
CH3
O
N
HN
N
H
N
O
O
CH3
N
N
N
CH3
кофеин
O
HN
O
N
N
N
H
H
ксантин
H
N
O
N
H
N
H
мочевая кислота
O
H3C
O
N
N
N
N
H
CH3
теофиллин
К пуриновым алкалоидам относятся метилированные
производные ксантина – теобромин (содержится в какао),
кофеин (кофе и чай) и теофиллин (чай)
12
3
13.
Нуклеиновые кислотыНуклеопротеины
Белок
Нуклеиновые кислоты (ДНК, РНК)
Аминокислоты
Мононуклеотиды
Нуклеозиды
H3PO4
Нуклеиновые основания
Пиримидиновые
Цитозин
Пуриновые
Урацил
Тимин
Пентозы
Аденин
Рибоза
Дезоксирибоза
Гуанин
13
4
14.
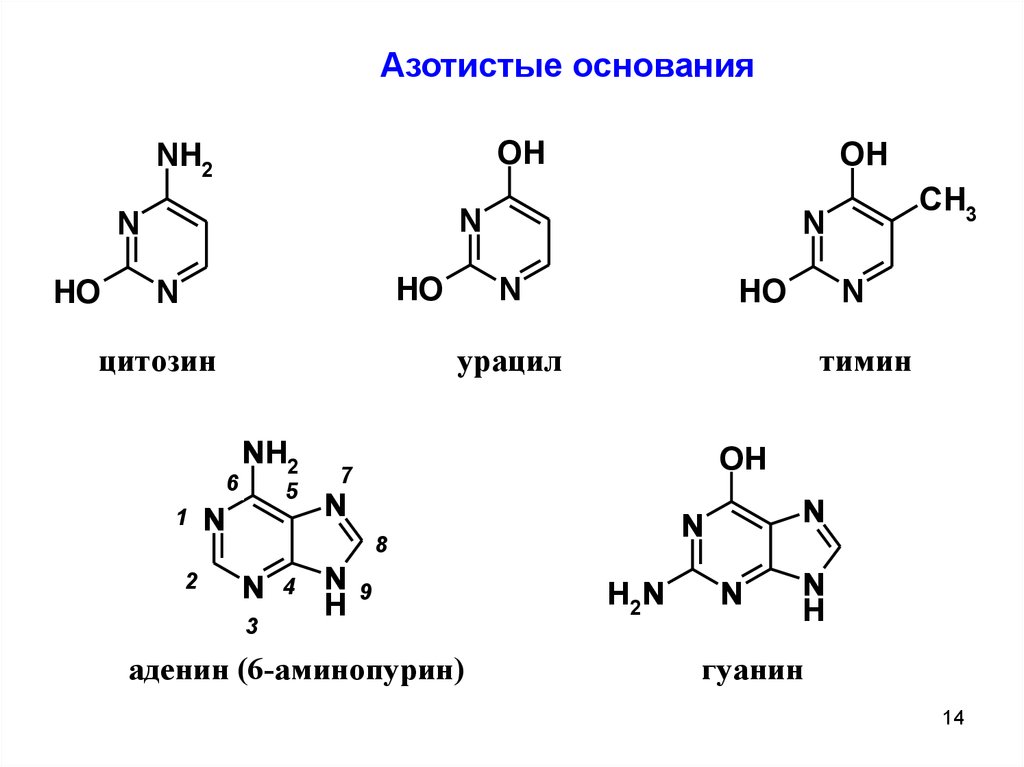
Азотистые основанияOH
NH2
N
N
HO
OH
HO
N
цитозин
6
1
2
N
N
HO
N
урацил
NH2
5
N
тимин
OH
7
N
3
4
N
H
9
аденин (6-аминопурин)
N
N
8
N
CH3
H2N
N
N
H
гуанин
14 5
15.
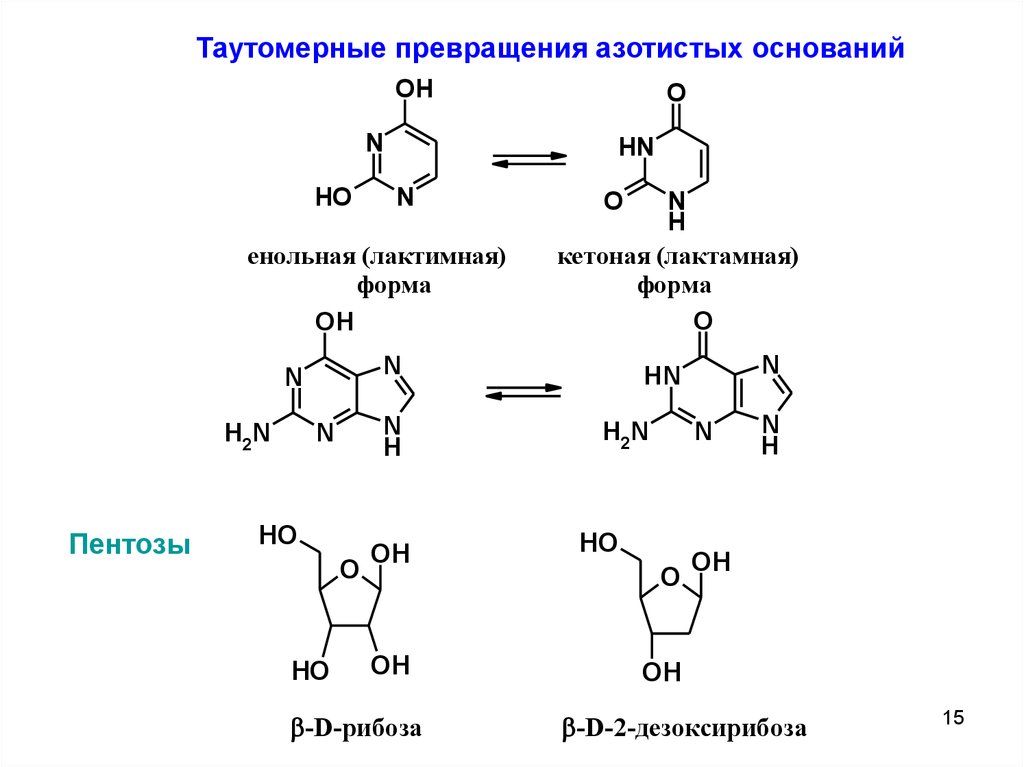
Таутомерные превращения азотистых основанийOH
N
HO
HN
N
енольная (лактимная)
форма
OH
Пентозы
O
N
H
кетоная (лактамная)
форма
O
N
N
H2N
O
N
H
N
HO
O
HO
OH
OH
-D-рибоза
N
HN
H2N
N
HO
O
N
H
OH
OH
-D-2-дезоксирибоза
15
16.
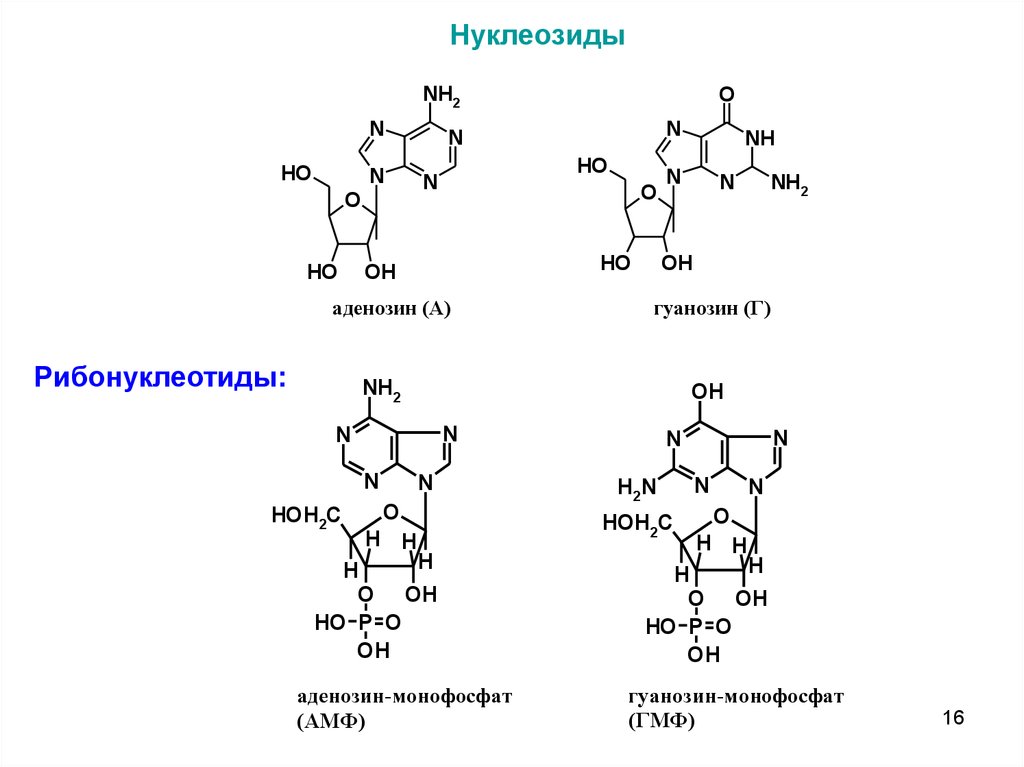
НуклеозидыNH2
N
HO
N
O
HO
N
N
HO
N
O
HO
OH
аденозин (А)
Рибонуклеотиды:
O
N
гуанозин (Г)
N
N
O
H H
NH2
OH
N
HOH2C
N
OH
NH2
N
NH
H2N
HOH2C
H
H
O OH
HO P O
OH
аденозин-монофосфат
(АМФ)
N
N
N
N
O
H H
H
H
O OH
HO P O
OH
гуанозин-монофосфат
(ГМФ)
16 9
17.
NH2OH
H3C
N
N
HOH2C
O
H
O
N
HOH2C
O
H H
N
O
H H
H
O H
HO P O
OH
H
H
O H
HO P O
OH
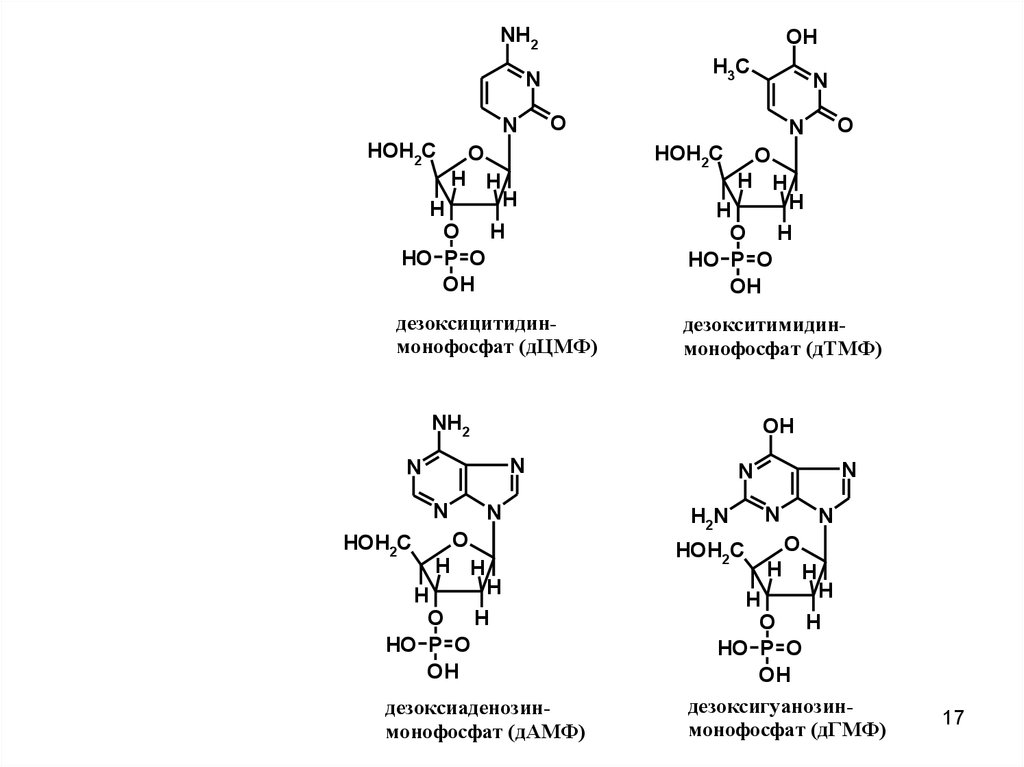
дезоксицитидинмонофосфат (дЦМФ)
дезокситимидинмонофосфат (дТМФ)
NH2
OH
N
N
N
HOH2C
N
O
H H
H2N
HOH2C
H
H
O H
HO P O
OH
дезоксиаденозинмонофосфат (дАМФ)
N
N
N
N
O
H H
H
H
O H
HO P O
OH
дезоксигуанозинмонофосфат (дГМФ)
17 11
18.
OHДезоксрибонуклеотиды:
N
HO P O
N
O
O
5' H2C
NH2
N
N
Фрагмент
Nполинуклеотидной
цепи
NH2
5'-конец
N
A
3'
N
HOH2C
H
O
HO P O
O
N
O
H H
H
H
O H
HO P O
OH
5'
H2C
NH2
N
O
Ц
O
N
3'
H
O
HO P O
дезоксиаденозинмонофосфат (дАМФ)
OH
N
H2C
5'
HOH2C
N
N
O
H H
H
H
O H
HO P O
OH
дезоксигуанозинмонофосфат (дГМФ)
NH
N
O
N
H2N
O
N
O
N
NH2
Г
3'
H
O
O
H3C
HO P O
NH
O
5' CH
O
N
2 O
T
3'
H
OH
18
19.
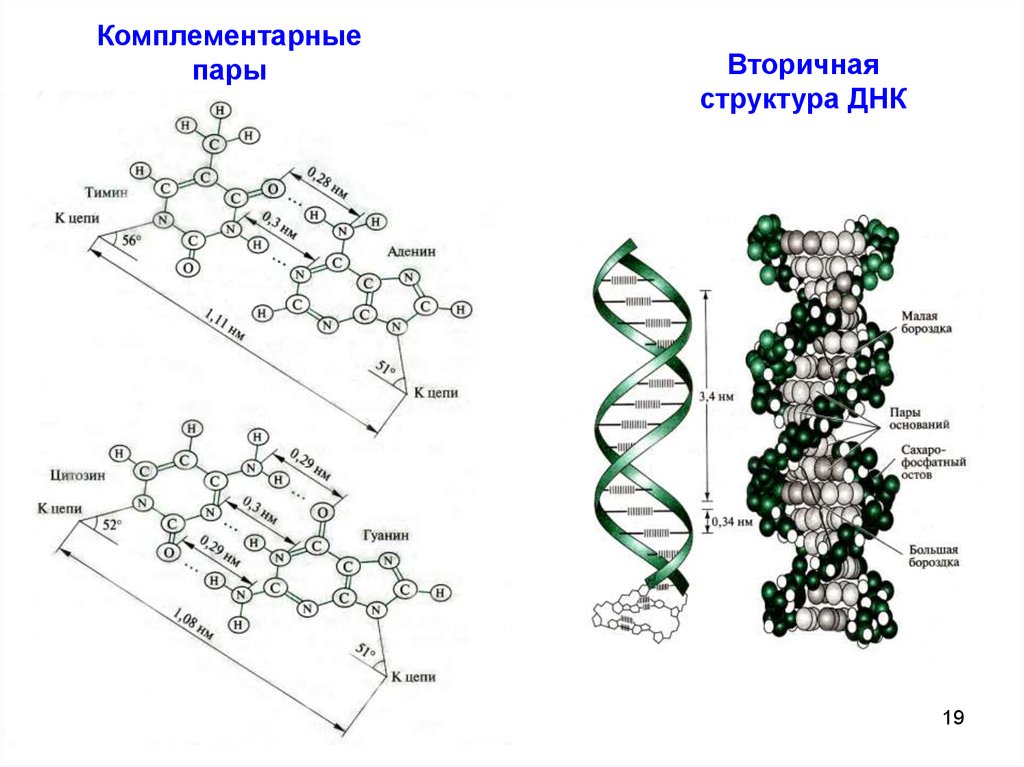
Комплементарныепары
Вторичная
структура ДНК
19
20.
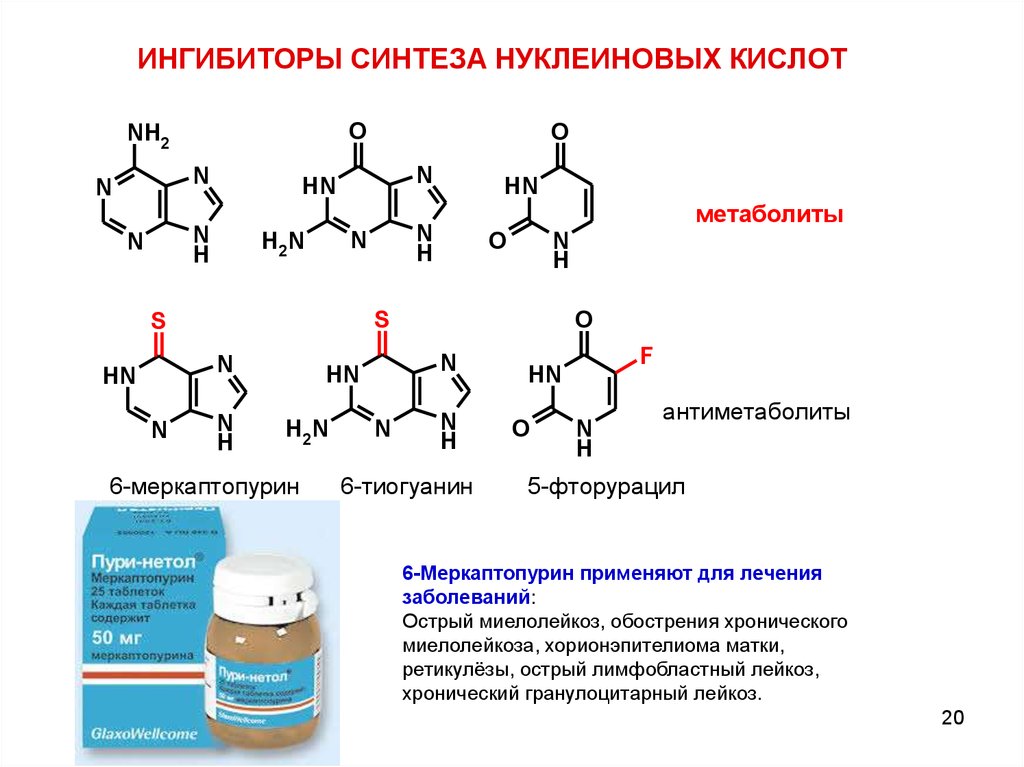
ИНГИБИТОРЫ СИНТЕЗА НУКЛЕИНОВЫХ КИСЛОТO
NH2
N
N
N
HN
N
H
N
N
H
H2N
6-меркаптопурин
O
N
HN
N
метаболиты
N
H
O
S
N
N
HN
N
H
N
H2N
S
HN
O
N
H
6-тиогуанин
F
HN
O
N
H
антиметаболиты
5-фторурацил
6-Меркаптопурин применяют для лечения
заболеваний:
Острый миелолейкоз, обострения хронического
миелолейкоза, хорионэпителиома матки,
ретикулёзы, острый лимфобластный лейкоз,
хронический гранулоцитарный лейкоз.
20
21.
антагонисты вирусной ДНК-полимеразы иобратной транскриптазы
O
NH2
N
N
N
HO
HN
N
HO
O
OH OH
NH2
N
HO
HO
O
OH
видарабин
O
O
N
N
N
O
O
HO
OH
OH
O
N
N
NH2
NH2
HN
N
O
HO
N
N
O
N3
азидотимидин
O
HO
N
O
зальцитабин
Показания для применения видарабина
Заболевания, вызываемые Herpes simplex типов 1 и 2, в т.ч.
кератит, кератоконъюнктивит, рецидивирующий генитальный
герпес, энцефалит.
21
22.
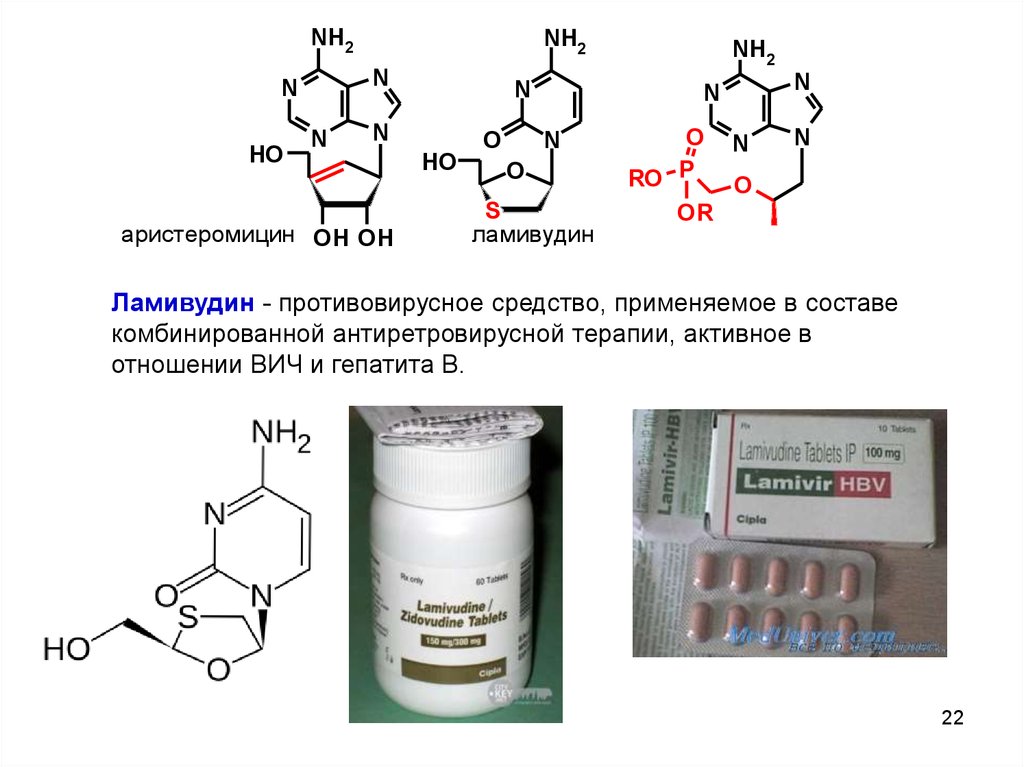
NH2N
N
HO
NH2
N
N
N
аристеромицин OH OH
HO
N
N
O
NH2
O
S
ламивудин
O N
RO P
O
OR
N
N
Ламивудин - противовирусное средство, применяемое в составе
комбинированной антиретровирусной терапии, активное в
отношении ВИЧ и гепатита В.
22
23.
OO
N
HN
H2N
HO
N
N
O
O
N
HN
H2N
HO
N
N
O
OH OH
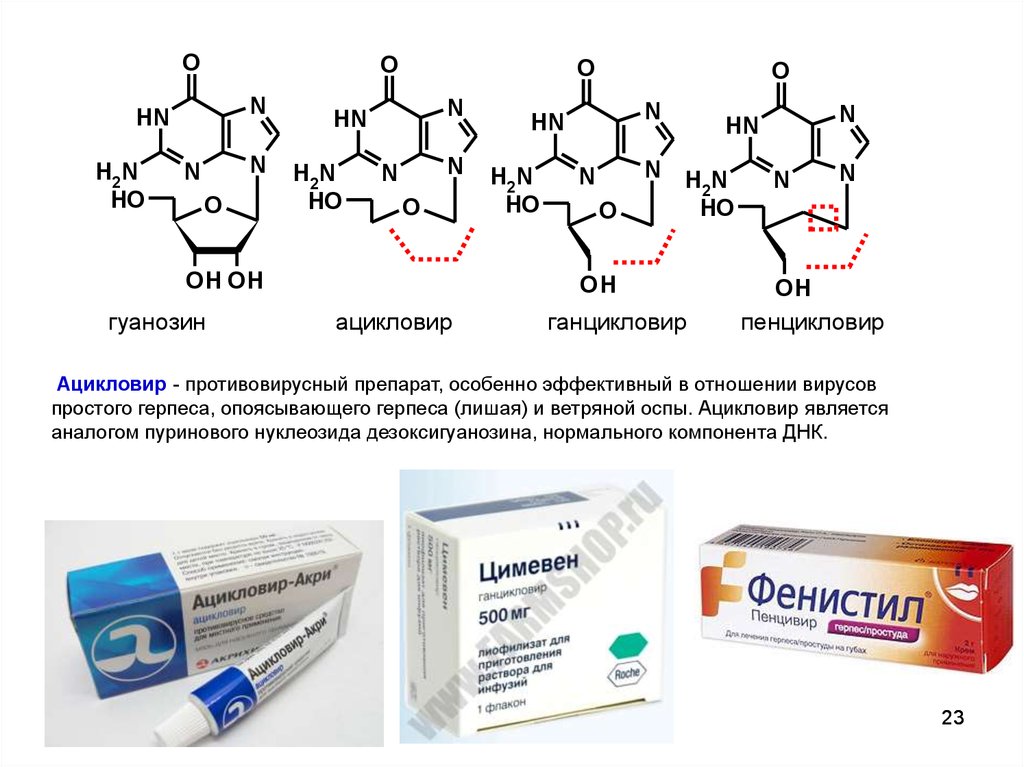
гуанозин
O
N
HN
H2N
HO
N
O
N HN
2
HO
OH
ацикловир
ганцикловир
N
HN
N
N
OH
пенцикловир
Ацикловир - противовирусный препарат, особенно эффективный в отношении вирусов
простого герпеса, опоясывающего герпеса (лишая) и ветряной оспы. Ацикловир является
аналогом пуринового нуклеозида дезоксигуанозина, нормального компонента ДНК.
23
24.
Курс лекций является частью учебно-методического комплекса«Химия биологически активных веществ»
автор:
Носова Эмилия Владимировна, д.х.н., доцент кафедры органической химии УрФУ
Учебно-методический комплекс подготовлен на кафедре органической и
биомолекулярной химии
химико-технологического института УрФУ
Никакая часть презентации не может быть воспроизведена в
какой бы то ни было форме без письменного разрешения авторов
24






 Биология
Биология Химия
Химия








