Похожие презентации:
Диазины. Общая характеристика диазинов
1.
Химиягетероциклических
соединений
ЛЕКЦИЯ 7
Диазины
2.
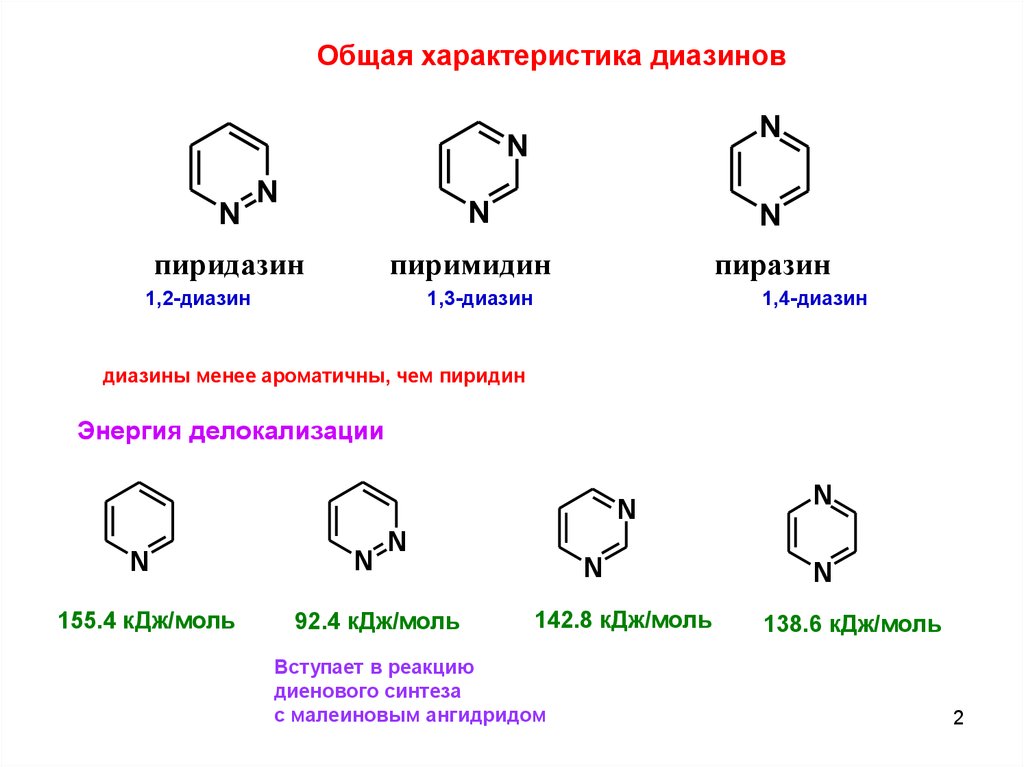
Общая характеристика диазиновN
N
N
N
пиридазин
N
N
пиримидин
пиразин
1,3-диазин
1,2-диазин
1,4-диазин
диазины менее ароматичны, чем пиридин
Энергия делокализации
N
N
155.4 кДж/моль
N
N
N
92.4 кДж/моль
N
142.8 кДж/моль
Вступает в реакцию
диенового синтеза
с малеиновым ангидридом
N
138.6 кДж/моль
2
3.
Реакционная способность диазиновнезамещенные диазины еще менее склонны
к реакциям электрофильного замещения, чем пиридин
облегчена атака диазинов нуклеофильными реагентами по сравнению с пиридином.
Все атомы углерода в молекулах диазинов расположены в орто- или пара-положениях
относительно гетероатома, за исключением атома С-5 в пиримидине
Интермедиаты, образующиеся при присоединении нуклеофилов к этим атомам углерода,
а также при депротонировании алкильных заместителей в этих положениях,
резонансно стабилизированы с участием гетероатомов.
-
H
Nu
N
Nu
Nu
N
CH2
N
H
H
-
N
N
N
N
-
CH2
N
N
N
CH2
CH2
-
N
N
N
N
-
3
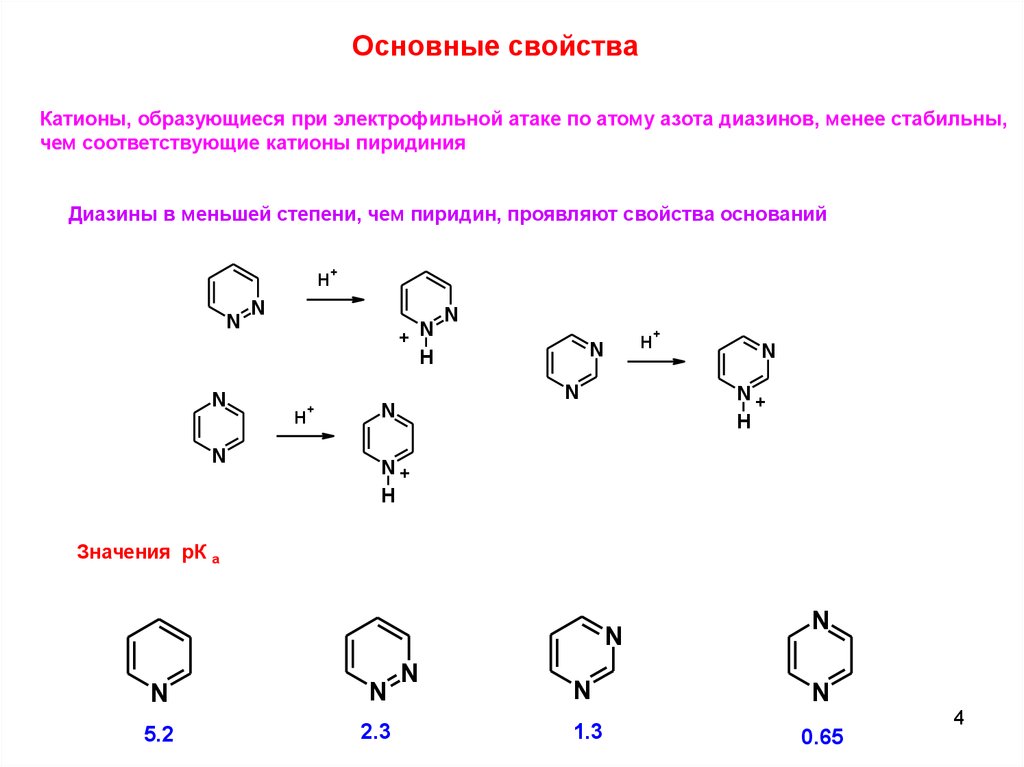
4.
Основные свойстваКатионы, образующиеся при электрофильной атаке по атому азота диазинов, менее стабильны,
чем соответствующие катионы пиридиния
Диазины в меньшей степени, чем пиридин, проявляют свойства оснований
H
N
N
N
+
H
N
H
N
N
N
H
N
+
+
+
N
N+
H
N
N+
H
Значения рК а
N
N
N
5.2
2.3
N
N
N
N
1.3
0.65
4
5.
Реакции алкилирования и окисления по атому азотаДиазины труднее образуют четвертичные соли и N-оксиды
Иодистый метил –
реагент для получения
моно-четвертичных солей
Триэтилоксония борфторид –
реагент для получения
бис-четвертичных солей
N
N
N
N
N
+
-
Et
+
N
BF
4
Me
N
+N
O-
R-C(O)-OOH
N
+ Et3O BF4
N
RCOOOH
BF4
R-C(O)-OOH
N
N
+
O-
+N
-O
N
+
O-
5
6.
Нуклеофильное замещение галогенаГалогенпроизводные диазинов, содержащие атомы галогена в a- или g-положении
относительно атома азота, чрезвычайно легко вступают в реакции нуклеофильного замещения
Y
N
N
-
N
N
Cl
Y
Cl
N
-
Y
Cl
N
N
- Cl
-
N
Y
Относительные скорости замещения хлора 4-нитрофенолят-анионом
(условия: 4-NO2C6H4OH, MeOH, 50 0C)
Cl
Cl
N
N
N
N
N
1.2•10 14
N
N
1.9•10 14
Cl
4.1•10 14
N
Cl
6.3•10 16
Cl
N
N
1.1•10 15
Cl
N
N
1.2•10 13
Cl
1
6
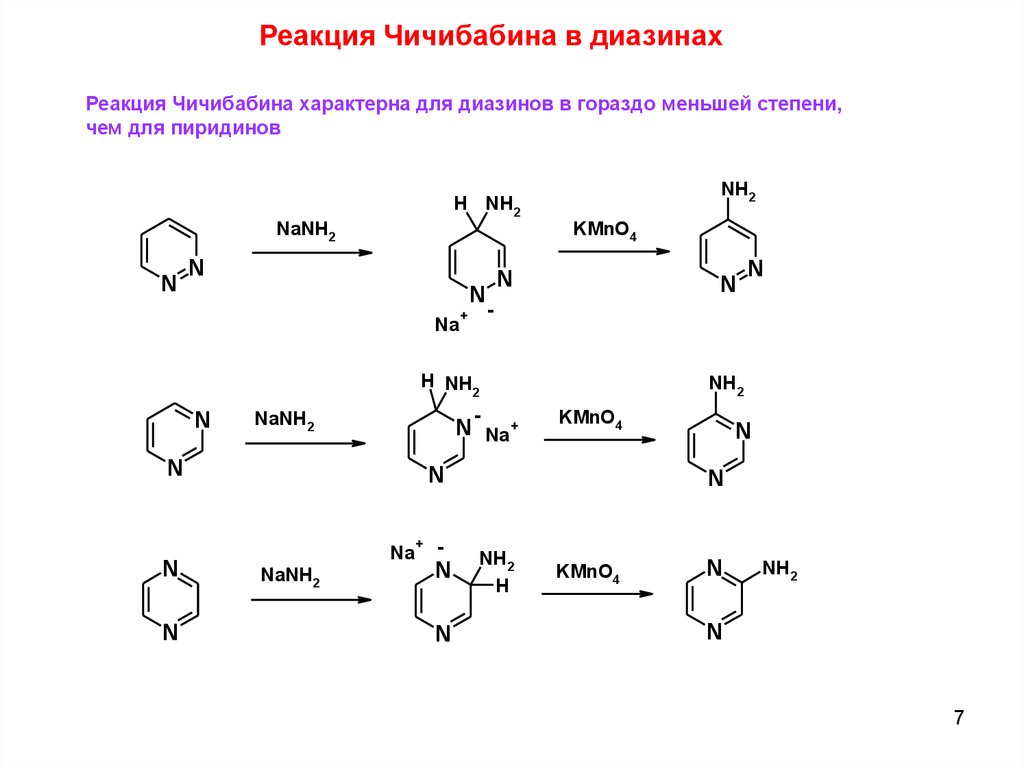
7.
Реакция Чичибабина в диазинахРеакция Чичибабина характерна для диазинов в гораздо меньшей степени,
чем для пиридинов
NH2
H NH2
NaNH2
N
KMnO4
N
N
Na
+
N
N
-
H NH
2
N
-
NaNH2
N Na+
N
N
N
NH2
KMnO4
N
Na
NaNH2
+
-
N
N
N
N
N
NH2
H
KMnO4
N
NH2
N
7
8.
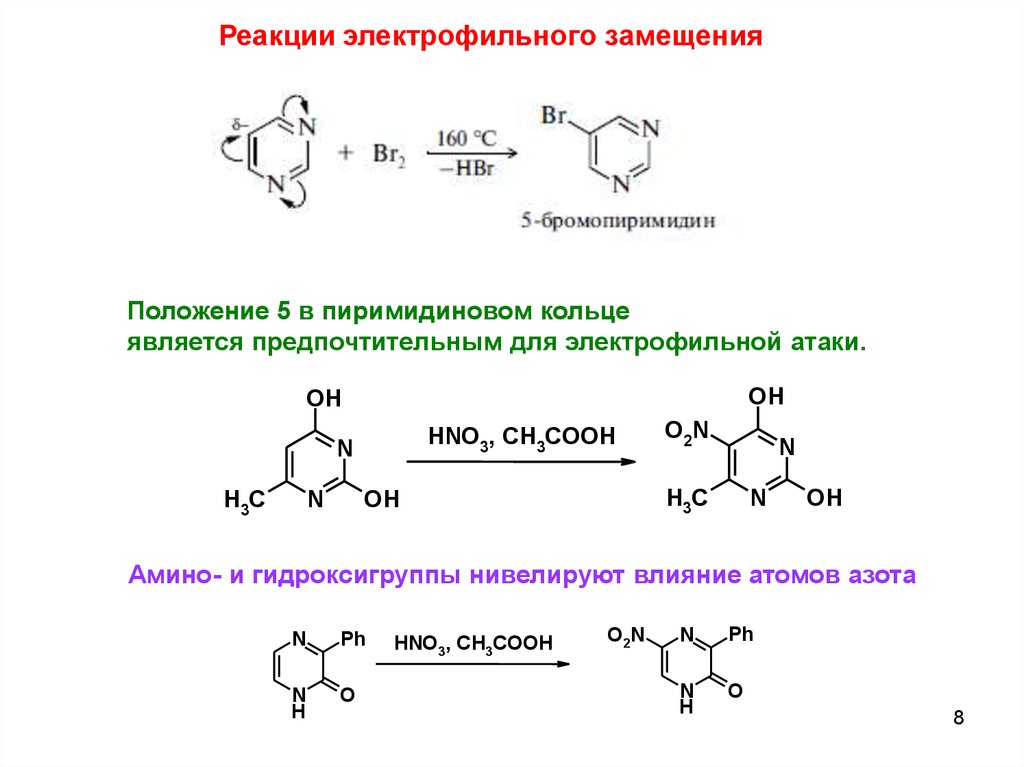
Реакции электрофильного замещенияПоложение 5 в пиримидиновом кольце
является предпочтительным для электрофильной атаки.
OH
OH
HNO3, CH3COOH
N
H3C
N
O2 N
N
H3C
OH
N
OH
Амино- и гидроксигруппы нивелируют влияние атомов азота
N
Ph
N
H
O
HNO3, CH3COOH
O2 N
N
Ph
N
H
O
8
9.
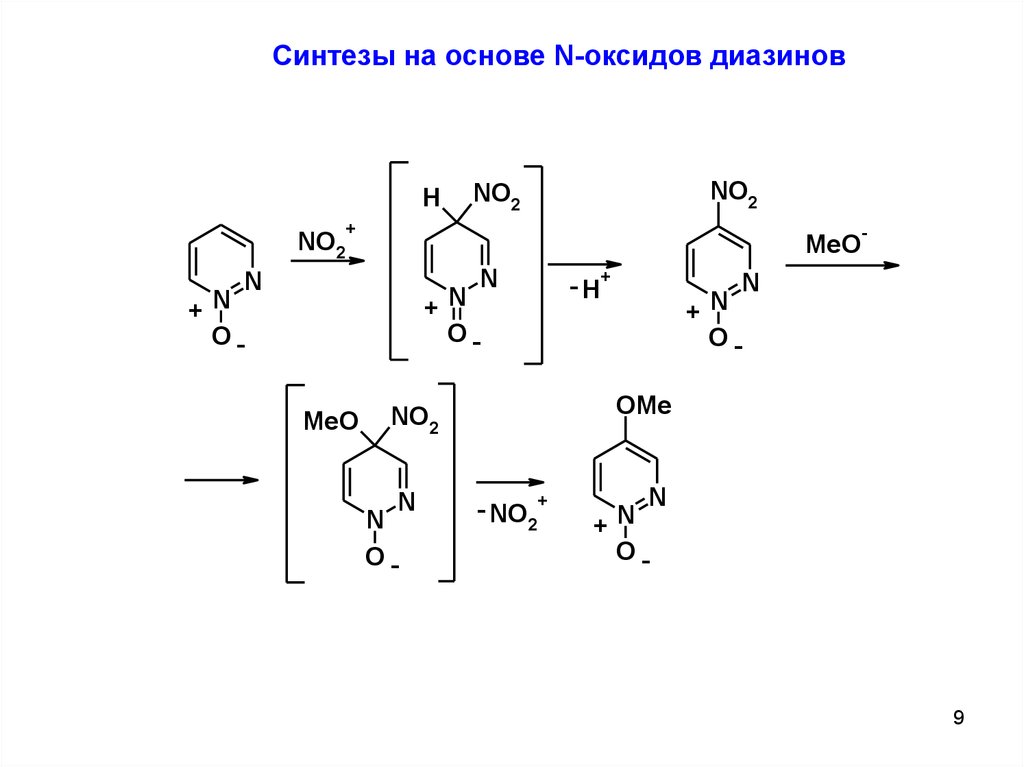
Синтезы на основе N-оксидов диазиновH
NO2
NO2
NO2
+
MeO
N
N
- H+
+N
O-
+N
O-
MeO
N
O-
N
N
+
OOMe
NO2
N
-
- NO
+
2
N
+N
O-
9
10.
Конденсации по активной метильной группеДля 3- и 4-метилпиридазинов характерна конденсация
с бензальдегидом по метильной группе
Me
N
N
PhC(O)H
HO
CH=CH-Ph
N
N
3-стирилпиридазин
Стирилпроизводные диазинов –
люминесцентные материалы
Journal of Heterocyclic Chemistry,
Vol. 46, 2009, pp. 691-701
10
11.
Синтез пиридазинов из 1,4-дикарбонильных соединений и гидразина2
R
1
R
O
2
R
H2N-NH2
O
1
R
N
2
R
[O]
N
1
R
N
N
Синтез незамещенного пиридазина из a-кетоглутаровой кислоты
H2N-NH2
COOH
HOOC
O
HOOC
O
HOOC
N
Cl
N
N
O
N
NH
O
t
NH
N
Br2, CH3COOH
- HBr
POCl3
NH
H2, Pd/C
- HCl
N
N
11
12.
Методы синтеза пиразина и его производныхКонденсация 2-аминокарбонильных соединений
Cl
R'
O
-
+
H3N
R
O
R
2
+
R
NH3 Cl+
3
HO
-
- 2HOH
R'
N
H
2
R
R
H
N
H2O2
2
R'
N
R
R
N
R
3
R
3
Из 1,2-дикарбонильных соединений и 1,2-диаминов
R'
NH2
R
O
R
+
R
NH2
2
O
R'
3
R
2
N
R
N
R
CuCrO2
3
300 oC
2
R'
N
R
R
N
R
3
Если оба компонента несимметричны, образуется 2 изомерных пиразина
Me
H2N
O
+
Et
O
H2N
0
EtOEt, 0 C
Me
N
Et
N
хромит меди
300 oC
Me
N
Et
N
12
13.
Методы синтеза пиримидиновКонденсация b-карбонильных соединений (или их эквивалентов,
например ацеталей,) с формамидом, амидинами, мочевиной,
тиомочевиной или гуанидином
NH
O
H
+
N
H2N
O
- 2HOH
N
Конденсация с участием тиомочевины
OMe
NH2
OMe
+
MeO
OMe
H2N
S
N
HCl, EtOH, t
N
H
S
13
14.
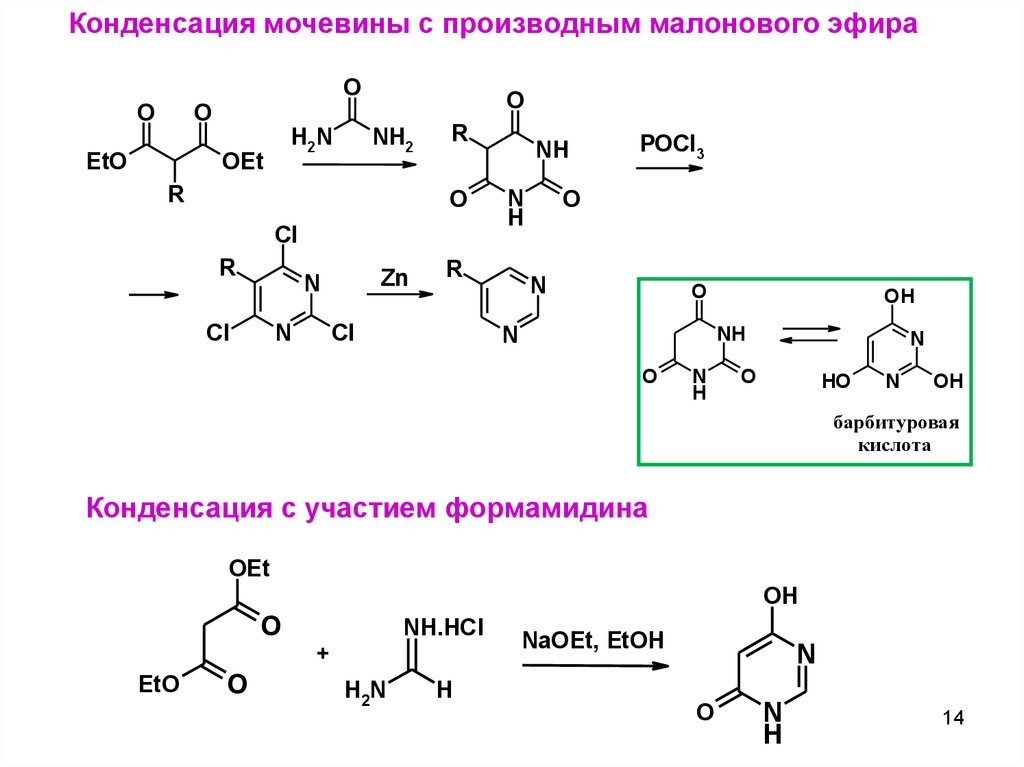
Конденсация мочевины c производным малонового эфираO
O
O
O
EtO
H2N
OEt
NH2
R
R
O
Cl
R
Zn
N
Cl
N
NH
N
H
R
Cl
POCl3
O
N
O
OH
NH
N
O
N
H
N
O
HO
N
OH
барбитуровая
кислота
Конденсация с участием формамидина
OEt
OH
O
NH.HCl
+
EtO
O
H2N
NaOEt, EtOH
N
H
O
N
H
14
15.
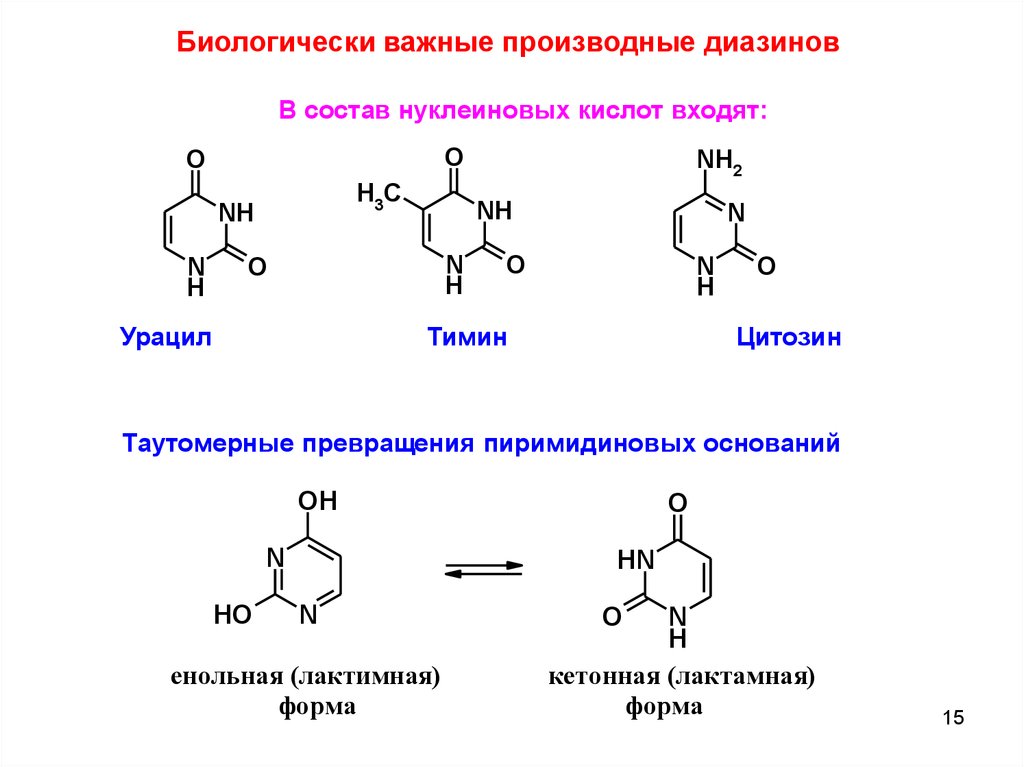
Биологически важные производные диазиновВ состав нуклеиновых кислот входят:
O
O
H3C
NH
N
H
NH
N
H
O
Урацил
NH2
N
O
N
H
Тимин
O
Цитозин
Таутомерные превращения пиримидиновых оснований
OH
N
HO
O
HN
N
енольная (лактимная)
форма
O
N
H
кетонная (лактамная)
форма
15
16.
НуклеозидыO
O
H3C
NH
N
HO
O
NH
N
HO
N
O
N
HO
O
O
HO
NH2
OH
O
HO
уридин (У)
HO
дезокситимидин (dT)
OH
N
N
N
HOH2C
O
N
HOH2C
O
H H
OH
цитидин (Ц)
NH2
Нуклеотиды
O
H
H
O OH
HO P O
OH
цитидин-монофосфат
(ЦМФ)
O
O
H H
H
H
O OH
HO P O
OH
уридин-монофосфат
(УМФ)
16
17.
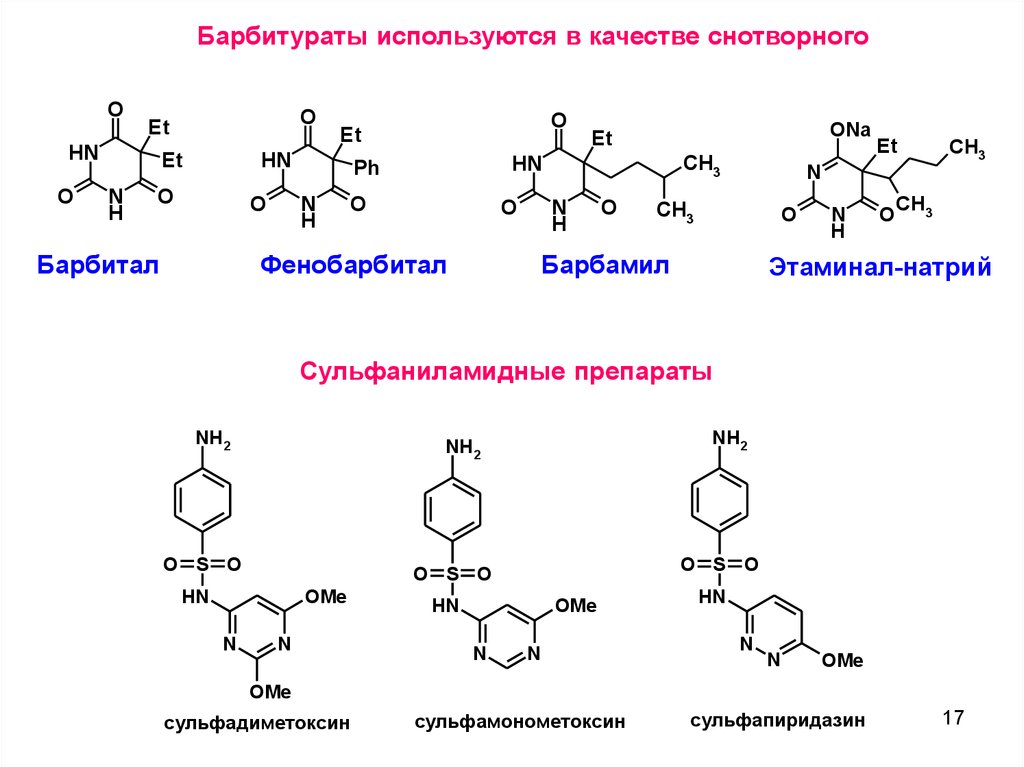
Барбитураты используются в качестве снотворногоO
HN
O
O
Et
Et
N
H
HN
O
O
Барбитал
O
Et
CH3
HN
Ph
N
H
ONa
Et
O
O
Фенобарбитал
N
H
O
Et
CH3
N
CH3
O
Барбамил
N
H
O
CH3
Этаминал-натрий
Сульфаниламидные препараты
NH2
O S O
O S O
O S O
OMe
HN
N
NH2
NH2
N
OMe
HN
N
N
HN
N
N
OMe
OMe
сульфадиметоксин
сульфамонометоксин
сульфапиридазин
17
18.
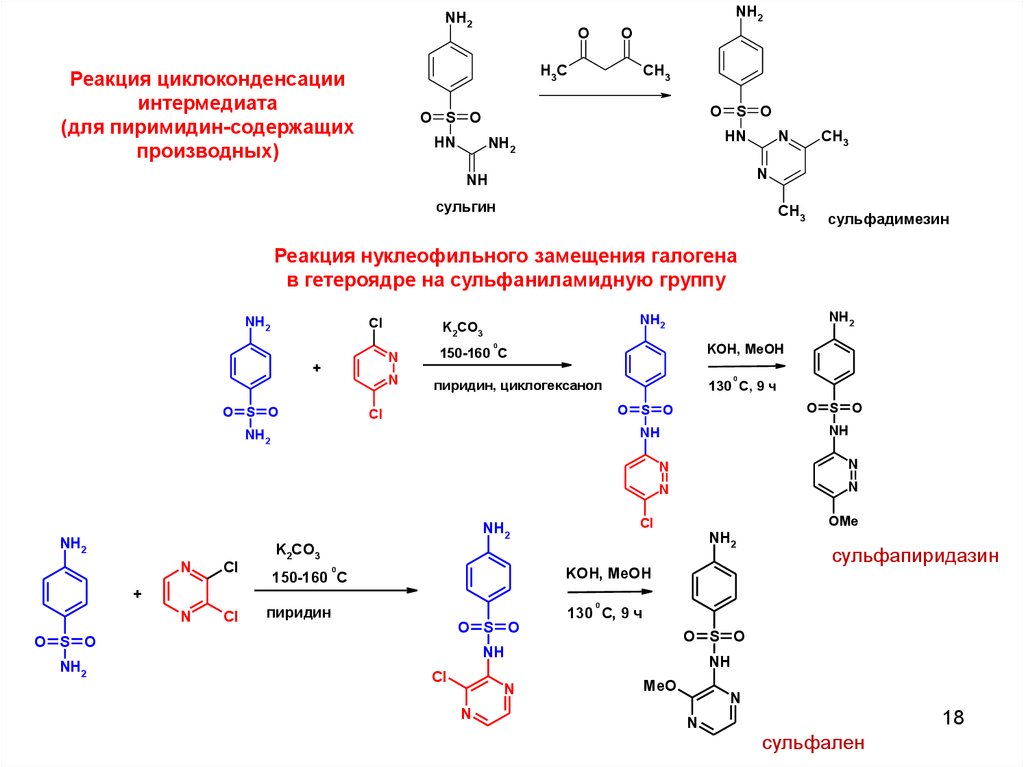
NH2NH2
O
O
CH3
H3C
Реакция циклоконденсации
интермедиата
(для пиримидин-содержащих
производных)
O S O
O S O
HN
HN
NH2
N
CH3
N
NH
сульгин
CH3
сульфадимезин
Реакция нуклеофильного замещения галогена
в гетероядре на сульфаниламидную группу
NH2
Cl
NH2
NH2
K2CO3
0
N
+
N
O S O
KOH, MeOH
150-160 C
130 C, 9 ч
O S O
O S O
Cl
NH
NH
NH2
N
N
N
N
OMe
Cl
NH2
NH2
0
пиридин, циклогексанол
NH2
K2CO3
N
Cl
N
Cl
0
сульфапиридазин
KOH, MeOH
150-160 C
+
0
пиридин
O S O
O S O
NH2
130 C, 9 ч
O S O
NH
Cl
N
N
NH
MeO
N
N
18
сульфален
19.
Хиноксалин – представитель бензодиазиновNH2
O
H
O
CH3
N
EtOH, t
+
NH2
ортофенилендиамин
N
метилглиоксаль
(пировиноградный альдегид)
CH3
2-метилхиноксалин
Электрофильное замещение протекает по бензольному кольцу хиноксалина в жестких условиях,
например, нитрование смесью конц. HNO3 и олеума при 90 °С (в течение суток)
приводит к образованию смеси 1,5% 5-нитро- и 24% 5,6-динитрохиноксалина.
NO2
NO2
N
N
O2N
N
HNO3, H2SO4
+
90 C, 1 сутки
N
N
N
1.5%
24%
19
20.
Курс лекций является частью учебно-методического комплекса«Химия гетероциклических соединений»
автор:
Носова Эмилия Владимировна, д.х.н., доцент кафедры органической химии УГТУ-УПИ
Учебно-методический комплекс подготовлен на кафедре органической и
биомолекулярной химии химико-технологического института УрФУ
Никакая часть презентации не может быть воспроизведена в
какой бы то ни было форме без письменного разрешения авторов
20 14











 Химия
Химия