Похожие презентации:
Белки и пептиды. Первичная структура. Лекция 2-3
1.
Доцент О.В. Стасевич, к.х.н., доцентЛЕКЦИЯ 2
«БЕЛКИ И ПЕПТИДЫ. ПЕРВИЧНАЯ
СТРУКТУРА БЕЛКОВ И ПЕПТИДОВ»
2.
БЕЛКИБелки, или протеины,—
важнейший класс биологически
активных веществ. Они играют
ключевую роль в клетке,
присутствуют в виде главных
компонентов в любых формах
живой материи, будь то
микроорганизмы, животные
или растения.
3.
Исторический очерк.Свое название белки получили от яичного
белка, который с незапамятных времен
использовался человеком как составная часть
пищи. Согласно описаниям Г. Плиния Старшего, уже в Древнем Риме яичный белок
применялся и как лечебное средство. Однако
подлинная история белковых веществ
начинается тогда, когда появляются первые
сведения о свойствах белков как химических
соединений (свертываемость при
нагревании, разложение кислотами и
крепкими щелочами и т. п.). Среди белков
живот- ного происхождения, вслед за яичным
белком, были охарактеризованы белки
крови.
4.
Белки5.
Строение белка. История.• Первая концепция строения белков
принадлежит голландскому химику Г.
Мульдеру (1836). Основываясь на теории
радикалов, он сформулировал понятие о
минимальной структурной единице,
входящей в состав всех белков. Эту
единицу, Г. Мульдер назвал протеином (Рг),
а свою концепцию — теорией протеина.
6.
Строение белка. История.• Дальнейшие структурные исследования белка,
а также основополагающие работы Т. Курциуса
по синтезу пептидов привели в конце концов к
формулированию (1902) пептидной гипотезы,
согласно которой белки построены из
аминокислот, соединенных пептидными
связями —СО—NH—. Пептидная теория (Э.
Фишер и В. Гофмейстер) получила полное
подтверждение в дальнейших исследованиях.
Изучение строения белков было поставлено на
прочную научную основу.
7.
БелкиБелки — высокомолекулярные природные
полимеры, построенные из остатков аминокислот,
соединенных амидной (пептидной) связью ( — С О
— N H — ) . Каждый белок характеризуется специфичной аминокислотной последовательностью.
Молекулярная масса белков колеблется в пределах от 6000 до 2 000 000
Да. Именно белки являются продуктом генетической информации,
передаваемой из поколения в поколение, и осуществляют все процессы
жизнедеятельности в клетке. Этим удивительным по разнообразию
полимерам присущи одни из наиболее важных и разносторонних
клеточных функций.
8.
Белки. Классификация построению.
1
• Простые
2
• Сложные
9.
Белки. Классификация по строению.Простые белки состоят из остатков аминокислот и
при гидролизе распадаются, соответственно,
только на свободные аминокислоты или их
производные.
Сложные белки – это двухкомпонентные белки,
которые состоят из какого-либо простого белка и
небелкового компонента, называемого
простетической группой. При гидролизе сложных
белков, помимо свободных аминокислот, образуется
небелковая часть или продукты ее распада.
В их состав могут входить ионы металлов (металлопротеины), молекулы пигментов
(хромопротеины), они могут образовывать комплексы с другими молекулами (липо-,
нуклео-, гликопротеины), а также ковалентно связывать неорганический фосфат
(фосфопротеины).
10.
Белки. Классификация порастворимости в воде.
1
• водорастворимые
2
• солерастворимые
3
• спирторастворимые
4. нерастворимые
11.
Белки. Классификация в зависимости отвыполняемой биологической функции
1
2
3
• каталитическая (ферментативная)
• регуляторная (способность регулировать
скорость химических реакций в клетке и
уровень метаболизма в целом организме)
• транспортная (транспорт веществ в
организме и перенос их через биомембраны)
4. структурная (в составе хромосом, цитоскелета,
соединительных, мышечных, опорных тканей)
5. рецепторная (взаимодействие рецепторных молекул с
внеклеточными компонентами и инициирование
специфического клеточного ответа)
Кроме этого, белки выполняют защитные, запасные, токсические,
сократительные и другие функции
12.
Белки. Классификация взависимости от пространственной
структуры.
1
• фибриллярные (они
используются природой
как структурный
материал)
2
• глобулярные
(ферменты, антитела,
некоторые гормоны и
др.).
13.
ПептидыПептиды — это цепочечные молекулы,
содержащие от двух до ста остатков
аминокислот, соединенных между собой
амидными (пептидными) связями.
Термин «пептиды» был предложен известным химиком Эмилем
Фишером (1832—1919 гг.). Слово образовано из первых четырех букв
названия пептоны (продукты расщепления белков пепсином) и
конечных букв названия углеводов полисахариды.
По размеру молекулы и своим свойствам пептиды стоят между высокомолекулярными белками и аминокислотами.
14.
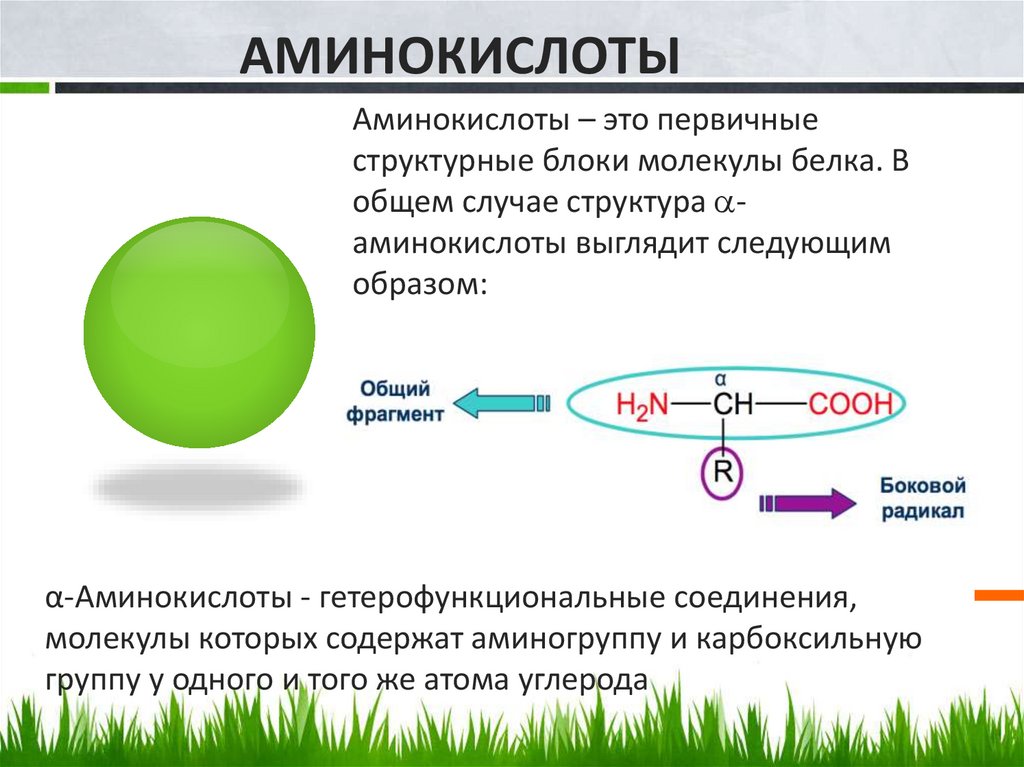
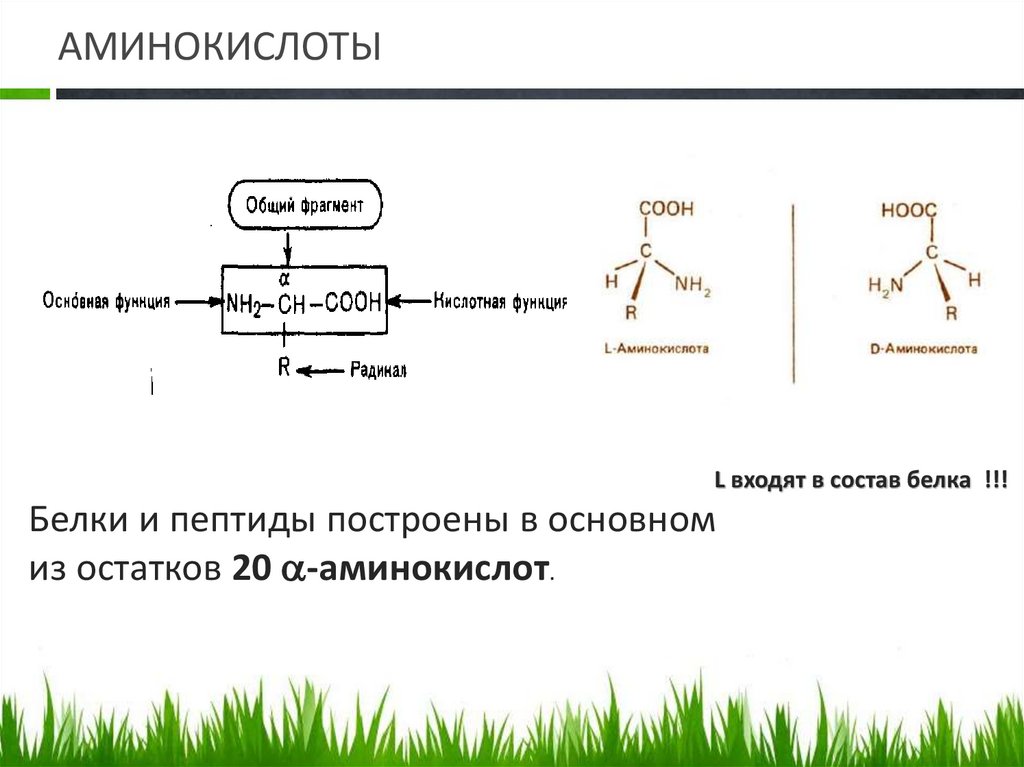
АМИНОКИСЛОТЫАминокислоты – это первичные
структурные блоки молекулы белка. В
общем случае структура аминокислоты выглядит следующим
образом:
α-Аминокислоты - гетерофункциональные соединения,
молекулы которых содержат аминогруппу и карбоксильную
группу у одного и того же атома углерода
15.
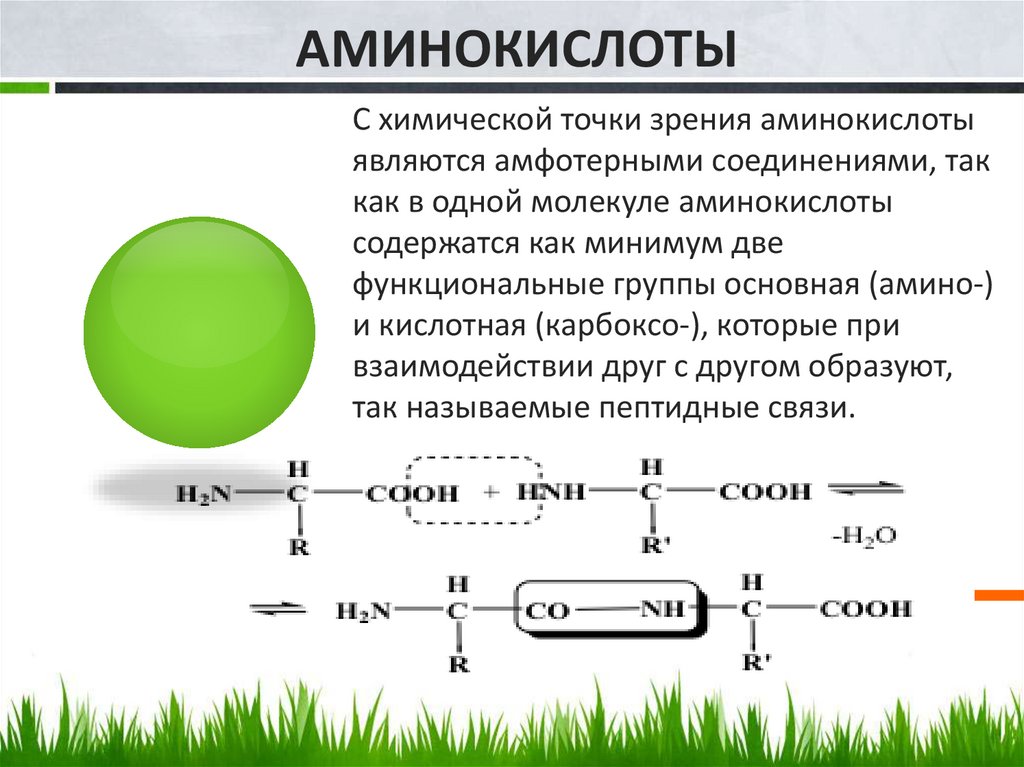
АМИНОКИСЛОТЫС химической точки зрения аминокислоты
являются амфотерными соединениями, так
как в одной молекуле аминокислоты
содержатся как минимум две
функциональные группы основная (амино-)
и кислотная (карбоксо-), которые при
взаимодействии друг с другом образуют,
так называемые пептидные связи.
16.
АМИНОКИСЛОТЫL входят в состав белка !!!
Белки и пептиды построены в основном
из остатков 20 -аминокислот.
17.
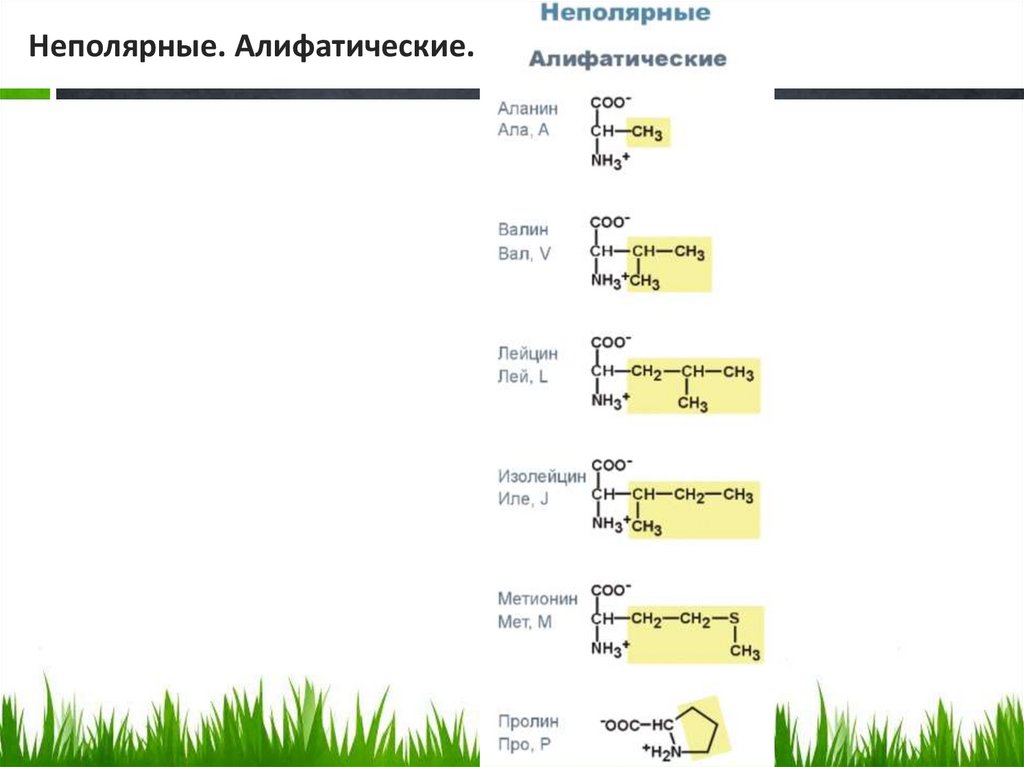
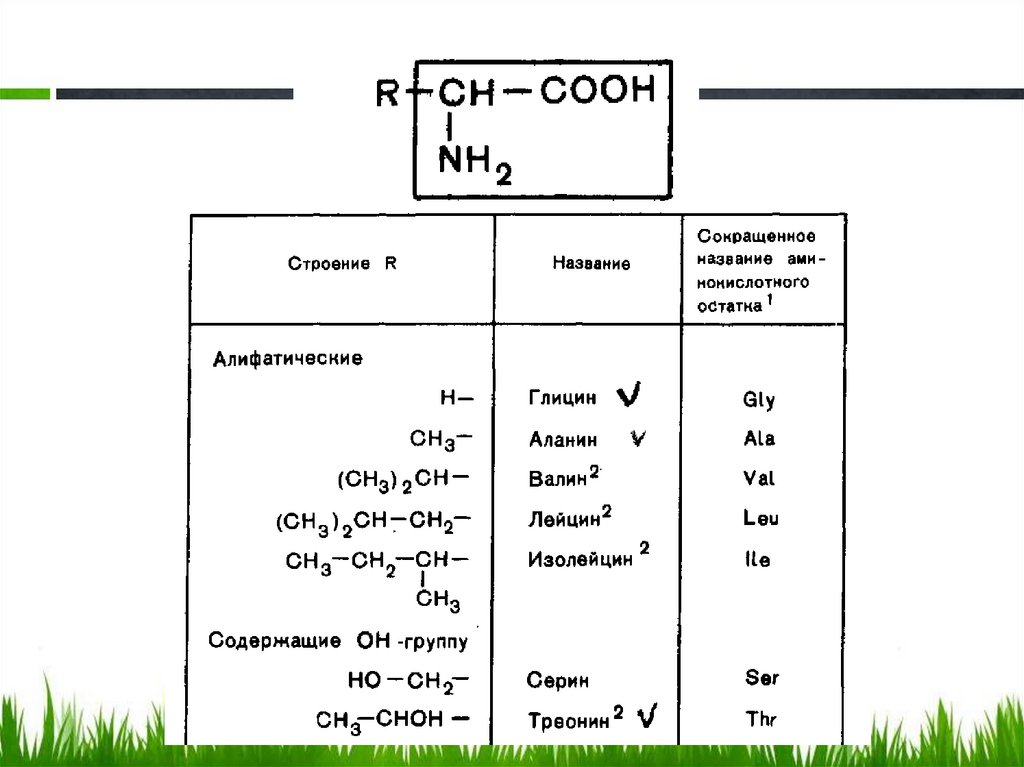
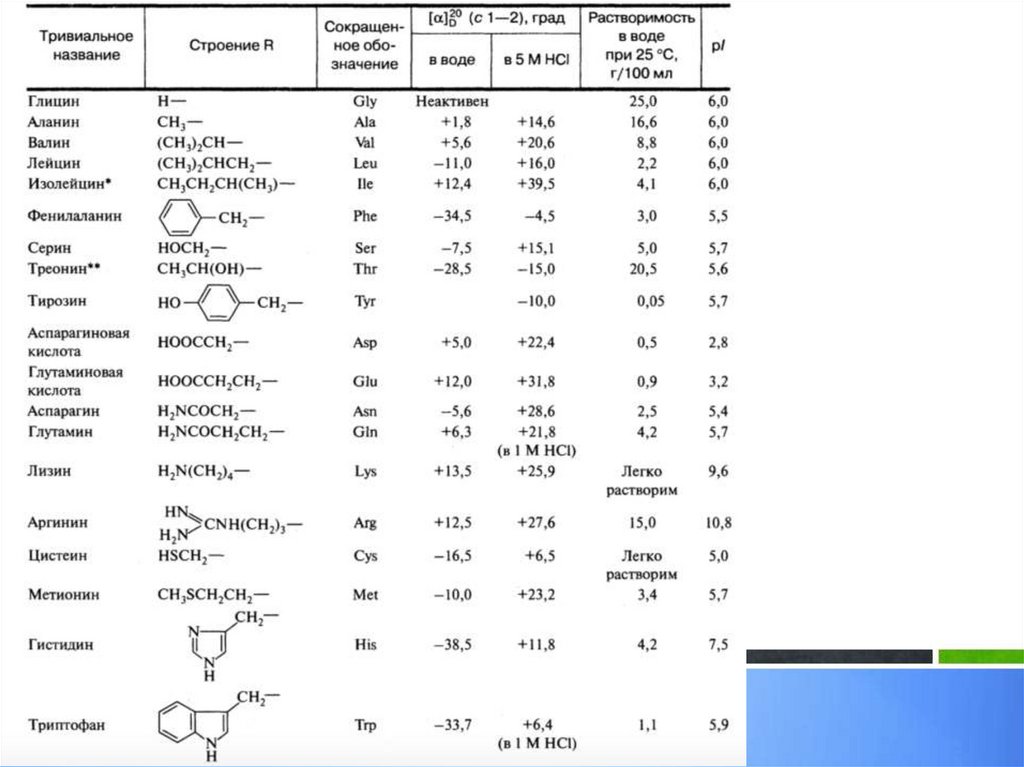
Неполярные. Алифатические.18.
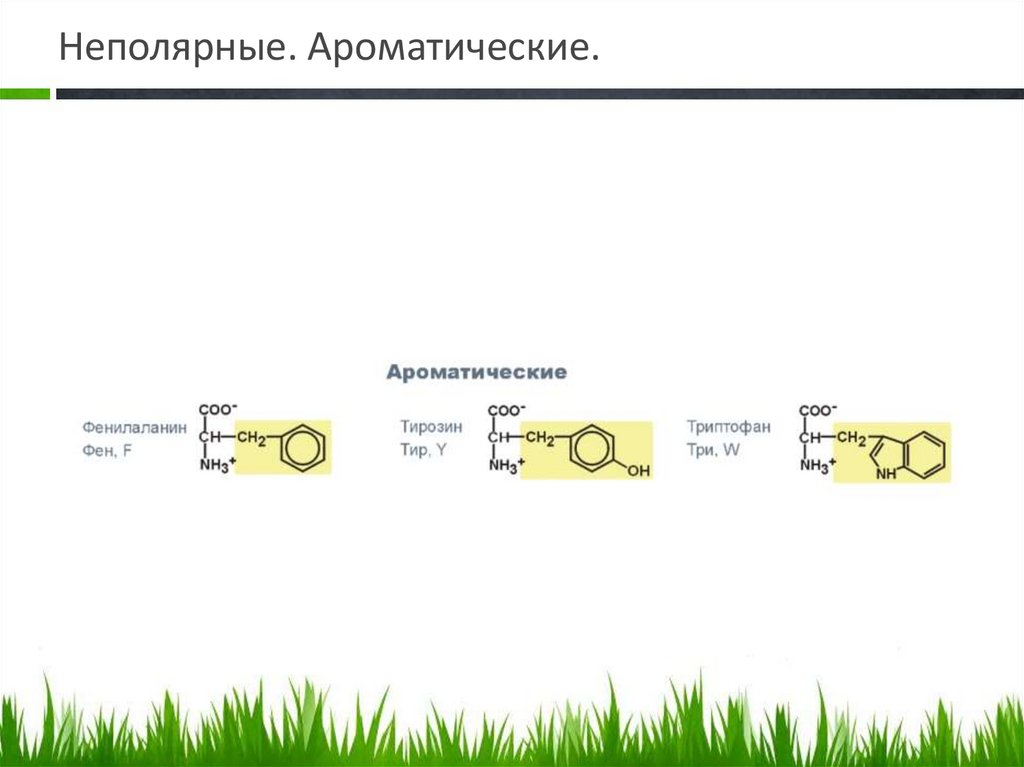
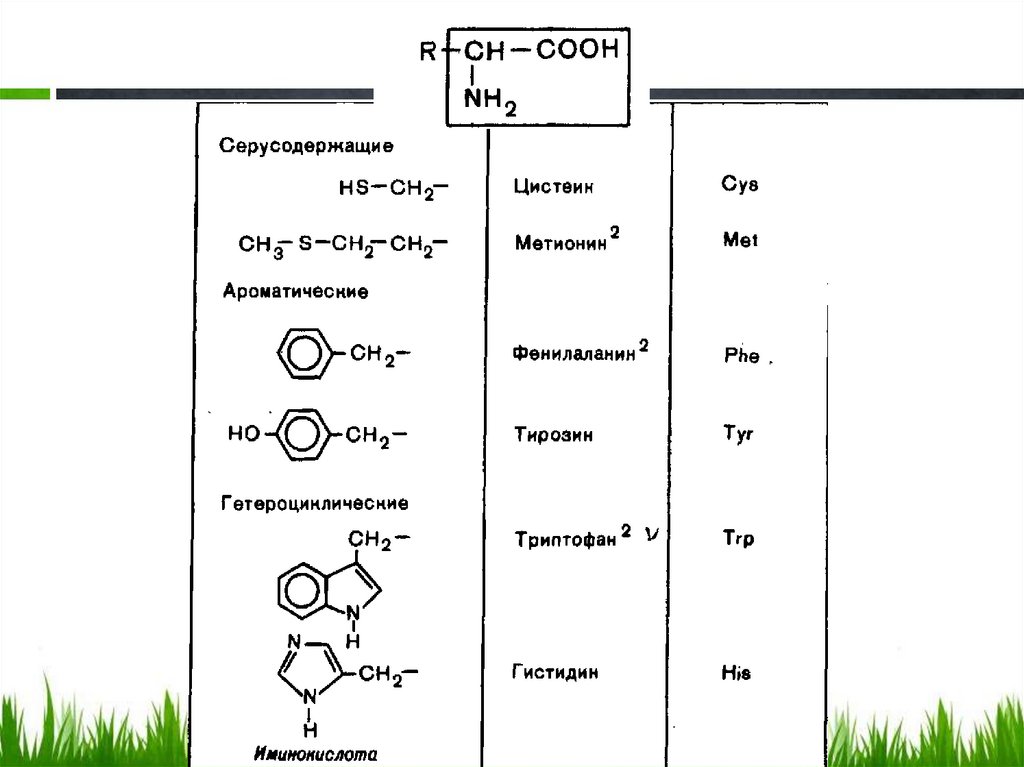
Неполярные. Ароматические.19.
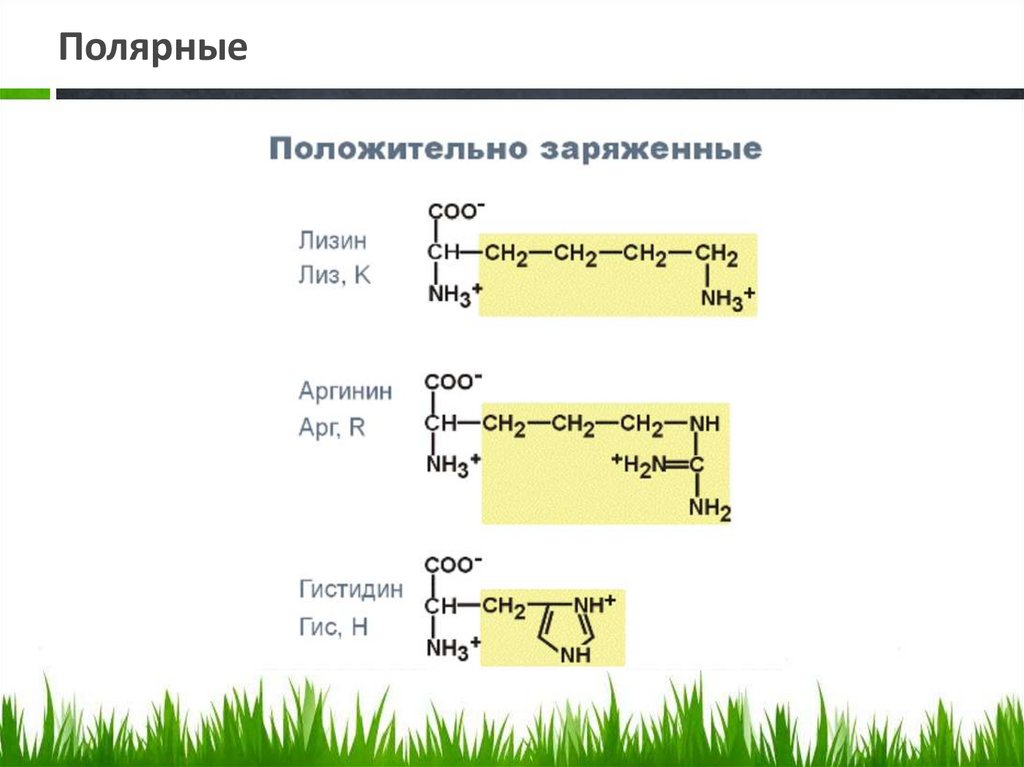
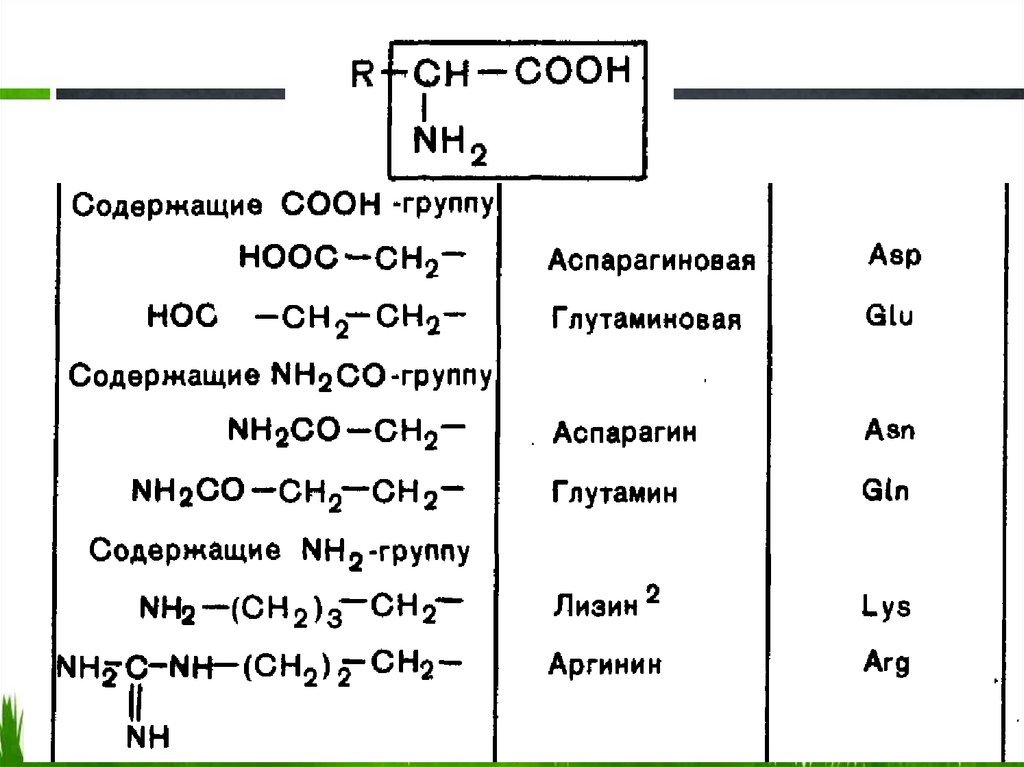
Полярные20.
Полярные21.
Полярные22.
23.
24.
25.
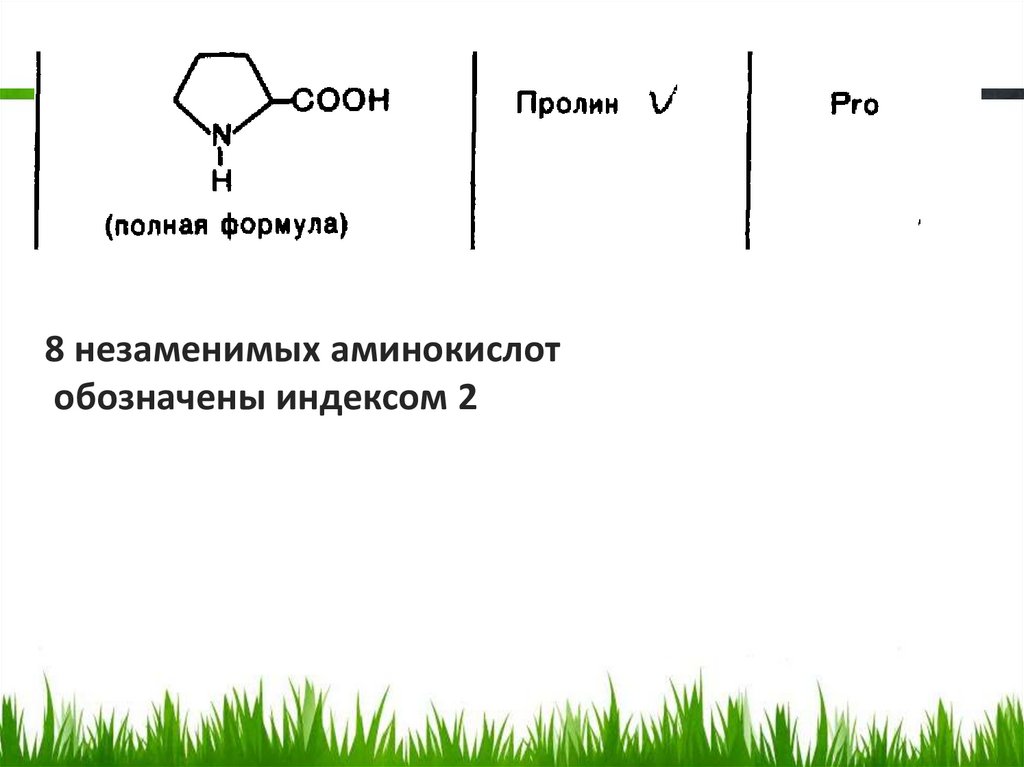
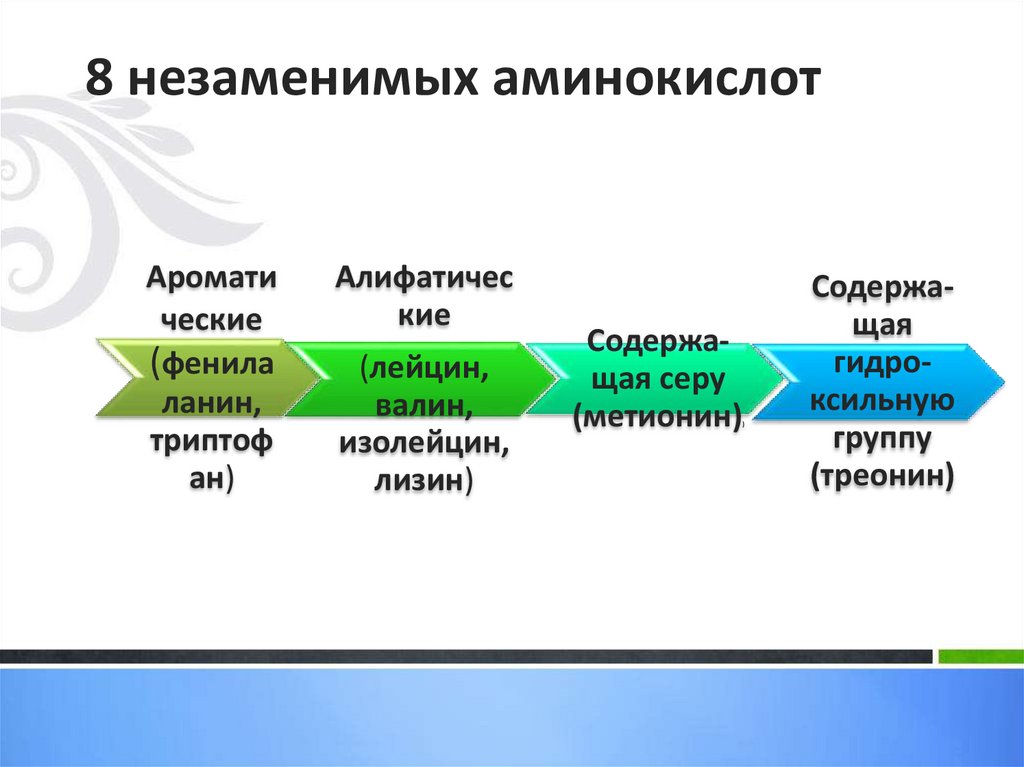
8 незаменимых аминокислотобозначены индексом 2
26.
Заменимые и незаменимые аминокислоты• В организме человека синтезируется только
часть аминокислот, другие должны
доставляться с пищей. Первые из них
называются заменимыми, вторые –
незаменимыми. Жизнедеятельность
человека обеспечивается ежедневным
потреблением с пищей сбалансированной
смеси, содержащей 8 незаменимых
аминокислот и 2 частично заменимые
(аргинин и гистидин).
27.
8 незаменимых аминокислотАромати
ческие
(фенила
ланин,
триптоф
ан)
Алифатичес
кие
(лейцин,
валин,
изолейцин,
лизин)
Содержащая серу
(метионин)
)
Содержащая
гидроксильную
группу
(треонин)
28.
29.
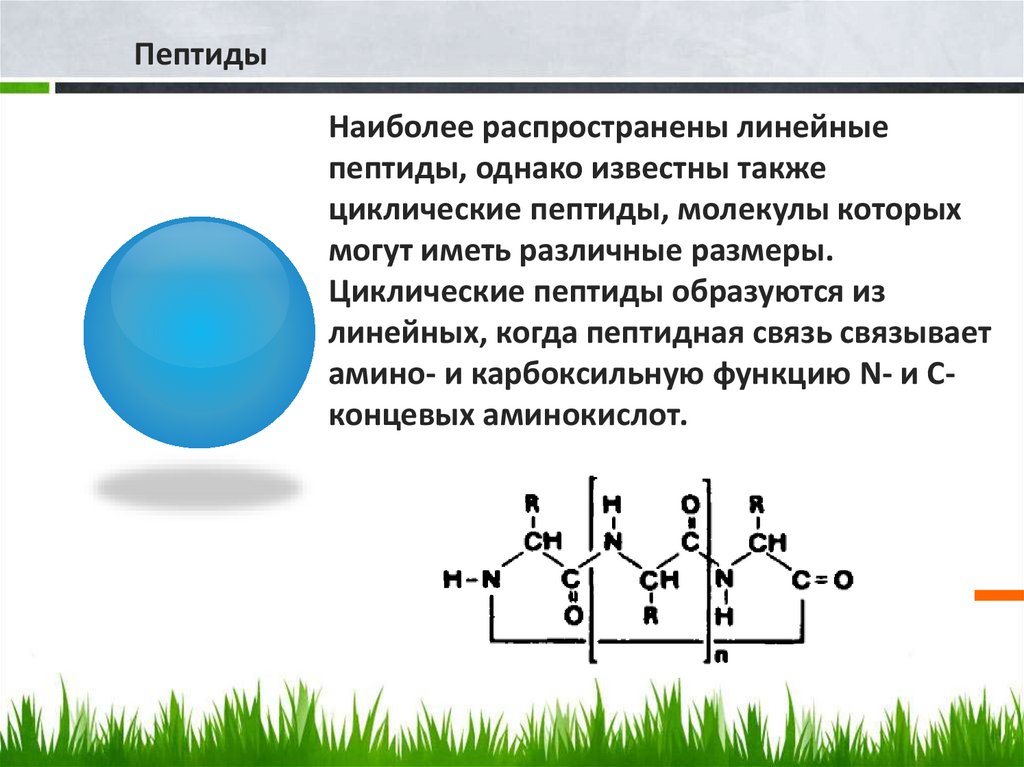
ПептидыНаиболее распространены линейные
пептиды, однако известны также
циклические пептиды, молекулы которых
могут иметь различные размеры.
Циклические пептиды образуются из
линейных, когда пептидная связь связывает
амино- и карбоксильную функцию N- и Сконцевых аминокислот.
30.
Пептиды. Классификация в зависимости отчисла аминокислот.
• ди-, три-, тетра-,
пента-, ..., окта-,
нона-, декапептиды
и т.д.
Чтобы избежать проблемы, связанной с греческой нумерацией
длинноцепочечных пептидов, Бодански предложил количество
аминокислотных остатков пептида обозначать арабской цифрой и
помещать перед словом «пептид». Например, 7- пептид вместо
гептапептид, 10-пептид вместо декапептид.
31.
ПептидыПептиды, в молекулах которых меньше
десяти аминокислотных остатков,
формально относятся к олигопептидам,
пептиды, построенные из большего числа
аминокислотных остатков (до - 100),— к
полипептидам.
Различие между полипептидами и белками (макропептидами)
чрезвычайно проблематично. Исторически сложилось так, что
границей между полипептидами и белками считают соединения с
молекулярной массой ~ 10 000, т. е. состоящие примерно из 100
остатков аминокислот. Такой принцип классификации основан на
способности к диализу через природные мембраны.
32.
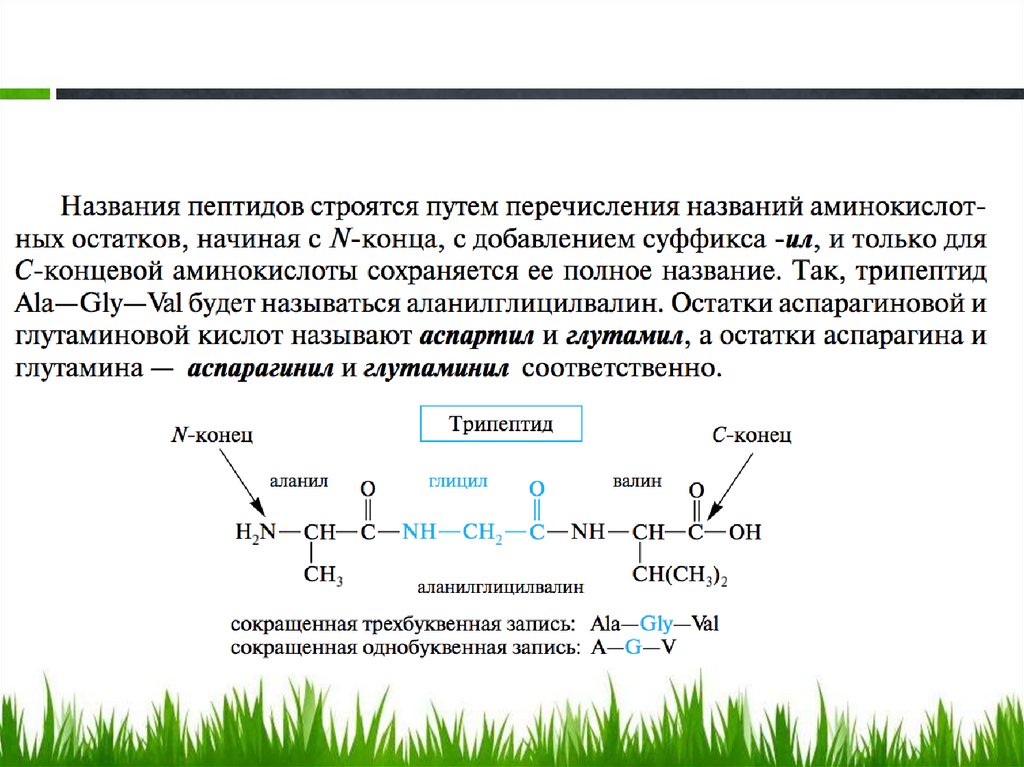
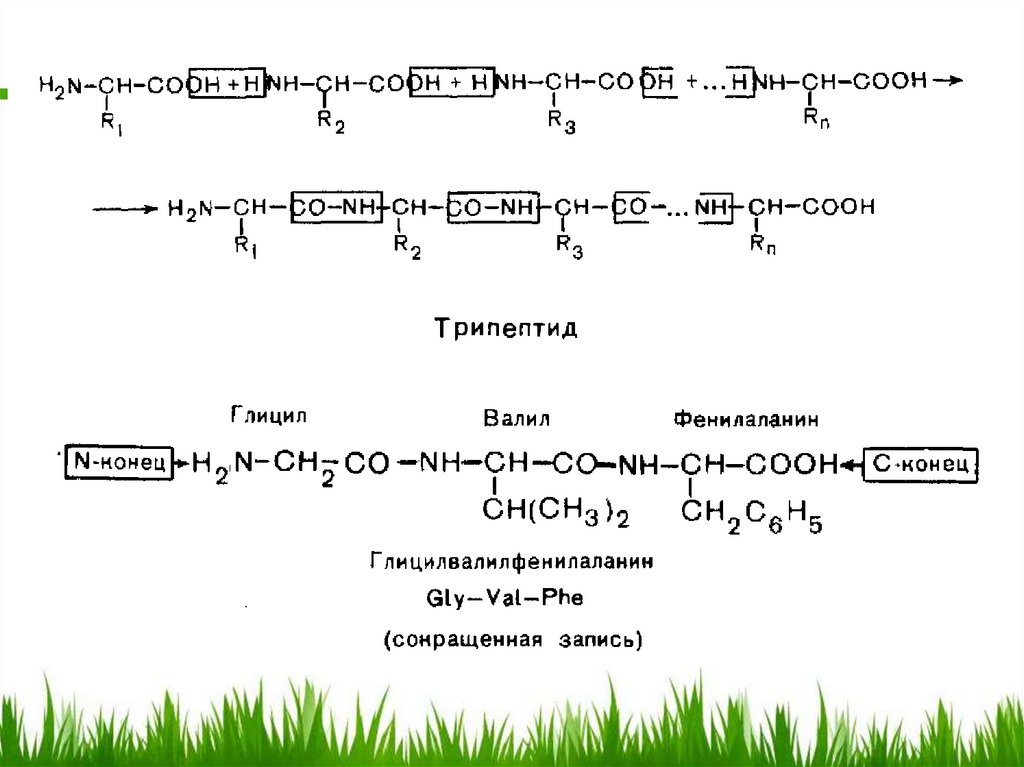
Пептиды. Номенклатура.Согласно принципам рациональной
номенклатуры, пептиды рассматривают
формально как ациламинокислоты, причем
аминокислоте, карбоксил которой участвует
в пептидной связи, придается окончаниеил. Поэтому только С-конечная
аминокислота сохраняет свое
первоначальное тривиальное название.
33.
34.
35.
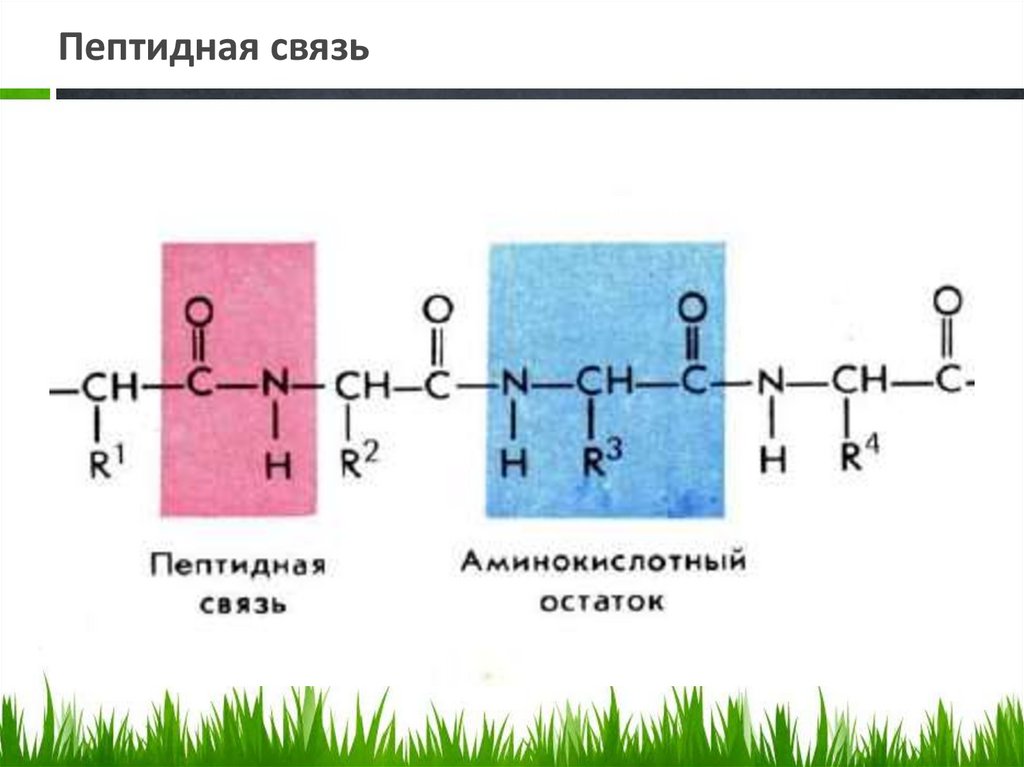
Пептидная связь36.
ФИЗИКОХИМИЧЕСКИЕСВОЙСТВА
АМИНОКИСЛОТ
37.
ФИЗИЧЕСКИЕ СВОЙСТВААМИНОКИСЛОТ
Алифатические аминокислоты –
бесцветные высокоплавкие
кристаллические вещества, имеющие
строение внутренних солей. Почти все
аминокислоты, представленные в
таблице, плавятся с разложением в
диапазоне от 220 0С (серин, пролин) до
340 0С и выше (валин, тирозин).
Растворимость алифатических
аминокислот в воде варьирует в широких
пределах и определяется природой
радикала R и главным образом наличием
в молекуле гидрофильных или
гидрофобных группировок.
38.
ГИДРОФИЛЬНЫЕ(РАСТВОРИМЫЕ)
В
ВОДЕ
Содержат следующие группы
1
• Амино-
2
• Гидрокси-
3
• Меркапто-
39.
ГИДРОФОБНЫЕ(НЕРАСТВОРИМЫЕ)
В
ВОДЕ
Содержат следующие группы
1
• Неполярные
углеводородные
фрагменты
Растворимость аминокислот в спирте на много ниже, чем в воде, в
эфире, хлороформе и других органических растворителях они
практически не растворяются. Ароматические аминокислоты,
существующие в основном в неионизированной форме, напротив,
мало растворимы в воде. Они значительно лучше растворимы в
спирте и эфире.
40.
41.
СТЕРЕОХИМИЯАМИНОКИСЛОТ
42.
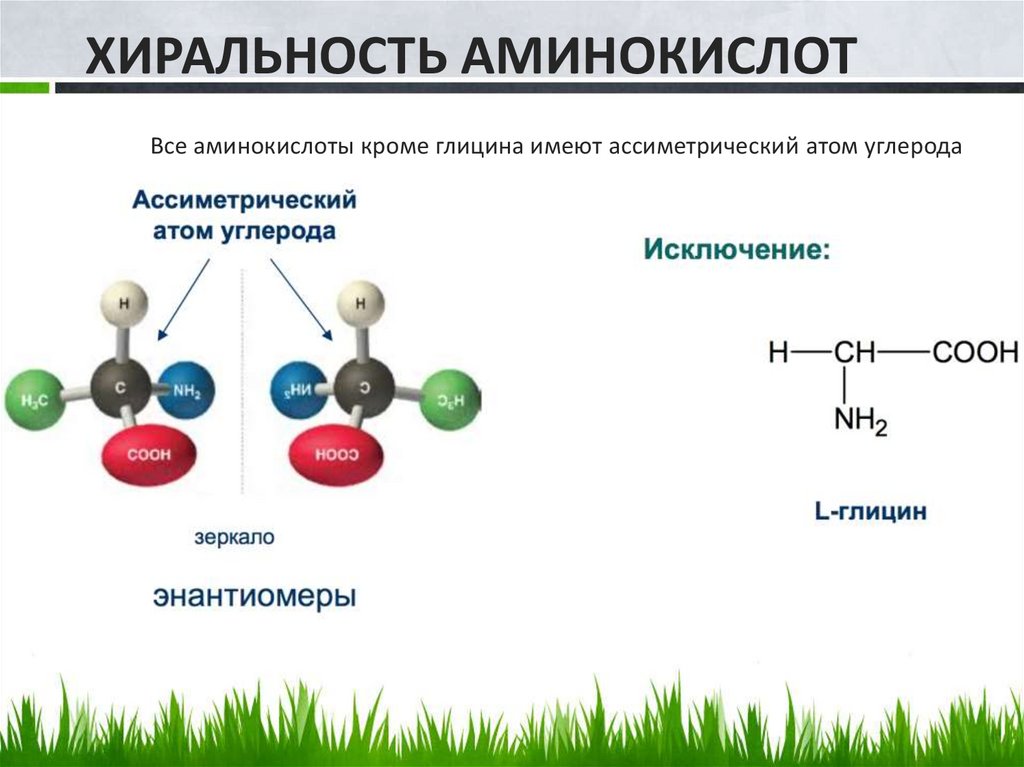
ХИРАЛЬНОСТЬ АМИНОКИСЛОТВсе аминокислоты кроме глицина имеют ассиметрический атом углерода
43.
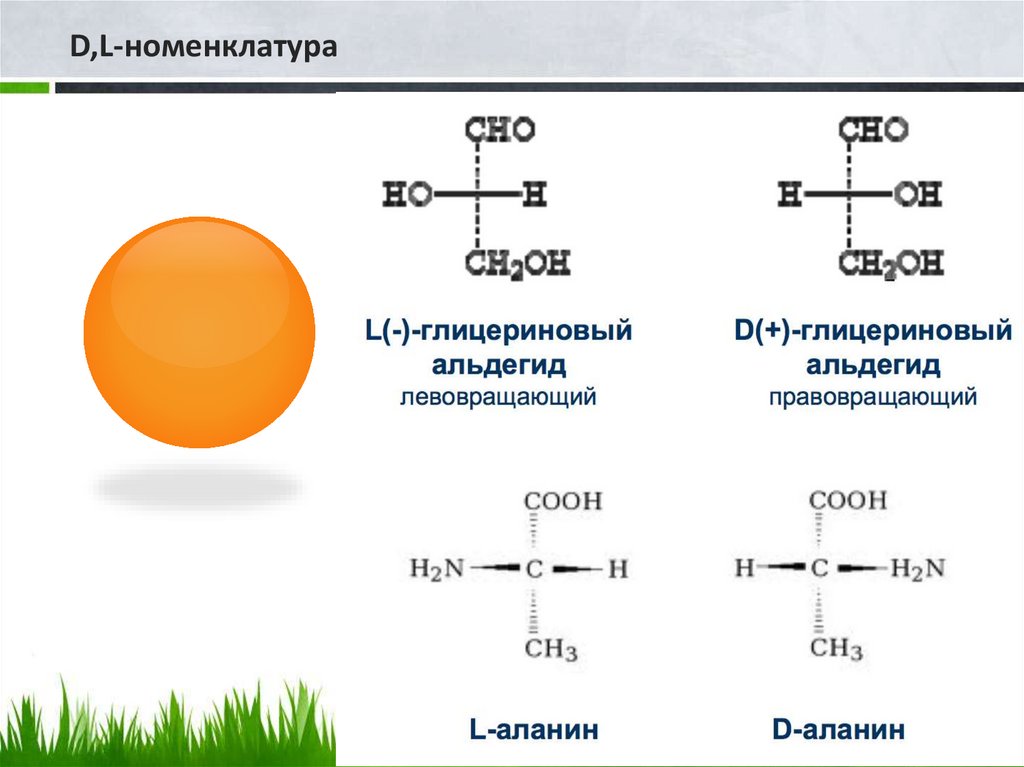
Относительная конфигурация α-аминокислотопределяется, как и у гидроксикислот, по
конфигурационному стандарту - глицериновому
альдегиду - с использованием «гидроксикислотного»
ключа. Расположение в (правильно построенной!)
проекционной формуле Фишера аминогруппы слева
(как ОН-группы в L-глицериновом альдегиде)
соответствует L-конфигурации, справа — Dконфигурации хирального атома углерода. По R, Sсистеме обозначений α -углеродный атом у всех α аминокислот L-ряда имеет S-, а у D-ряда— Rконфигурацию (исключение составляет цистеин).
В основе R, S- номенклатуры лежит принцип
старшинства заместителей, окружающих центр
хиральности или как его называют, правилом
последовательности.
44.
R-, S- номенклатураПосле ранжирования лигандов (чем выше
порядковый номер в ТМ, тем старше) самый
младший заместитель располагают от глаза
наблюдателя. Если старшинство трех оставшихся
заместителей снижается по часовой стрелке, это Rконфигурация. Если против –S конфигурация.
45.
D,L-номенклатура46.
Большинство α -аминокислот содержит одинасимметрический атом углерода и существует в виде двух
оптически активных энантиомеров и одного оптически
неактивного рацемата. Почти все природные α аминокислоты принадлежат к L-ряду
47.
Использование для построения белков человеческогоорганизма только одного вида стереоизомеров α –
аминокислот, а именно L-энантиомеров, имеет
важнейшее значение для формирования
пространственной структуры белков. С этим
непосредственно связана стереоспецифичность действия
ферментов. Макромолекулы ферментов, построенные из
α -аминокислот, т. е. хирального материала, в целом
являются хиральными и поэтому вступают во
взаимодействие только с теми субстратами, которые
также имеют определенную конфигурацию.
α -Аминокислоты D-ряда называют иногда
«неприродными», так как они не используются для
построения белков человеческого организма. D- α аминокислоты встречаются во многих природных
пептидах, продуцируемых микроорганизмами, например
в антибиотиках (грамицидин, актиномицин, полимиксин),
а также в составе биополимеров клеточной стенки
бактерий.
48.
Аминокислоты, принадлежащие к разнымстереохимическим рядам, имеют разный вкус
49.
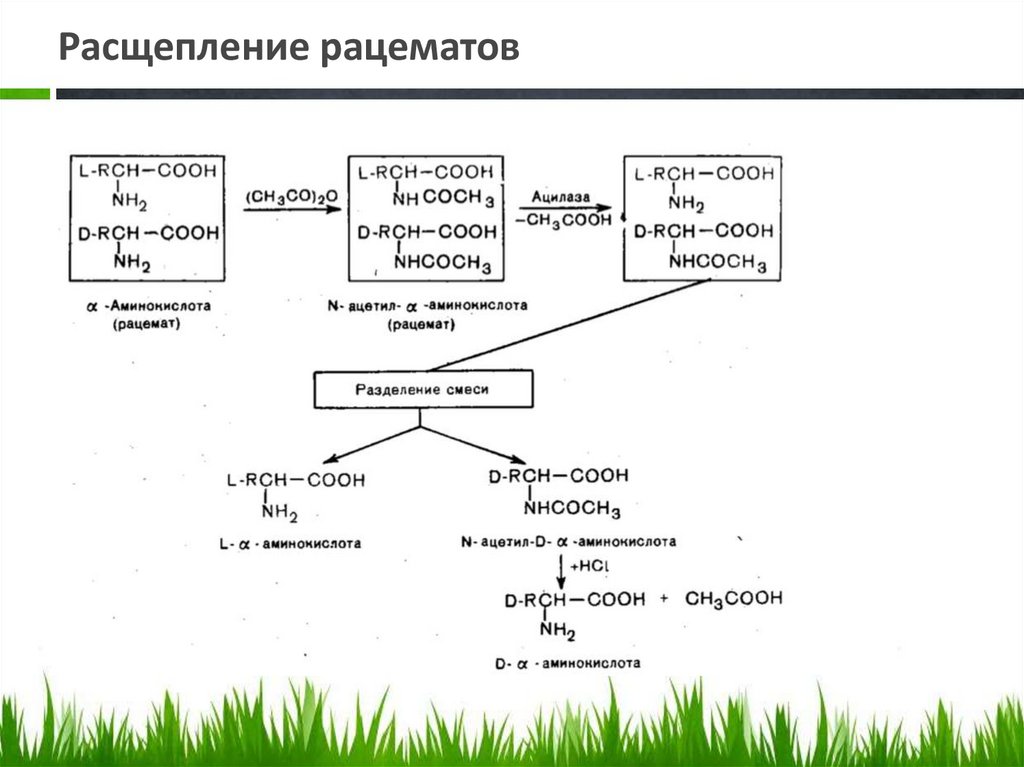
Расщепление рацематов• Источником α -аминокислот L-ряда служат белки,
которые подвергают для этого гидролитическому
расщеплению. Синтетическим путем, например
аммонолизом α -галогенкарбоновых кислот,
получаются только рацемические α -аминокислоты.
В связи с большой потребностью в отдельных
энантиомерах (для синтеза белков, лекарственных
веществ и т.п.), разработаны химические методы
расщепления синтетических рацемических α аминокислот. Однако более предпочтительным
является ферментативный способ расщепления с
использованием ферментов ацилаз, способных
гидролизовать N-ацетил-L- α -аминокислоты.
50.
Расщепление рацематов• Смесь энантиомеров ацетилируют уксусным
ангидридом и получают смесь Nацетилпроизводных α -аминокислоты, которую
обрабатывают ферментом, выделенным из
животного сырья (например, почек свиньи). При
этом гидролизуются производные аминокислоты
только L-ряда. Свободная аминокислота отличается
от ацетилированной растворимостью: кислота
растворяется как в кислотах, так и, щелочах, а Nацетил- α -аминокислота — только в щелочах.
После отделения L- α -аминокислоты можно
провести кислотный гидролиз и получить
свободную D- α -аминокислоту.
51.
Расщепление рацематов52.
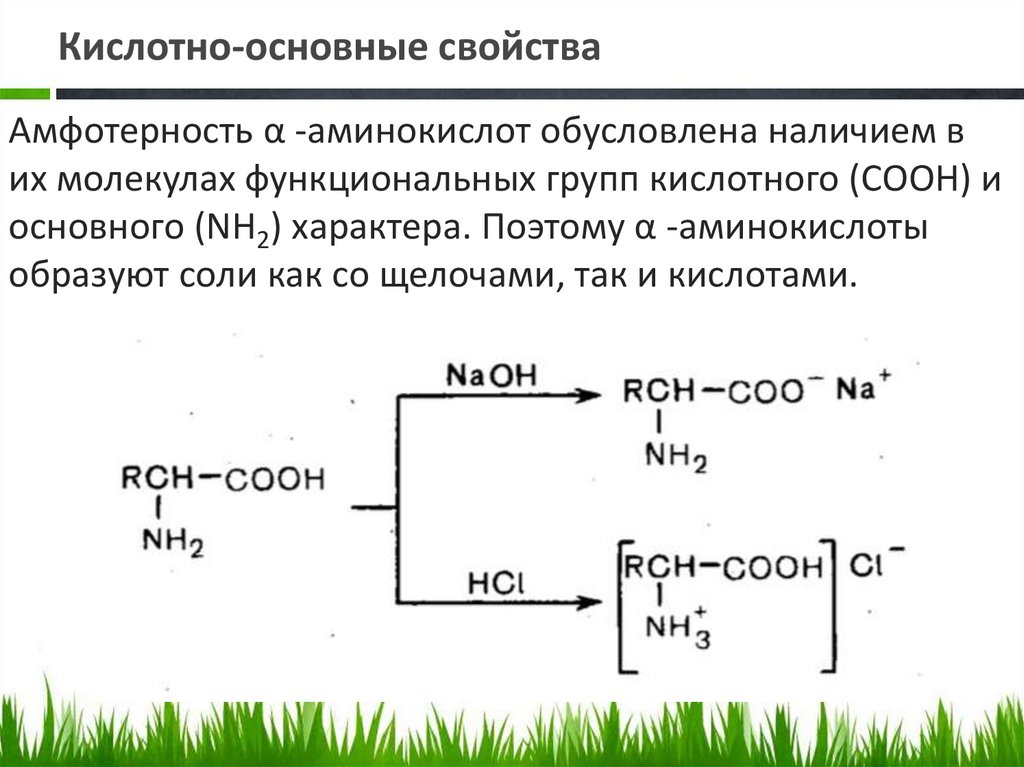
Кислотно-основные свойстваАмфотерность α -аминокислот обусловлена наличием в
их молекулах функциональных групп кислотного (СООН) и
основного (NН2) характера. Поэтому α -аминокислоты
образуют соли как со щелочами, так и кислотами.
53.
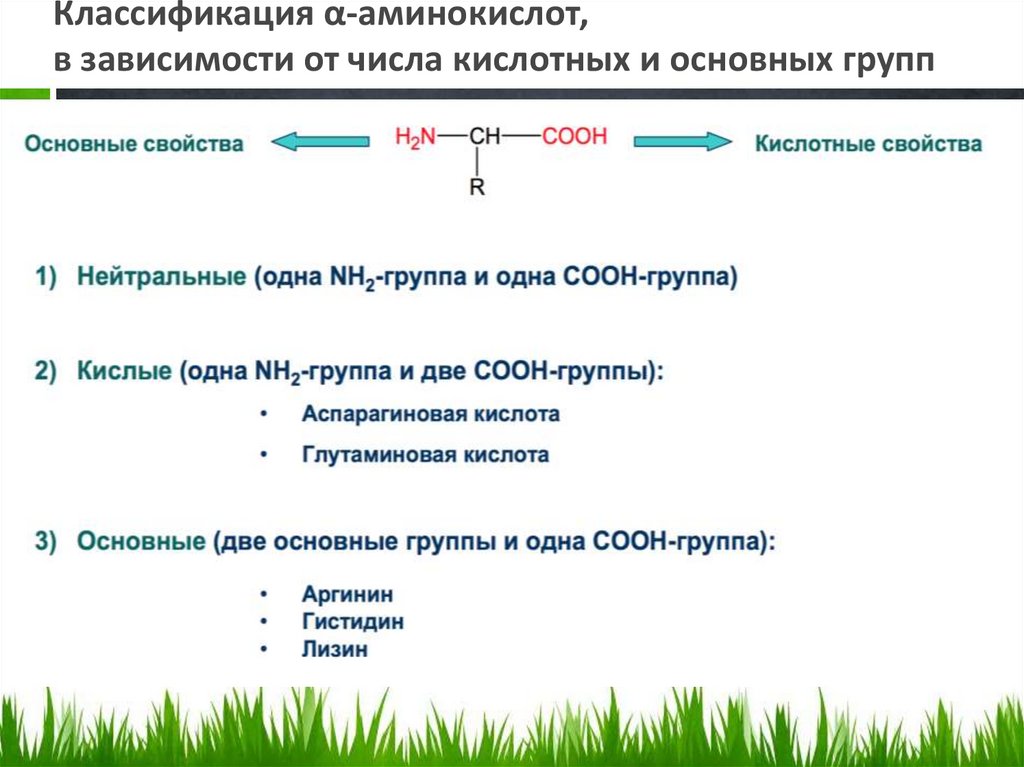
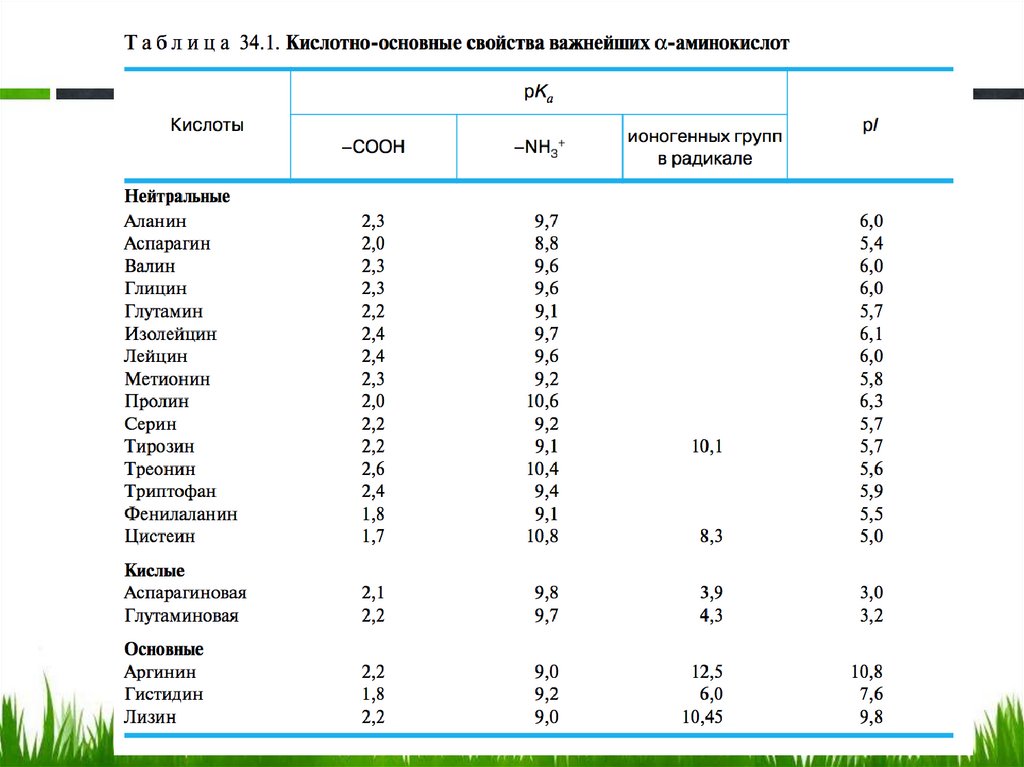
Классификация α-аминокислот,в зависимости от числа кислотных и основных групп
54.
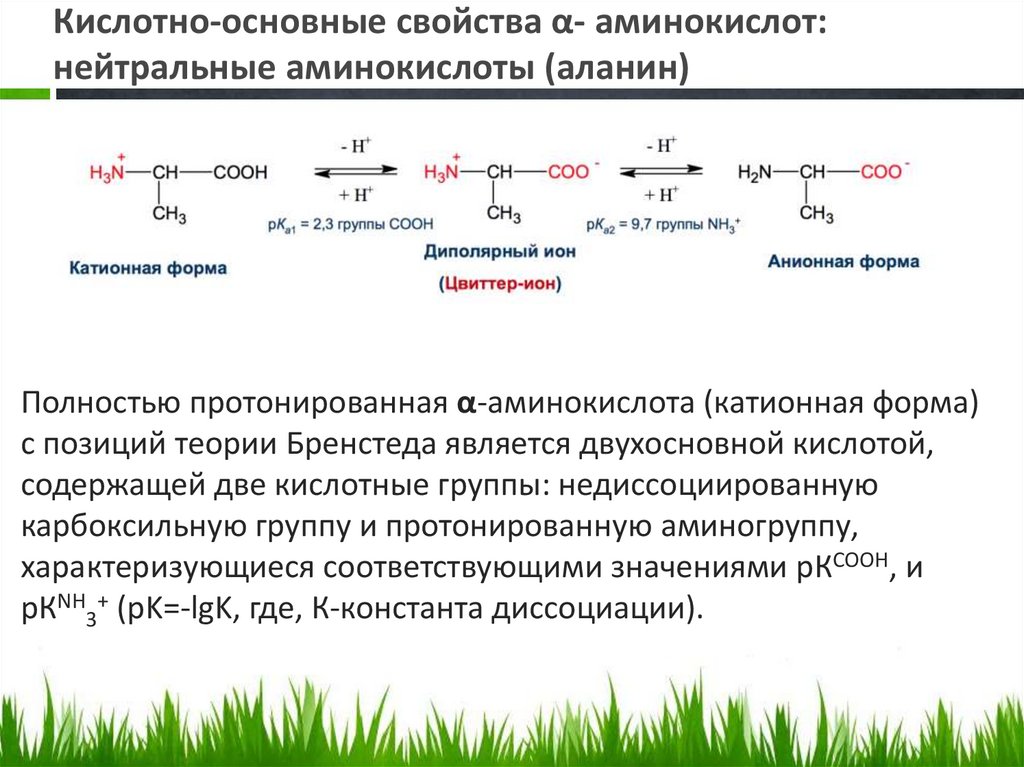
Кислотно-основные свойства α- аминокислот:нейтральные аминокислоты (аланин)
Полностью протонированная α-аминокислота (катионная форма)
с позиций теории Бренстеда является двухосновной кислотой,
содержащей две кислотные группы: недиссоциированную
карбоксильную группу и протонированную аминогруппу,
характеризующиеся соответствующими значениями рКCOOH, и
рКNH3+ (pK=-lgK, где, К-константа диссоциации).
55.
• Отдавая один протон, такая двухосновнаякислота превращается в слабую одноосновную
кислоту — диполярный ион с одной кислотной
NH3+-группой. Депротонирование диполярного
иона приводит к получению анионной формы
α-аминокислоты — ацилат-иону, являющемуся
основанием Бренстеда. Значения рКа
характеризующие кислотные свойства
карбоксильной группы α-аминокислот, обычно
лежат в интервале от 1 до 3.
56.
• Значение рК2, характеризующие кислотностьаммониевой группы, — от 9 до 10 (табл.).
• Положение равновесия т. е. соотношение различных
форм α-аминокислоты, в водном растворе при
определенных значениях рН существенно зависит от
строения радикала, главным образом наличия в нем
ионогенных групп, играющих роль дополнительных
кислотных и основных центров.
• Значение рН, при котором концентрация диполярных
ионов максимальна, а минимальные концентрации
катионных и анионных форм α-аминокислоты равны,
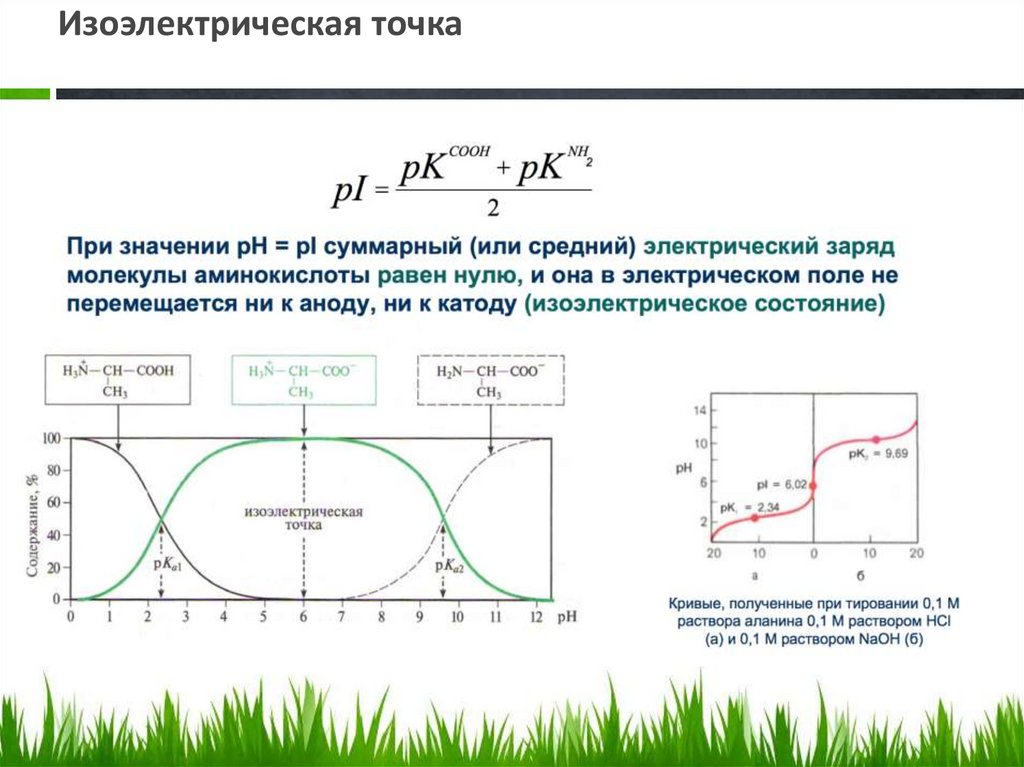
называется изоэлектрической точкой (рI).
57.
Изоэлектрическая точка58.
• В изоэлектрической точке суммарный зарядмолекулы аминокислоты равен 0. И тогда
диполярные ионы не перемещаются в
электрическом поле.
59.
60.
• Если рН буферного раствора (среды) > рКаили pI, молекула становится отрицательно
заряженной/ анионом (ацилат –ион) и
перемещается к аноду.
• Если рН буферного раствора (среды) < рКа
или pI, молекула становится положительно
заряженной/катионом (аммониевая
форма) и перемещается к катоду.
61.
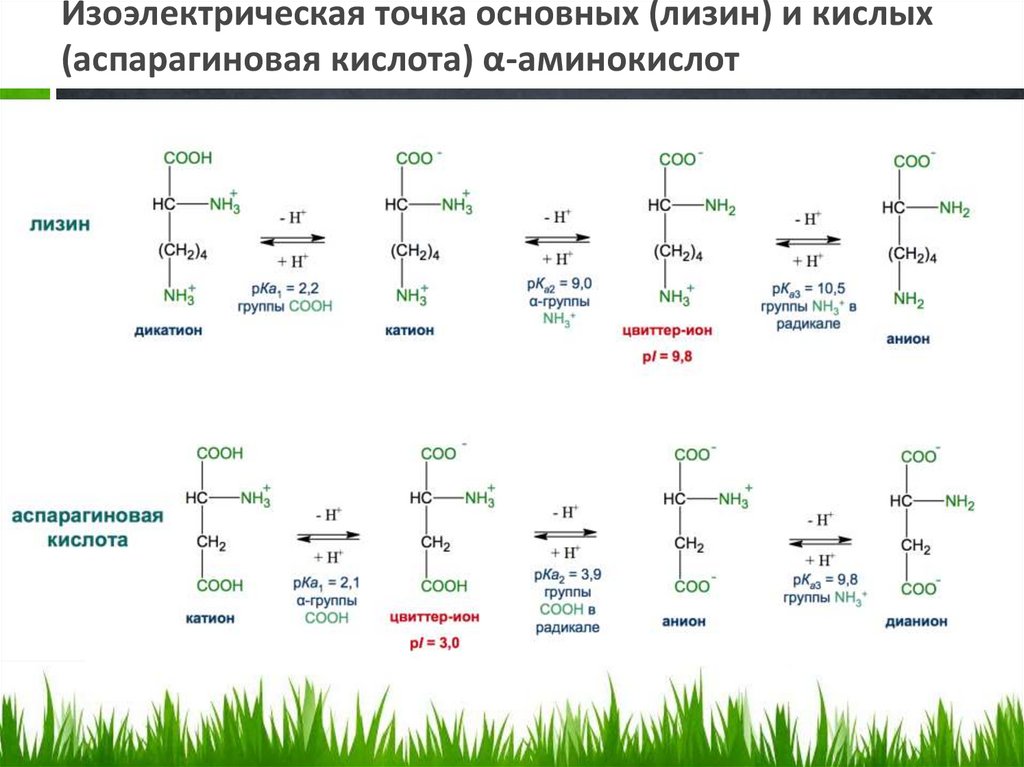
Изоэлектрическая точка основных (лизин) и кислых(аспарагиновая кислота) α-аминокислот
62.
• В организме при физиологическихзначениях рН (например, рН крови 7,3—7,5,
см. табл. 4.4) эти кислые кислоты находятся
в анионной форме, так как у них
ионизированы обе карбоксильные группы.
• В организме основные а-аминокислоты
находятся в виде катионов, т. е. у них
протонированы обе аминогруппы.
63.
• В целом ни одна а-аминокислота in vivo ненаходится в своей изоэлектрической точке
и не попадает в состояние, отвечающее
наименьшей растворимости в воде. Таким
образом, а-аминокислоты в организме
находятся в ионной форме.
64.
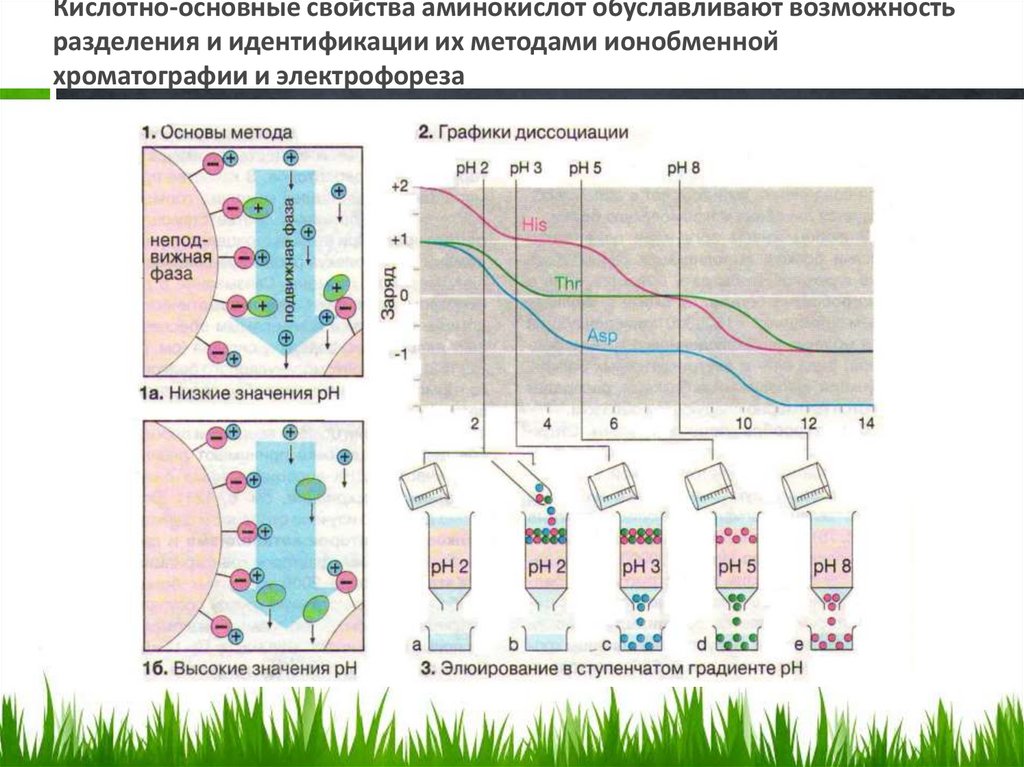
• Видео электрофорез• Кислотно-основные свойства ааминокислот обусловливают их разделение
и идентификацию методом ионообменной
хроматографии
65.
Кислотно-основные свойства аминокислот обуславливают возможностьразделения и идентификации их методами ионобменной
хроматографии и электрофореза
66.
Разделение смесей аминокислот ионообменнойхроматографией.
• При разделении аминокислот методом
ионообменной хроматографии в качестве
неподвижной фазы используются гранулы
синтетического полимера, несущие
сульфогруппы (-SО3-). Эти группы
ионизированы во всем диапазоне рН и несут
отрицательный заряд. Для подготовки к
работе ионообменник помещают в колонку и
промывают Na+-содержащим буферным
раствором с рН 2. При этом сульфогруппа
связывает ионы натрия.
67.
• Если теперь нанести на колонку раствораминокислот, то положительно заряженные аминокислоты вытеснят ионы натрия и
будут сорбированы на ионите. Поскольку
аминокислоты не несут заряда в
изоэлектрической точке, их элюируют с
колонки буфером с более высоким
значением рН.
68.
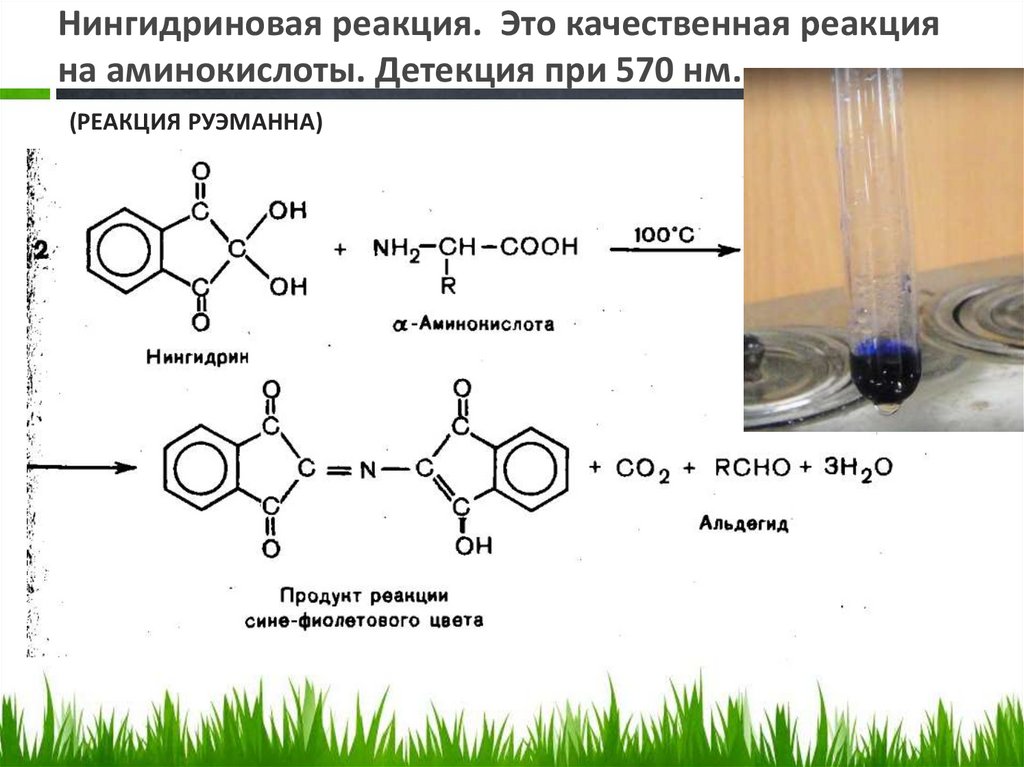
Нингидриновая реакция (реакция Руэманна, 1910)• Используется для визуального
обнаружения a-аминокислот на
хроматограммах (на бумаге, в тонком слое),
а также для колориметрического
определения концентрации аминокислот
по интенсивности окраски продукта
реакции.
69.
Нингидриновая реакция. Это качественная реакцияна аминокислоты. Детекция при 570 нм.
(РЕАКЦИЯ РУЭМАННА)
70.
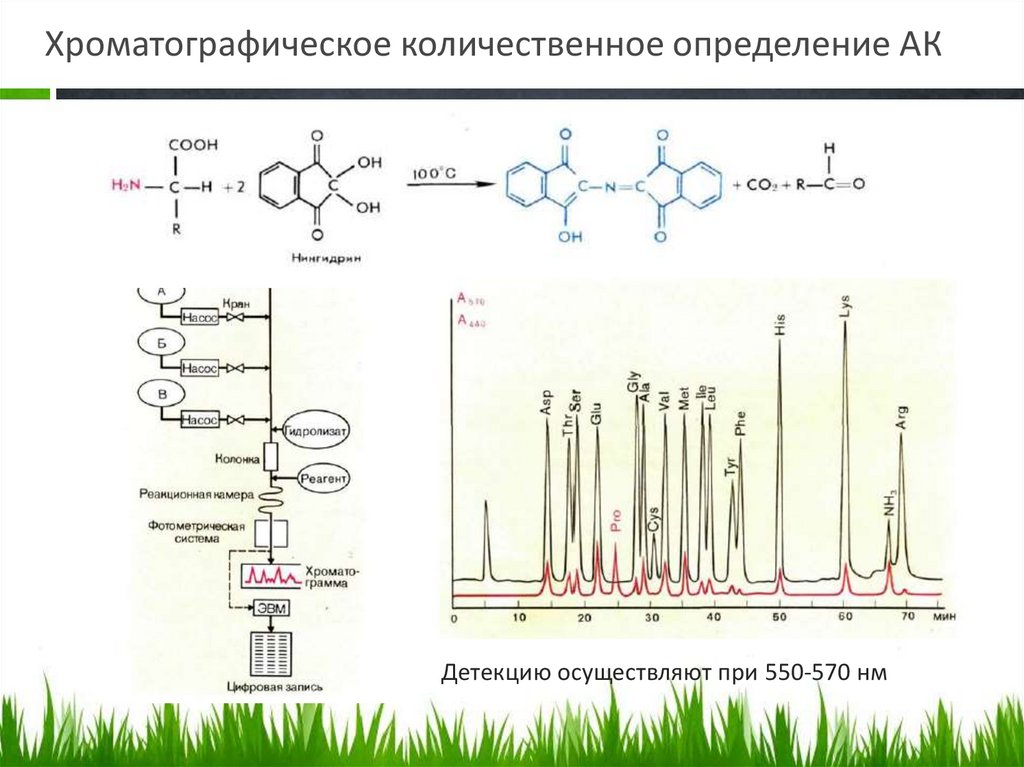
Хроматографическое количественное определение АКДетекцию осуществляют при 550-570 нм
71.
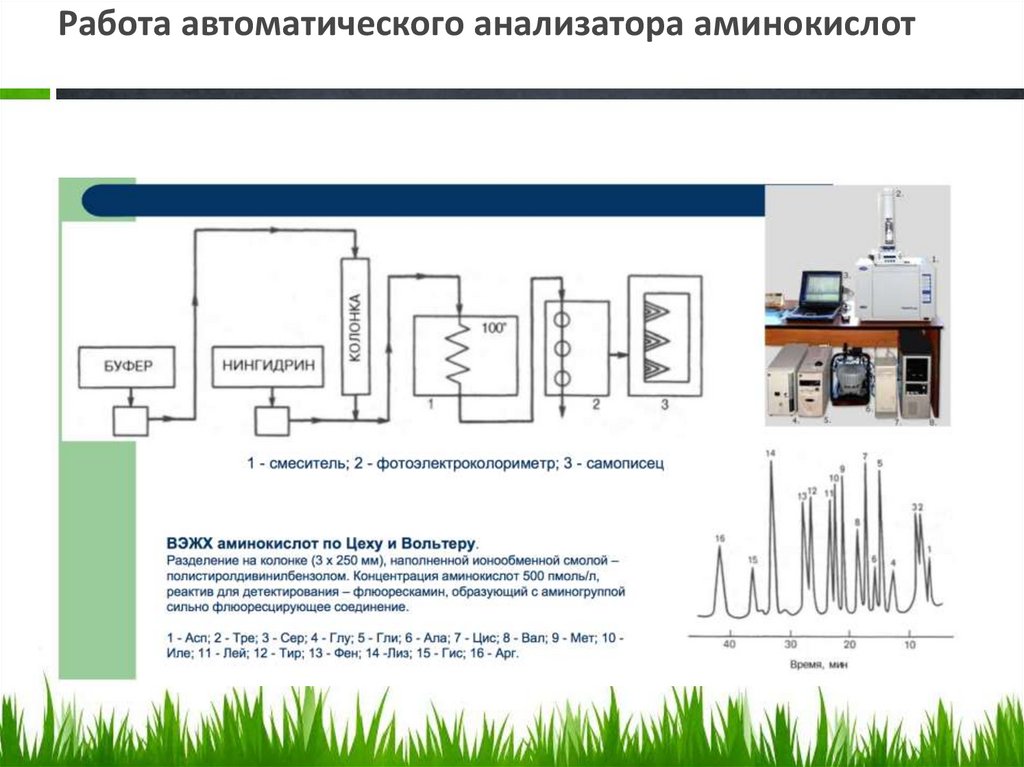
Работа автоматического анализатора аминокислот72.
Качественные реакции α-аминокислот. Их функции.• Для аминокислот, постоянно встречающихся в
составе белков, разработано множество цветных (в
том числе именных) реакций. Многие из них
высокоспецифичны, что позволяет определять
ничтожные количества той или иной аминокислоты
•
Надо помнить, что все качественные
реакции – это реакции не собственно на белки, а на
определенные аминокислоты, входящие в их состав
•
Качественные реакции служат как для
определения принадлежности вещества к классу
белков, так и для идентификации входящих в его
состав аминокислот
73.
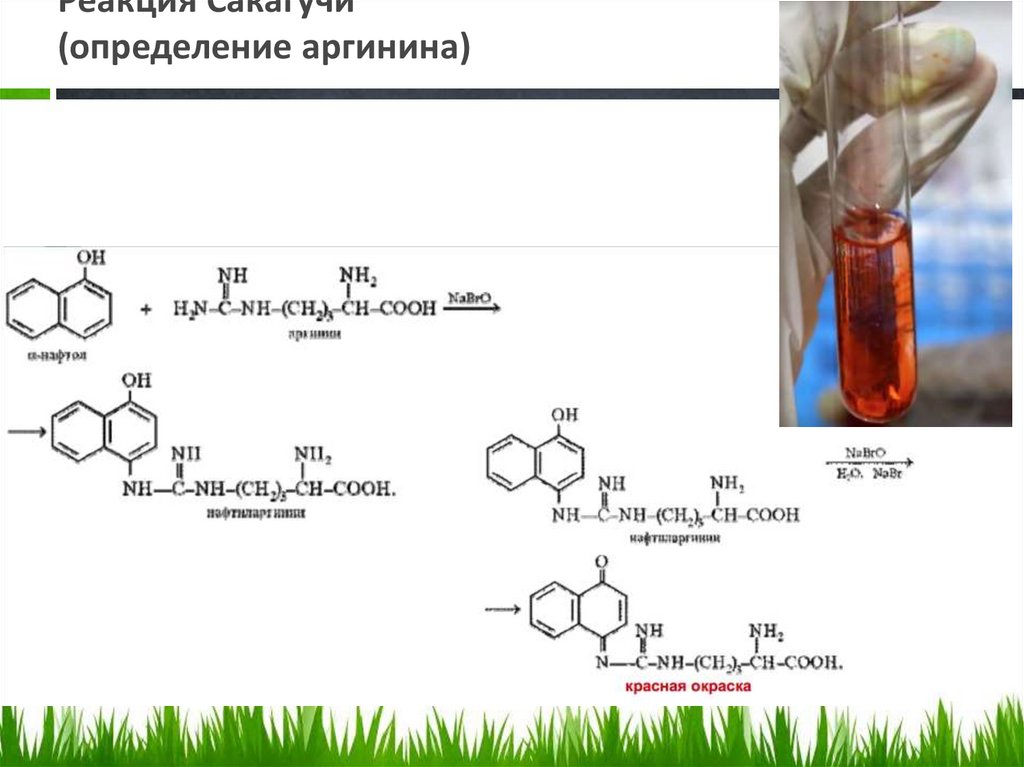
Реакция Сакагучи(определение аргинина)
74.
Реакция Фоля (определение цистеина и цистина)75.
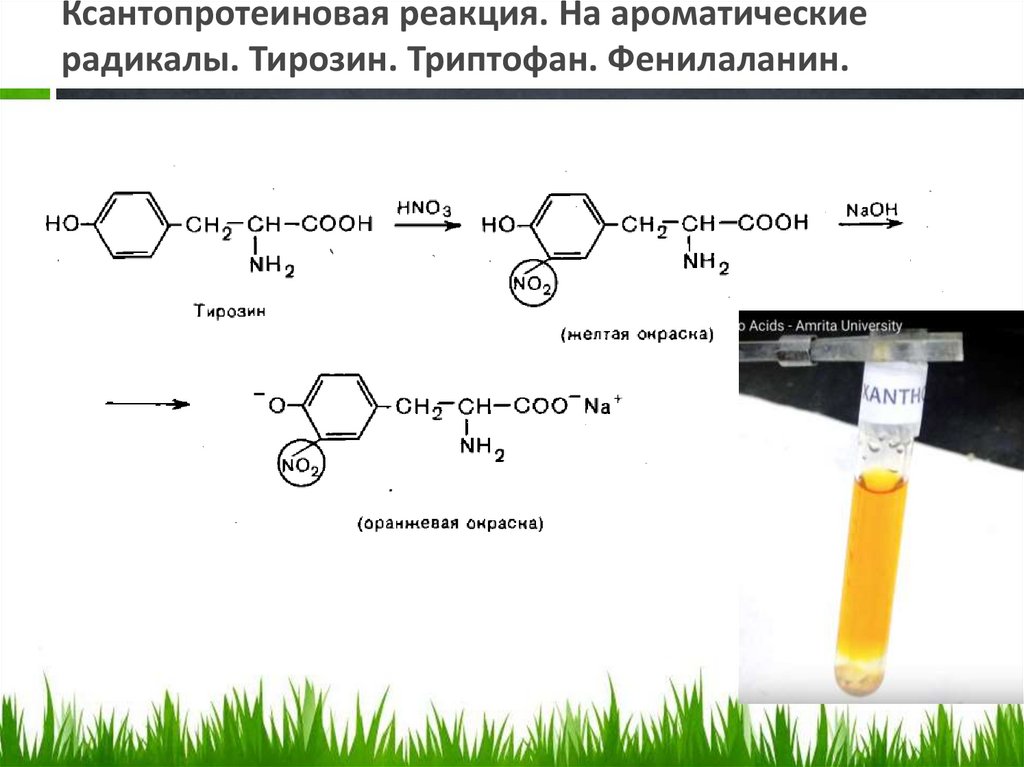
Ксантопротеиновая реакция. На ароматическиерадикалы. Тирозин. Триптофан. Фенилаланин.
76.
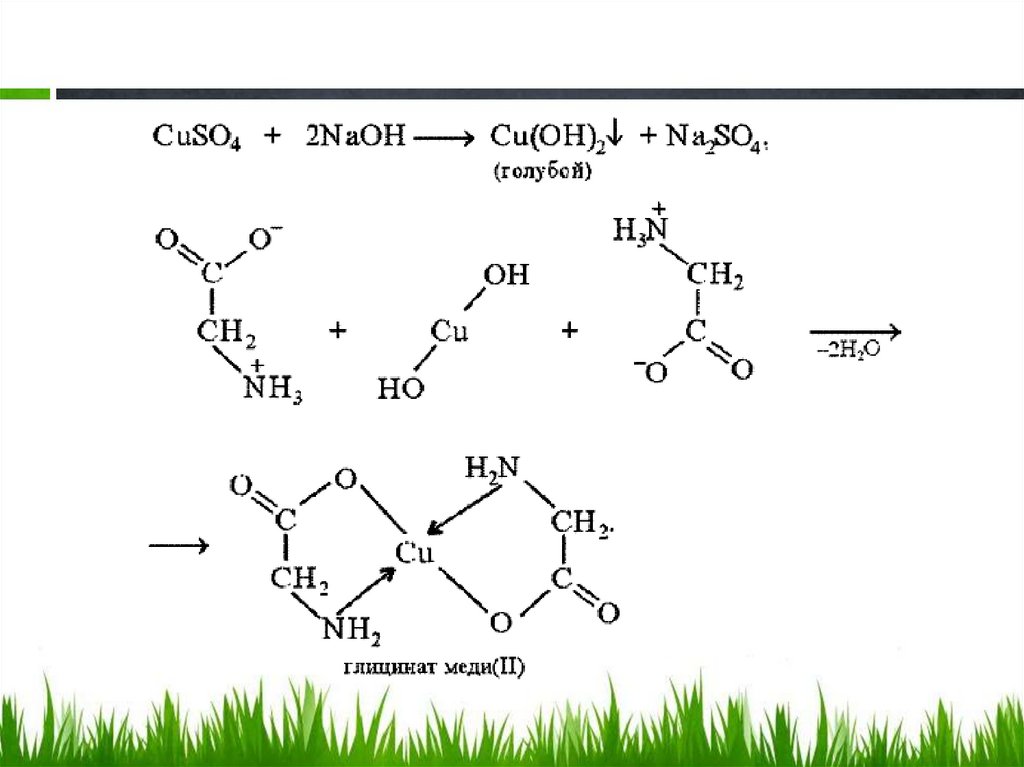
Биуретовая реакция.Биуретовая реакция – качественная на все без исключения белки, а также продукты их
неполного гидролиза, которые содержат не менее двух пептидных связей.
Принцип метода. Биуретовая реакция обусловлена присутствием в белках пептидных
связей (- СО – NH -), которые в щелочной среде образуют с сульфатом меди (ІІ)
окрашенные в красно-фиолетовый цвет медные солеобразные комплексы. Биуретовую
реакцию дают также некоторые небелковые вещества, например биурет (NH2-CO-NHCO-NH2), оксамид (NH2CO-CO-NH2), ряд аминокислот (гистидин, серин, треонин,
аспарагин).
77.
78.
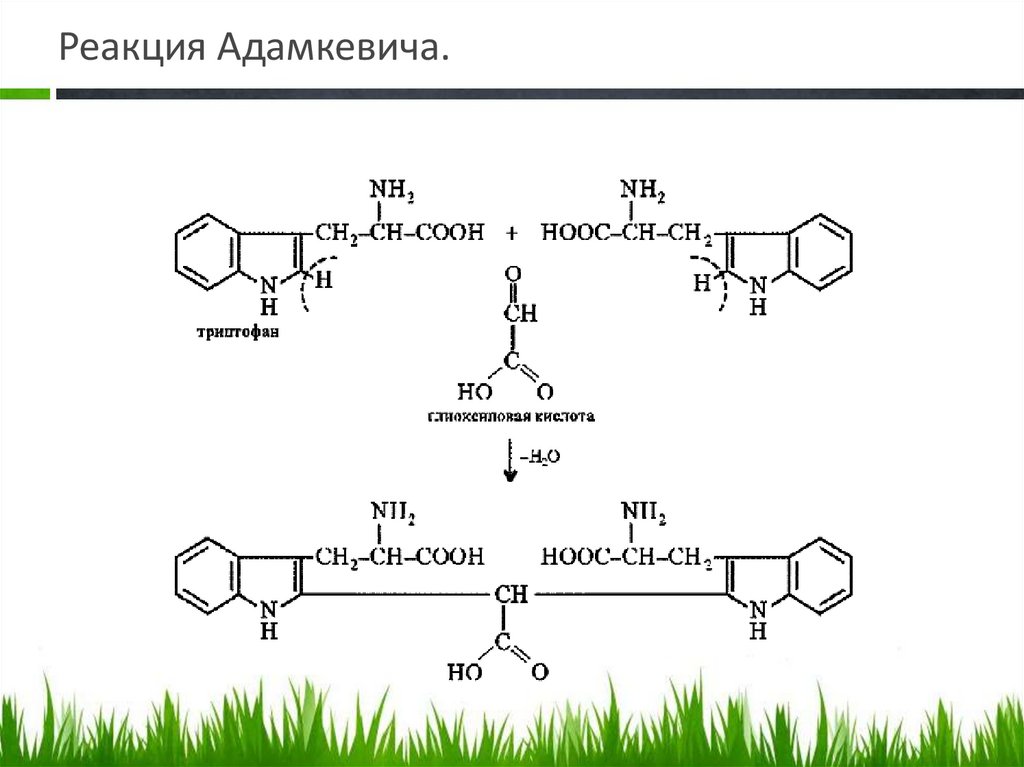
Реакция Адамкевича.Принцип метода. Белки, содержащие триптофан, в присутствии глиоксиловой и
серной кислот дают красно-фиолетовое окрашивание. Реакция основана на
способности триптофана взаимодействовать в кислой среде с альдегидами
глиоксиловой кислоты (являющейся примесью к концентрированной уксусной
кислоте) с образованием окрашенных продуктов конденсации. Реакция
протекает по уравнению:













































 Химия
Химия