Похожие презентации:
Аминокислоты, пептиды, белки
1.
Запорожский государственный медицинский университетКафедра органической и биоорганической химии
2.
Аминокислоты - это органические соединения, содержащиев составе молекулы основную аминогруппу NH2— и кислую
карбоксильную группу —СООН. Различают а-аминокислоты, у
которых амино- и карбоксильная группы соединены с одним и
тем же атомом углерода, и бета-, гамма-аминокислоты,
функциональные группы которых разделены несколькими
атомами углерода:
3.
В природе встречаются главным образом а-аминокислоты. αаминокислоты являются составными частями белков и участвуют вважнейших биологических процессах. Все многообразие пептидов и
белков связано с α-аминокислотами. α-аминокислоты являются
мономерами белков и относятся к бифункциональным или
гетерофункциональным соединениям.
общая формула α- аминокислот
Они обязательно содержат карбоксильную
и аминогруппу,
находящиеся у одного и того же тома – α-углеродного атома. Первая αаминокислота – глицин - была выделена в 1820 году французским
исследователем Браконно, кислотным гидролизом различных тканей
(кожа, сухожилия, хрящи). В 1871 году Любавин показал роль αаминокислот, как структурных элементов белка.
4.
Номенклатура аминокислотНазвания аминокислот произошли в основном от исходных
материалов, из которых они были впервые выделены; например,
аспарагин (от лат. asparagus — спаржа) получен из сока спаржи,
цистеин и цистин (от греч. cystis — мочевой пузырь) — из камней
мочевого пузыря,
глутаминовая кислота (от нем. das Gluten — клейковина) — из
клейковины пшеницы,
серин (от греч. serös — шелковичный червь) — из шелка
тирозин(от греч. tyros — сыр) — из сыра.
α-аминокислоты – кристаллические вещества, растворимые в воде.
Основным источником α-аминокислот для животного организма служат
пищевые белки. Многие α-аминокислоты синтезируются самим
организмом и называются заменимые аминокислоты. Некоторые αаминокислоты синтезироваться в организме не могут и должны
поступать извне. Такие кислоты наз. незаменимые. К ним относятся:
валин, лейцин, изолейцин, лизин, треонин, метионин, фенилаланин,
триптофан.
5.
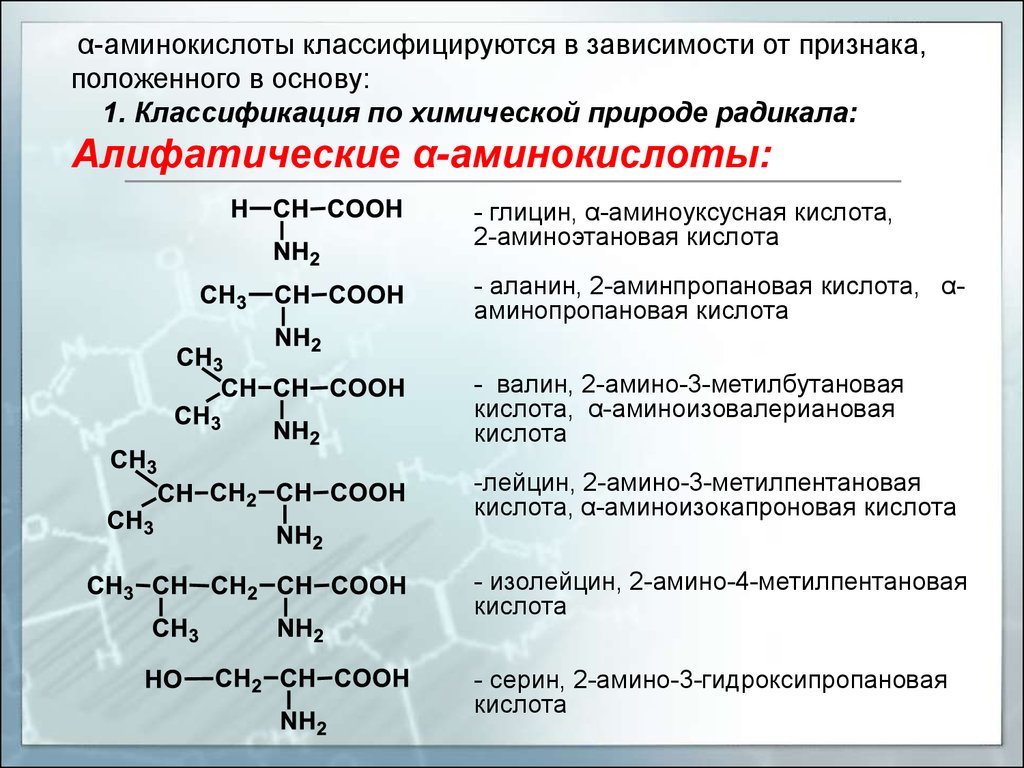
α-аминокислоты классифицируются в зависимости от признака,положенного в основу:
1. Классификация по химической природе радикала:
Алифатические α-аминокислоты:
- глицин, α-аминоуксусная кислота,
2-аминоэтановая кислота
- аланин, 2-аминпропановая кислота, αаминопропановая кислота
- валин, 2-амино-3-метилбутановая
кислота, α-аминоизовалериановая
кислота
-лейцин, 2-амино-3-метилпентановая
кислота, α-аминоизокапроновая кислота
- изолейцин, 2-амино-4-метилпентановая
кислота
- серин, 2-амино-3-гидроксипропановая
кислота
6.
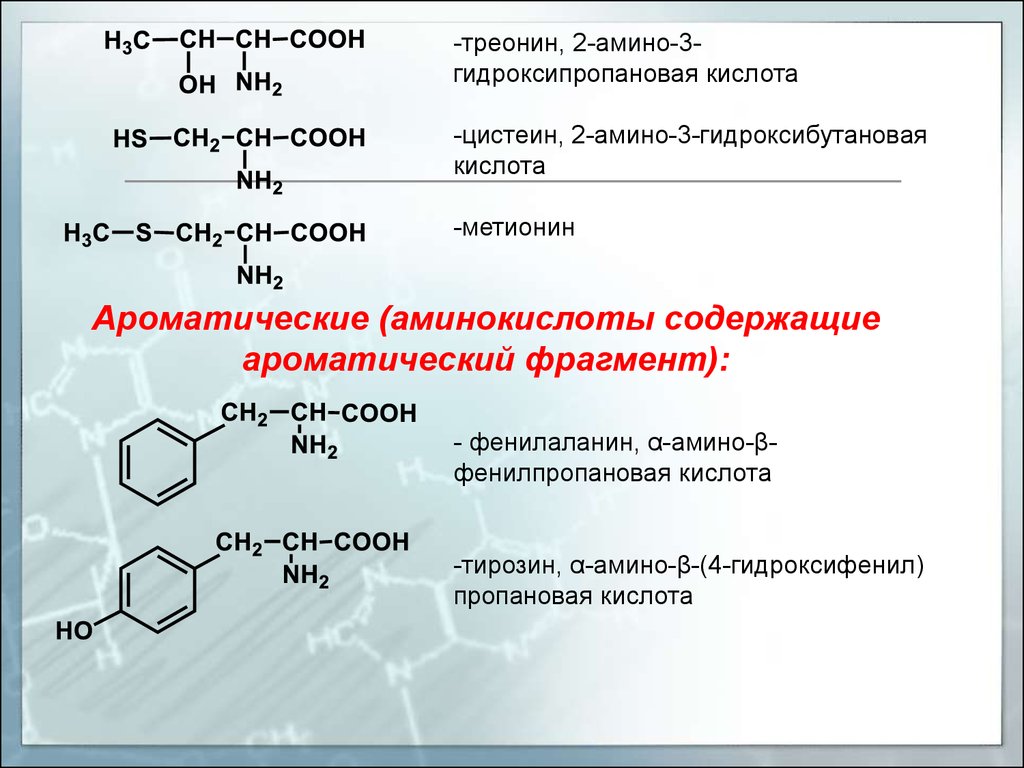
-треонин, 2-амино-3гидроксипропановая кислота-цистеин, 2-амино-3-гидроксибутановая
кислота
-метионин
Ароматические (аминокислоты содержащие
ароматический фрагмент):
- фенилаланин, α-амино-βфенилпропановая кислота
-тирозин, α-амино-β-(4-гидроксифенил)
пропановая кислота
7.
Гетероциклические α-аминокислоты:-триптофан, α-амино-β-индолилпропановая
кислота
-гистидин, 2-амино-β-(4(5-имидазолил)пропановая кислота
-пролин, пирролидин-α-карбоновая кислота
-оксипролин, β-оксипирролидин-α-карбоновая
кислота
8.
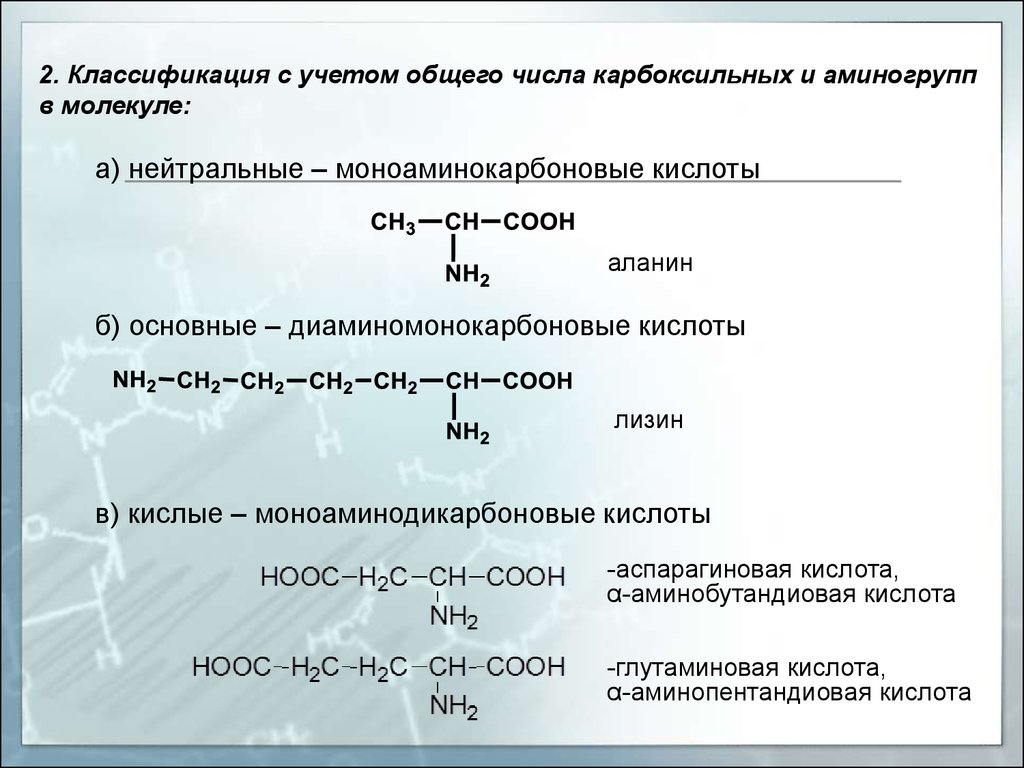
2. Классификация с учетом общего числа карбоксильных и аминогруппв молекуле:
а) нейтральные – моноаминокарбоновые кислоты
аланин
б) основные – диаминомонокарбоновые кислоты
лизин
в) кислые – моноаминодикарбоновые кислоты
-аспарагиновая кислота,
α-аминобутандиовая кислота
-глутаминовая кислота,
α-аминопентандиовая кислота
9.
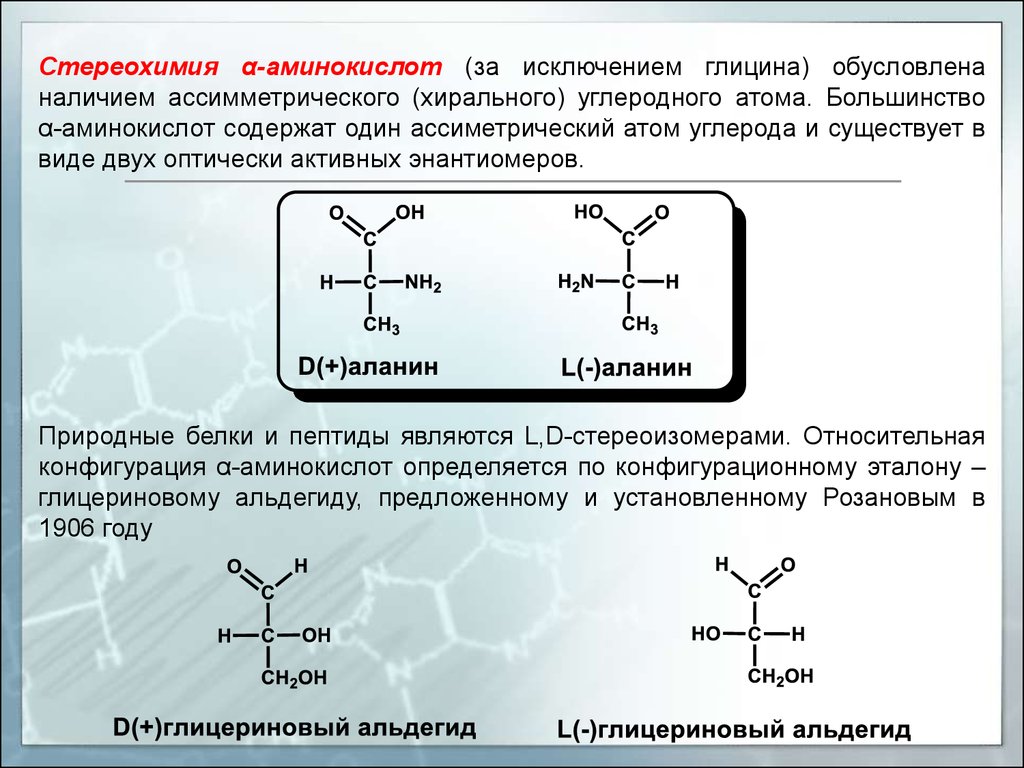
Стереохимия α-аминокислот (за исключением глицина) обусловленаналичием ассимметрического (хирального) углеродного атома. Большинство
α-аминокислот содержат один ассиметрический атом углерода и существует в
виде двух оптически активных энантиомеров.
Природные белки и пептиды являются L,D-стереоизомерами. Относительная
конфигурация α-аминокислот определяется по конфигурационному эталону –
глицериновому альдегиду, предложенному и установленному Розановым в
1906 году
10.
ПоR-,S-системе
α-аминокислоты
имеющие
L-конфигурацию
соответствуют S- изомерам, а D-конфигурация соответствует Rизомеру. Знак вращения не имеет прямой связи с конфигурацией. Два
соединения
могут
иметь
одинаковую
конфигурацию,
но
противоположные знаки вращения.
Знак вращения определяется экспериментально с помощью
поляриметра. Правое вращение обозначается знаком (+), левое –
знаком (-).
11.
Способы получения аминокислот:in vitro 1. Аммонолиз галогенкарбоновых кислот:
2. Циангидринный способ получения ( метод Штрекера):
12.
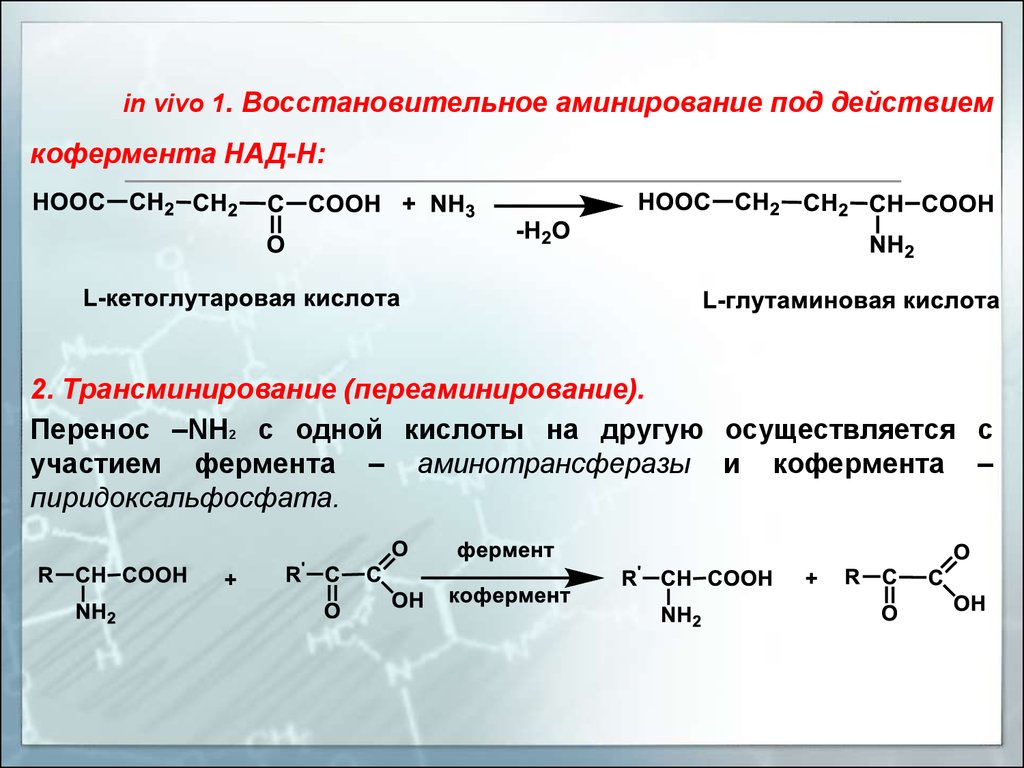
in vivo 1. Восстановительное аминирование под действиемкофермента НАД-Н:
2. Трансминирование (переаминирование).
Перенос –NH2 с одной кислоты на другую осуществляется с
участием фермента – аминотрансферазы и кофермента –
пиридоксальфосфата.
13.
Химические свойства аминокислот:Амфотерность аминокислот
Благодаря наличию у аминокислот гидрофильных свойств, они
легко растворимы в воде. В водных растворах α-аминокислоты
существуют в виде внутренней соли (биполярного иона)
Это равновесная система биполярного иона, катионной и
анионной форм молекулы и зависит от рН среды.
14.
В сильнокислых средах рН 1-2 преобладают α-аминокислоты вкатионной форме а в сильнощелочных - анионные.
Значение рН, при котором концентрация биполярных ионов
максимальна, а минимальная концентрация катионных и
анионных форм α-аминокислоты равны между собой –
называется изоэлектрической точкой (ИЭТ, рI).
При этом аминокислота имеет суммарный нулевой заряд.
15.
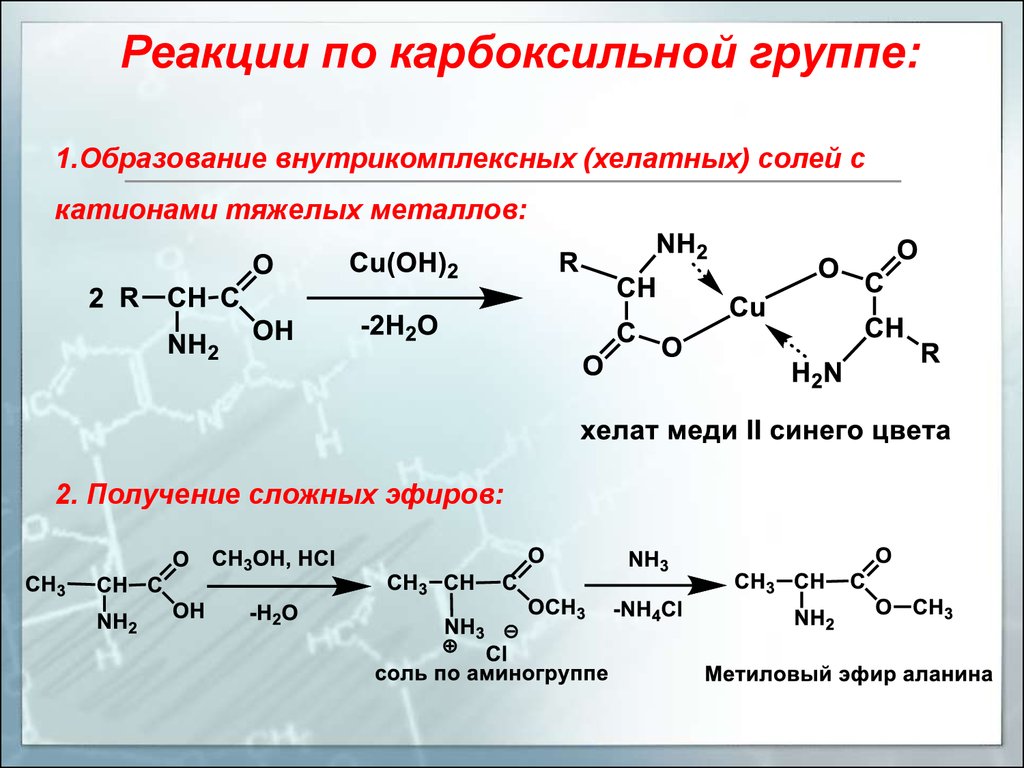
Реакции по карбоксильной группе:1.Образование внутрикомплексных (хелатных) солей с
катионами тяжелых металлов:
2. Получение сложных эфиров:
16.
3. Образование галогенангидридовПри
действии
на
аминокислоту,
с
защищенной
аминогруппой,
тионилхлоридом или оксихлоридом фосфора образуются хлорангидриды.
4. Декарбоксилирование in vitro протекает в присутствии поглотителей
диоксида углерода Ва(ОН)2 , in vivo протекает с участием фермента
декарбоксилазы с образованием биогенных аминов:
in vitro
in vivo
17.
Реакции аминогруппы:1. Образование N-ацетильных производных
В качестве ацилирующих веществ используются
ангидриды кислот.
хлорангидриды
или
2. Дезаминирование
in vitro может быть окислительное и неокислительное. Окислительное
дезаминирование протекает с участием ферментов оксидаз и кофермента
НАД+ с выделением NH3 образованием α-аминокислоты. Неокислительное
дезаминирование (бактерии, грибы) протекает с потерей NH2, без участия
кислорода. Выделение NH3 происходит под действием ферментов с
образованием непредельных кислот.
18.
in vivoin vitro реакция α-аминокислот с азотистой кислотой (метод Ван-Слайка)
позволяет
количественно
выделившегося азота
определить
аминокислоты
по
объёму
19.
3. Образование оснований ШиффаРеакция аминокислот с альдегидами и кетонами
Практическое значение имеет реакция с формальдегидом – формольное
титрование метод Серенсена – лежащий в основе количественного
определения α-аминокислот.
В образовавшемся устойчивом N-метилольном соединении, оттитровывают
свободную карбоксильную группу и количественно определяют αаминокислоту.
20.
4.Реакция с 2,4-динитрофторбензолом, лежащая в основе
идентификации α-аминокислот.
Производное окрашено в желтый
идентифицируют α-аминокислоты.
цвет,
с
помощью
хроматографии
5. Реакция с фенилизоцианатом (реакция Эдмана)
Реакция Эдмана используется для установления строения пептидов.
Циклическое
соединение
получают
с
количественным
выходом.
Фенилтиогидантоиновые (ФТГ)-производные α-аминокислот различаются
строением радикала и физико-химическими свойствами.
21.
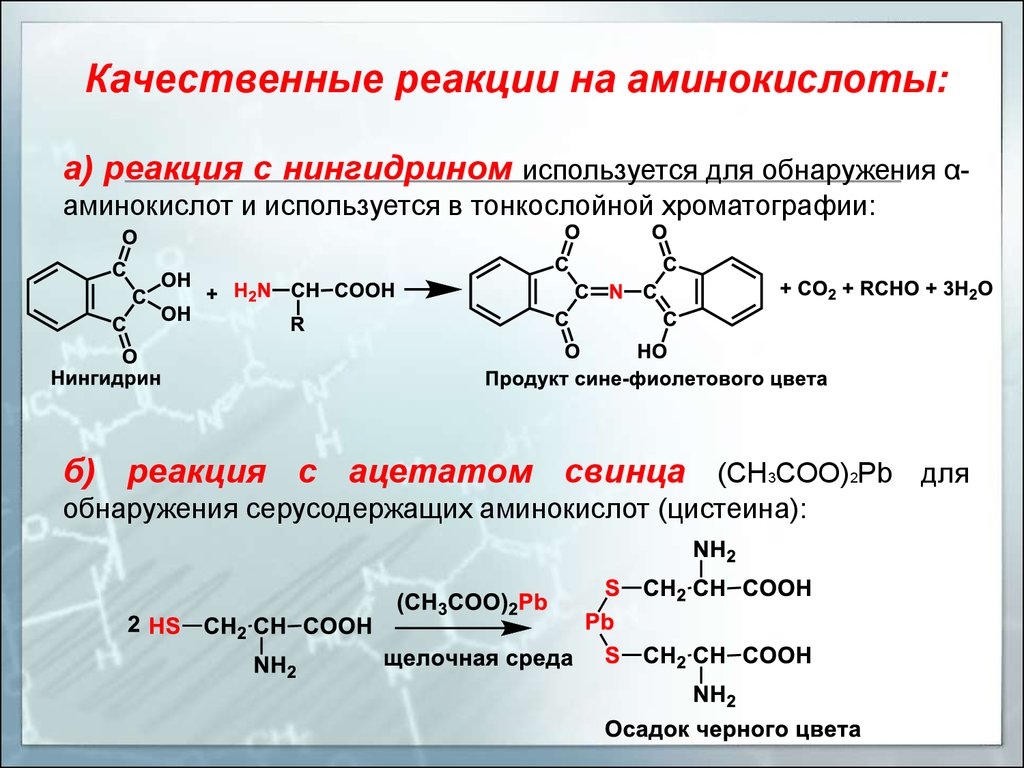
Качественные реакции на аминокислоты:а) реакция с нингидрином используется для обнаружения αаминокислот и используется в тонкослойной хроматографии:
б) реакция с ацетатом свинца (CH3COO)2Pb для
обнаружения серусодержащих аминокислот (цистеина):
22.
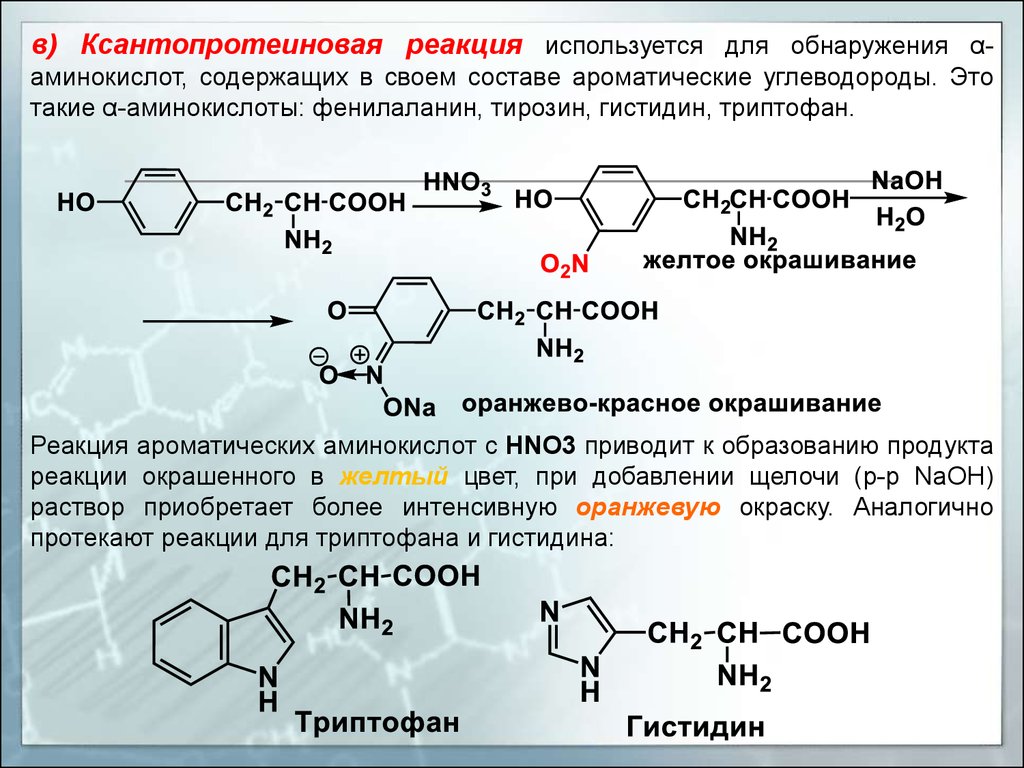
в) Ксантопротеиновая реакция используется для обнаружения αаминокислот, содержащих в своем составе ароматические углеводороды. Этотакие α-аминокислоты: фенилаланин, тирозин, гистидин, триптофан.
Реакция ароматических аминокислот с HNO3 приводит к образованию продукта
реакции окрашенного в желтый цвет, при добавлении щелочи (р-р NaOH)
раствор приобретает более интенсивную оранжевую окраску. Аналогично
протекают реакции для триптофана и гистидина:
23.
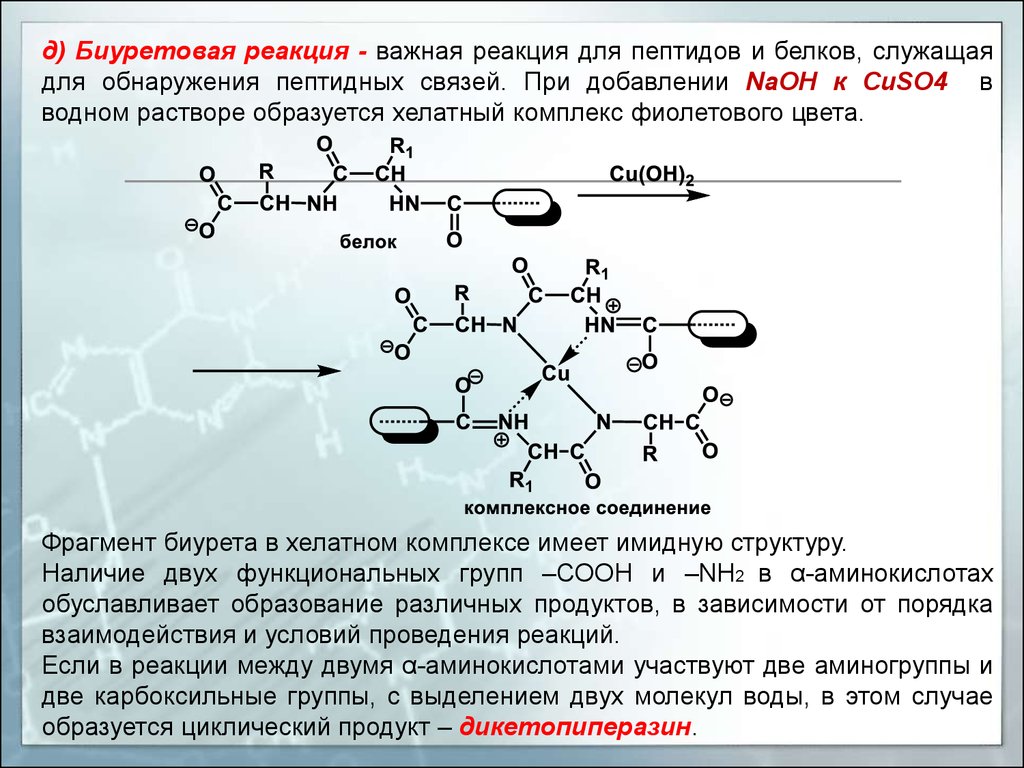
д) Биуретовая реакция - важная реакция для пептидов и белков, служащаядля обнаружения пептидных связей. При добавлении NaOH к СuSO4 в
водном растворе образуется хелатный комплекс фиолетового цвета.
Фрагмент биурета в хелатном комплексе имеет имидную структуру.
Наличие двух функциональных групп –СООН и –NН2 в α-аминокислотах
обуславливает образование различных продуктов, в зависимости от порядка
взаимодействия и условий проведения реакций.
Если в реакции между двумя α-аминокислотами участвуют две аминогруппы и
две карбоксильные группы, с выделением двух молекул воды, в этом случае
образуется циклический продукт – дикетопиперазин.
24.
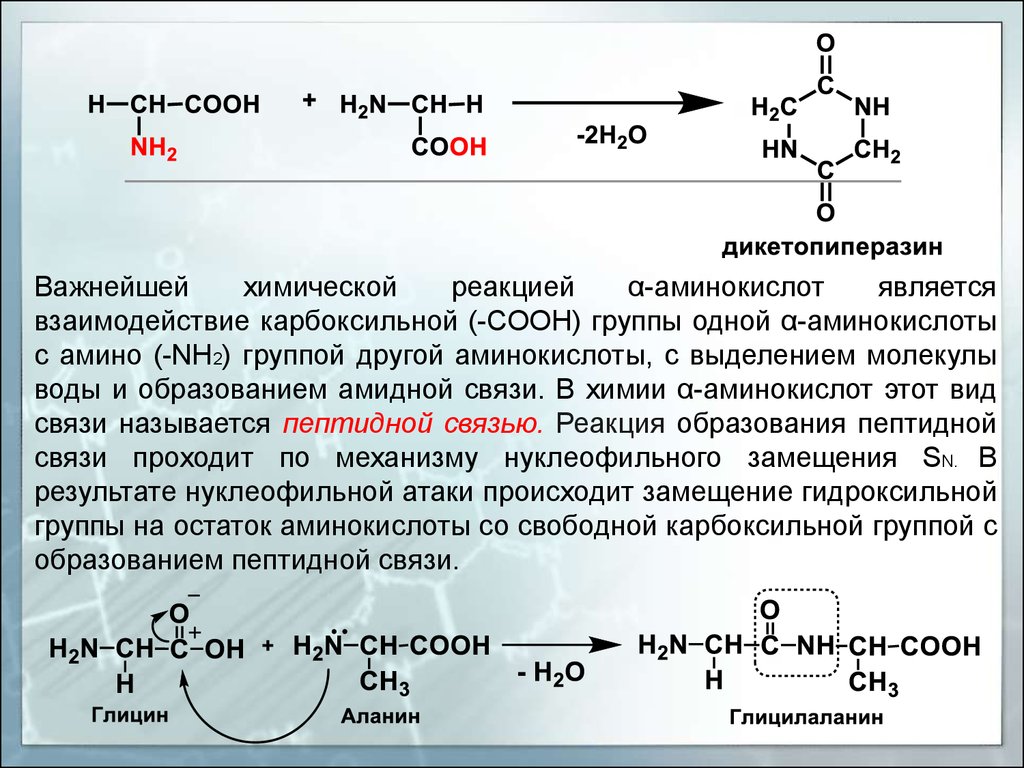
Важнейшейхимической
реакцией
α-аминокислот
является
взаимодействие карбоксильной (-СOOH) группы одной α-аминокислоты
с амино (-NН2) группой другой аминокислоты, с выделением молекулы
воды и образованием амидной связи. В химии α-аминокислот этот вид
связи называется пептидной связью. Реакция образования пептидной
связи проходит по механизму нуклеофильного замещения SN. В
результате нуклеофильной атаки происходит замещение гидроксильной
группы на остаток аминокислоты со свободной карбоксильной группой с
образованием пептидной связи.
25.
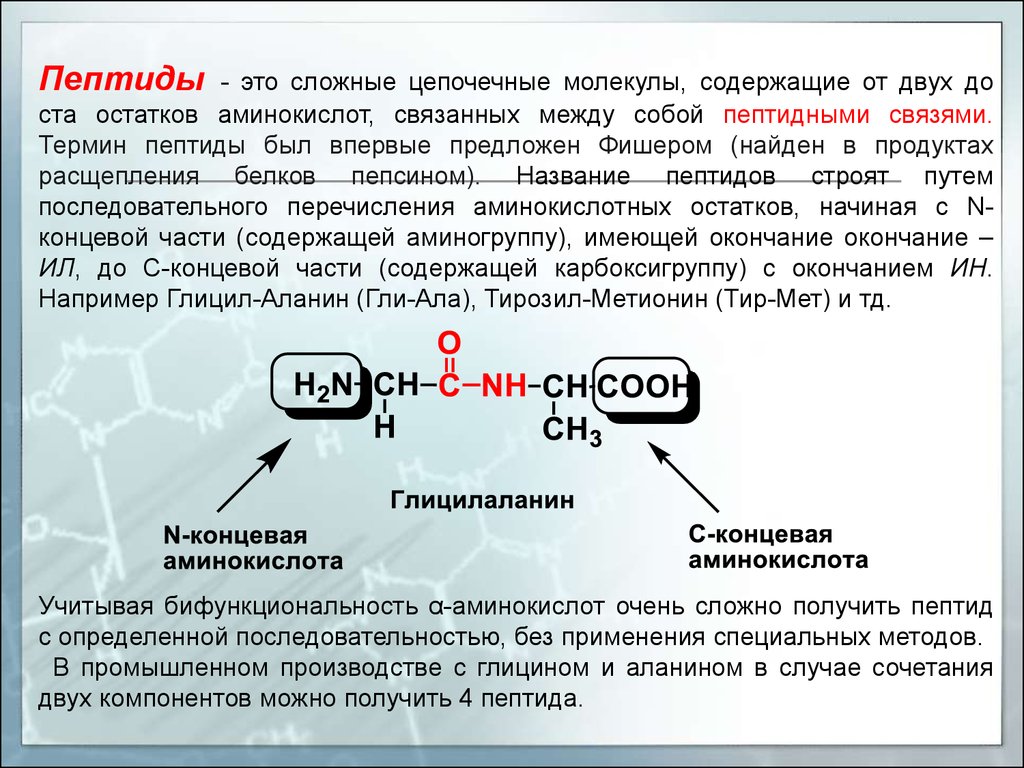
Пептиды- это сложные цепочечные молекулы, содержащие от двух до
ста остатков аминокислот, связанных между собой пептидными связями.
Термин пептиды был впервые предложен Фишером (найден в продуктах
расщепления белков пепсином). Название пептидов строят путем
последовательного перечисления аминокислотных остатков, начиная с Nконцевой части (содержащей аминогруппу), имеющей окончание окончание –
ИЛ, до С-концевой части (содержащей карбоксигруппу) с окончанием ИН.
Например Глицил-Аланин (Гли-Ала), Тирозил-Метионин (Тир-Мет) и тд.
Учитывая бифункциональность α-аминокислот очень сложно получить пептид
с определенной последовательностью, без применения специальных методов.
В промышленном производстве с глицином и аланином в случае сочетания
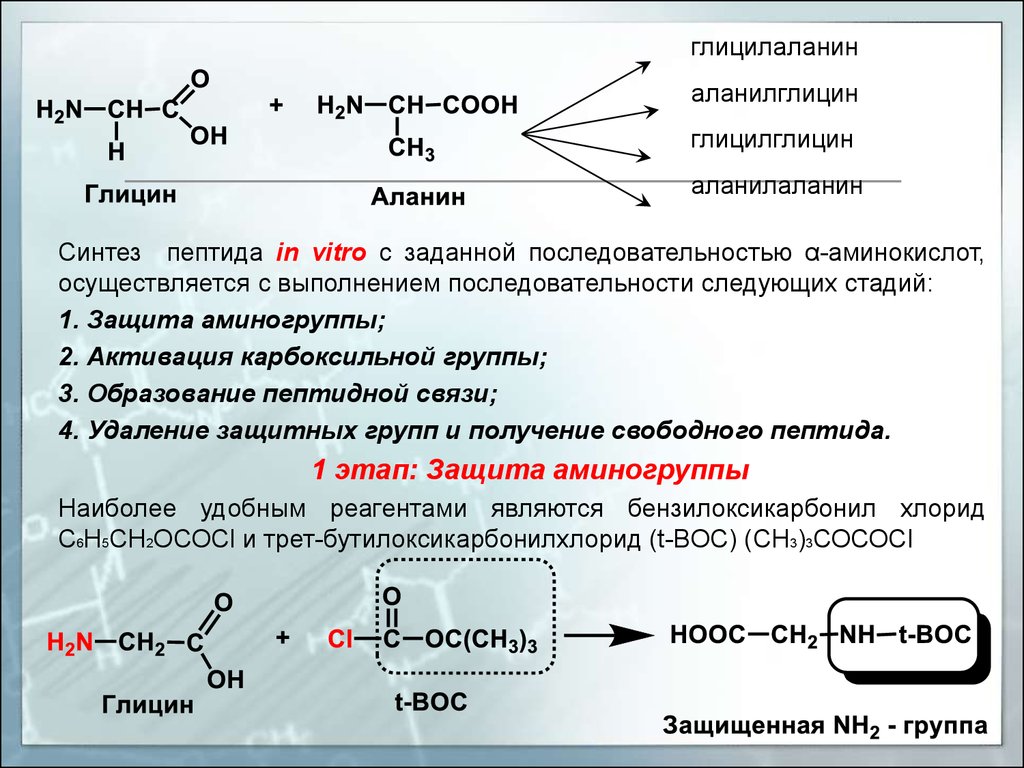
двух компонентов можно получить 4 пептида.
26.
глицилаланиналанилглицин
глицилглицин
аланилаланин
Синтез пептида in vitro с заданной последовательностью α-аминокислот,
осуществляется с выполнением последовательности следующих стадий:
1. Защита аминогруппы;
2. Активация карбоксильной группы;
3. Образование пептидной связи;
4. Удаление защитных групп и получение свободного пептида.
1 этап: Защита аминогруппы
Наиболее удобным реагентами являются бензилоксикарбонил хлорид
С6Н5СН2ОСОСl и трет-бутилоксикарбонилхлорид (t-BOC) (СН3)3СОСОСl
27.
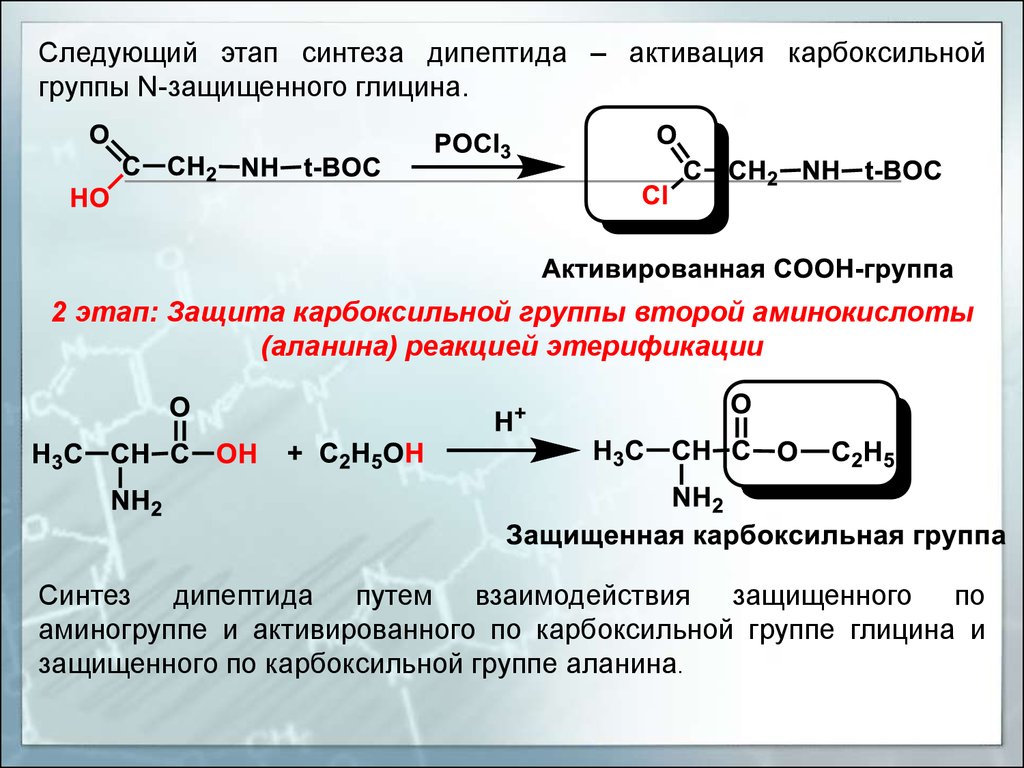
Следующий этап синтеза дипептида – активация карбоксильнойгруппы N-защищенного глицина.
2 этап: Защита карбоксильной группы второй аминокислоты
(аланина) реакцией этерификации
Синтез дипептида путем взаимодействия защищенного по
аминогруппе и активированного по карбоксильной группе глицина и
защищенного по карбоксильной группе аланина.
28.
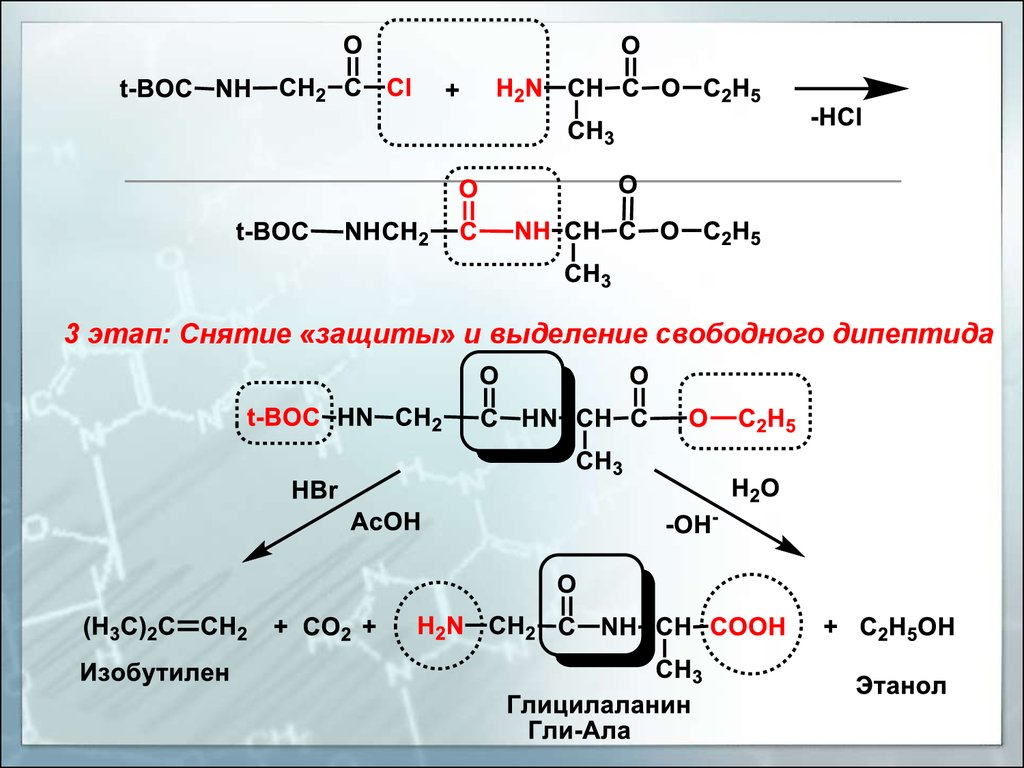
3 этап: Снятие «защиты» и выделение свободного дипептида29.
Пептидные гормоны и нейропептиды, например, регулируют большинствопроцессов организма человека, в том числе, и принимают участие в процессах
регенерации клеток. Пептиды иммунологического действия защищают
организм от попавших в него токсинов. Для правильной работы клеток и тканей
необходимо адекватное количество пептидов. С возрастом и при патологии
возникает дефицит пептидов, который существенно ускоряет износ тканей, что
приводит к старению всего организма. Сегодня проблему недостаточности
пептидов в организме научились решать с помощью синтеза пептидов в
лабораторных условиях.
Белки-высокомолекулярные
соединения, построенные из аминокислот и
составляющие большую часть органических веществ, содержащихся в живой
клетке. Молекулы белков состоят из полипептидных цепей организованных в
сложные трехмерные структуры.
Классификация белков
1) По функциям: Ферменты, структурные, транспортные, резервные,
рецепторные.
2) По растворимости: глобулярные и фибриллярные
3) По происхождению: растительные, животные, вирусные и бактериальные.
30.
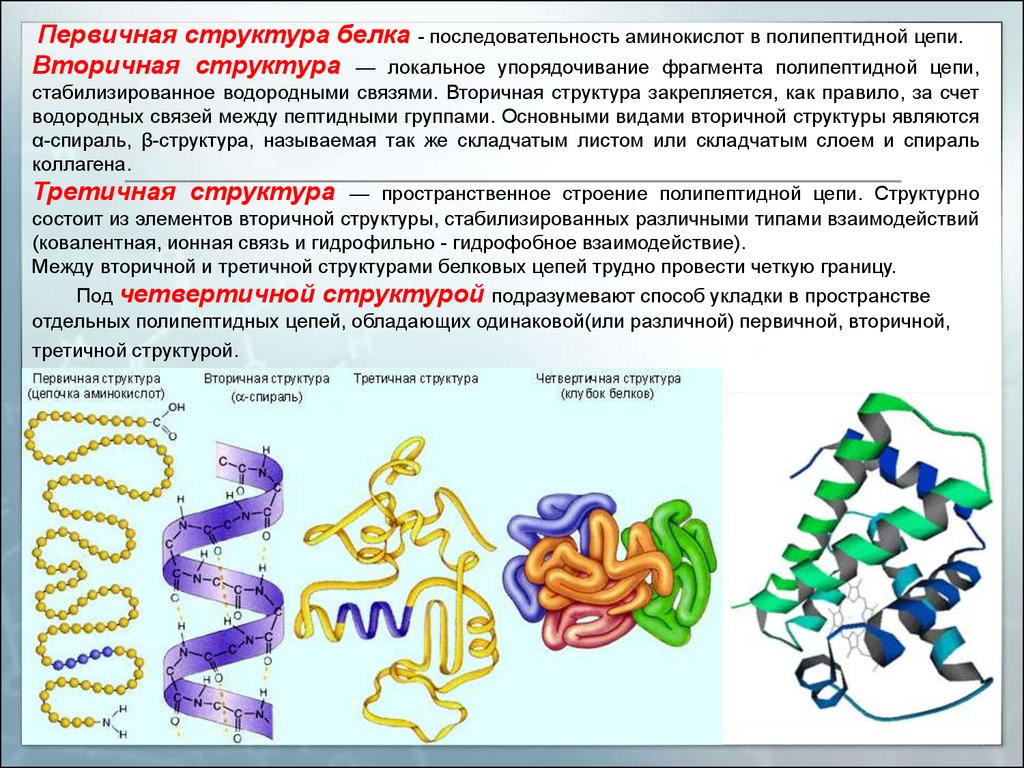
Первичная структура белка - последовательность аминокислот в полипептидной цепи.Вторичная структура — локальное упорядочивание фрагмента полипептидной цепи,
стабилизированное водородными связями. Вторичная структура закрепляется, как правило, за счет
водородных связей между пептидными группами. Основными видами вторичной структуры являются
α-спираль, β-структура, называемая так же складчатым листом или складчатым слоем и спираль
коллагена.
Третичная структура — пространственное строение полипептидной цепи. Структурно
состоит из элементов вторичной структуры, стабилизированных различными типами взаимодействий
(ковалентная, ионная связь и гидрофильно - гидрофобное взаимодействие).
Между вторичной и третичной структурами белковых цепей трудно провести четкую границу.
Под четвертичной структурой подразумевают способ укладки в пространстве
отдельных полипептидных цепей, обладающих одинаковой(или различной) первичной, вторичной,
третичной структурой.
















 Химия
Химия