Похожие презентации:
Механизм регуляции ферментационной активности
1.
Кафедра биологической и общей химииМеханизмы регуляции ферментативной активности
2.
Ферментыэто специфические белки, которые
обладают каталитическими свойствами,
т.е. они способны ускорять химические реакции,
активно участвуя в них, но регенерируются в ходе реакции
3.
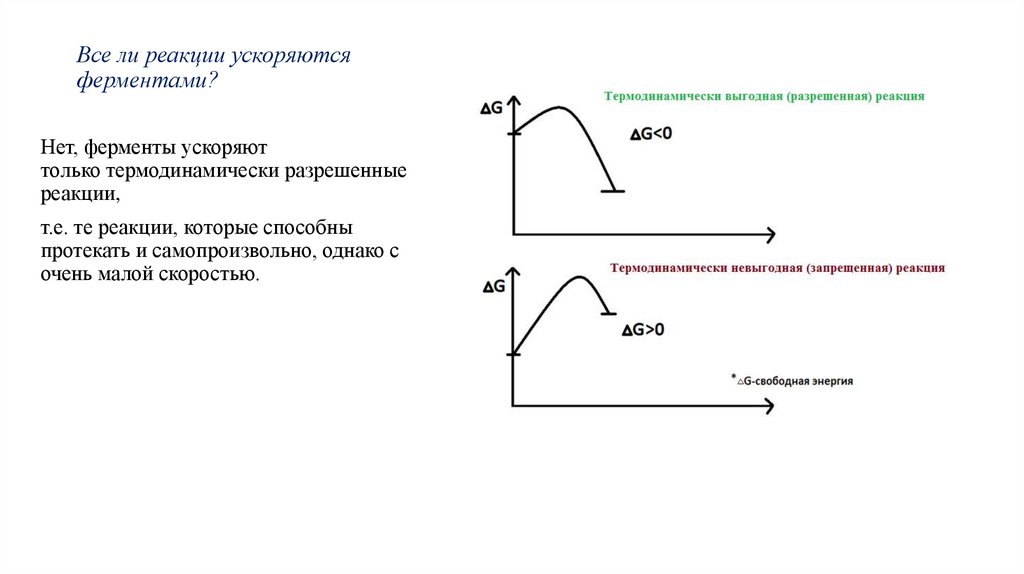
Все ли реакции ускоряютсяферментами?
Нет, ферменты ускоряют
только термодинамически разрешенные
реакции,
т.е. те реакции, которые способны
протекать и самопроизвольно, однако с
очень малой скоростью.
4.
Сходство и различия ферментов и химических катализаторов• Сходство с химическими
катализаторами:
1) Не сдвигают равновесие
в обратимых реакциях
2) Активны в малых
концентрациях
3) Не расходуются
4) Ускоряют только
термодинамически
разрешенные процессы
• Отличия от химических
катализаторов:
1) Сильная зависимость от рН среды,
температуры, ионной силы
раствора
2) Уникально высокая активность (на
много порядков превышает
активность химических
катализаторов)
3) Высокая специфичность
4) Регулируемость действия,
подвержены действия
ингибиторов, активаторов и
других регуляторных молекул.
5.
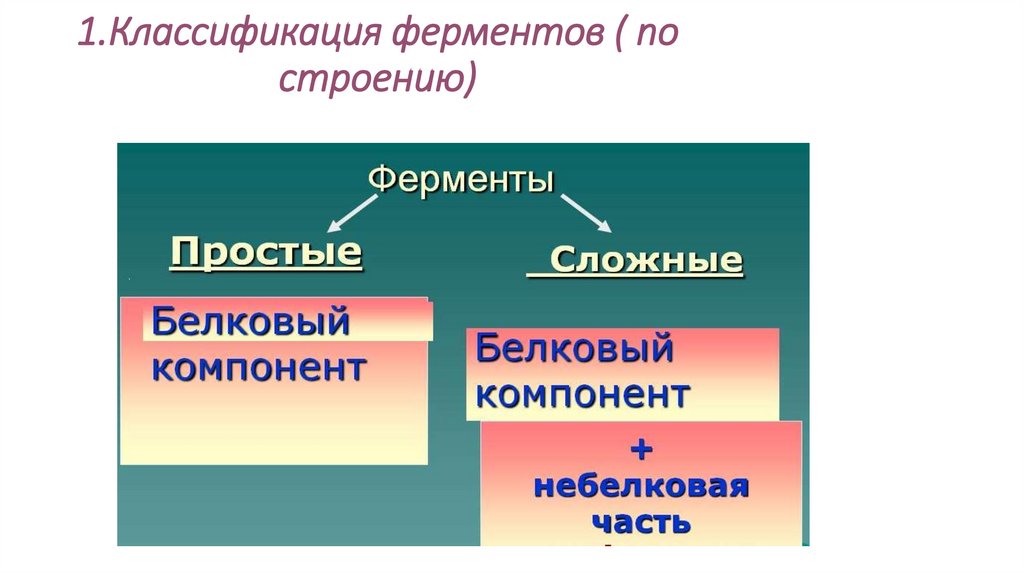
Строение ферментовФерменты-простые белки
• Обычно представляют из себя
белок с третичной структурой.
Ферменты-простые белки
состоят только из аминокислот
• Например: пепсин, трипсин,
лизоцим
Ферменты - сложные белки
• Состоят из белковой части - апофермента и
небелковой – кофермента или
простетической группы (производные
витаминов) или кофактора (ионы металлов)
• Например: сукцинатдегидрогеназа (FAD),
аминотрансферазы (пиридоксальфосфат),
пероксидазы (ГЕМ)
6.
1.Классификация ферментов ( построению)
7.
Белковый компонент (часть) Е• называется апоферментом
• построен из альфа-аминокислот
8.
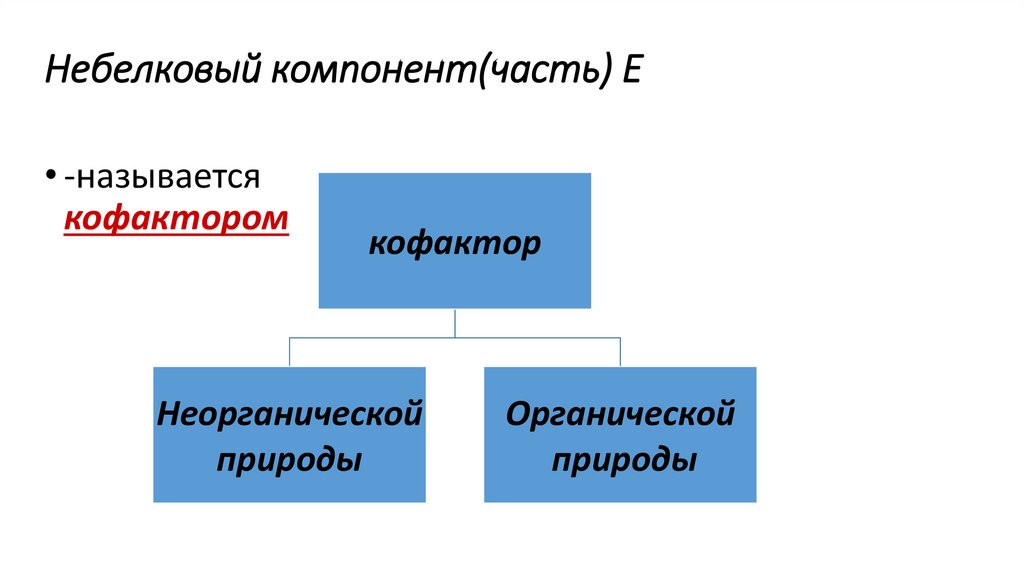
Небелковый компонент(часть) Е• -называется
кофактором
кофактор
Неорганической
природы
Органической
природы
9.
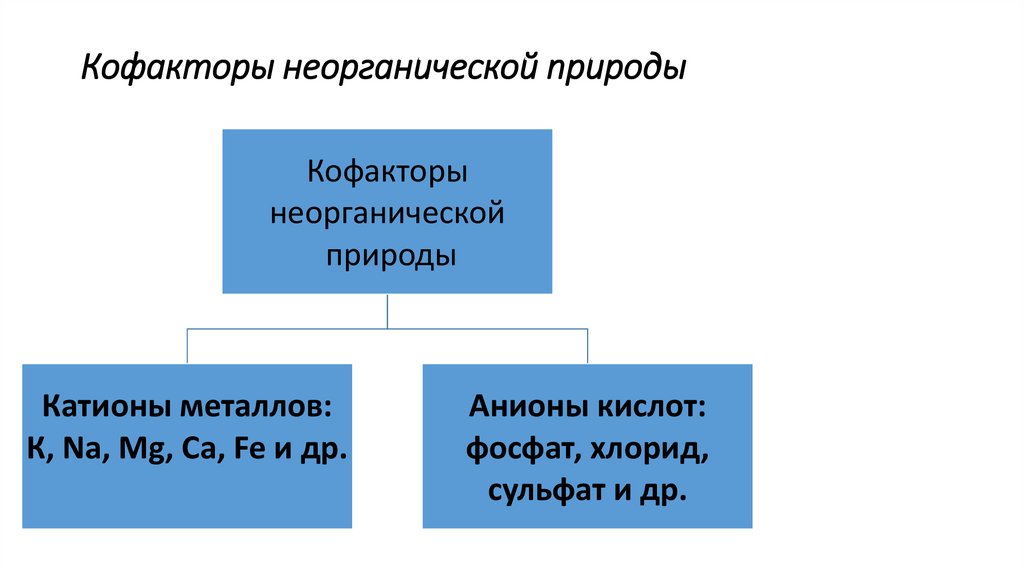
Кофакторы неорганической природыКофакторы
неорганической
природы
Катионы металлов:
К, Na, Mg, Ca, Fe и др.
Анионы кислот:
фосфат, хлорид,
сульфат и др.
10.
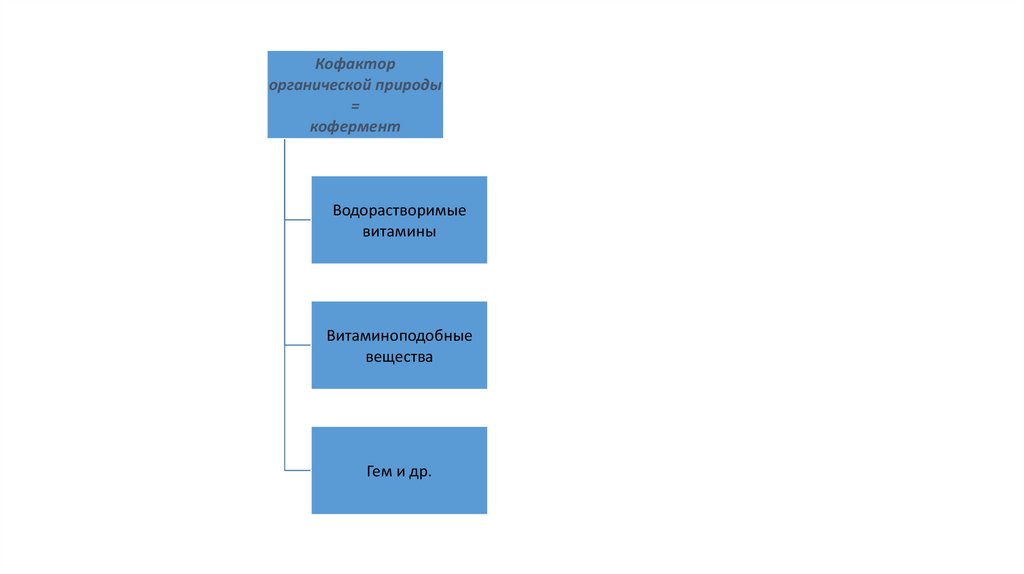
Кофакторорганической природы
=
кофермент
Водорастворимые
витамины
Витаминоподобные
вещества
Гем и др.
11.
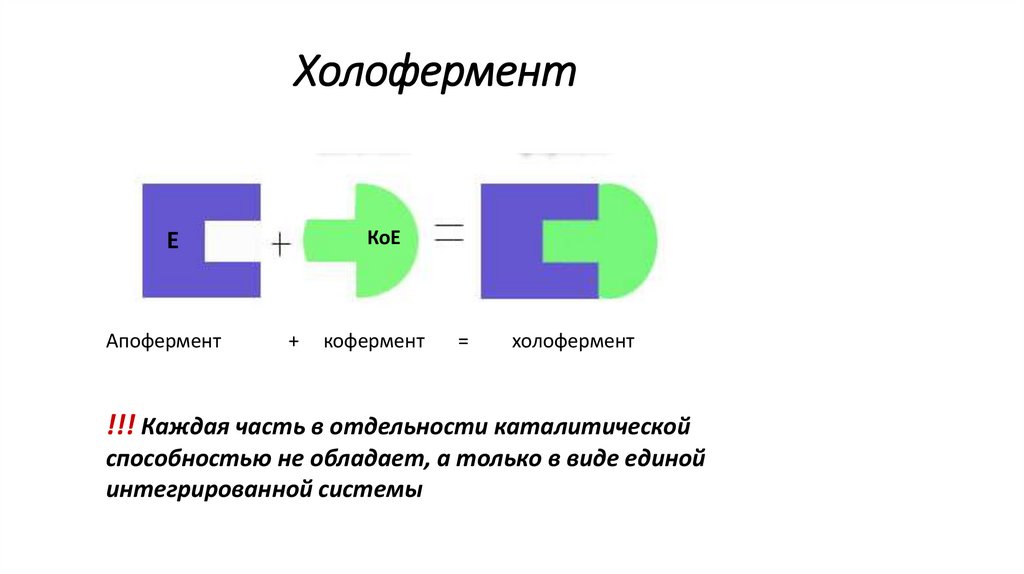
ХолоферментКоЕ
Е
Апофермент
+
кофермент
=
холофермент
!!! Каждая часть в отдельности каталитической
способностью не обладает, а только в виде единой
интегрированной системы
12.
НоменклатураРазработана Международной Комиссией по ферментам (КФ или англ. EC)
Основа классификации – тип реакции, которую катализируют фермент.
Все названия ферментов имеют характерное окончание – аза.
Исключение: пепсин, трипсин, химотрипсин, реннин
Выделяют 7 классов, каждый класс разделяют на подклассы.
Для обозначения каждого фермента предложен четырехзначный международный
шифр
13.
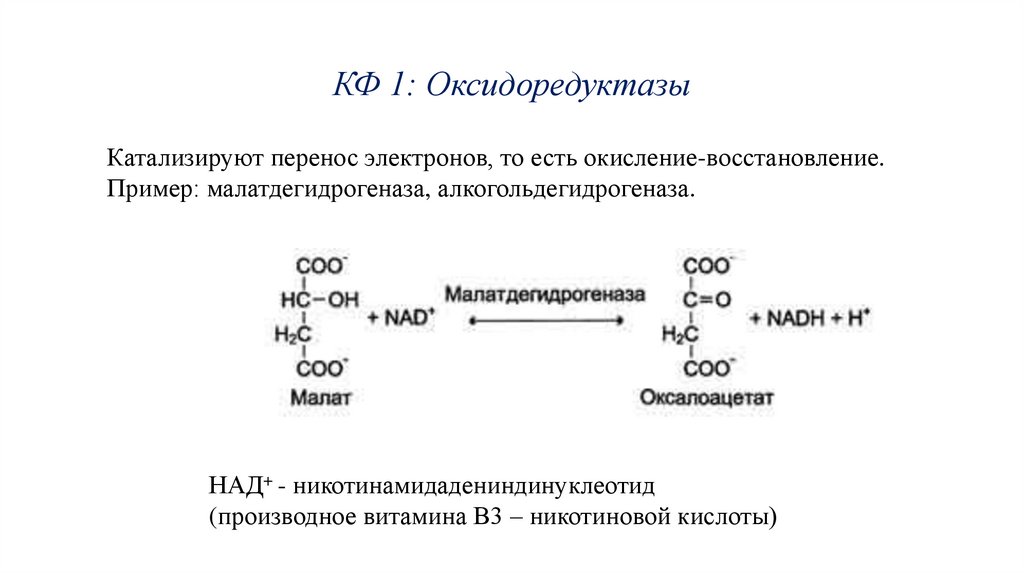
КФ 1: ОксидоредуктазыКатализируют перенос электронов, то есть окисление-восстановление.
Пример: малатдегидрогеназа, алкогольдегидрогеназа.
НАД+ - никотинамидадениндинуклеотид
(производное витамина В3 – никотиновой кислоты)
14.
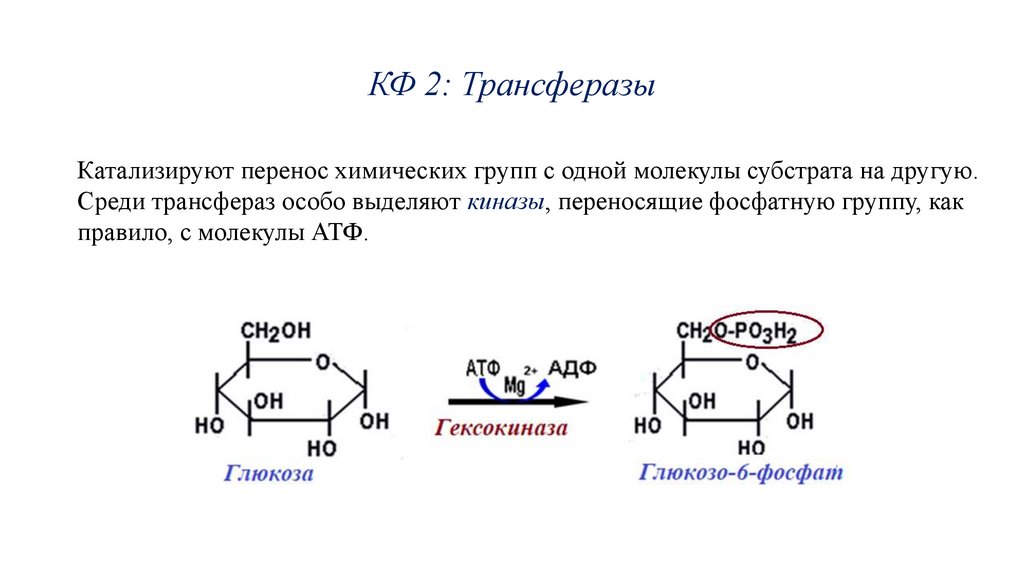
КФ 2: ТрансферазыКатализируют перенос химических групп с одной молекулы субстрата на другую.
Среди трансфераз особо выделяют киназы, переносящие фосфатную группу, как
правило, с молекулы АТФ.
15.
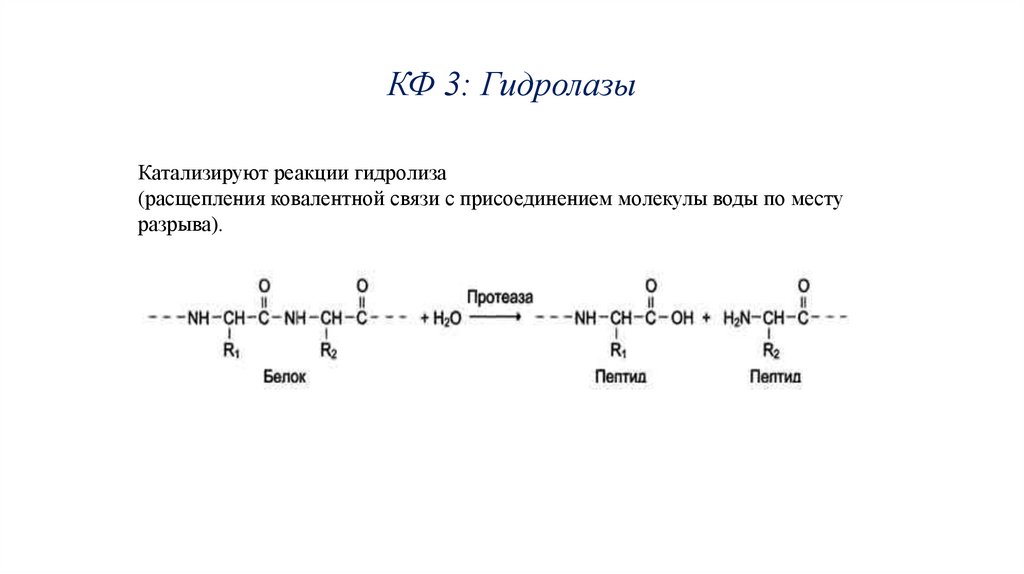
КФ 3: ГидролазыКатализируют реакции гидролиза
(расщепления ковалентной связи с присоединением молекулы воды по месту
разрыва).
16.
КФ 4: ЛиазыК лиазам относят ферменты,
отщепляющие от субстратов
негидролитическим путём
определённую группу
(при этом могут отщепляться
СО2, Н2О, NH2,SН2и др.)
или присоединяющие, чаще
всего, молекулу воды по
двойной связи.
17.
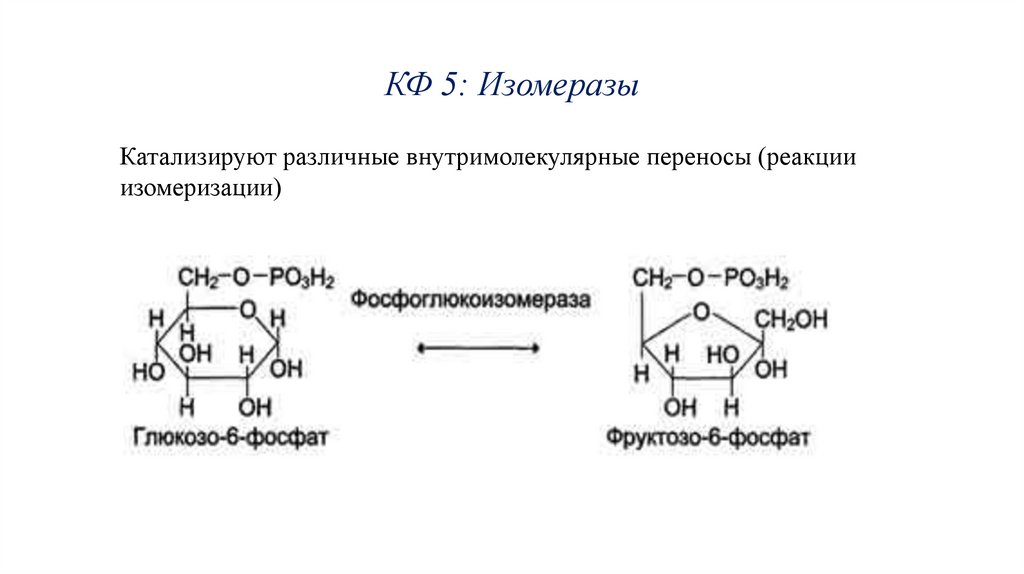
КФ 5: ИзомеразыКатализируют различные внутримолекулярные переносы (реакции
изомеризации)
18.
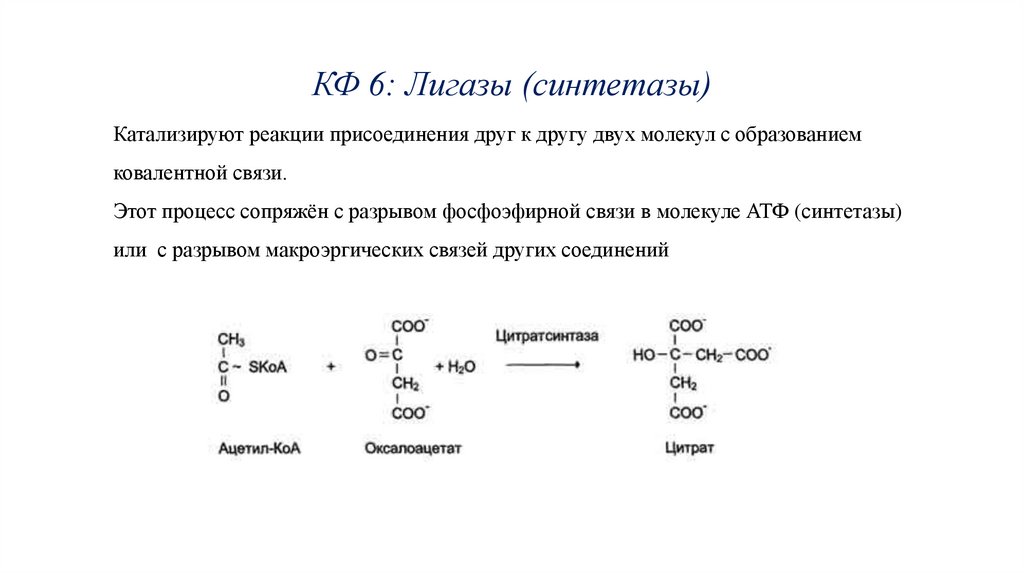
КФ 6: Лигазы (синтетазы)Катализируют реакции присоединения друг к другу двух молекул с образованием
ковалентной связи.
Этот процесс сопряжён с разрывом фосфоэфирной связи в молекуле АТФ (синтетазы)
или с разрывом макроэргических связей других соединений
19.
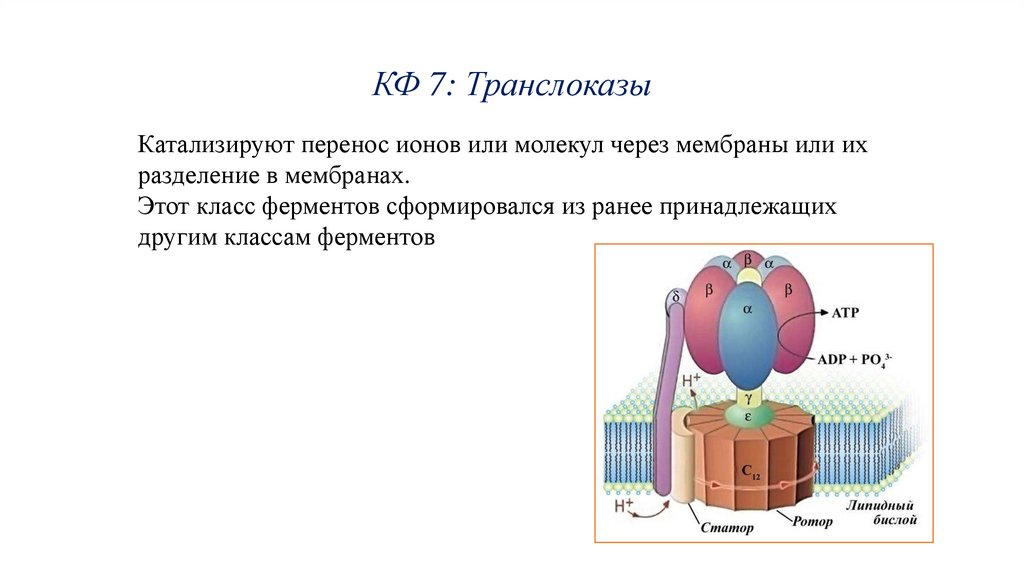
КФ 7: ТранслоказыКатализируют перенос ионов или молекул через мембраны или их
разделение в мембранах.
Этот класс ферментов сформировался из ранее принадлежащих
другим классам ферментов
20.
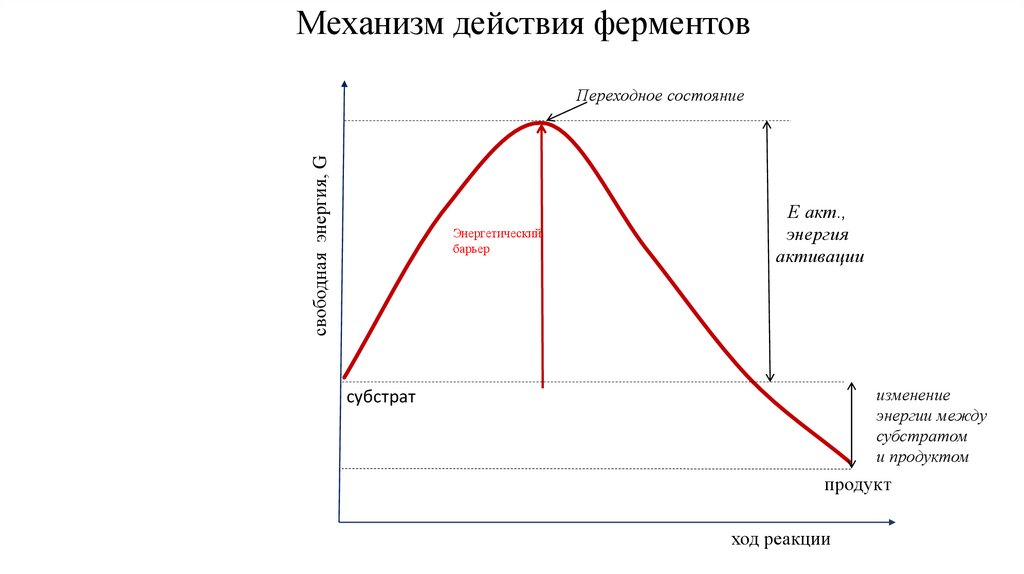
Механизм действия ферментовсвободная энергия, G
Переходное состояние
Энергетический
барьер
Е акт.,
энергия
активации
изменение
энергии между
субстратом
и продуктом
субстрат
продукт
ход реакции
21.
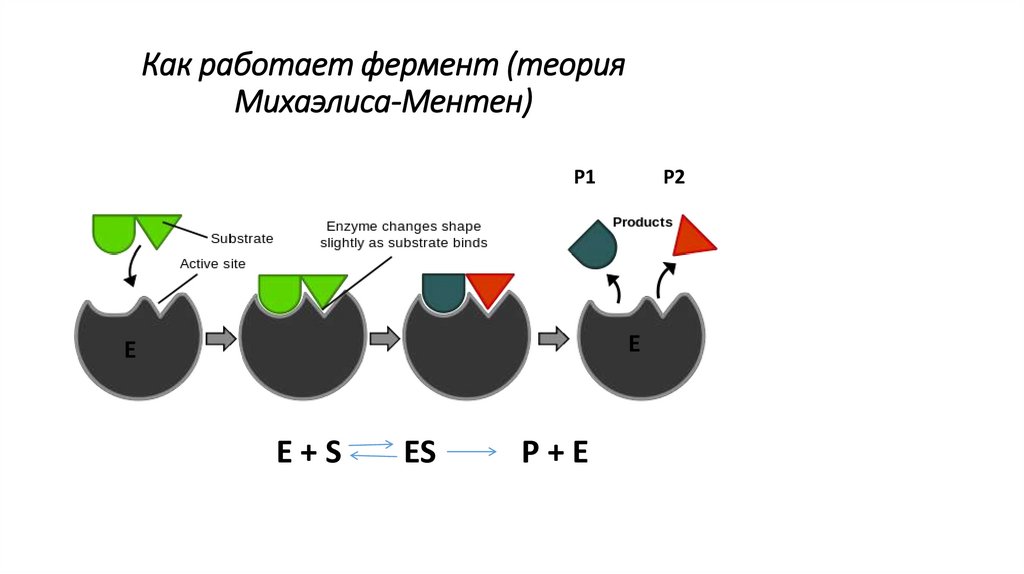
Как работает фермент (теорияМихаэлиса-Ментен)
Р1
Р2
Е
Е
E+S
ES
P+E
22.
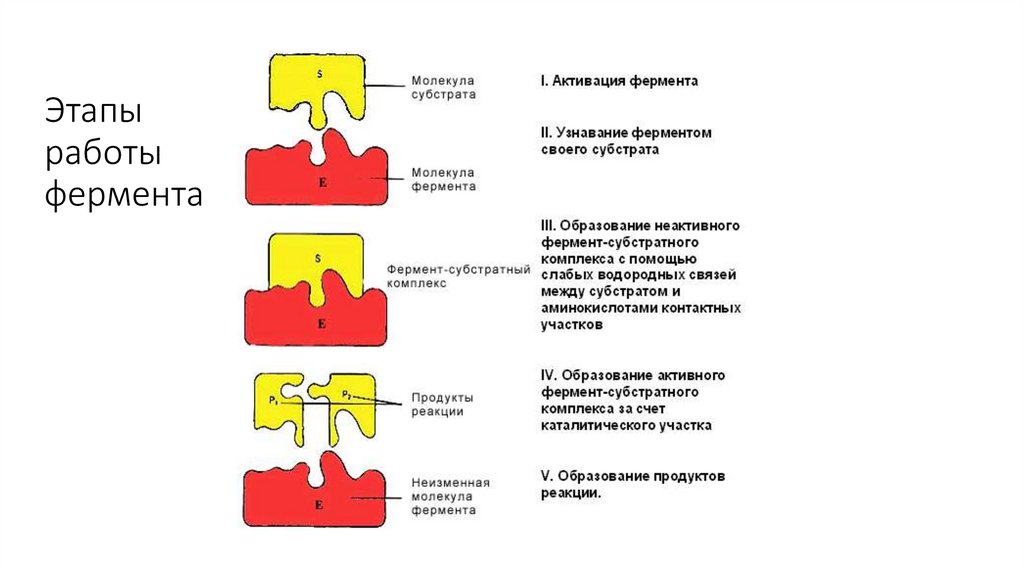
Этапыработы
фермента
23.
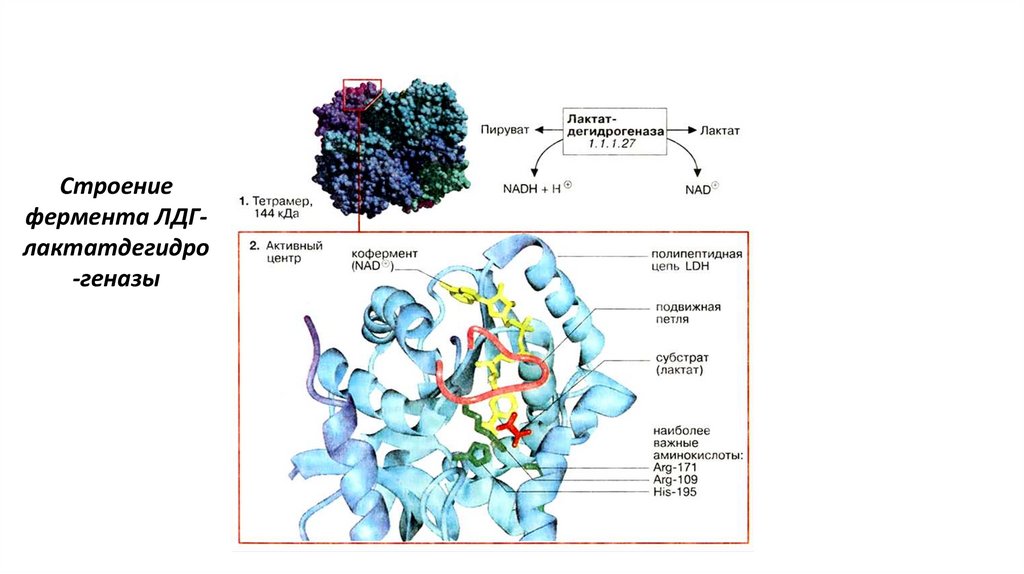
Строениефермента ЛДГлактатдегидро
-геназы
24.
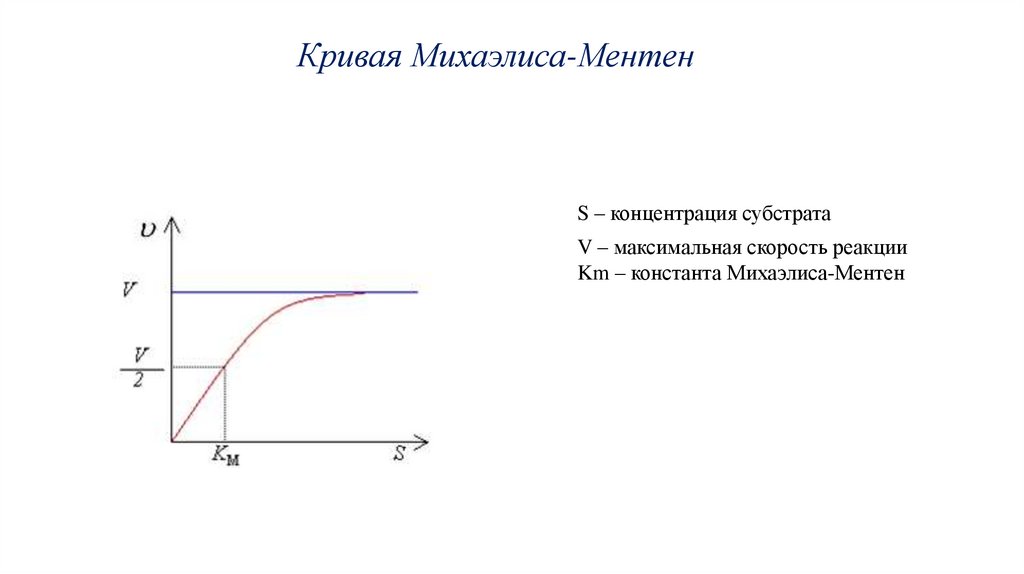
Кривая Михаэлиса-МентенS – концентрация субстрата
V – максимальная скорость реакции
Km – константа Михаэлиса-Ментен
25.
Уравнение Михаэлиса-Ментен=
V S
KM + S
26.
Константа Михаэлиса-Ментен• Достижение ферментом Vmax,
свидетельствует о том, что все
активные центры заняты
субстратом.
• Константа Михаэлиса - численно
равна концентрации субстрата, при
которой стационарная скорость
реакции равна половине
максимальной, т.е.
= V/2
• Кm характеризует сродство
фермента к субстрату
27.
Что такое активность ферментов?- При исследовании фермента определяется не количество фермента, а
его активность, поскольку весовое содержание фермента в биологических
системах трудно определить
- Мерой активности фермента является скорость катализируемой им реакции,
которая называется стационарной скоростью (обозначается ), равна половине
максимальной скорости
- В свою очередь скорость определяется убылью субстрата или накоплением
продукта реакции, которая определяется аналитически, обычно фотометрическим
методом
28.
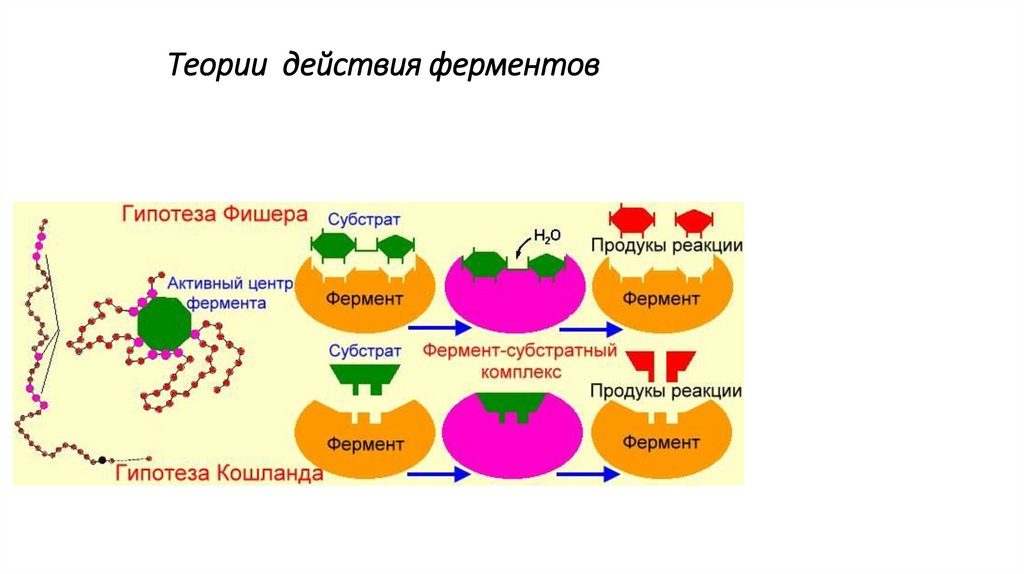
Теории действия ферментов29.
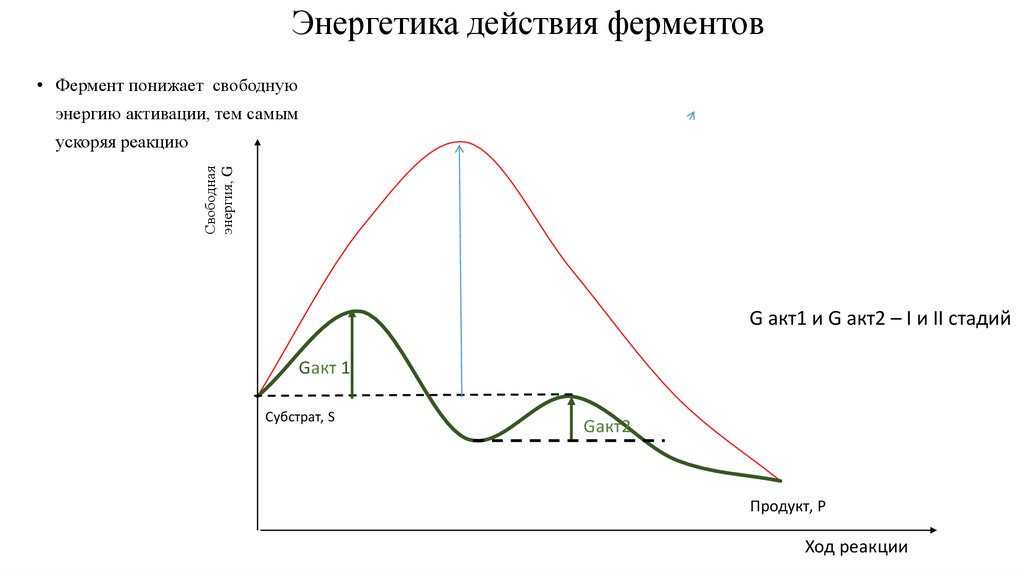
Энергетика действия ферментов• Фермент понижает свободную
энергию активации, тем самым
Свободная
энергия, G
ускоряя реакцию
G акт1 и G акт2 – I и II стадий
Gакт 1
Субстрат, S
Gакт2
Продукт, P
Ход реакции
30.
Энзимотерапия• Применение ферментов с лечебной целью:
• Заместительная терапия болезней ЖКТ (фестал, мезим и т.д.)
• В комплексной терапии в виде, орошений, промываний для санации
гнойных ран, полостей (протеазы, нуклеазы и др. гидролазы)
• Для тромболизиса (стрептолиаза, стрептодеказа, урокиназа)
• Для лечения лейкозов (аспарагиназа)
• Для рассасывания контрактур и рубцов после ожогов и операций
(гиалуронидаза - лидаза)
• Для лечения вирусных конъюнктивитов и кератитов (РНК-аза и ДНКаза) ингаляций
31.
32.
33.
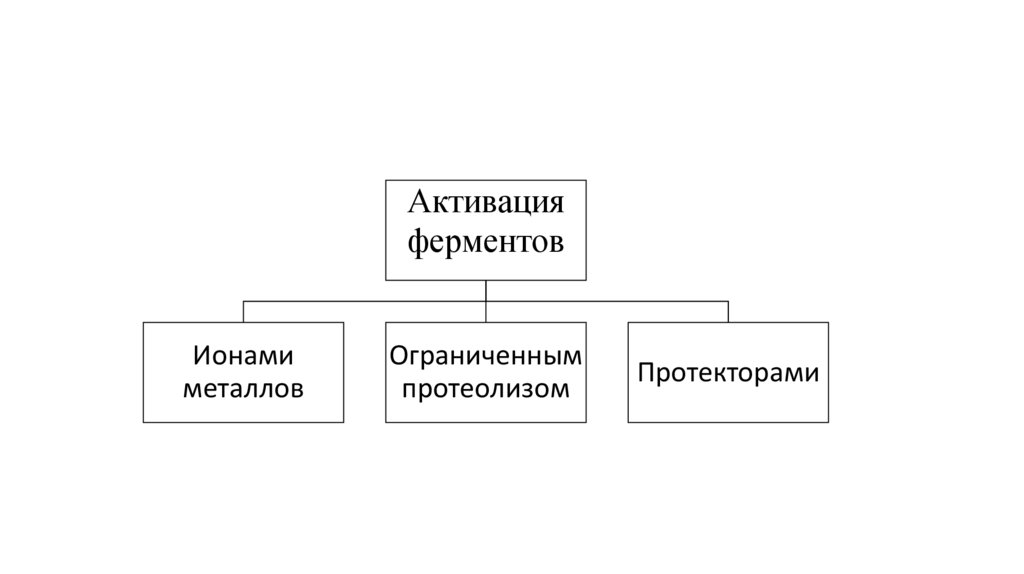
Активацияферментов
Ионами
металлов
Ограниченным
протеолизом
Протекторами
34.
• Изменяют конформацию молекулы субстрата• Обеспечивают нативную конформацию активного центра фермента
• Стабилизируют конформацию белковой молекулы фермента
• Непосредственно участвуют в ферментативном катализе
35.
Cu, Zn-супероксиддисмутаза (СОД)• Zn необходим для стабилизации молекулы
• Cu – активный участник в реакции дисмутации супероксиданиона:
О2 - + О2 - + 2Н+ = Н2О2 + О2
1) О2 - + Cu2+ + Н+ = Cu1+ + О2
2) О2 - + Cu1+ + Н+ = Cu2+ + Н2О2
36.
Активация ионами металловФермент
Металл
Фермент
Металл
Цитохромы
Fe
Амилаза
Ca
Каталаза
Fe
Липаза
Ca
Пероксидаза
Fe
Карбоангидраза
Zn
Триптофаноксидаза
Fe
Уриказа
Zn
Аскорбиноксидаза
Cu
Карбоксипептидаза
Zn
Тирозиназа
Cu
Пируваткарбоксилаза
Mg
Альдегидоксидаза
Mo
Фосфатаза
Mg
Холинэстераза
Mn
Аргиназа
Mn
37.
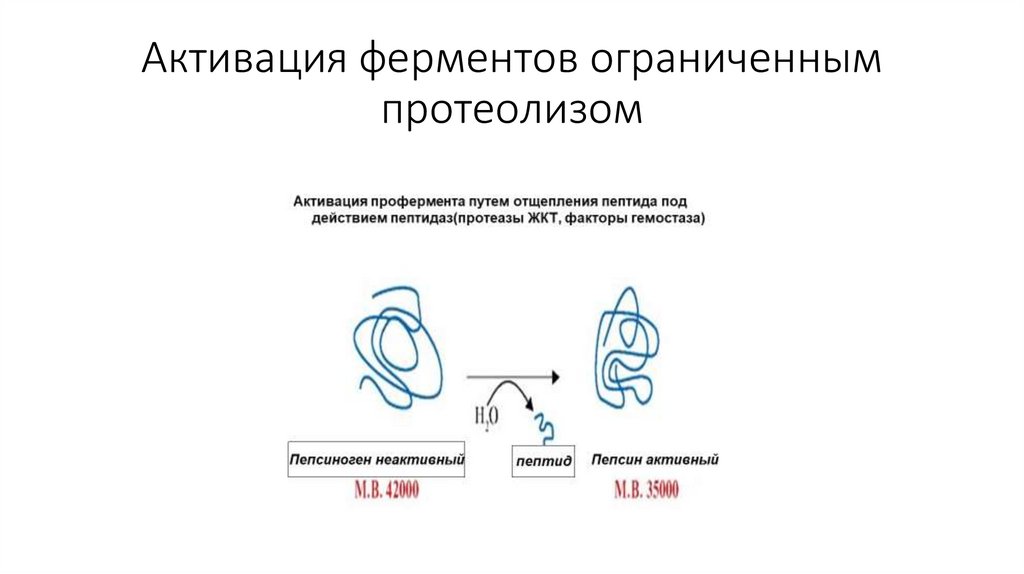
Активация ферментов ограниченнымпротеолизом
38.
АКТИВАЦИЯ ПРОТЕКТОРАМИ• Протекторы ( глутатион, унитиол ) – низкомолекулярные
вещества, содержащие SН-группы, которые подвергаются
воздействию тиоловых ядов, тем самым защищая SН-группы
ферментов
39.
Регуляция скорости реакции в клетке осуществляетсяна 3-х независимых уровнях:
• Регуляция количества фермента в клетке
• Наличие и концентрация субстрата в клетке
• Изменение активности фермента
40.
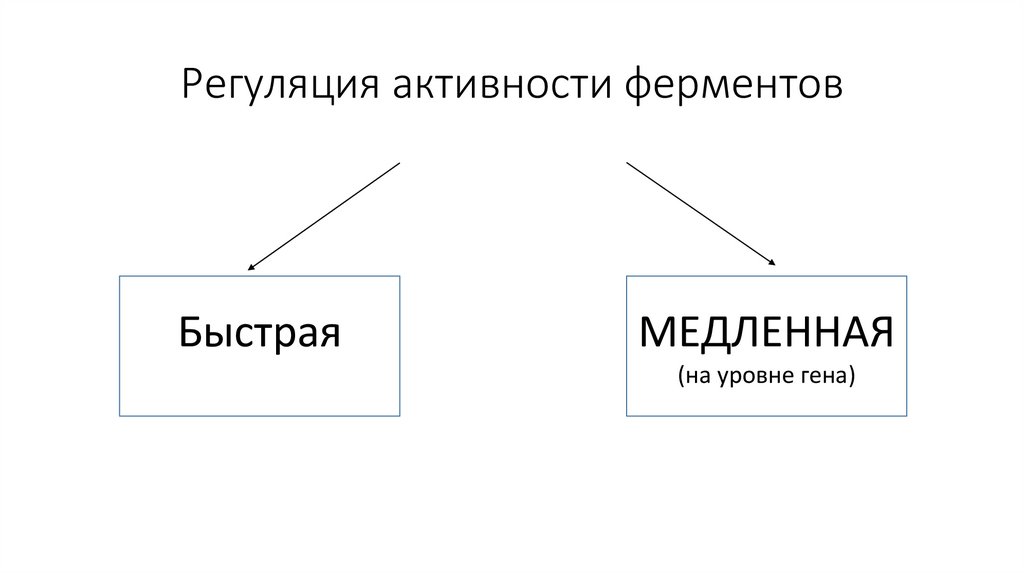
Регуляция активности ферментовБыстрая
МЕДЛЕННАЯ
(на уровне гена)
41.
Изменение количества молекул ферментаКоличество молекул фермента в клетке определяется соотношением двух
процессов: синтеза и распада. Наиболее изучен механизм регуляции синтеза
фермента на уровне транскрипции (синтеза мРНК), который регулируется
определенными метаболитами, гормонами и рядом биологически активных
молекул
Это медленная регуляция, осуществляется метаболитами, гормонами и др.
42.
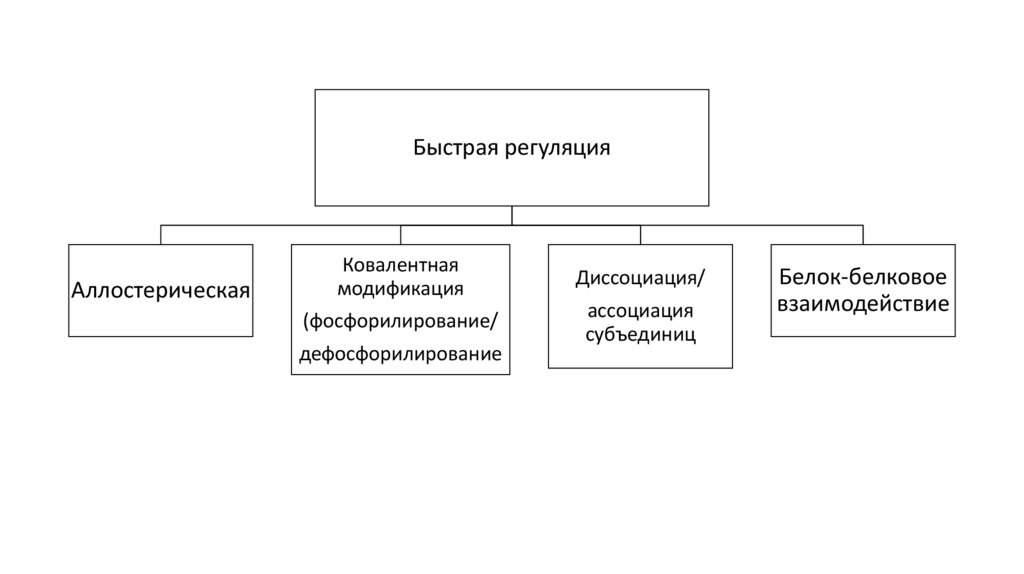
Быстрая регуляцияАллостерическая
Ковалентная
модификация
Диссоциация/
(фосфорилирование/
ассоциация
субъединиц
дефосфорилирование
Белок-белковое
взаимодействие
43.
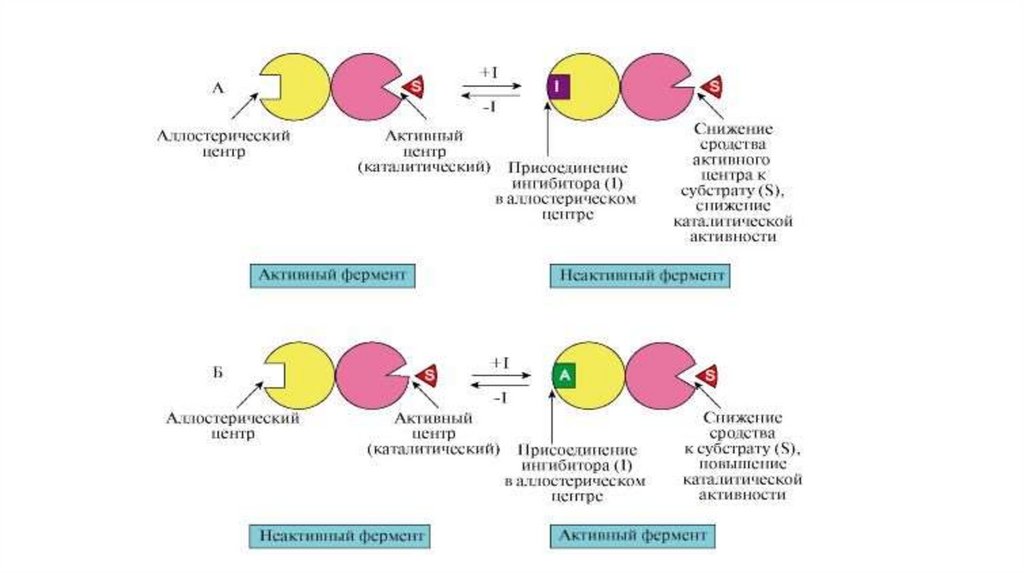
Аллостерическая регуляция
Характерна для олигомерных ферментов
(четвертичная структура). В структуре имеются
каталитические протомеры( с активным центром) и
протомеры - регуляторные ( с аллостерическим
центром)
Аллостерические ферменты меняют активность не
только от концентрации субстрата, но и под
действием эффекторов (результат- изменение
конфигурации молекулы и активного центра).
Аллостерические ферменты- регуляторные ферменты
метаболических путей, катализируют 1-ю
необратимую (самую медленную) реакцию
метаболического пути.
Активность остальных ферментов этого пути от [S]
S
P1
P2
P3→
P
E1
E2
E3
E4
44.
45.
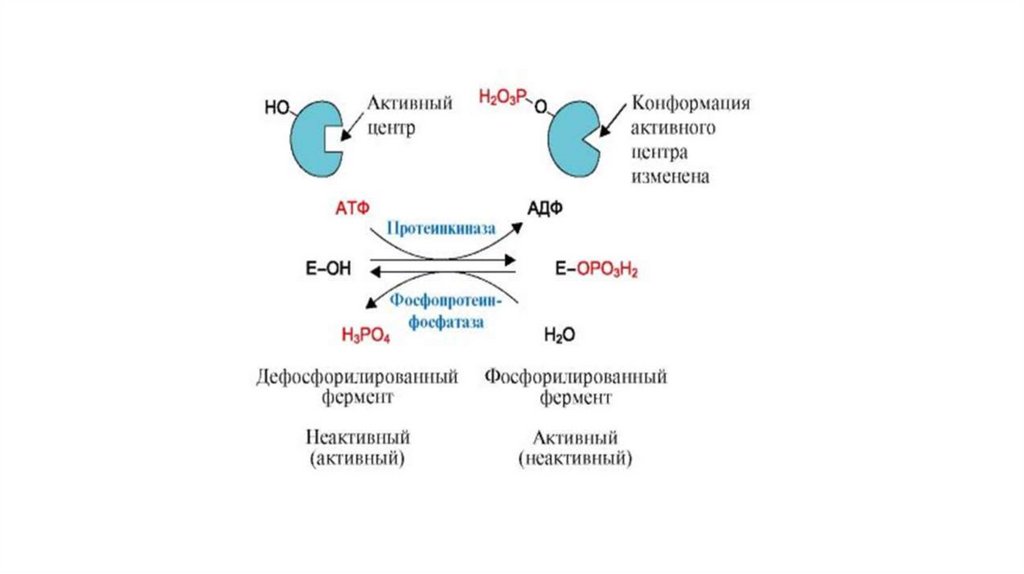
Регуляция путёмфосфорилирования-дефосфорилирования
• Фосфорилированию подвергаются ОН-группы фермента, которое
осуществляется ферментами протеинкиназами
(фосфорилирование) и фосфатазами (дефосфорилирование)
• Присоединение остатка фосфорной кислоты приводит к
изменению конформации активного центра и его каталитической
активности. При этом результат может быть двояким: одни
ферменты при фосфорилировании активируются, другие,
напротив, становятся менее активными
46.
47.
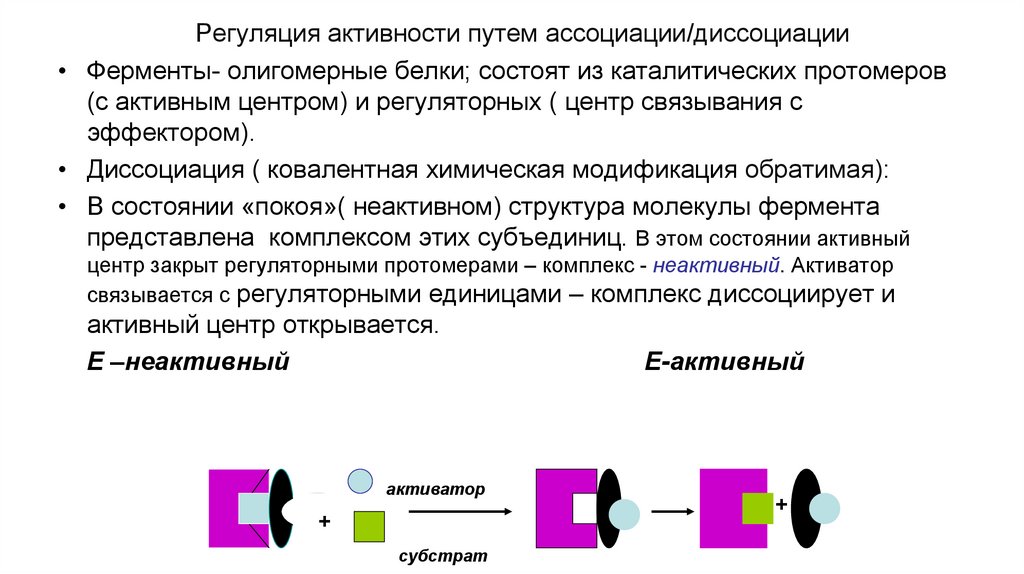
Регуляция активности путем ассоциации/диссоциации• Ферменты- олигомерные белки; состоят из каталитических протомеров
(с активным центром) и регуляторных ( центр связывания с
эффектором).
• Диссоциация ( ковалентная химическая модификация обратимая):
• В состоянии «покоя»( неактивном) структура молекулы фермента
представлена комплексом этих субъединиц. В этом состоянии активный
центр закрыт регуляторными протомерами – комплекс - неактивный. Активатор
связывается с регуляторными единицами – комплекс диссоциирует и
активный центр открывается.
E –неактивный
активатор
+
субстрат
E-активный
+
48.
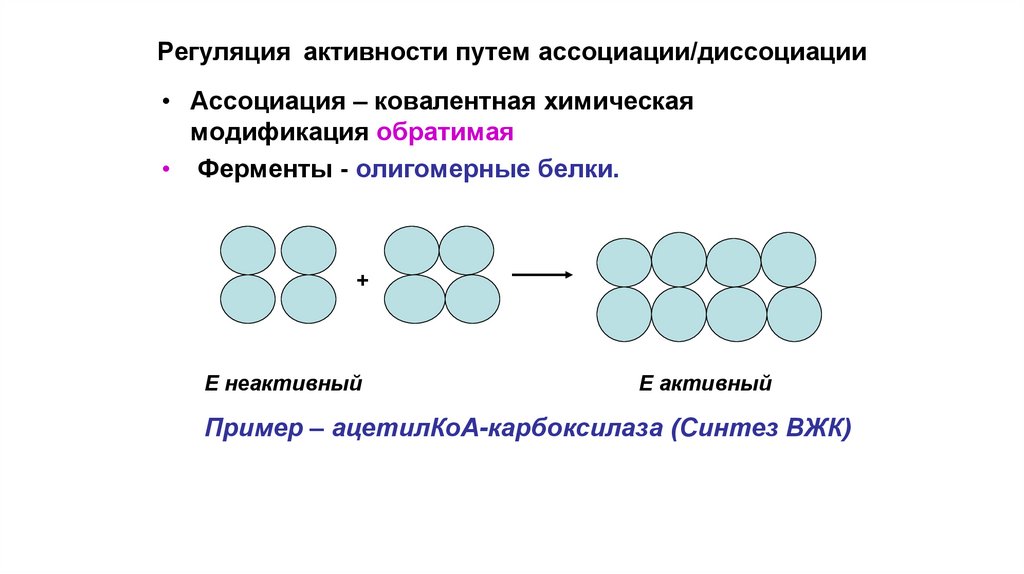
Регуляция активности путем ассоциации/диссоциации• Ассоциация – ковалентная химическая
модификация обратимая
• Ферменты - олигомерные белки.
+
E неактивный
E активный
Пример – ацетилКоА-карбоксилаза (Синтез ВЖК)





















 Биология
Биология








