Похожие презентации:
Биохимия и молекулярная биология. Ферменты, строение, механизм действия, свойства, регуляция. Лекция 3
1.
БИОХИМИЯ И МОЛЕКУЛЯРНАЯБИОЛОГИЯ
Лекция
3.
Ферменты
строение, механизм действия,
свойства, регуляция
1
2. План лекции
Ферменты – биокатализаторы. Сходство иотличия с небиологическими
катализаторами
Структурная организация ферментов
Кофакторы
Активные и аллостерические центры
Механизм действия ферментов
Свойства ферментов: влияние температуры
и рН на активность ферментов
Специфичность действия ферментов
Активаторы и ингибиторы ферментов
Регуляция активности ферментов
Ферменты - строение, механизм действия, свойства, регуляция
2
3. Ферменты - биокатализаторы
Практически все реакции в живом организмепротекают с участием природных
биокатализаторов, называемых ферментами,
или энзимами.
Слово «фермент» происходит от лат.
fеrmеntum - закваска, а «энзим» - от греч. еп в, внутри и zyme – дрожжи. Данная
терминология возникла исторически при
изучении ферментативных процессов спиртового
брожения.
В настоящее время известно более 5600
ферментов.
Ферменты - строение, механизм действия, свойства, регуляция
3
4. Ферменты - биокатализаторы
Ферменты, энзимы – это белки, действующиекак специфические высокоэффективные
катализаторы химических реакций,
протекающих в живых организмах.
Посредством ферментов реализуется
генетическая информация и осуществляются
все процессы обмена веществ и энергии в
клетках. В отсутствие ферментов
большинство химических реакций клеточного
метаболизма не может происходить, и
поэтому жизнь без ферментов невозможна.
Ферменты - строение, механизм действия, свойства, регуляция
4
5. Ферменты - биокатализаторы
Рибозимы – рибонуклеиновые кислоты,Проявляющие свойства катализаторов.
За открытие каталитических свойств РНК
Т. Чеку и С. Ольтману в 2989 году присуждена
Нобелевская премия по химии.
Ферменты - строение, механизм действия, свойства, регуляция
5
6. Ферменты - биокатализаторы
Сходство ферментов с небиологическими катализаторамизаключается в том, что ферменты:
1. катализируют только энергетически
возможные реакции, т.е. те реакции
которые могут протекать и без них;
2. не изменяют направление реакции;
3. не сдвигают равновесие обратимой
реакции, а лишь ускоряют его
наступление;
4. не расходуются в процессе реакции и
выходят из реакции в первоначальном
виде.
Ферменты - строение, механизм действия, свойства
6
7. Ферменты - биокатализаторы
Oтличия ферментов от небиологических катализаторов:1. скорость ферментативных реакций выше, чем реакций,
катализируемых
небелковыми
катализаторами
(эффективность действия ферментов).
2. ферменты обладают высокой специфичностью действия;
3. ферменты катализируют реакции в очень мягких
условиях (обычное давление, нейтральная рН, невысокая t);
4. активность ферментов в клетках строго регулируется как
на генетическом уровне, так и посредством определённых
низкомолекулярных соединений (субстраты и продукты
реакций, катализируемых этими же ферментами);
5. скорость ферментативной реакции прямо
пропорциональна количеству фермента.
Ферменты - строение, механизм действия, свойства
7
8. Ферменты - биокатализаторы
Высокая каталитическая активностьферментов
Фермент
Уреаза
Скорость
Скорость
(vк)/(vнк)
некатализируемой катализируем
реакции (vнк)
ой реакции (vк)
3*10-10
3*104
1*1014
Ферменты - строение, механизм действия, свойства, регуляция
8
9. Структурная организация ферментов
Молекулярная масса ферментовФермент
Молекулярная масса
Рибонуклеаза
13 700
Трипсин
23 000
Пепсин
32 000
Гексокиназа
Щелочная фосфатаза
45 000
80 000
Лактатдегидрогеназа
140 000
Каталаза
250 000
глутаматдегидрогеназа
336 000
Уреаза
480 000
Чаще всего встречаются ферменты с мол. массой 20 – 60 тысяч,
более крупные обычно состоят из субъединиц одинаковых или
различных. Субъединица может состоять из двух и более
полипептидных цепей, соединенных дисульфидными связями.
Ферменты - строение, механизм действия, свойства, регуляция
9
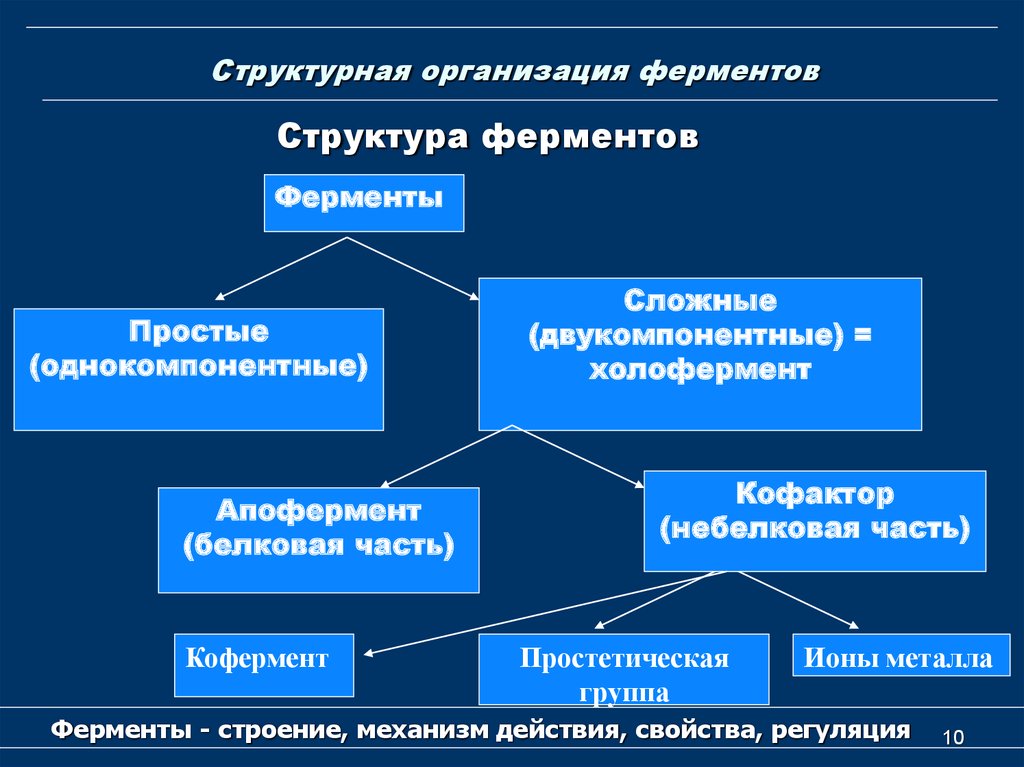
10. Структурная организация ферментов
Структура ферментовФерменты
Простые
(однокомпонентные)
Апофермент
(белковая часть)
Кофермент
Сложные
(двукомпонентные) =
холофермент
Кофактор
(небелковая часть)
Простетическая
группа
Ионы металла
Ферменты - строение, механизм действия, свойства, регуляция
10
11. Структурная организация ферментов
КофакторыНеорганические молекулы
(например, ионы металлов)
Органические молекулы
(например, NAD+, АТР)
Кофакторы
Коферменты способны
диссоциировать от
фермента
Простетические группы
связаны с ферментом
ковалентно
Ферменты - строение, механизм действия, свойства, регуляция
11
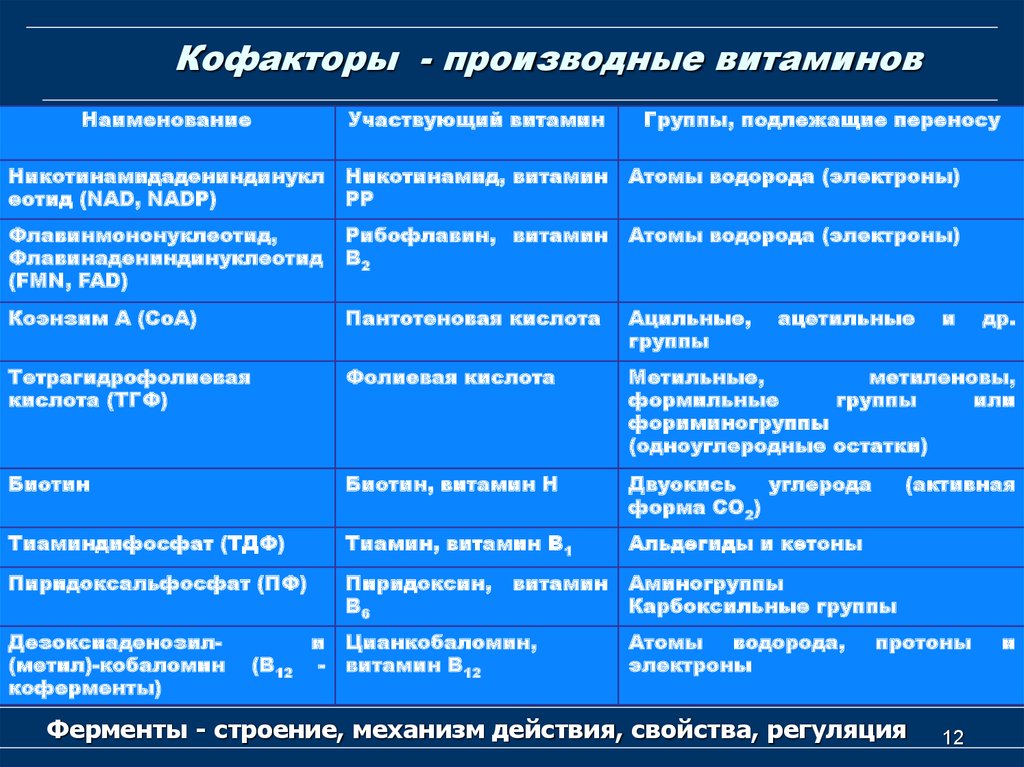
12. Кофакторы - производные витаминов
НаименованиеУчаствующий витамин
Никотинамидадениндинукл
еотид (NAD, NADР)
Никотинамид, витамин
РР
Атомы водорода (электроны)
Флавинмононуклеотид,
Флавинадениндинуклеотид
(FMN, FAD)
Рибофлавин, витамин
В2
Атомы водорода (электроны)
Коэнзим А (СоА)
Пантотеновая кислота
Ацильные,
группы
Тетрагидрофолиевая
кислота (ТГФ)
Фолиевая кислота
Метильные,
метиленовы,
формильные
группы
или
фориминогруппы
(одноуглеродные остатки)
Биотин
Биотин, витамин Н
Двуокись
углерода
форма СО2)
Тиаминдифосфат (ТДФ)
Тиамин, витамин В1
Альдегиды и кетоны
Пиридоксальфосфат (ПФ)
Пиридоксин,
В6
Аминогруппы
Карбоксильные группы
Дезоксиаденозил(метил)-кобаломин
коферменты)
(В12
и
-
витамин
Цианкобаломин,
витамин В12
Группы, подлежащие переносу
ацетильные
Атомы
водорода,
электроны
и
др.
(активная
протоны
Ферменты - строение, механизм действия, свойства, регуляция
12
и
13. Кофакторы - производные витаминов
Ферменты - строение, механизм действия, свойства, регуляция13
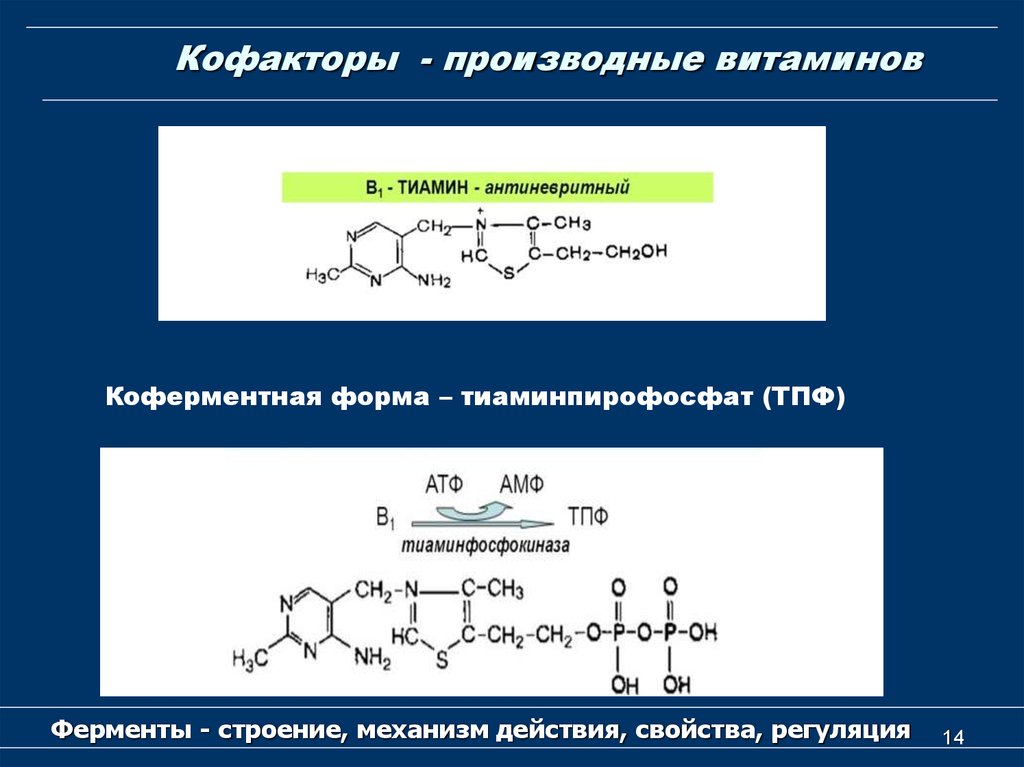
14. Кофакторы - производные витаминов
Коферментная форма – тиаминпирофосфат (ТПФ)Ферменты - строение, механизм действия, свойства, регуляция
14
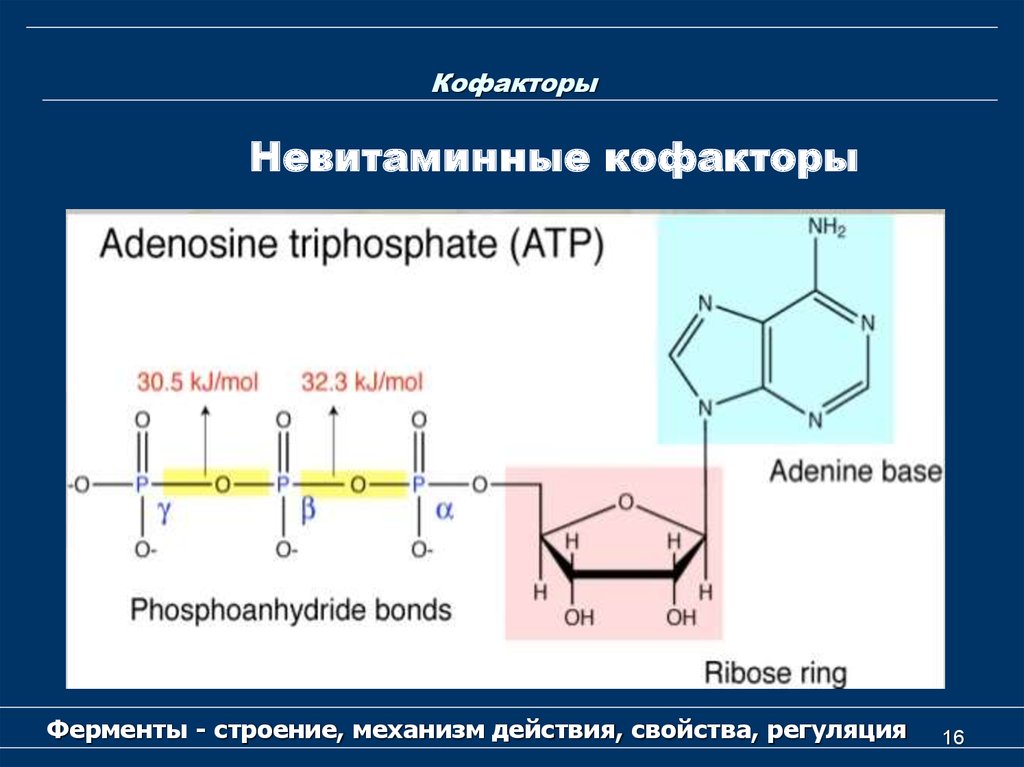
15. Кофакторы
Невитаминные кофакторыК невитаминным кофакторам относятся
следующие соединения:
- Восстановленный глутатион (GSH),
- АТP,
- липоевая кислота,
- производные нуклеозидов (уридинфосфат,
цитидинфосфат,
- порфиринсодержащие вещества.
Ферменты - строение, механизм действия, свойства, регуляция
15
16. Кофакторы
Невитаминные кофакторыФерменты - строение, механизм действия, свойства, регуляция
16
17. Кофакторы
Невитаминные кофакторыФерменты - строение, механизм действия, свойства, регуляция
17
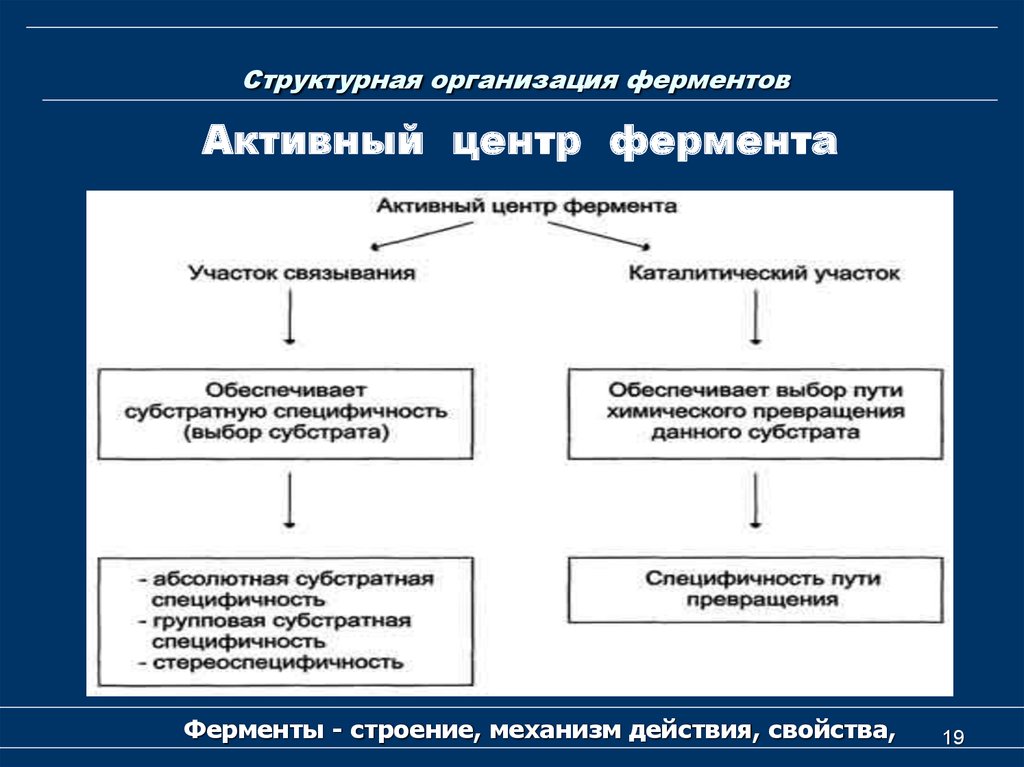
18. Структурная организация ферментов
Активный центр ферментаАктивный центр - участок молекулы фермента, который
предназначен для специфического связывания и
каталитического превращения субстрата.
Структура активного центра фермента складывается
из двух составляющих:
1) сорбционного участка (подцентра, сайта),
ответственного
за
связывание,
фиксацию
и
ориентацию субстратов; свойства этого центра
определяют специфичность действия фермента;
2) каталитического участка (подцентра, сайта),
осуществляющего химическое превращение молекул
субстрата.
Ферменты - строение, механизм действия, свойства,
18
19. Структурная организация ферментов
Активный центр ферментаФерменты - строение, механизм действия, свойства,
19
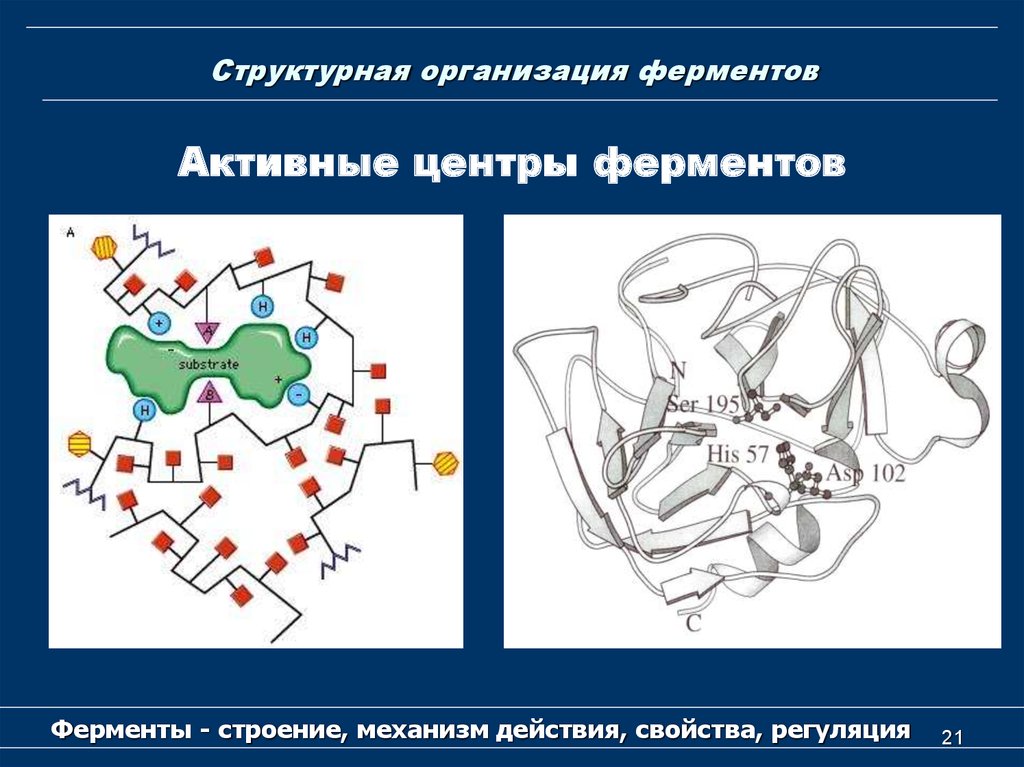
20. Структурная организация ферментов
Активный центр у простых ферментовобразует уникальная комбинация
аминокислотных остатков.
У сложных ферментов в состав активного
центра наряду с аминокислотными остатками
входят также кофактор.
Активный центр возникает в тот момент, когда
белковая молекула приобретает присущую ей
третичную структуру.
Ферменты - строение, механизм действия, свойства, регуляция
20
21. Структурная организация ферментов
Активные центры ферментовФерменты - строение, механизм действия, свойства, регуляция
21
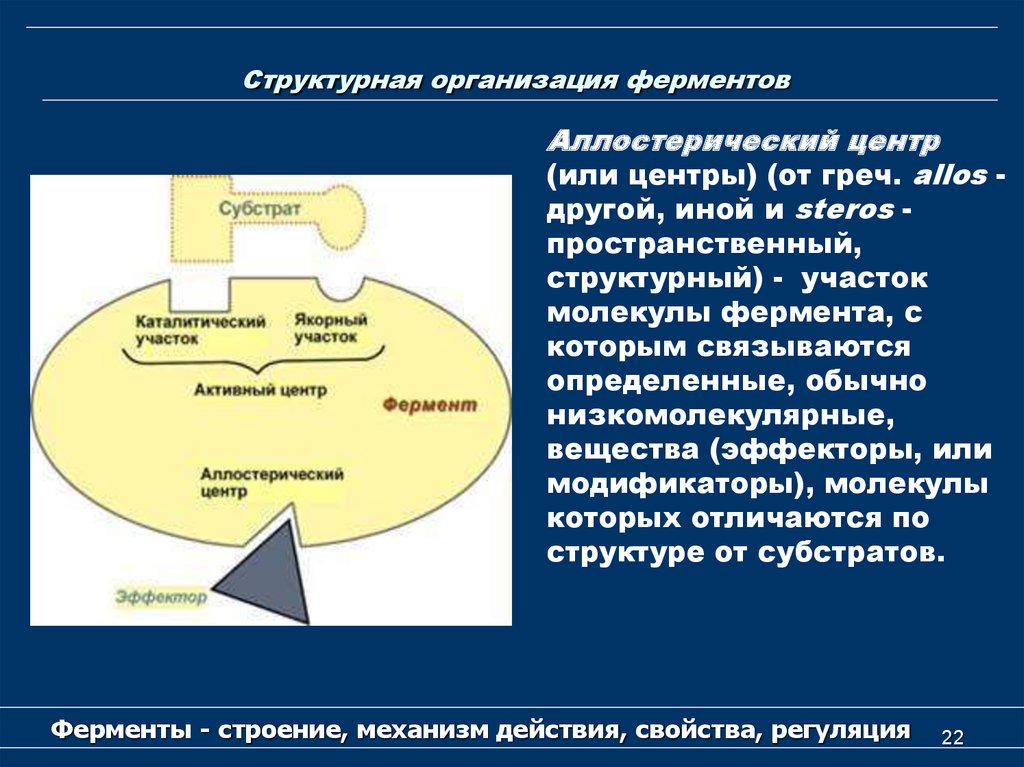
22. Структурная организация ферментов
Аллостерический центр(или центры) (от греч. аllos другой, иной и steros пространственный,
структурный) - участок
молекулы фермента, с
которым связываются
определенные, обычно
низкомолекулярные,
вещества (эффекторы, или
модификаторы), молекулы
которых отличаются по
структуре от субстратов.
Ферменты - строение, механизм действия, свойства, регуляция
22
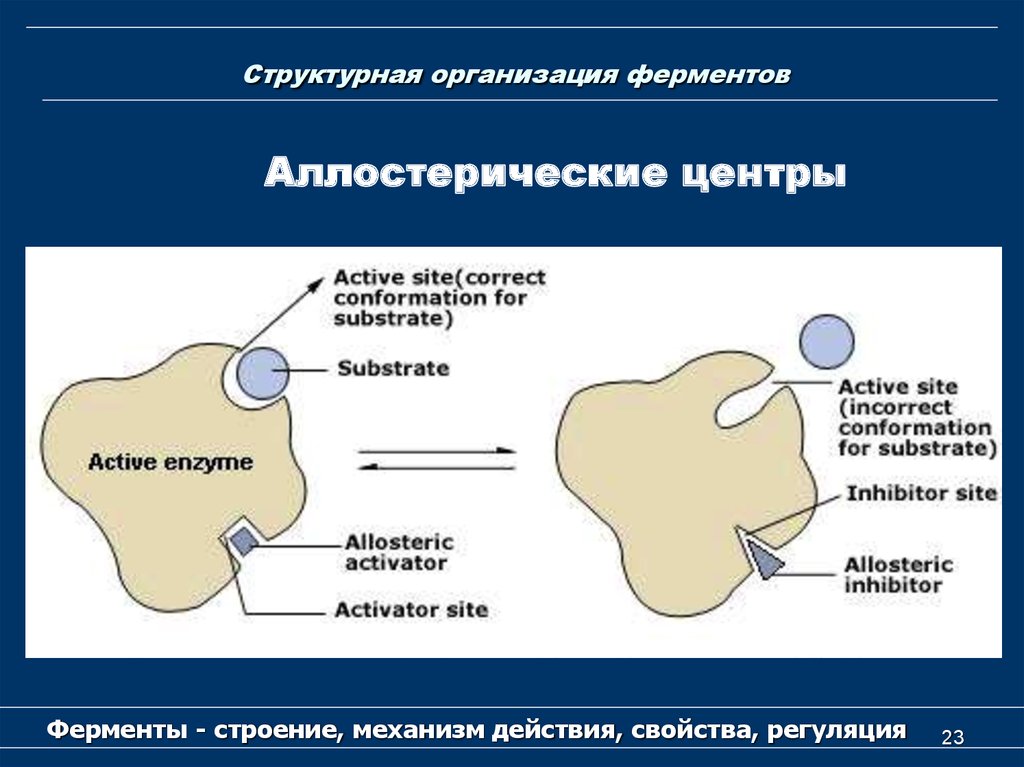
23. Структурная организация ферментов
Аллостерические центрыФерменты - строение, механизм действия, свойства, регуляция
23
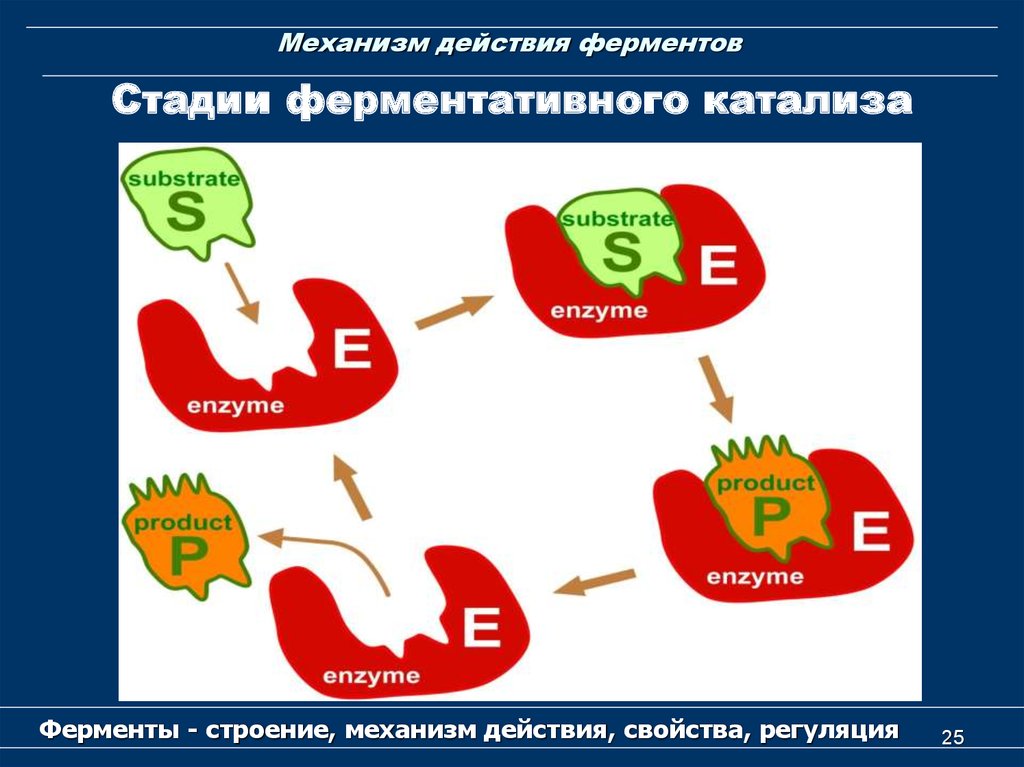
24. Механизм действия ферментов
Стадии ферментативного катализаE
S
ES
ES
*
* *
EP
E
P
ES
1
Образование
2
Преобразование
3
Отделение
I. Диффузия субстрата к ферменту и стерическое
связывание его с активным центром фермента, т.е.
образование фермент-субстратного комплекса (ES).
II. Преобразование первичного комплекса в один
или несколько активированных фермент-субстратных
комплексов (ES*, ES**…);
III. Отделение продуктов (Р) реакции от активного
центра и диффузия его в окружающую среду.
Ферменты - строение, механизм действия, свойства, регуляция
24
25. Механизм действия ферментов
Стадии ферментативного катализаФерменты - строение, механизм действия, свойства, регуляция
25
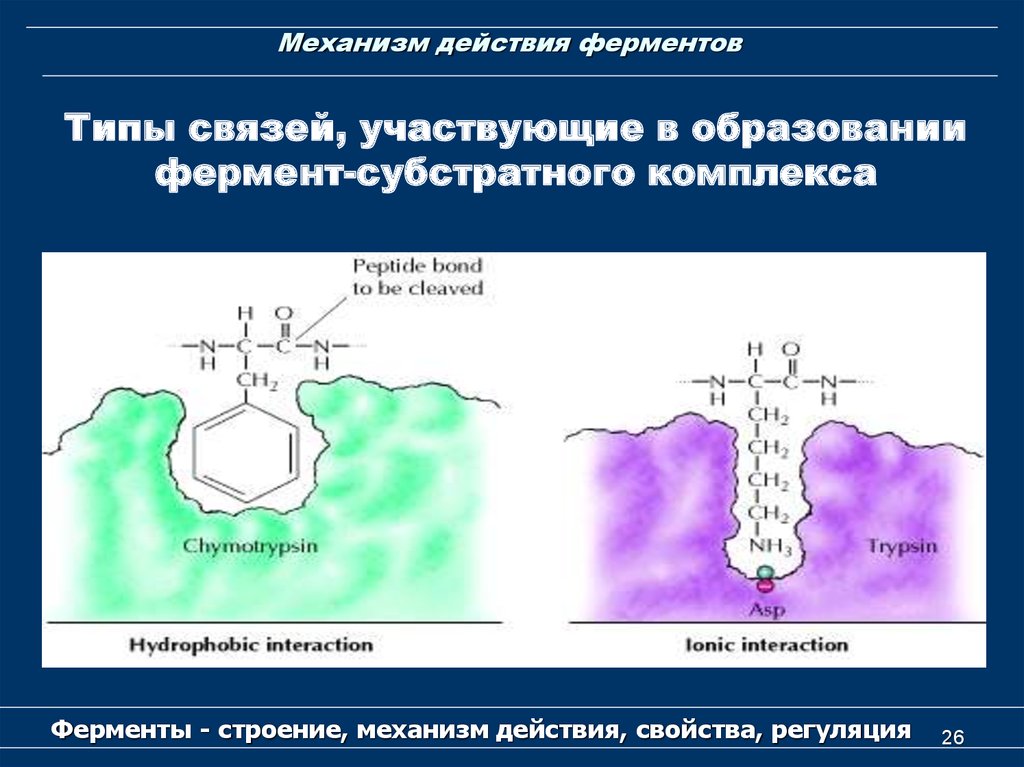
26. Механизм действия ферментов
Типы связей, участвующие в образованиифермент-субстратного комплекса
Ферменты - строение, механизм действия, свойства, регуляция
26
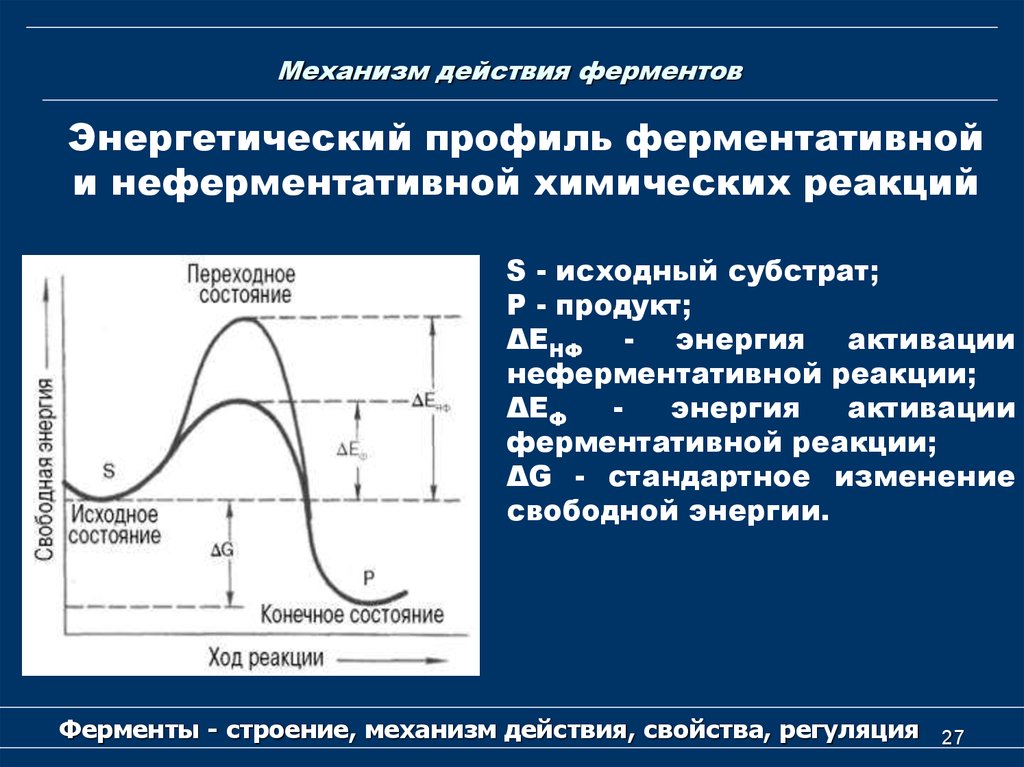
27. Механизм действия ферментов
Энергетический профиль ферментативнойи неферментативной химических реакций
S - исходный субстрат;
Р - продукт;
ΔЕНФ - энергия активации
неферментативной реакции;
ΔЕФ
энергия
активации
ферментативной реакции;
ΔG - стандартное изменение
свободной энергии.
Ферменты - строение, механизм действия, свойства, регуляция
27
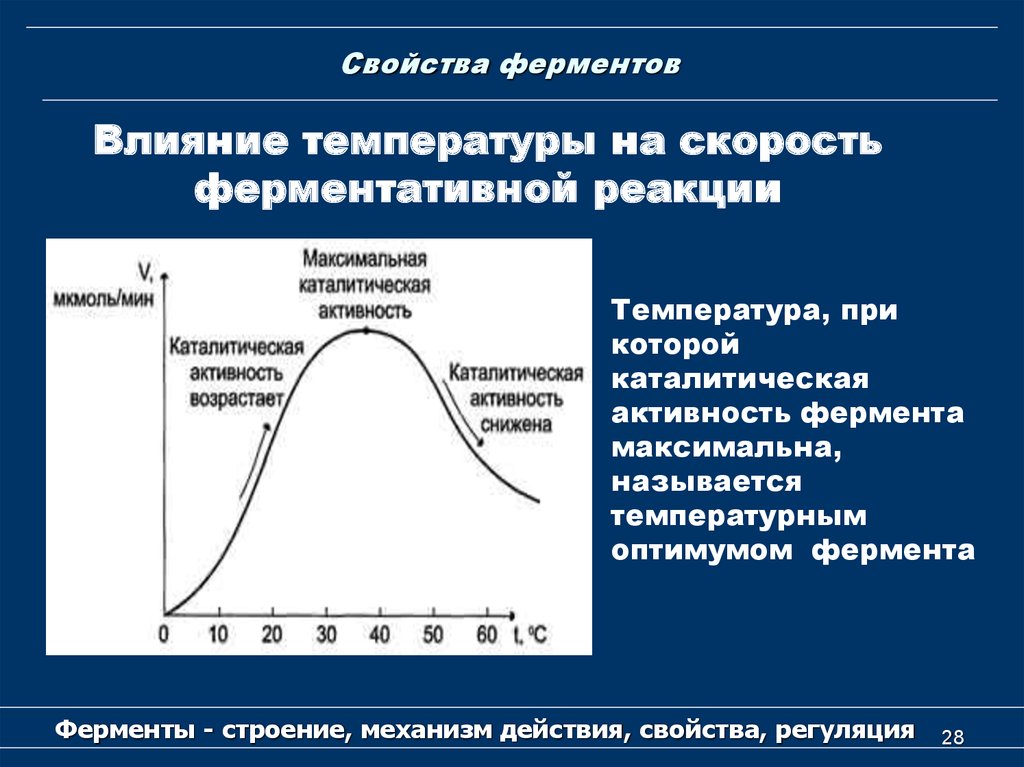
28. Свойства ферментов
Влияние температуры на скоростьферментативной реакции
Температура, при
которой
каталитическая
активность фермента
максимальна,
называется
температурным
оптимумом фермента
Ферменты - строение, механизм действия, свойства, регуляция
28
29. Свойства ферментов
Влияние рН на скоростьферментативной реакции
Ферменты - строение, механизм действия, свойства, регуляция
29
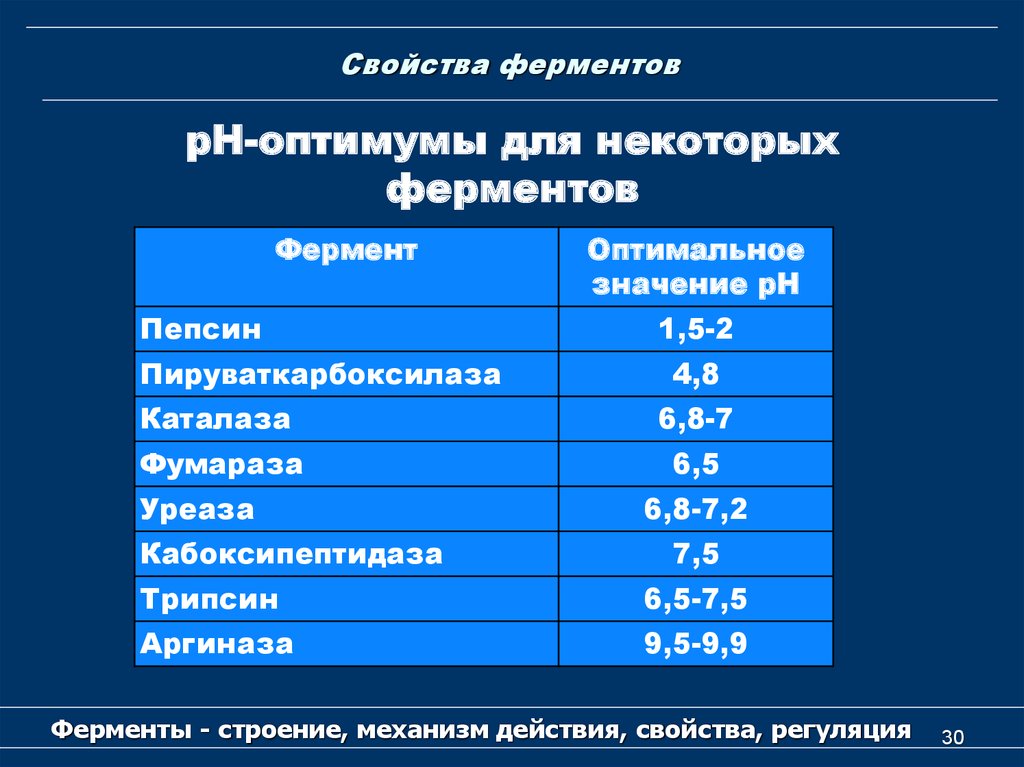
30. Свойства ферментов
рН-оптимумы для некоторыхферментов
Фермент
Пепсин
Пируваткарбоксилаза
Оптимальное
значение рН
1,5-2
4,8
Каталаза
6,8-7
Фумараза
6,5
Уреаза
Кабоксипептидаза
6,8-7,2
7,5
Трипсин
6,5-7,5
Аргиназа
9,5-9,9
Ферменты - строение, механизм действия, свойства, регуляция
30
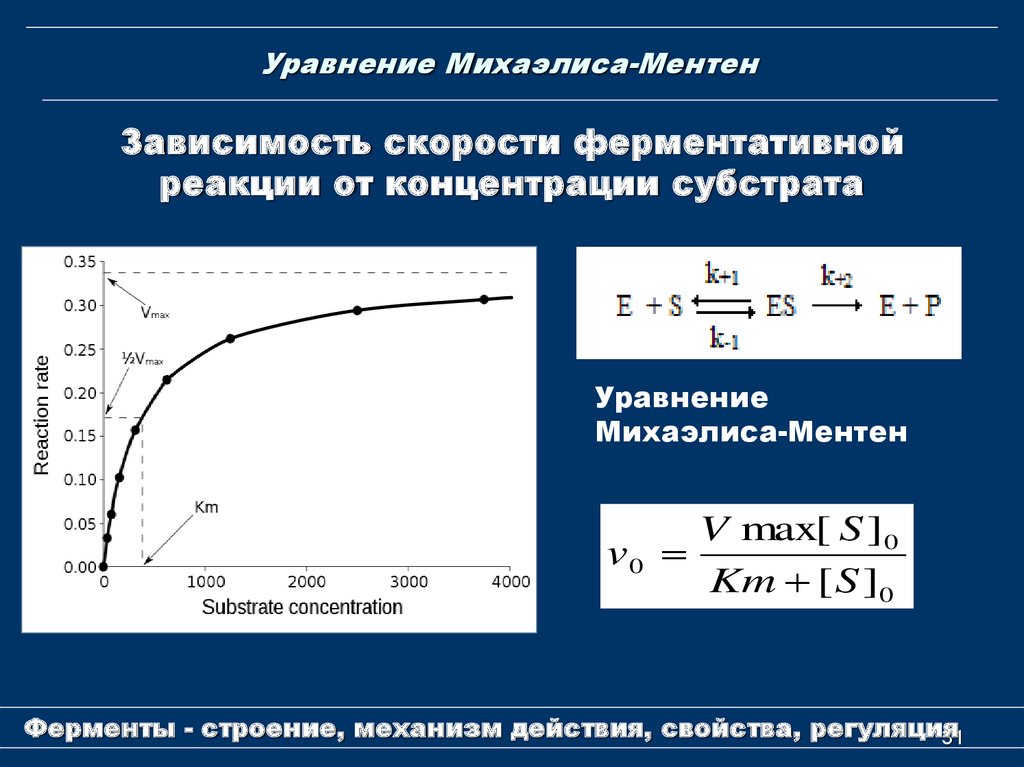
31. Уравнение Михаэлиса-Ментен
Зависимость скорости ферментативнойреакции от концентрации субстрата
Уравнение
Михаэлиса-Ментен
V max[ S ]0
v0
Km [ S ]0
Ферменты - строение, механизм действия, свойства, регуляция
31
32. Уравнение Михаэлиса-Ментен
Ученые – основоположники ферментативнойкинетики
Браун А., 1900
Анри В., 1902
Михаэлис Л. и
Ментен М., 1913
Бриггс Дж. и
Холден Д., 1925
Ферменты - строение, механизм действия, свойства, регуляция
32
33.
Уравнение Михаэлиса-МентенКм и Vmax - важнейшие
характеристики ферментов
Км - константа Михаэлиса - это концентрации
субстрата, при которой скорость ферментативной
реакции равна половине максимальной.
Км – мера сродства фермента к субстрату. Чем
меньше Км, тем больше сродство фермента к
субстрату, тем выше скорость реакции и
наоборот, чем больше Кm, тем меньше сродство
фермента к субстрату, тем медленнее идет
реакция.
Ферменты - строение, механизм действия, свойства
33
34. Уравнение Михаэлиса-Ментен
Км и Vmax - важнейшиехарактеристики ферментов
Для большинства ферментативных реакций Км
колеблется в пределах 10-2 – 10-5 М.
Vmax - максимальную скорость образования
продукта при данной концентрации фермента
и в условиях избытка субстрата. Vmax
наблюдается, когда все активные центры
заняты субстратом.
Ферменты - строение, механизм действия, свойства, регуляция
34
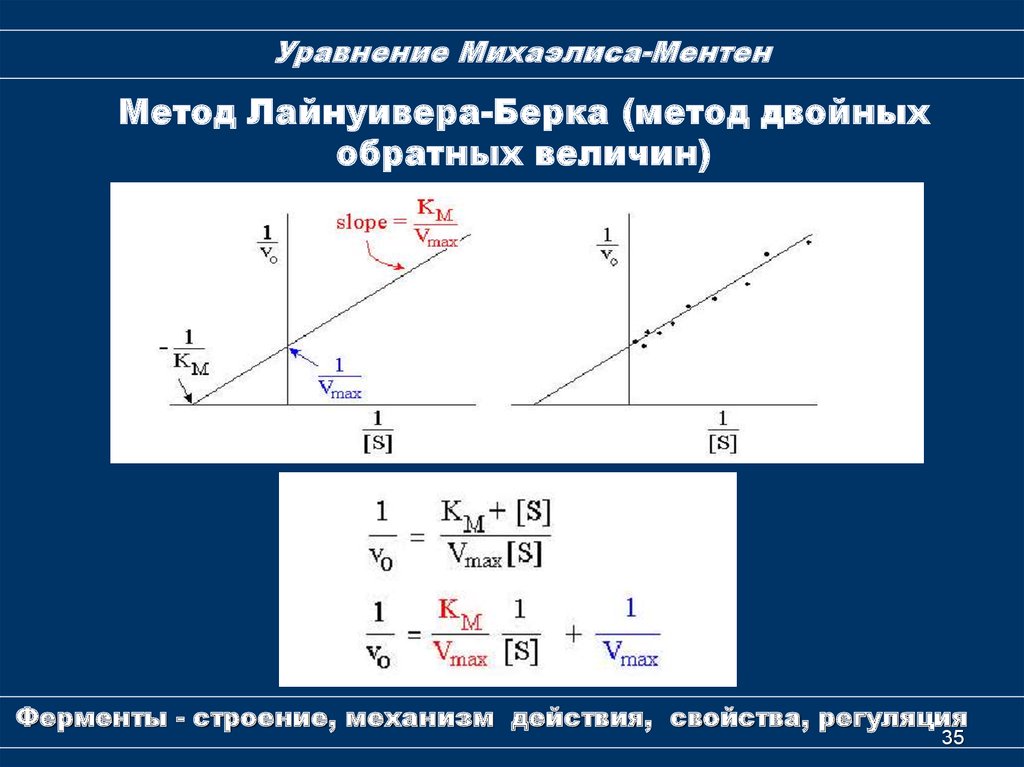
35.
Уравнение Михаэлиса-МентенМетод Лайнуивера-Берка (метод двойных
обратных величин)
Ферменты - строение, механизм действия, свойства, регуляция
35
36. Единицы ферментов
Определение количественногосодержания ферментов
- О количестве ферментов судят по скорости
катализируемой им реакции в стандартных условиях
измерения.
- Скорость ферментативной реакции определяют по
скорости убыли субстрата, или по скорости образования
продукта реакции в единицу времени.
- За единицу активности любого фермента (Е или U)
принимается то количество его, которое в оптимальных
условиях катализирует превращение 1 микромоля
субстрата или образование 1 микромоля продукта в
минуту (мкмоль/мин) .
- 1 катал есть каталитическая активность, способная
осуществлять реакцию со скоростью, равной 1 молю в 1
с (1 моль/с).
Ферменты - строение, механизм действия, свойства, регуляция
36
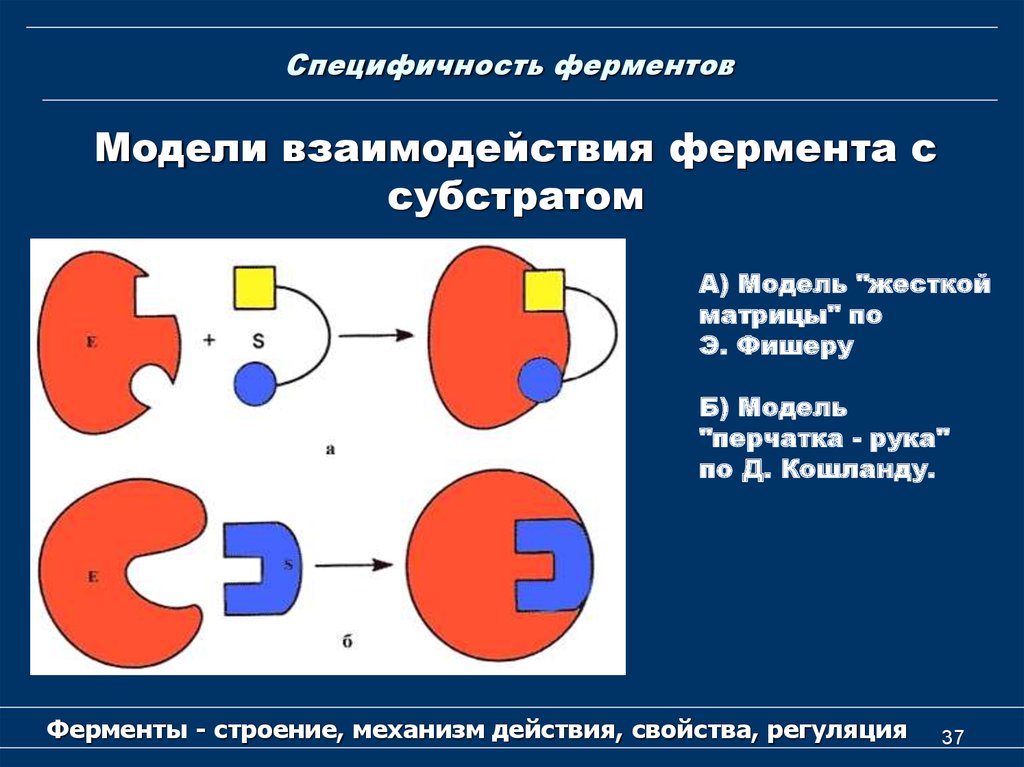
37. Специфичность ферментов
Модели взаимодействия фермента ссубстратом
А) Модель "жесткой
матрицы" по
Э. Фишеру
Б) Модель
"перчатка - рука"
по Д. Кошланду.
Ферменты - строение, механизм действия, свойства, регуляция
37
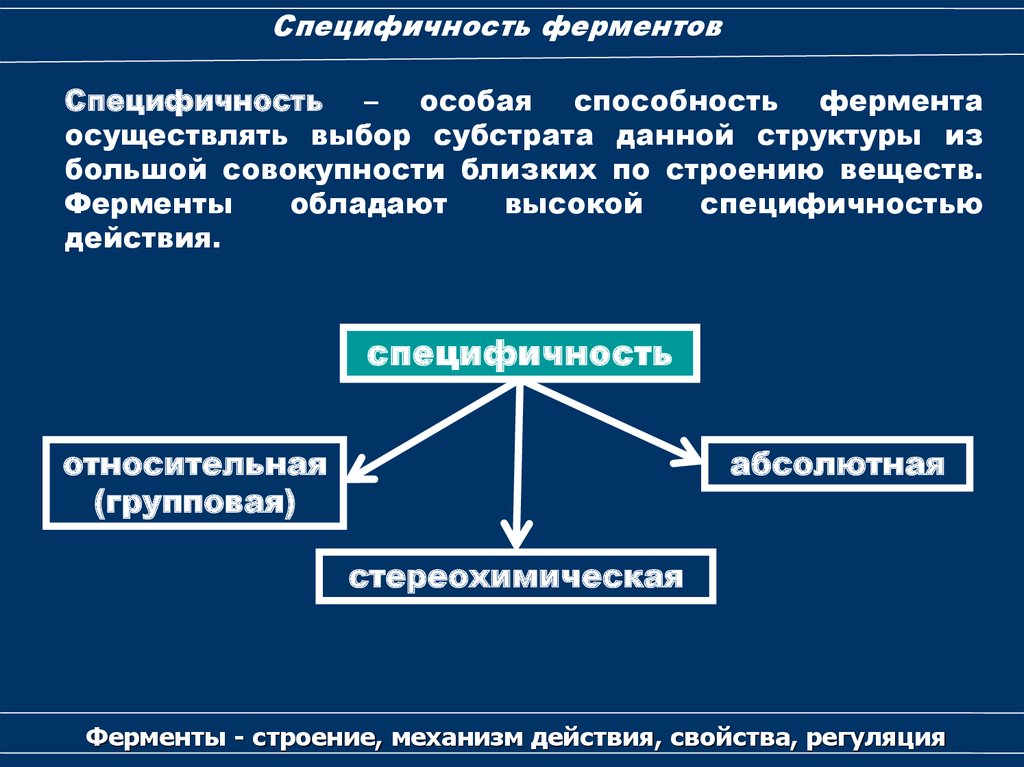
38.
Специфичность ферментовСпецифичность – особая способность фермента
осуществлять выбор субстрата данной структуры из
большой совокупности близких по строению веществ.
Ферменты
обладают
высокой
специфичностью
действия.
специфичность
относительная
(групповая)
абсолютная
стереохимическая
Ферменты - строение, механизм действия, свойства, регуляция
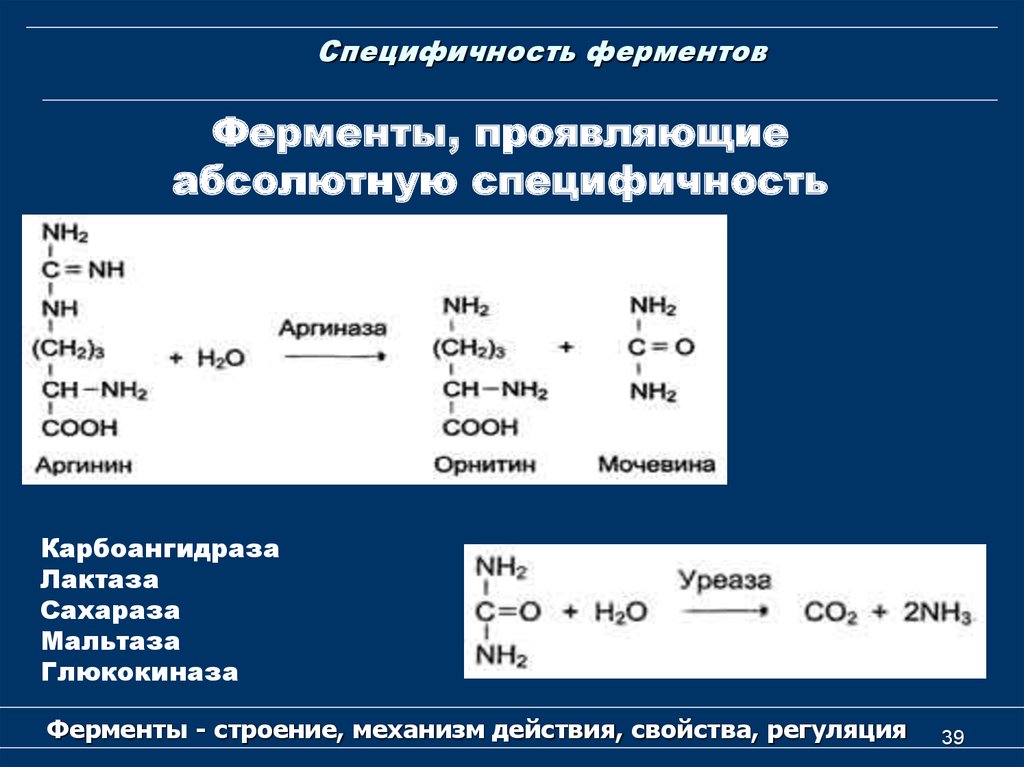
39. Специфичность ферментов
Ферменты, проявляющиеабсолютную специфичность
Карбоангидраза
Лактаза
Сахараза
Мальтаза
Глюкокиназа
Ферменты - строение, механизм действия, свойства, регуляция
39
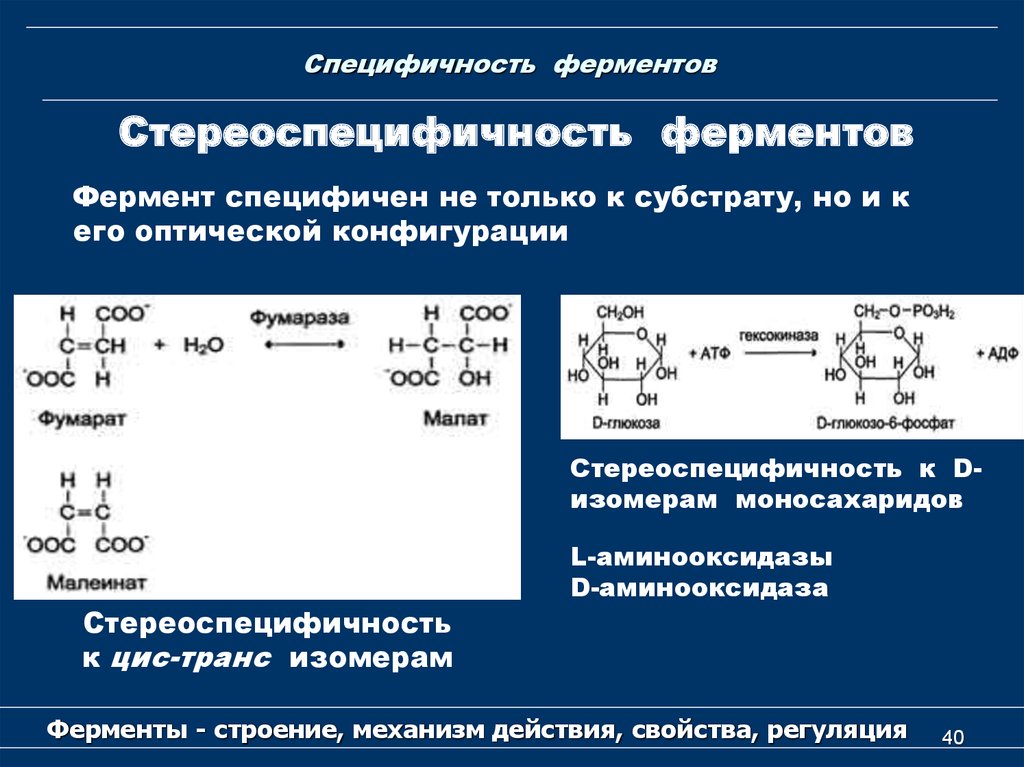
40. Специфичность ферментов
Стереоспецифичность ферментовФермент специфичен не только к субстрату, но и к
его оптической конфигурации
Стереоспецифичность к Dизомерам моносахаридов
Стереоспецифичность
к цис-транс изомерам
L-аминооксидазы
D-аминооксидаза
Ферменты - строение, механизм действия, свойства, регуляция
40
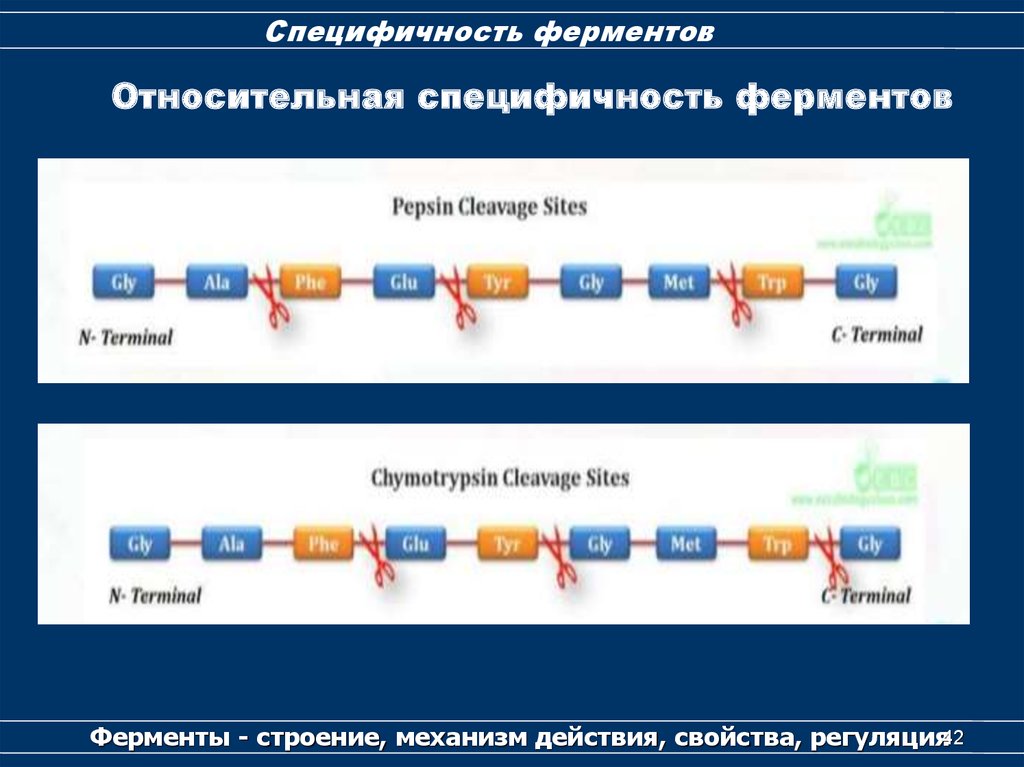
41. Специфичность ферментов
Относительная специфичностьферментов
Ферменты - строение, механизм действия, свойства, регуляция
41
42.
Специфичность ферментовОтносительная специфичность ферментов
Ферменты - строение, механизм действия, свойства, регуляция42
43. Активаторы и ингибиторы ферментов
Активаторы ферментовАктиваторами называют вещества, увеличивающие
каталитическую активность ферментов. Среди
активаторов встречаются самые разнообразные
вещества.
Особенно часто роль активаторов ферментов
выполняют ионы металлов: калия, кальция, магния,
цинка, меди, железа, марганца, кобальта, а из
анионов - хлора. Для проявления максимальной
активности ферментов требуется определенная
концентрация ионов-активаторов в среде.
Ферменты - строение, механизм действия, свойства, регуляция
43
44. Активаторы ферментов
Примеры активаторов- Соляная кислота активирует действие пепсина
желудочного сока;
- Желчные кислоты повышают активность
панкреатической липазы;
- Соединения, содержащими свободные SН-группы
(глутатион, цистеин) активируют некоторые тканевые
ферменты (оксидоредуктазы, катепсины, аргиназу
и др);
- Ионы металлов особенно часто выступают
активаторами. Около четверти всех известных
ферментов для проявления полной каталитической
активности нуждаются в присутствии металлов.
Ферменты - строение, механизм действия, свойства, регуляция
44
45. Активаторы ферментов
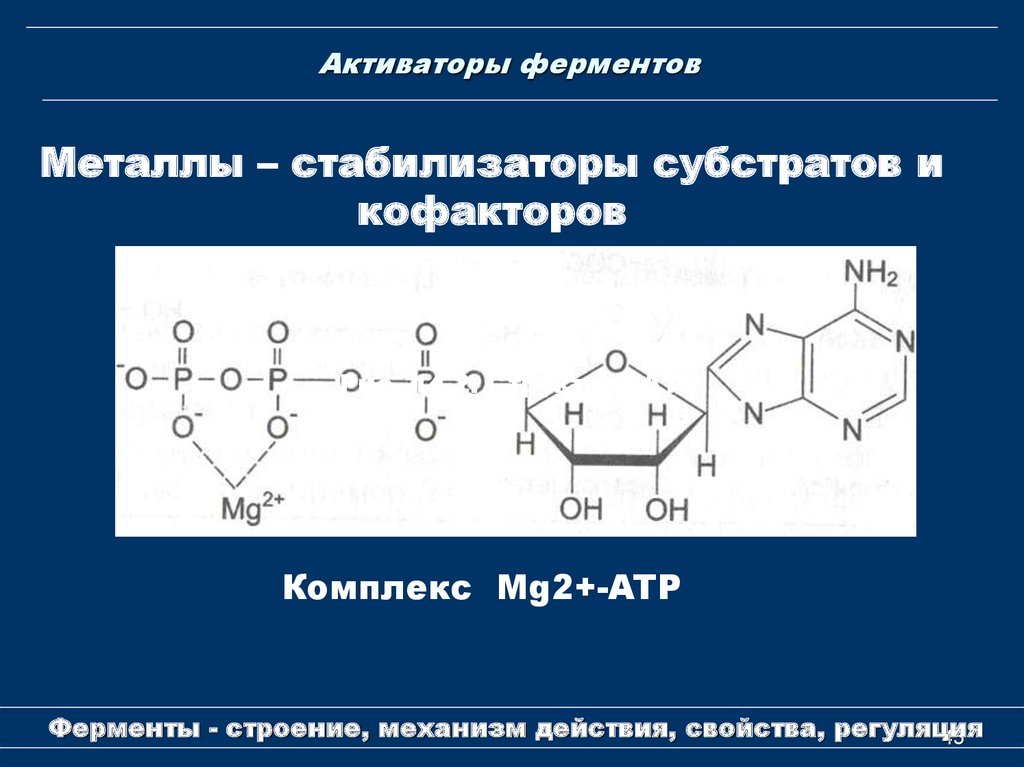
Металлы – стабилизаторы субстратов икофакторов
Рис. 14.2. Структура АТР
Комплекс Мg2+-ATP
Ферменты - строение, механизм действия, свойства, регуляция
45
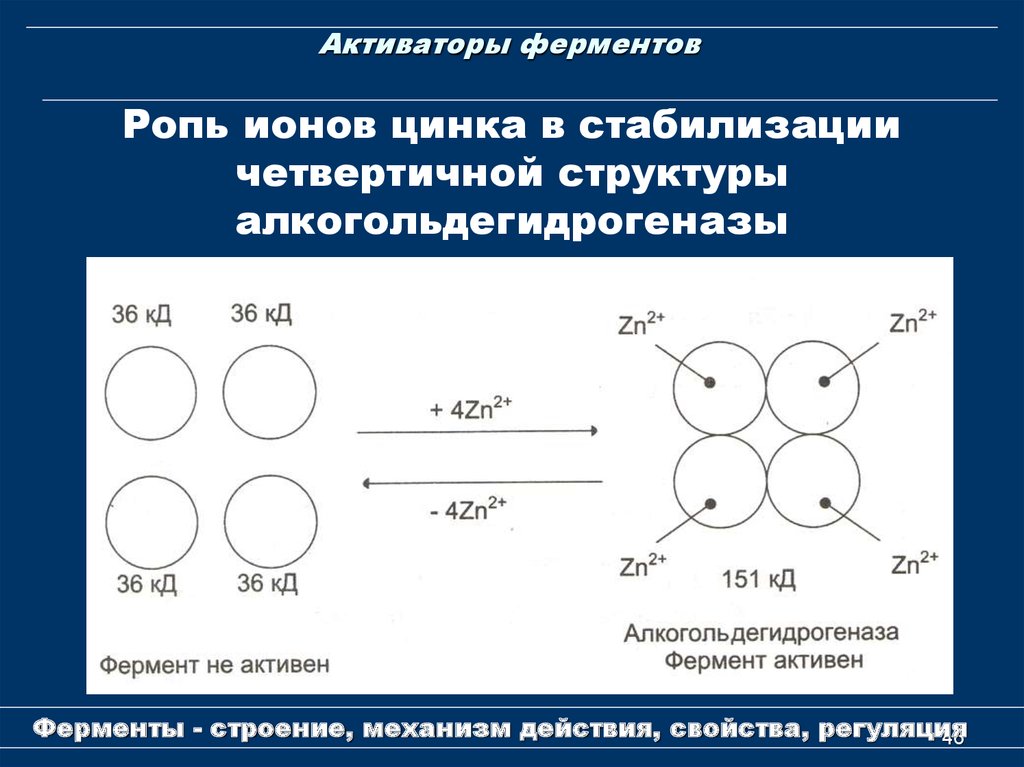
46. Активаторы ферментов
Ропь ионов цинка в стабилизациичетвертичной структуры
алкогольдегидрогеназы
Ферменты - строение, механизм действия, свойства, регуляция
46
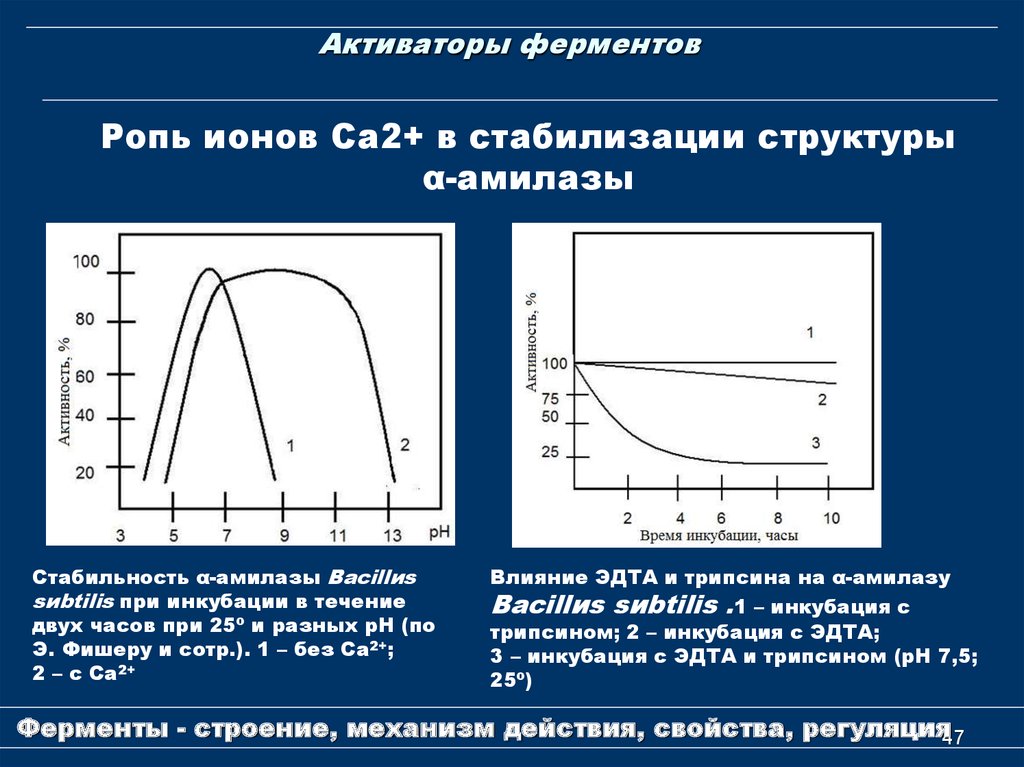
47. Активаторы ферментов
Ропь ионов Са2+ в стабилизации структурыα-амилазы
Стабильность α-амилазы Bacillиs
sиbtilis при инкубации в течение
двух часов при 25º и разных рН (по
Э. Фишеру и сотр.). 1 – без Cа2+;
2 – с Са2+
Влияние ЭДТА и трипсина на α-амилазу
Bacillиs sиbtilis .1 – инкубация с
трипсином; 2 – инкубация с ЭДТА;
3 – инкубация с ЭДТА и трипсином (рН 7,5;
25º)
Ферменты - строение, механизм действия, свойства, регуляция47
48. Ингибиторы ферментов
Ингибиторы ферментовИнгибиторы - вещества, вызывающие снижение
активности фермента.
Если ингибитор вызывает стойкие изменения
пространственной третичной структуры молекулы
фермента или модификацию функциональных групп
фермента, то такой тип ингибирования называется
необратимым.
Необратимое действие ингибитора в самом простом
случае может быть описано уравнением:
E + I → EI, где Е – фермент, I – ингибитор, EI – комплекс.
Ферменты - строение, механизм действия, свойства, регуляция
48
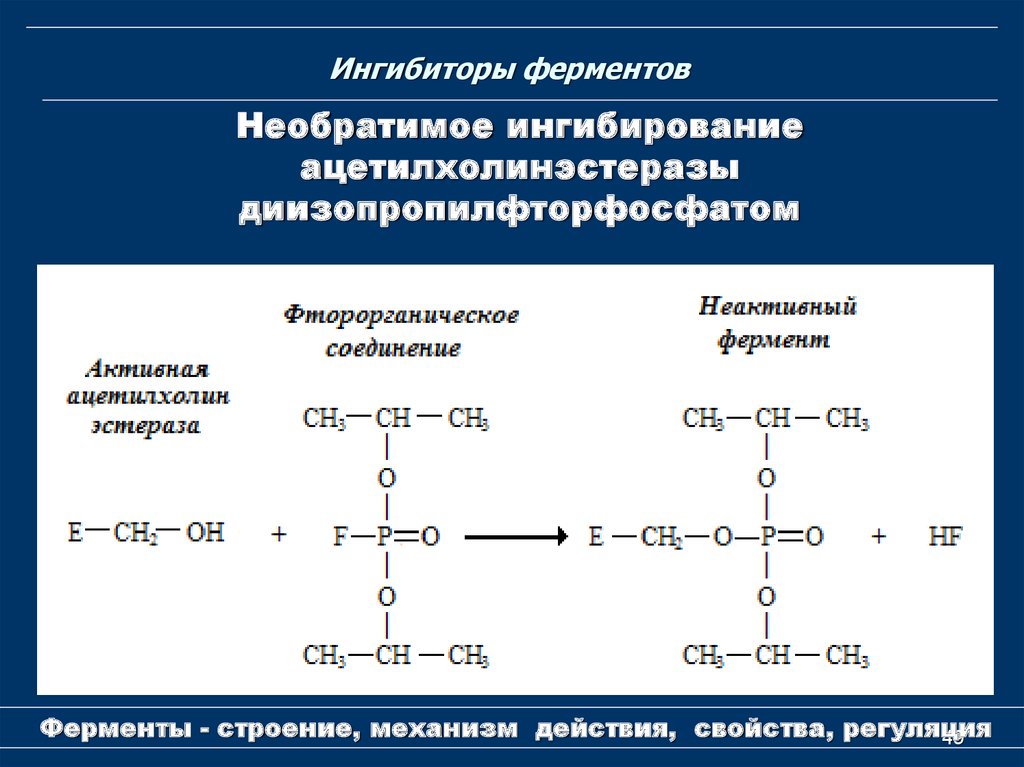
49. Ингибиторы ферментов
Необратимое ингибированиеацетилхолинэстеразы
диизопропилфторфосфатом
Ферменты - строение, механизм действия, свойства, регуляция
49
50. Ингибиторы ферментов
Обратимое ингибированиеВ случае обратимого действия ингибитор образует с
ферментом непрочный комплекс, способный
распадаться, в результате чего снова возникает
активный фермент.
Обратимое действие ингибитора может быть описано
уравнением:
E + I EI, где Е – фермент, I – ингибитор, EI –
комплекс.
Обратимое ингибирование делят на:
- Конкурентное
- Неконкурентное
Ферменты - строение, механизм действия, свойства, регуляция
50
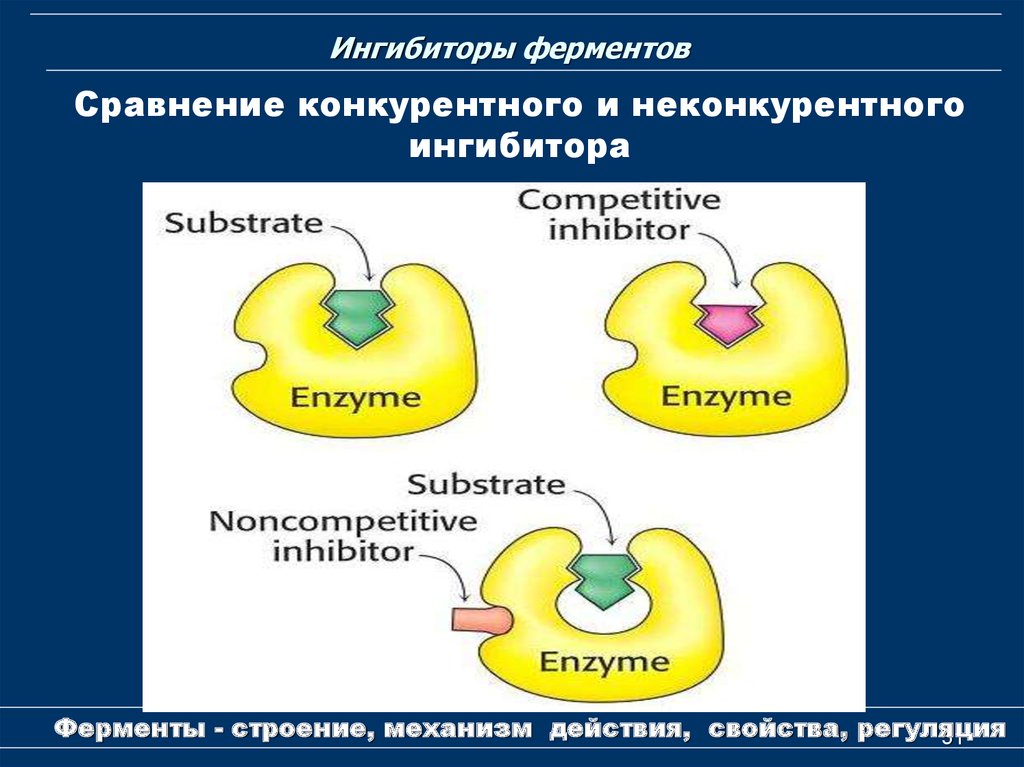
51. Ингибиторы ферментов
Сравнение конкурентного и неконкурентногоингибитора
Ферменты - строение, механизм действия, свойства, регуляция
51
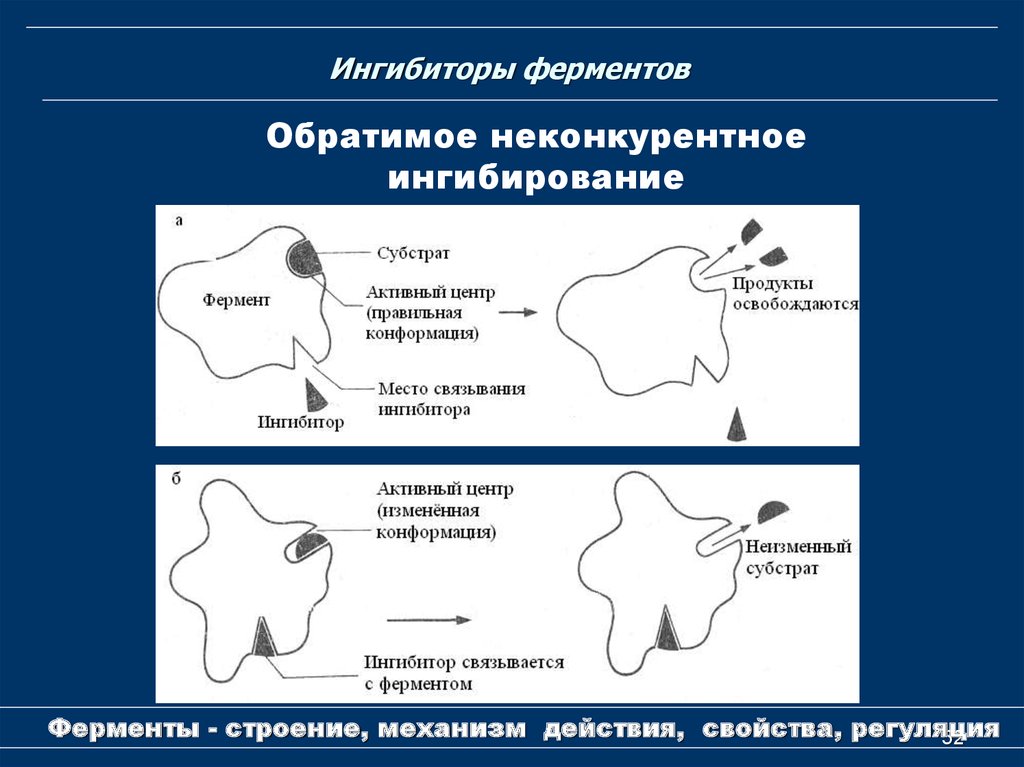
52. Ингибиторы ферментов
Обратимое неконкурентноеингибирование
Ферменты - строение, механизм действия, свойства, регуляция
52
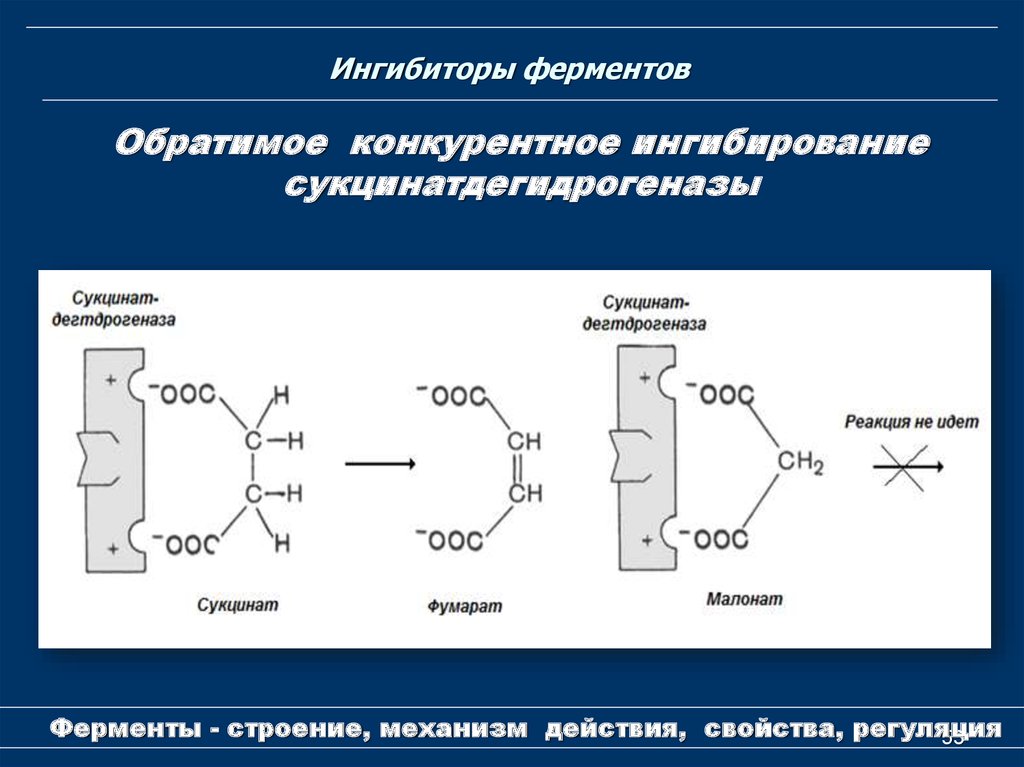
53. Ингибиторы ферментов
Обратимое конкурентное ингибированиесукцинатдегидрогеназы
Ферменты - строение, механизм действия, свойства, регуляция
53
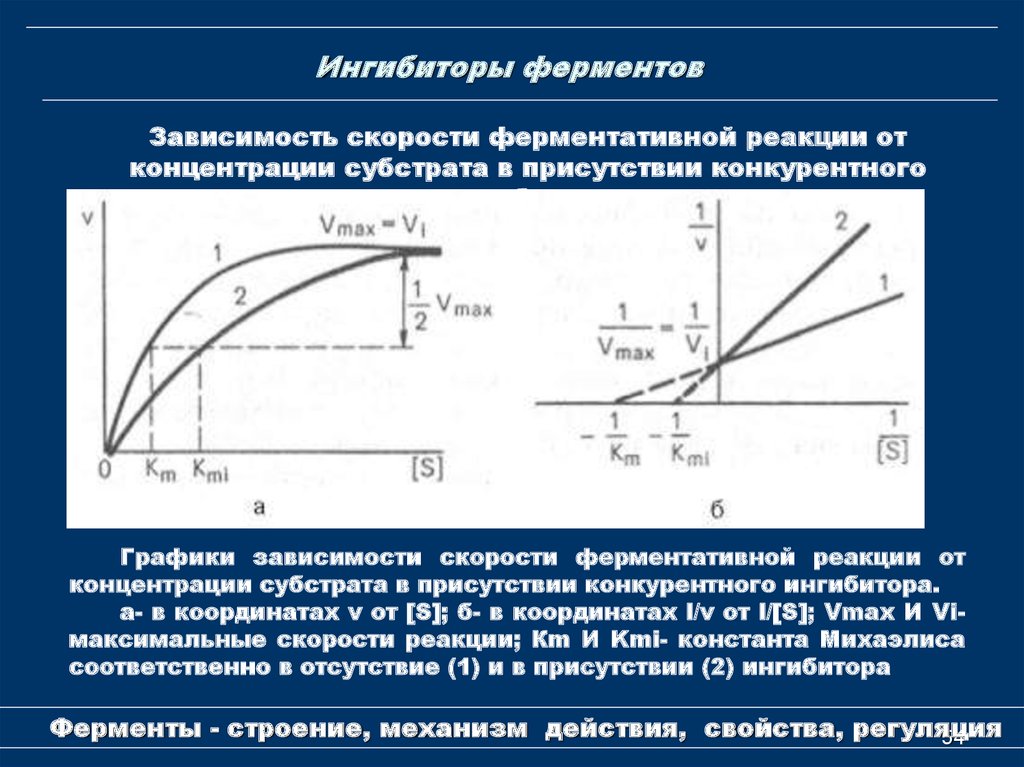
54. Ингибиторы ферментов
Зависимость скорости ферментативной реакции отконцентрации субстрата в присутствии конкурентного
ингибитора
Графики зависимости скорости ферментативной реакции от
концентрации субстрата в присутствии конкурентного ингибитора.
а- в координатах v от [S]; б- в координатах l/v от l/[S]; Vmах И Viмаксимальные скорости реакции; Кm И Kmi- константа Михаэлиса
соответственно в отсутствие (1) и в присутствии (2) ингибитора
Ферменты - строение, механизм действия, свойства, регуляция
54
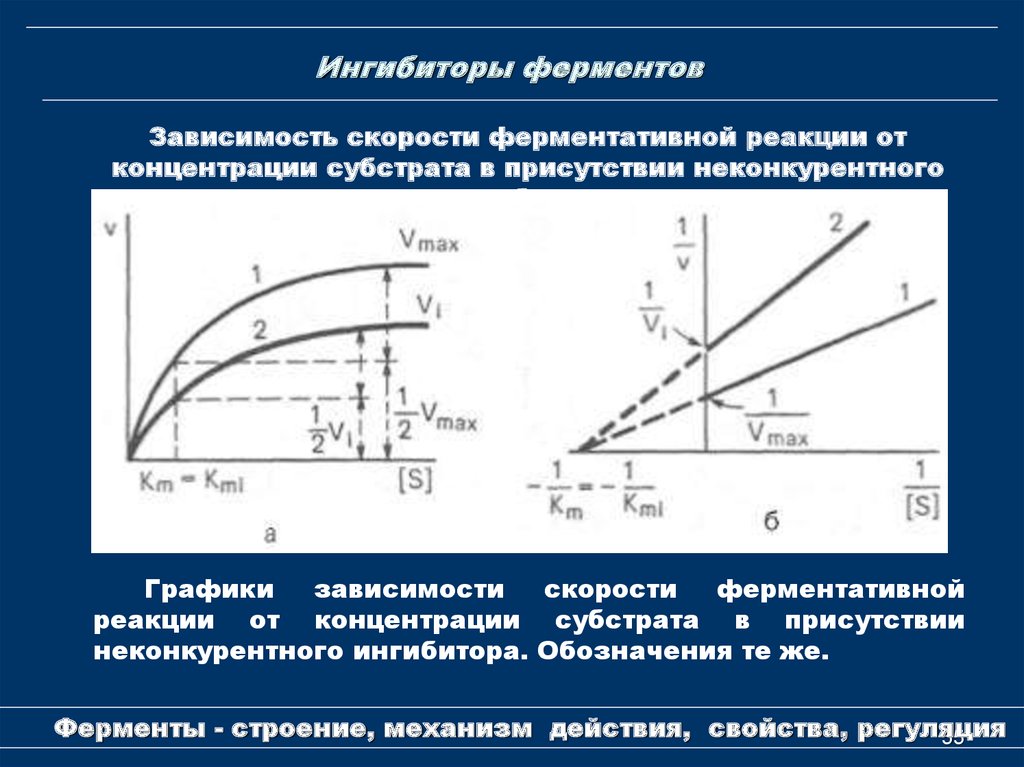
55. Ингибиторы ферментов
Зависимость скорости ферментативной реакции отконцентрации субстрата в присутствии неконкурентного
ингибитора
Графики
зависимости
скорости
ферментативной
реакции от концентрации субстрата в присутствии
неконкурентного ингибитора. Обозначения те же.
Ферменты - строение, механизм действия, свойства, регуляция
55
56. Регуляция активности ферментов
Регуляция активности ферментов1. Изменение количества ферментного белка –
индукция или репрессия синтеза ферментного
белка.
2. Изменение каталитической активности молекул
ферментов.
3. Доступность молекул субстрата и кофермента.
Чем выше концентрация исходного субстрата,
тем выше скорость реакции.
Ферменты - строение, механизм действия, свойства, регуляция
56
57. Регуляция активности ферментов
Изменение каталитической активности молекулферментов
Основные виды:
аллостерическая регуляция;
ковалентная (химическая) модификация;
частичный (ограниченный) протеолиз.
Ферменты - строение, механизм действия, свойства, регуляция
57
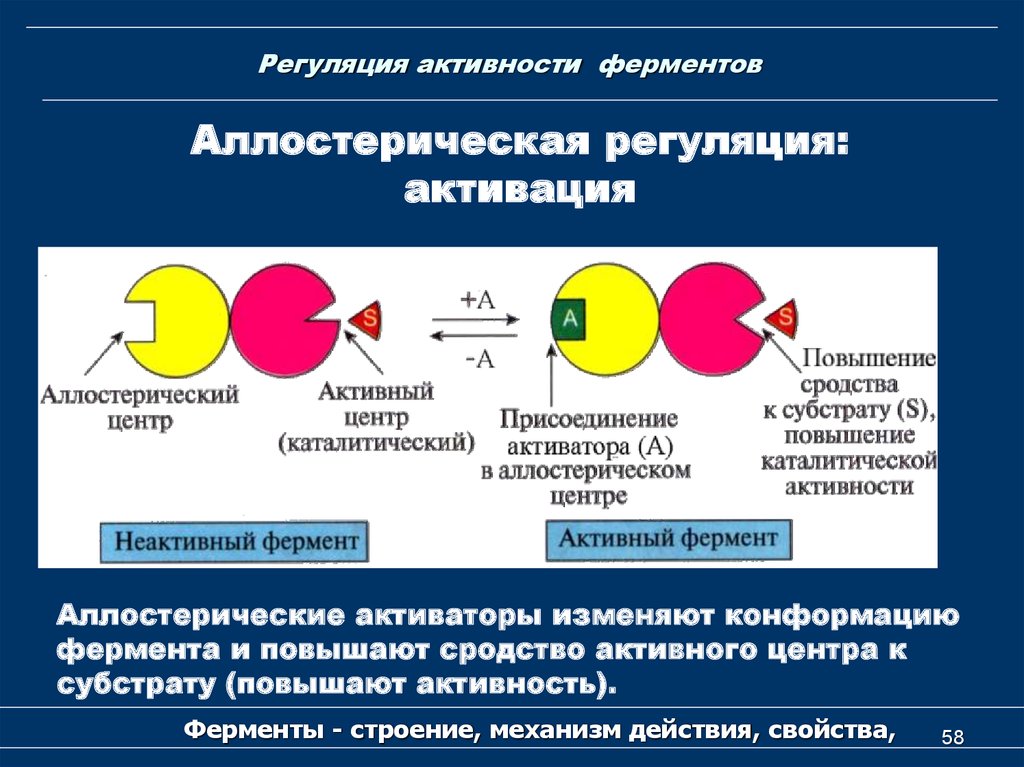
58. Регуляция активности ферментов
Аллостерическая регуляция:активация
Аллостерические активаторы изменяют конформацию
фермента и повышают сродство активного центра к
субстрату (повышают активность).
Ферменты - строение, механизм действия, свойства,
58
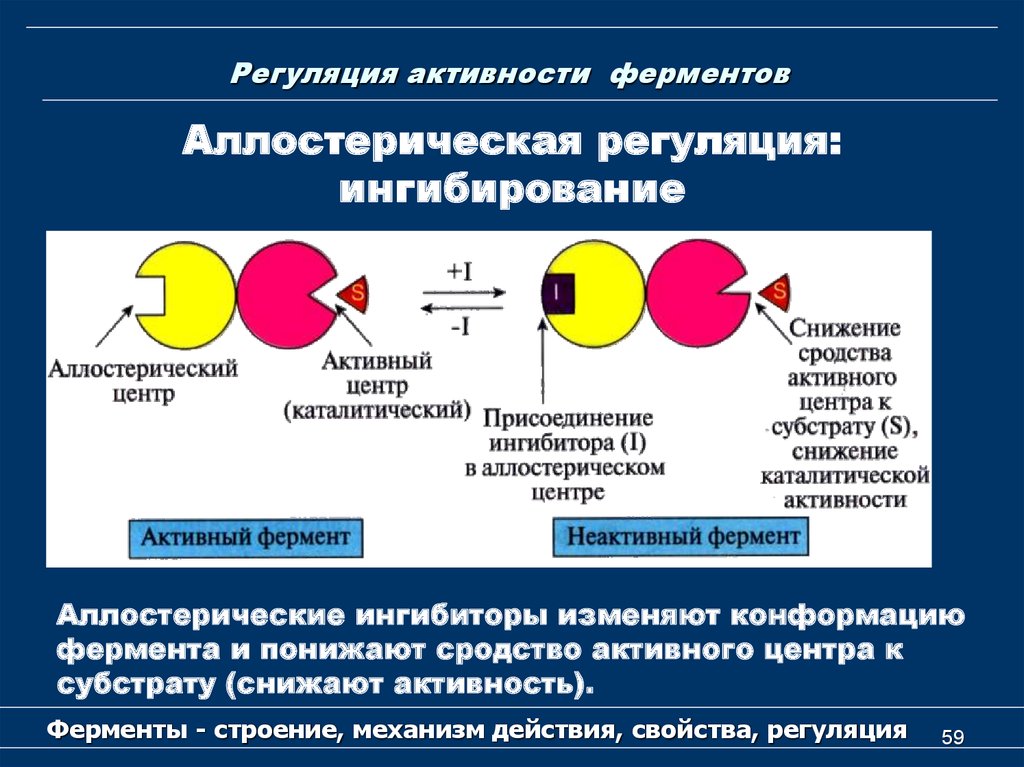
59. Регуляция активности ферментов
Аллостерическая регуляция:ингибирование
Аллостерические ингибиторы изменяют конформацию
фермента и понижают сродство активного центра к
субстрату (снижают активность).
Ферменты - строение, механизм действия, свойства, регуляция
59
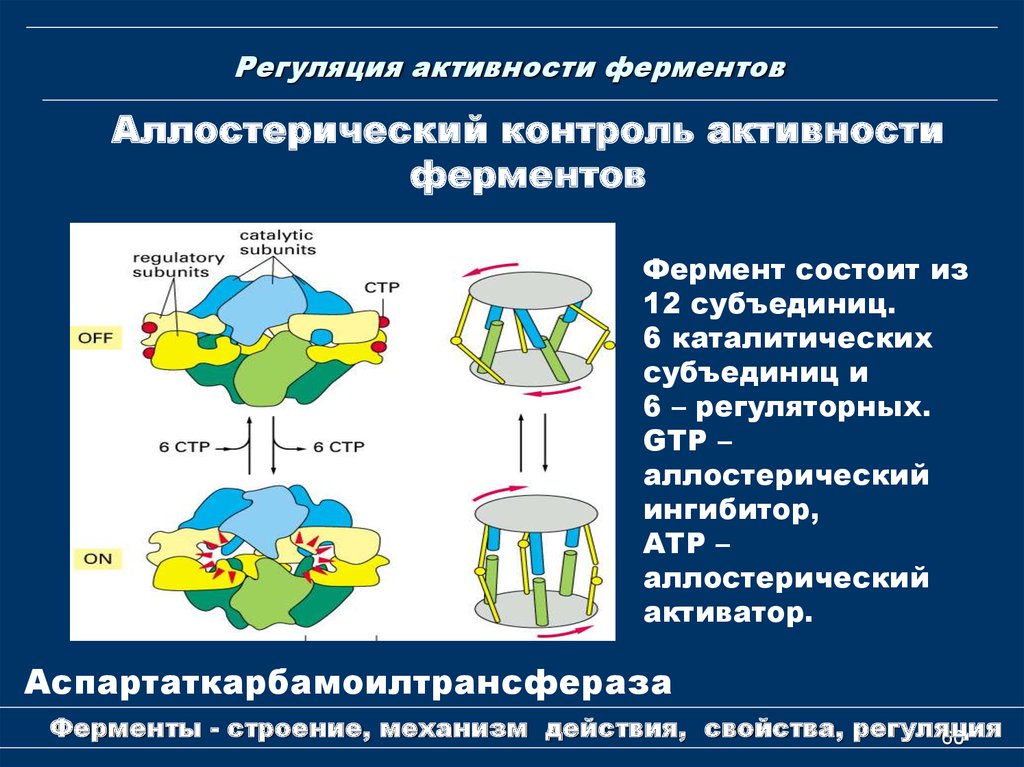
60. Регуляция активности ферментов
Аллостерический контроль активностиферментов
Фермент состоит из
12 субъединиц.
6 каталитических
субъединиц и
6 – регуляторных.
GTP –
аллостерический
ингибитор,
АТР –
аллостерический
активатор.
Аспартаткарбамоилтрансфераза
Ферменты - строение, механизм действия, свойства, регуляция
60
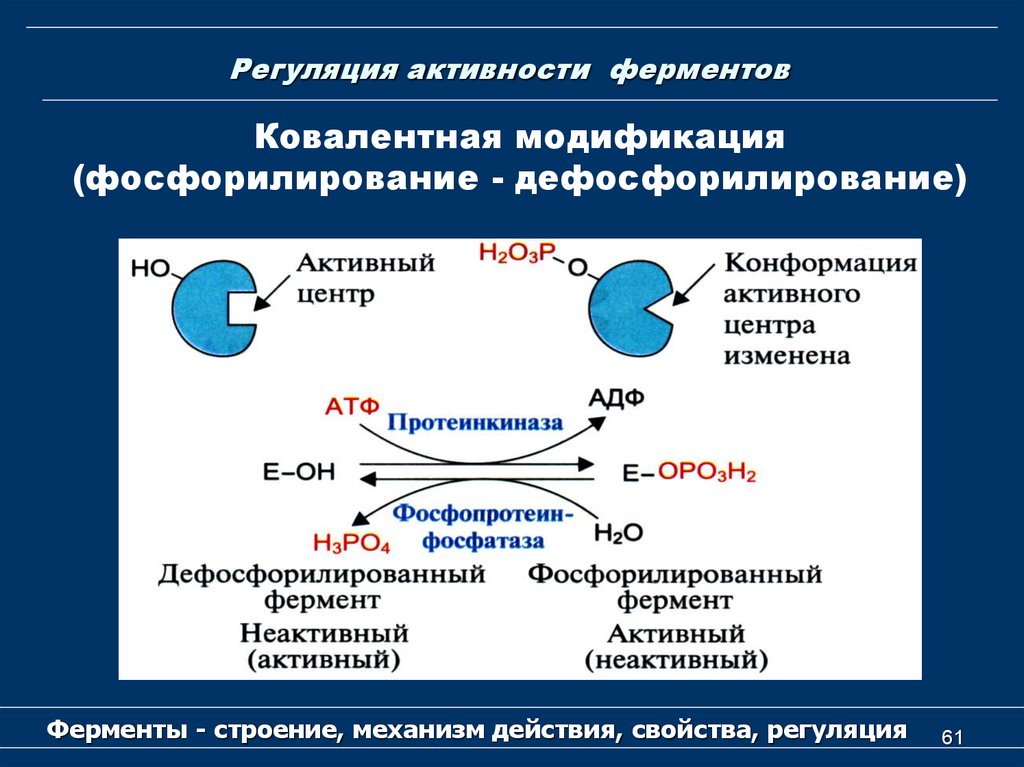
61. Регуляция активности ферментов
Ковалентная модификация(фосфорилирование - дефосфорилирование)
Ферменты - строение, механизм действия, свойства, регуляция
61
62. Регуляция активности ферментов
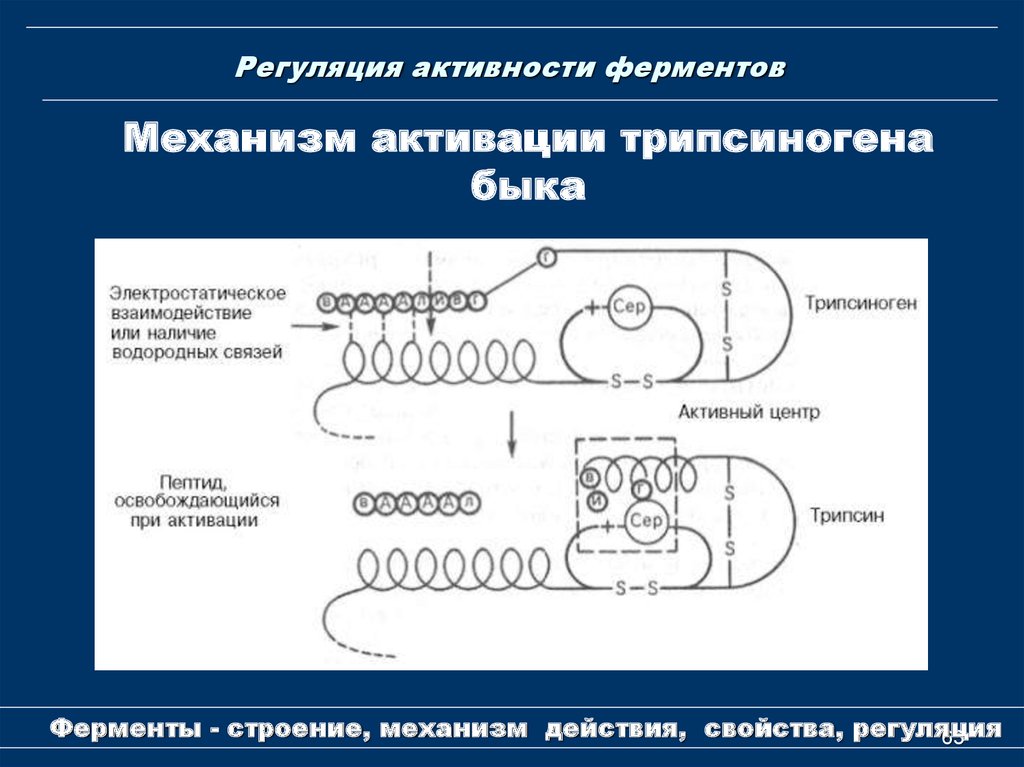
Регуляция путем частичного протеолизаПроферменты - неактивные предшественники ферментов.
Частичный протеолиз профермента – отщепление фрагмента
его молекулы в результате гидролиза одной или нескольких
пептидных связей, вызывающее конформационную
перестройку оставшейся части молекулы и формирование
активного центра.
Ферменты - строение, механизм действия, свойства, регуляция
62
63. Регуляция активности ферментов
Механизм активации трипсиногенабыка
Ферменты - строение, механизм действия, свойства, регуляция
63
64.
Классификация ферментовКлассы ферментов
1. Оксидоредуктазы
2. Tрансферазы
3. Гидролазы
4. Лиазы
5. Изомеразы
6. Лигазы
(синтетазы)
Классификация и номенклатура ферментов
64
65. Классификация ферментов
Международная классификация иноменклатура ферментов
6 классов ферментов в зависимости от типа
катализируемой реакции;
в каждом классе выделяют несколько
подклассов;
в каждом подклассе – несколько
подподклассов;
в каждом подподклассе – индивидуальные
ферменты.
Ферменты - строение, механизм действия, свойства, регуляция
65
66.
Номенклатура ферментовКаждому ферменту присвоен четырехзначный
классификационный номер (шифр).
КФ 1.1.1.37 – Малатдегидрогеназа
КФ – Комиссия по ферментам
1. – Класс
1.1 – Подкласс
1.1.1 – Подподкласс
37 - Порядковый номер в своем подподклассе.
Классификация и номенклатура ферментов
66
67.
Классы ферментовСистематическое
название
L- малат: NAD+ оксидоредуктаза
Рабочее название
малатдегидрогеназа
Класс
1. Оксидоредуктазы
Подкласс
1.1. Действуют на СНОН-группу
донора
Подподкласс
1.1.1. NAD+ в качестве ацептора
Класификационный
номер (шифр)
Кофактор
КФ 1.1.1.37
NAD+
Классификация и номенклатура ферментов
67

































 Биология
Биология








