Похожие презентации:
Этанол. Классификация спиртов
1.
Работу выполнила учительхимии МОУ «СОШ №22»
города Балаково
Антипина С.В.
2.
Спирты – органические вещества,молекулы которых содержат одну или
несколько гидроксильных групп (групп –
ОН), соединенных с углеводородным
радикалом.
Общая формула одноатомных предельных
спиртов СnН2n+1ОН
3.
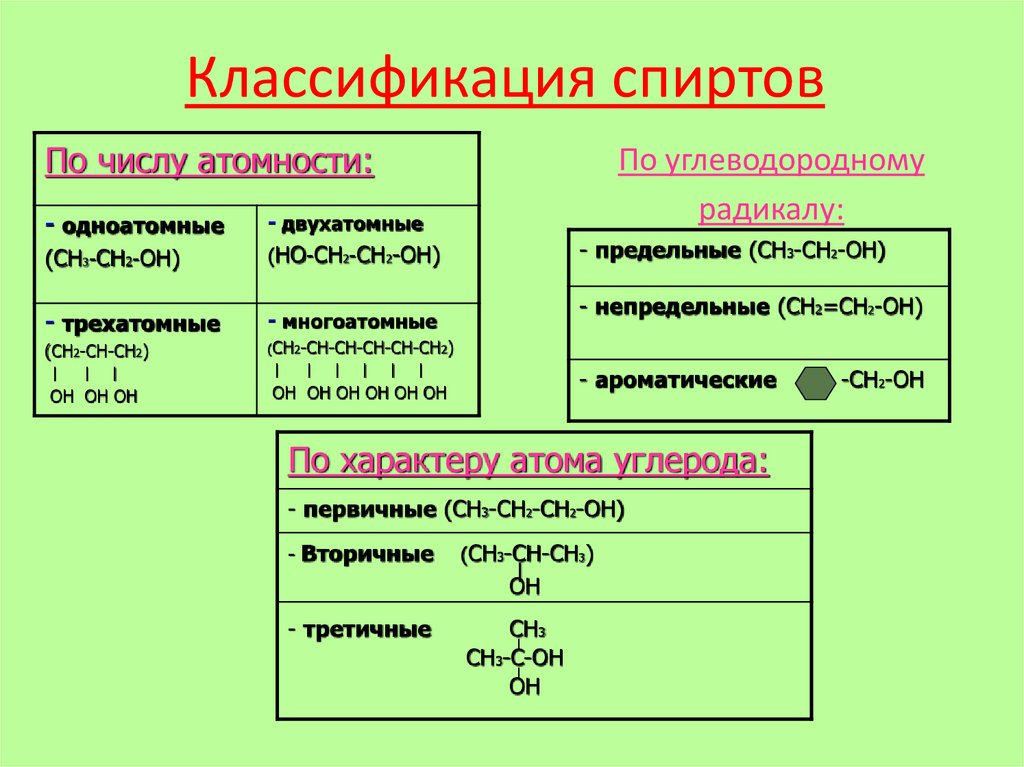
Классификация спиртовПо числу атомности:
- одноатомные
(СН3-CH2-ОН)
- двухатомные
(НО-СН2-СН2-ОН)
- трехатомные
- многоатомные
(СН2-СН-СН2)
(СН2-СН-СН-CH-CH-СН2)
|
|
|
|
ОН ОН ОН
|
|
|
|
По углеводородному
радикалу:
- предельные (СН3-СН2-ОН)
- непредельные (СН2=СН2-ОН)
|
- ароматические
ОН ОН ОН ОН OH OH
По характеру атома углерода:
- первичные (СН3-СН2-СН2-ОН)
- Вторичные
(СН3-СН-СН3)
|
ОН
- третичные
СН
3
|
СН3-C-ОН
|
ОН
-СН2-ОН
4.
НОМЕНКЛАТУРА И ИЗОМЕРИЯПри образовании названий спиртов к названию углеводорода, соответствующего спирту,
добавляют (родовой) суффикс – ОЛ.
Цифрами после суффикса указывают положение гидроксильной группы в главной цепи:
H
H- C – O H
|
H
метанол
H Н
H H H
|3 |2 |1
H- C – C – C -OH
| |
H H
пропанол-1
| 1 | 2 |3
H - C – C – C -H
| | |
H OH H
пропанол -2
ВИДЫ ИЗОМЕРИИ:
1. Изомерия положения функциональной группы (пропанол–1 и пропанол–2) учебник стр. 66
2.Изомерия углеродного скелета
CH3-CH2-CH2-CH2-OH
бутанол-1
CH3-CH-CH2-OH
|
CH3 2-метилпропанол-1
3.Изомерия межклассовая – спирты изомерны простым эфирам:
СН3-СН2-ОН
этанол
СН3-О-СН3
диметиловый эфир
5.
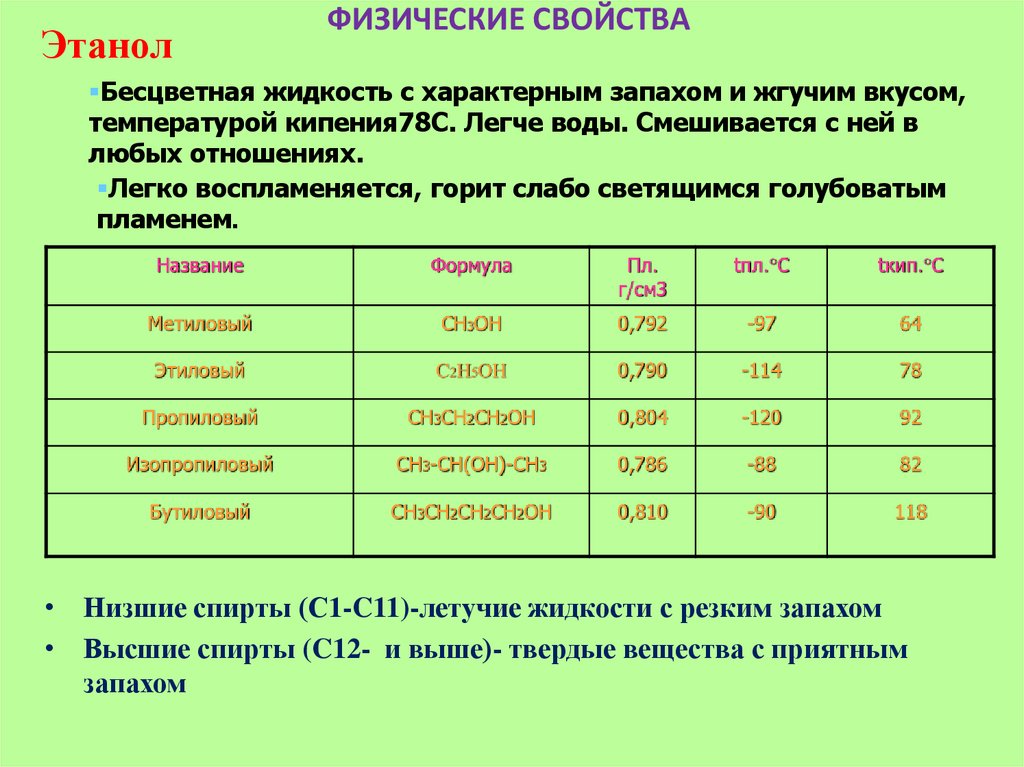
ЭтанолФИЗИЧЕСКИЕ СВОЙСТВА
Бесцветная жидкость с характерным запахом и жгучим вкусом,
температурой кипения78С. Легче воды. Смешивается с ней в
любых отношениях.
Легко воспламеняется, горит слабо светящимся голубоватым
пламенем.
Название
Формула
Пл.
г/см3
tпл. C
tкип. C
Метиловый
CH3OH
0,792
-97
64
Этиловый
C2H5OH
0,790
-114
78
Пропиловый
CH3CH2CH2OH
0,804
-120
92
Изопропиловый
CH3-CH(OH)-CH3
0,786
-88
82
Бутиловый
CH3CH2CH2CH2OH
0,810
-90
118
• Низшие спирты (С1-C11)-летучие жидкости с резким запахом
• Высшие спирты (C12- и выше)- твердые вещества с приятным
запахом
6.
Химические свойстваI. Реакции с разрывом связи RO–H
Спирты реагируют с щелочными и щелочноземельными
металлами, образуя солеобразные соединения –
алкоголяты.
2СH CH CH OH + 2Na 2СH CH CH ONa + H
3
2
2
3
2
2
2
Взаимодействие с органическими кислотами (реакция
этерификации) приводит к образованию сложных эфиров.
CH COОH + HOC H CH COОC H (уксусноэтиловый
эфир (этилацетат)) + H O
3
2
5
3
2
2
5
7.
II. Реакции с разрывом связи R–OH.С галогеноводородами:
R–OH + HBr R–Br + H2O
III. Реакции окисления
Спирты горят:
2С3H7ОH + 9O2 6СO2 + 8H2O
При действии окислителей:
–
первичные спирты превращаются в альдегиды, рис. 35 учебник,
стр.69.
IV. Дегидратация
Протекает при нагревании с водоотнимающими реагентами(конц.
Н2SO4).
1. Внутримолекулярная дегидратация приводит к образованию
алкенов
CH3–CH2–OH CH2=CH2 + H2O
2. Межмолекулярная дегидратация даёт простые эфиры
R-OH + H-O–R R–O–R(простой эфир) + H2O
8.
Способы полученияЛабораторные:
• Гидролиз галогеналканов:
R-CL+NaOH
R-OH+NaCL (пример реакции?)
• Гидратация алкенов: CH2=CH2+H2O
C2H5OH
• Гидрирование карбонильных соединений
Промышленные:
• Гидратация алкенов
• Брожение глюкозы: C6H12O6
2C2H5OH+2CO2
9.
Применение этанола10.
Применение этанола• Этиловый спирт является
мощным наружным
антисептиком и надежным
консервантом.
• Легко понять: если вещество
вызывает моментальное
прекращение жизни и гибель
микробов, то такое же
действие оно окажет на наш
организм.
11.
Применение этанола• Всем известно, что в
этиловом спирте
десятилетиями сохраняются
биологические
структуры(кусочки тканей,
органы)
• Это возможно только потому,
что все процессы
жизнедеятельности в спирте
прекращаются
12.
Биологическое значение спиртов• Где белки – там и жизнь.
• В результате разрушения белков в клетках
наступает смерть. (Смертельная доза
этанола – 7 г/кг веса).
• Окисляясь в печени, спирты
превращаются в альдегиды, т.е. вреден
и страшен не сам спирт, а продукт его
окисления.
13.
Физиологическое значение• Этанол проникает в яйцеклетки и сперматозоиды,
нарушая генетические структуры (гены).
• Употребление алкоголя повреждает мозг, разрушает
нервные клетки.
• Больные диабетом – даже при умеренном потреблении
спиртного рискуют вызвать у себя коматозное
состояние.
• Алкоголь вызывает ожирение сердца, разрушает
эритроциты, способствует развитию гипертонии.
• Сильный вред наносит алкоголь печени.
Цирроз печени – удел многих злоупотребляющих.
14.
Социальные исследования показывают:В пьющих семьях 40% детей недоразвитые и больные. В
таких семьях мертворожденные дети появляются в 2
раза чаще, а детская смертность в 3 раза выше, чем в
непьющих семьях.
Одна рюмка водки снижает работоспособность на 2030%.
До 40% правонарушений совершается в нетрезвом
состоянии.
В состоянии опьянения совершается 55% всех краж, 79%
грабежей, 69% нападений.
Средняя продолжительность жизни на 15-20 лет меньше
у людей, употребляющих алкоголь.
15.
Будущей России – здоровуюмолодежь!
Число людей, которые
себя погубили, куда
значительнее, нежели
число погубленных
другими.
Леббок
Здоровое тело- продукт
здравого рассудка.
Б. Шоу
16.
Самая большая победа – этопобеда над собой,
а самое постыдное – это
быть побежденным своими
страстями.
Демокрит.
17.
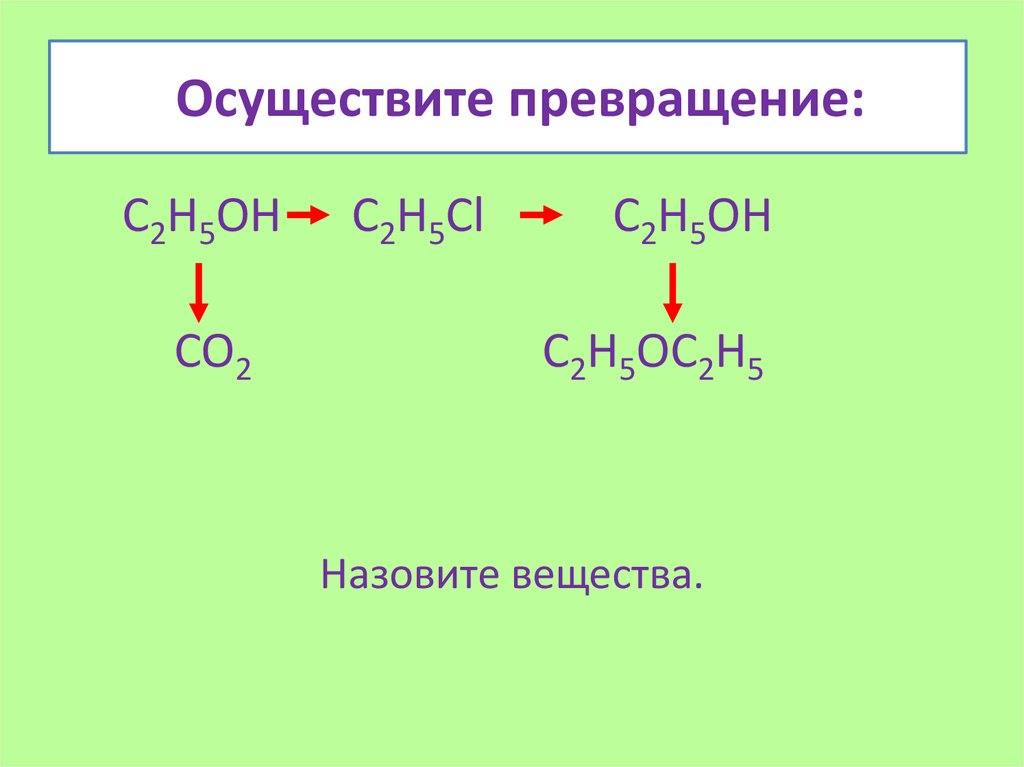
Осуществите превращение:С2Н5ОН
CO2
С2Н5Сl
C2H5OH
C2H5OC2H5
Назовите вещества.
18.
Домашнее задание:Параграф № 9, задание №13, №14
Найдите высказывания великих писателей и
ученых о злоупотреблении алкоголя.
Найдите русские народные поговорки о
злоупотреблении алкоголя.
19.
Используемые ресурсы:http://festival.1september.ru/articles/314551/
http://old.internet-school.ru/demo/530732?page=5
http://imc.rkc-74.ru/dlrstore/c/ccf90e7d-5c60-1c72-5adbe2c80d04fb93/Konspekt.doc
http://yolagim48.narod.ru/urok2.doc















 Химия
Химия








